Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Оценка влияния гликемии на показатели сна при сахарном диабете 1-го типа: результаты одномоментного когортного исследования
Авторы: Дорошкевич И.П. — УО «Гродненский государственный медицинский университет», Республика Беларусь; Мохорт Т.В. — УО «Белорусский государственный медицинский университет», г. Минск
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Данное исследование демонстрирует влияние значений гликемии по данным суточного мониторирования глюкозы на показатели ночного сна у пациентов с сахарным диабетом 1-го типа вне зависимости от уровня гликированного гемоглобина.
Наведене дослідження демонструє вплив значень глікемії за даними добового моніторування глюкози на показники нічного сну у пацієнтів із цукровим діабетом 1-го типу незалежно від рівня глікованого гемоглобіну.
This study demonstrates the impact of glycemia according to daily monitoring of blood glucose on parameters of nocturnal sleep in type 1 diabetic patients, regardless of the glycated haemoglobin level.
сахарный диабет, среднее значение гликемии, показатели сна.
цукровий діабет, середнє значення глікемії, показники сну.
diabetes mellitus, glycemia average value, parameters of sleep.
Статья опубликована на с. 23-27
Сон у пациентов с сахарным диабетом (СД) характеризуется целым рядом особенностей, касающихся изменений его циклов, правильного чередования фаз и стадий, изменений их продолжительности. Кроме того, измененный сон вызывает снижение качества жизни, что может способствовать прогрессированию психических и неврологических расстройств у больных СД [1, 5]. В литературе присутствуют данные о наличии взаимосвязи между долгосрочной компенсацией углеводного обмена и состоянием сна у пациентов с СД 1-го типа. Отмечена тенденция к увеличению общего времени сна, снижению латентности сна. Высокий показатель гликированного гемоглобина (НbА1с) сопровождается уменьшением продолжительности глубокого сна. Ночные гипогликемии повышают эффективность сна, увеличивают продолжительность медленного сна, затрудняют пробуждение [5, 10, 12, 13, 16]. Влияние показателя гликемии в течение суток перед предстоящим ночным сном вне зависимости от показателя НbА1с вызывает определенный интерес.
Цель исследования — оценить влияние гликемии в течение суток по данным системы длительного мониторирования глюкозы перед предстоящим сном на показатели сна у пациентов с СД 1-го типа.
Материалы и методы
Исследование включало последовательное анкетирование; оценку уровня НbА1с; исследование параметров суточной динамики гликемии и проведение полисомнографического мониторинга в течение одной диагностической ночи.
Уровень НbА1с определялся после забора венозной крови из локтевой вены натощак с использованием методики ингибирования латексной агглютинации на автоматическом биохимическом анализаторе Architeсt C8000 (Abbott, USA), реагенты фирмы Cormay.
Суточное мониторирование гликемии проводилось с помощью системы SGMS Gold компании Medtroniс MiniMed, США, позволяющей в течение 72 часов через подкожно установленную иглу-сенсор регистрировать значения глюкозы интерстициальной жидкости каждые 5 минут, и последующей компьютерной обработки данных с использованием специального программного обеспечения. При проведении мониторирования суточной гликемии (СМГ) с помощью SGMS Gold были определены следующие критерии гликемических параметров: границы эугликемии — от 3,9 до 10,0 ммоль/л; гипергликемии > 10,0 ммоль/л; выраженные гипогликемии — < 3,9 ммоль/л; среднее значение гликемии (СГ) в сутки (ммоль/л). Длительность эугликемии, гипергликемии, гипогликемии рассчитана в процентном соотношении (%) по отношению указанных значений друг к другу в течение суток. В исследование включены следующие показатели суточного мониторирования гликемии: СГ, а также длительность гипергликемии, гипогликемии, эугликемии в течение суток перед сном «b» и после сна «a» (включающее продолжительность сна).
Полисомнографический мониторинг в течение одной диагностической ночи с помощью комплекса SOMNOlab 2 (PSG) Polysomnography (R & K). В исследование включены следующие показатели: общее время сна (ОВС), латентность засыпания, количество пробуждений, медленный сон, латентность быстрого сна — REM-сон, общее время циклов сна (ОВЦ), смена фаз сна, эффективность фаз сна 1–3, REM-сон, фазы сна S1, S2, S3, S4.
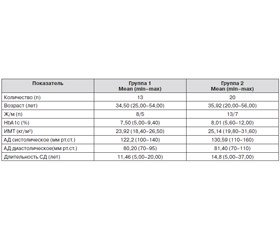
Нами обследованы 33 пациента в возрасте от 18 до 56 лет с диагнозом СД 1-го типа. Все пациенты в зависимости от СГ были разделены на группы. Группу 1 составили пациенты с уровнем СГ < 8,0 ммоль/л, группу 2 — с показателем СГ > 8,0 ммоль/л. Принявшие участие в исследовании сопоставимы по возрасту, полу, индексу массы тела (ИМТ), показателям артериального давления (АД), длительности СД, НbА1с. Принцип формирования данных групп основан на компенсации СД в течение дня перед предстоящим ночным сном и не зависел от показателя долгосрочной компенсации углеводного обмена — НbА1с. В данном исследовании контрольная группа не предусмотрена в связи с некорректностью проведения инвазивного мониторинга гликемии с использованием СМГ у лиц без СД 1-го типа и сравнения результатов колебаний гликемии у лиц без инсулинотерапии.
Статистический анализ выполнен при помощи пакета Statistiсa 6.0 (StatSoft, США) и включал использование методов описательной статистики и проведение рангового корреляционного анализа Спирмена. Межгрупповые различия определяли посредством теста Манна — Уитни, T-теста независимых выборок.
Результаты и их обсуждение
Общая характеристика пациентов, включенных в исследование, представлена в табл. 1.
Достоверных различий между группами в характеристиках сна нами не было выявлено (табл. 2). При дальнейшем анализе отмечены различия при сравнении определенных показателей. У пациентов второй группы продолжительность наступления быстрого сна в течение 77,59 (0,00–137,00) мин, что на 25,33 мин больше, чем у пациентов первой группы, — 52,26 (0,00–137,00) мин. У данной категории пациентов отмечена более частая смена фаз сна — в 13,5 раза чаще, чем у пациентов первой группы, — 156,65 (15,00–257,00) и 143,09 (37,00–220,00) соответственно; продолжительность медленного сна длиннее на 6,76 мин и составляет 41,94 (0,00–102,00) мин при сравнении с пациентами группы 1 — 35,18 (0,00–115,30) мин. Важно отметить такой факт, как увеличение эффективности фазы сна 3 (S3). Эффективность данной фазы (эффективность полезного сна) состоит из соотношения суммы стадии S3 и REM-сна с общим временем сна, и в норме данный показатель должен быть более 32 %. У пациентов первой группы он равен 57,7 % (25,20–88,10), в группе 2 он составил 44,72 % (15,90–99,10) — на 13 % больше.
Достоверные различия отмечены между такими показателями в течение суток перед предстоящим ночным сном, как СГ «b», гипергликемия «b», гипогликемия «b», нормогликемия «b». В группе 1 значение СГ составило 6,68 (3,20–8,00), этот показатель на 3,32 ммоль/л меньше при сравнении со второй группой — 10,00 (8,10–16,60) и является показателем изолированной компенсации углеводного обмена у пациентов данной категории накануне сна. Соотношение гликемии в течение суток перед диагностической ночью значительно отличалось у пациентов двух групп. Показатель гипергликемии «b» во второй группе — 43,50 % (10,00–86,00) — на 31,97 % больше, чем в первой группе, — 11,53 % (0,00–22,00); нормогликемии «b» в группе 1 составил 74,15 % (20,00–92,00), а в группе 2 — на 21,40 % меньше — 52,75 % (0,00–77,00); гипогликемии «b» в первой группе — 14,46 % (0,00–80,00), а во второй — 3,75 % (0,00–25,00).
Гипогликемии — наиболее частое осложнение СД 1-го типа, обеспечивающее поддержание адекватного гликемического контроля [11]. Снижение уровня НbА1с сопровождается обратно пропорциональным риском повышения гипогликемических реакций [3, 14, 15]. Данное утверждение имеет подтверждение в группе пациентов с изолированной компенсацией СД, где показатель гипогликемий на 10,70 % больше, чем в группе 2. Отличий среди показателей гликемии (нормогликемии «a», гипогликемии «a», гипергликемии «a») в течение суток после сна не получено.
Для уточнения наличия связи между уровнем гликемии и показателями сна был применен корреляционный анализ. В результате установлены некоторые значимые взаимосвязи (р < 0,05). Группа с компенсированным СД в течение суток имеет следующие показатели: СГ перед сном взаимосвязана с продолжительностью медленного сна (r = –0,73), ОВЦ (r = –0,84), частотой смен фаз сна (r = –0,73), эффективностью фаз сна 1, 2, 3 (r = –0,72, r = –0,61, r = 0,63 соответственно), длительностью REM-сна (r = 0,76), длительностью S2-, S3-стадий сна (r = –0,72, r = –0,61 соответственно). Показатель гипергликемии (перед сном) имеет отрицательную взаимосвязь с эффективностью фазы сна 2 (r = –0,60). Гипогликемия в этот же момент влияет на глубокую стадию сна S3 (r = 0,68). Эугликемия после сна находится в прямой зависимости с латентностью засыпания (r = 0,64). Стаж диабета оказывает негативное влияние на смену фаз сна (r = –0,72).
В современной литературе доказано, что как сон, так и метаболические процессы в организме оказывают взаимное влияние друг на друга. В данной когорте пациентов отмечена взаимосвязь между продолжительностью засыпания и длительностью эугликемии после сна. Увеличение СГ перед сном уменьшает продолжительность медленного сна, ОВЦ, уменьшает частоту смен фаз сна, эффективность фаз сна 1, 2, продолжительность S2-, S3-стадий сна. Уменьшение длительности гипогликемии в течение суток уменьшает длительность третьей стадии сна. Большая эффективность третьей фазы сна, длительность REM-сна прослеживаются с увеличением СГ перед предстоящим ночным сном. Быстрый сон (REM) играет важную роль в консолидации мозгом полученной в течение дня информации (память, обучение), переработке эмоциональной информации, восстановлении психологического статуса, закладке программы поведения на завтра. REM-сон важен для процессов обучения и запоминания, он воздействует на творческие способности, настроение [6–8].
У пациентов с СД 1-го типа функциональное состояние центральной нервной системы характеризуется снижением ряда познавательных и интеллектуальных функций в зависимости от степени компенсации [4]. Доказано влияние долгосрочной компенсации СД на данные функции.
В группе 2 отмечена взаимосвязь между показателями гликемии и характеристиками сна. Так, среднее значение гликемии перед сном в данной группе составило более 10,0 ммоль/л, оказывает прямое влияние совместно с показателем гипергликемии на глубокую стадию сна S4 (r = 0,56 и r = 0,50 соответственно). Продолжительность гипергликемии в данный временной промежуток имеет прямую корреляционную зависимость между эффективностью фазы 3 сна (r = 0,45) и зависимость между фазой поверхностного сна S1 (r = –0,56). Показатель гипогликемии взаимосвязан со сменой фаз сна (r = –0,56), продолжительностью медленного сна (r = –0,68), стадиями глубокого сна S3, S4 (r = –0,49 и r = –0,68 соответственно). Таким образом, увеличение продолжительности гипогликемии уменьшает частоту смен фаз сна, продолжительность медленного сна в целом и его составляющих стадий 3 и 4. Нормогликемия показывает прямую корреляционную зависимость между продолжительностью фазы сна S1 (r = 0,59) и обратную — с эффективностью фазы сна 3 (r = –0,49). Продолжительность S4 влияет на гипогликемию после сна (r = –0,47).
Пациенты с декомпенсированным углеводным обменом в сутки перед предстоящим ночным сном, вне зависимости от уровня НbА1с, имеют тенденцию к увеличению продолжительности глубокой стадии сна 4 с увеличением среднего значения СГ накануне сна, доли гипергликемии и уменьшением продолжительности гипогликемии в структуре СГ. Длительность гипергликемии также увеличивает эффективность фазы сна 3 и уменьшает долю первой стадии медленного сна — S1. У данной категории продолжительность гипогликемии в день после сна зависит от длительности стадии 4 медленного сна, следовательно, чем более продолжительная стадия S4, тем меньший процент суточной гипогликемии днем у пациентов после сна.
Поиск взаимосвязей между показателями сна и уровнем гликемии у пациентов с СД представляет огромный интерес, так как именно в определенные фазы сна происходит восстановление психологического статуса, физиологического гомеостаза. В течение медленного сна происходит накопление энергетических фосфатергических связей, синтез пептидов и нуклеиновых кислот, наблюдается пик секреции соматотропного гормона, пролактина, мелатонина, повышается функциональная активность интерлейкинов-1 и -2 и других компонентов иммунной системы; в фазу медленного сна происходит восстановление физической активности организма. Сокращение глубокого сна — стадии сна 3 и 4 — рассматривается как признак физиологического старения организма [1, 2, 5, 7]. У пациентов группы 2 отмечено компенсаторное увеличение продолжительности четвертой стадии сна на фоне гипергликемии, увеличения СГ, а также увеличение эффективности полезного сна, что имеет особое значение для пациентов с СД 1-го типа. Гипогликемии в данной группе оказывают негативное влияние на показатели глубокого сна, продолжительность медленного сна в целом, сокращая их длительность и уменьшая продолжительность накопления молекулярных компонентов для жизненно важных структур организма.
Нами доказано, что колебания гликемии в группе пациентов в стадии декомпенсации с СГ 11,6 ммоль/л и уровнем НbА1с ≥ 8,5 % увеличивают продолжительность ОВС, эффективность фазы сна 1 и 2. Увеличение показателя СГ более 7,75 ммоль/л удлиняет латентность засыпания, латентность REM-фазы сна; длительность эугликемии на протяжении суток уменьшает латентность REM–фазы сна. Увеличение показателя НbА1с у пациентов с СГ более 7,75 ммоль/л перед предстоящим ночным сном увеличивает латентность засыпания [9].
Выводы
Изолированный показатель СГ без учета уровня НbА1с оказывает следующие эффекты.
1. При СГ 10,0 ммоль/л отмечается удлинение латентности быстрого сна, учащение смены фаз сна, увеличение продолжительности четвертой стадии сна, эффективности полезного сна.
2. Регистрация гипогликемических эпизодов по данным СМГ без клинически выраженных гипогликемий сопровождается увеличением длительности медленного сна, третьей и четвертой стадии медленного сна, смены фаз сна.
3. У компенсированных пациентов в течение суток с СГ 6,68 ммоль/л перед предстоящим ночным сном отмечено удлинение фазы быстрого сна, увеличение эффективности полезного сна. В данной группе отмечено влияние СГ на продолжительность медленного сна, ОВЦ, эффективность сна 1 и 2. Латентность засыпания ассоциирована с увеличением частоты гипогликемий в течение дня после сна.
Колебания гликемии в течение суток перед предстоящим ночным сном оказывают влияние на продолжительность и частоту различных показателей сна.
1. Быков А.Т., Маляренко Т.Н., Матюхов А.В. Современный взгляд на значение сна и его структуру у человека. Белорусский государственный медицинский университет [Электронный ресурс]. — Режим доступа: http://www.bsmu.by/index.php? option= com_content&view=article&id=1601%3a–&catid=116%3a32009&itemid =196&showall=1. — Дата доступа: 29.04.2014.
2. Левин И.Я. Современная сомнология // Психические расстройства в общей медицине. — 2007. — № 2. — С. 446–450.
3. Махлина Е.С., Мохорт Т.В., Холодова Е.А. Комплексная оценка компенсации сахарного диабета 1 типа // Лечебное дело. — 2013. — № 5(33). — С. 54–57.
4. Никитина И.Л., Прошутинская Ю.М., Бадогова Т.Н. Характеристика некоторых функциональных параметров ЦНС при сахарном диабете 1 типа // Вопросы современной педиатрии. — 2006. — № 3. — С. 23.
5. Пузикова О.З. Особенности ночного сна при сахарном диабете 1 типа у детей и подростков // Международный журнал экспериментального образования. — 2013. — № 4. — С. 84–91.
6. Петров А.М., Гиниатулин А.Р. Нейробиология сна: современный взгляд: учебное пособие. — Казань: КГМУ, 2012. — 109 с.
7. Соколов Л.П., Стеблецов С.В. Нарушения сна в клинике внутренних болезней // Consilium Medicum. — 2007. — № 3(4). — С. 2341–2348.
8. Соколов Л.П., Кислый Н.Д. Инсомнии и нарушения сна у пожилых: особенности терапии // Consilium Medicum. — 2007. — № 2(9). — С. 1356–1359.
9. Darashkevich I., Mokhort T., Nikonova L. et al. Effect of glycemia on sleep indicators for patients with type 1 diabetes mellitus // Abstract book of 16th European Congress of Endocrinology. — Wrocław, 2014. — P. 333
10. Dijk M., Donga E., Dijk J. et al. Disturbed subjective sleep characteristics in adult patients with long-standing type 1 diabetes // Diabetologia. — 2011. — № 54(8). — Р. 1967–1976.
11. Gard S.K. Improved glucose excursion an implantable real time continuous glucose sensor in adults with type 1 diabetes // Diabetes Care. — 2004. — № 27. — P. 734–738.
12. Schultes B., Jauch–Chara K., Gais S. et al. Defective аwakening response to nocturnal hypoglycemia in patients with type 1 diabetes mellitus [Electronic resource]. Mode ofaccess: http://www.plosmedicine.org/article/info:doi/10.1371/journal.pmed.0040069. — Date of access: 30.04.2014.
13. Spiegel К., Knutson K., Leproult R. et al. Sleep loss: a novel risk factor for insulin resistance and type 2 diabetes // Appl. Physiol. — 2005. — № 99. — Р. 2008–19.
14. The Diabetes control and complications trial research group. The absence of a glycemic threshold for the development of long term complications: the perspective of the diabetes control and complications trial // Diabetes. — 1996. — № 45. — P. 1289–1298.
15. The Diabetes control and complications trial research group. Hypoglycemia in the diabetes control and complications trial research group // Diabetes. — 1997. — № 46. — P. 271–286.
16. Pillar G., Schuscheim G., Weiss R. et al. Interactions between hypoglycemia and sleep architecture in children with type 1 diabetes mellitus // Pediatr. — 2003. — № 142(2). — Р. 163–168.

/24/24.jpg)
/24/24_2.jpg)
/25/25.jpg)