Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Обґрунтування підходів до терапії хворих на повільно прогресуючий автоімунний діабет дорослих
Авторы: Тихонова Т.М. — ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Метою даного дослідження було на підставі результатів комплексного клінічного обстеження хворих на повільно прогресуючий автоімунний діабет дорослих обґрунтувати підходи до терапії даної форми захворювання.
Матеріали та методи дослідження. Обстежено 121 хворого на повільно прогресуючий автоімунний діабет дорослих, 60 хворих на ЦД 1-го типу та 81 хворий на ЦД 2-го типу.
Результати і їх обговорення. Установлено значуще підвищення рівня глікемії у хворих на повільно прогресуючий автоімунний діабет дорослих на стадії маніфестації захворювання. Призначення їм пероральної цукрознижуючої терапії призводило до декомпенсації в строки до 3 років та обґрунтовувало переведення на інсулінотерапію. Рівень С-пептиду у хворих даної групи, що був співвідносний з таким у хворих на цукровий діабет 1-го типу, свідчить при суттєве зниження інсулінпродукуючої функції β-клітин. Виявлення тільки у хворих на повільно прогресуючий автоімунний діабет дорослих виражених мікросудинних ускладнень слід пов’язати з феноменом метаболічної пам’яті.
Висновки. Дані аналізу стану вуглеводного обміну на етапі маніфестації та в динаміці еволюції повільно прогресуючого автоімунного діабету дорослих, а також зниження на тлі автоімунного інсуліту інсулінпродукуючої функції β-клітин за розвитку даної форми захворювання обґрунтовують доцільність призначення інсуліну з моменту встановлення діагнозу. За наявності у хворих цієї групи кластерів метаболічного синдрому є цілком виправданим застосування метформіну додатково до інсуліну.
Целью данного исследования было на основании результатов комплексного клинического обследования больных медленно прогрессирующим аутоиммунным диабетом взрослых обосновать подходы к терапии данной формы заболевания.
Материалы и методы исследования. Обследован 121 больной медленно прогрессирующим аутоиммунным диабетом взрослых, 60 больных СД 1-го типа и 81 больной СД 2-го типа.
Результаты и их обсуждение. У больных медленно прогрессирующим аутоиммунным диабетом взрослых на стадии манифестации установлено значительное повышение уровня гликемии. Назначение им пероральной сахароснижающей терапии приводило к развитию декомпенсации в сроки до 3 лет, что обосновывало перевод на инсулинотерапию. Уровень С-пептида у больных данной группы был сопоставим с данным показателем у больных сахарным диабетом 1-го типа. Указанное свидетельствует о существенном снижении инсулинпродуцирующей функции β-клеток у больных данной формой СД. Выявление только у больных медленно прогрессирующим аутоиммунным диабетом взрослых выраженных микрососудистых осложнений следует связать с феноменом метаболической памяти.
Выводы. Данные анализа состояния углеводного обмена на этапе манифестации и в динамике эволюции медленно прогрессирующего аутоиммунного диабета взрослых, а также снижение на фоне аутоиммунного инсулита инсулинпродуцирующей функции β-клеток при развитии данной формы заболевания обосновывают целесообразность назначения инсулина с момента установления диагноза. При наличии у больных этой группы кластеров метаболического синдрома вполне оправданно применение метформина дополнительно к инсулину.
The objective of this study was to substantiate the approaches to the treatment of latent autoimmune diabetes in adults on the basis of a comprehensive clinical examination of patients with this form of the disease.
Research design and methods. The study involved 121 patients with latent autoimmune diabetes in adults — 60 patients with diabetes mellitus type 1 and 81 patients with diabetes mellitus type 2.
The results and discussion. On the manifestation stage a significant increase in blood glucose was established in patients with latent autoimmune diabetes in adults. Prescribed oral hypoglycemic therapy led to decompensation within 3 years that required transferring to insulin therapy. C-peptide level in patients of this group matched that parameter in type 1 diabetic patients. That confirmed the reduction of β-cells insulin-producing function. Revealing microvascular complications only in patients with latent autoimmune diabetes in adults should be attributed to the phenomenon of «metabolic memory».
Conclusions. Analysis of carbohydrate metabolism on the manifestation stage and over time development of latent autoimmune diabetes in adults as well as reduction of β-cells insulin-producing function associated with autoimmune insulitis and progressing while the development of this form of disease, substantiate the rational for insulin administration as this form of diabetes has been diagnosed. If patients with latent autoimmune diabetes in adults have metabolic syndrome clusters it is quite reasonable to add metformin to insulin.
повільно прогресуючий автоімунний діабет дорослих, лікування.
медленно прогрессирующий аутоиммунный диабет взрослых, лечение.
latent autoimmune diabetes of adults, treatment.
Статья опубликована на с. 28-32
Питання адекватної терапії цукрового діабету (ЦД), незважаючи на проведення численних досліджень та отримання певних результатів, залишаються на сьогодні одними з основних у сучасній діабетології. Визначення згідно із класифікацією ВООЗ двох основних типів захворювання окреслило патогенетичні підходи до лікування ЦД 1-го та 2-го типу з необхідністю застосування відповідних груп цукрознижуючих препаратів [1, 2]. Однак навіть за наявності протоколів лікування не завжди вибір того чи іншого лікарського засобу є однозначним [3]. Відносно недавнє виділення особливої форми ЦД — повільно прогресуючого автоімунного діабету дорослих (ППАДД, Latent autoimmune diabetes of the adults — LADA) стало підставою для пошуку й затвердження найбільш обґрунтованої терапії даного варіанта захворювання. Особливістю ППАДД є маніфестація клінічними ознаками, що притаманні ЦД 2-го типу, можливість досягнення короткочасної суб- або компенсації на тлі дієти та/або застосування пероральних цукрознижуючих препаратів із розвитком інсулінозалежності у строки від 0,5 року до 3–5 років від дебюту захворювання [4]. Такий перебіг ППАДД зумовлений значно більш торпідною порівняно з класичним варіантом ЦД 1-го типу деструкцією бета-клітин підшлункової залози та тривалішим збереженням їх секреторної активності. [5]. У зв’язку з неоднозначними поглядами на діагностичні критерії та патогенетичні механізми розвитку ППАДД на даний момент не встановлено єдиного загальноприйнятого підходу до лікування даної форми ЦД. Помилковий діагноз ЦД 2-го типу на етапі виявлення захворювання призводить найчастіше до призначення хворим пероральних цукрознижуючих препаратів [4].
Сьогодні обговорюються можливості застосування тіазолідиндіонів, бігуанідів, аналогів глюкагоноподібного пептиду-1 та інгібіторів дипептидилпептидази-4 як базової цукрознижуючої терапії ППАДД [6–8]. Водночас більшістю дослідників визнається безпідставність використання цукрознижуючих сульфаніламідних препаратів у лікуванні ППАДД: за умов розвитку автоімунного інсуліту застосування даної групи лікарських засобів призводить до прискорення деструктивних процесів із виснаженням β-клітин, що в подальшому обумовлює застосування великих доз інсуліну [9].
Необхідність призначення інсулінотерапії хворим на ППАДД на сьогодні визнається низкою дослідників. Предметом дискусії залишається питання, на якому етапі еволюції захворювання застосування інсулінотерапії найбільш виправдане. Незважаючи на можливість досягнення компенсації вуглеводного обміну на початкових стадіях ППАДД завдяки пероральній цукрознижуючій терапії, все ж таки обговорюється доцільність якомога раннього призначення інсуліну [9, 10].
Мета даного дослідження: на підставі результатів комплексного клінічного обстеження хворих на ППАДД обґрунтувати підходи до терапії даної форми захворювання.
Матеріали та методи дослідження
Клініко-лабораторне обстеження проведено в 262 осіб, які були розподілені на 3 групи (1-ша — основна, 2-га та 3-тя — групи порівняння). До першої (основної) групи було віднесено 121 хворого (52 чоловіки та 69 жінок; середній вік 48,64 ± 10,07 року), яким за даними анамнезу (повільна маніфестація захворювання та розвиток інсулінозалежності в строки від 0,5 року до 5 років від діагностування ЦД) був встановлений попередній діагноз ППАДД. Другу групу становили 60 пацієнтів (35 чоловіків та 25 жінок; середній вік 34,38 ± 10,88 року), хворих на ЦД 1-го типу з класичною гострою маніфестацією захворювання, у певній кількості випадків із розвитком пре- або коматозних станів. До третьої групи було віднесено 81 пацієнта (35 чоловіків та 46 жінок; середній вік 52,44 ± 7,47 року) з діагнозом ЦД 2-го типу, у яких призначення пероральної цукрознижуючої терапії призводило до стабільної компенсації вуглеводного обміну. Слід зазначити, що діабетичний анамнез у хворих груп спостереження коливався від 0,5 до 6,5 року.
Усім хворим проведено загальноклінічне обстеження з визначенням рівня С-пептиду, а також показників вуглеводного та ліпідного обміну. Верифікація діагнозу ППАДД здійснювалася за допомогою визначення антитіл до цитоплазматичного антигену острівців Лангерганса (ІСА ab) із використанням набору Qualitative ELISA Test for the Detection of Circulating Autoantibodies Against Islet Cell Antigens (США; Biomerica), до декарбоксилази глутамінової кислоти (GAD ab) за допомогою набору Qualitative ELISA Test for the Detection of Circulating Autoantibodies Against GAD Antigens (США; Biomerica), а також до тирозинфосфатази (IA-2 ab) з використанням набору Qualitative ELISA Test for the Detection of Circulating Autoantibodies Against IA-2A (США, Medipan). Титр антитіл розцінювався як позитивний при перевищенні оптичної щільності досліджуваної сироватки оптичної щільності контролю. Контрольну групу становили репрезентативні за статтю та віком здорові особи з необтяженою спадковістю за ЦД. Діагноз вважався підтвердженим за наявності відповідних анамнестичних даних у поєднанні з виявленням позитивного титру принаймні одного із зазначених антитіл. Уміст глюкози в плазмі крові визначали глюкозооксидазним методом за допомогою аналізатора глюкози «Biosen C-line» (Німеччина), референтні значення для якого становили 4,4–6,1 ммоль/л. Глікозильований гемоглобін (HbA1c) визначали методом «Діабет-тест» за допомогою фотометра КФК-3 (Росія). Дослідження концентрації загального холестерину (ЗХС), тригліцеридів (ТГ), холестерину ліпопротеїдів високої щільності (ХС-ЛПВЩ) проводили ферментативним колориметричним методом: при визначенні ЗХС та ТГ — за допомогою наборів фірми «СпайнЛаб» (Харків, Україна), при визначенні ХС-ЛПВЩ — із використанням набору фірми ЗАТ «Диакон-ДС» (Москва, Росія). Концентрації ліпопротеїдів низької щільності (ЛПНЩ), ліпопротеїдів дуже низької щільності (ЛПДНЩ) та коефіцієнт атерогенності (КА) обчислювали розрахунковим методом за загальноприйнятими формулами. Концентрацію С-пептиду досліджували за допомогою імуноферментного набору для кількісного визначення останнього в сироватці крові (C-peptide ELISA EIA-1293 DRG Instruments GmbH, Німеччина). Зразки венозної крові забирали у кожної особи після 12-годинного голодування.
При статистичному аналізі даних перевірку розподілу кількісних ознак на відповідність закону Гаусса проводили, розраховуючи показники асиметрії та ексцесу. Обробка отриманих результатів проводилась за допомогою пакета аналізу даних Microsoft Excel, програм Biostat та Statistica V6 за розрахунком середнього значення, стандартного відхилення з застосуванням критерію Стьюдента. Ураховуючи великий розкид певних даних та відмінний від нормального їх розподіл, обробка цих результатів проводилась шляхом визначення медіани (Ме), мінімуму (Min), максимуму (Max) з використанням непараметричного критерію Краскела — Уолліса.
Результати і їх обговорення
На першому етапі дослідження проведено аналіз анамнестичних даних щодо стану вуглеводного обміну у хворих на ППАДД порівняно з відповідними показниками у хворих на ЦД 1-го та 2-го типу. При цьому оцінювалися такі дані, як рівень глікемії на етапі встановлення діагнозу, динаміка глікемії на тлі прийому пероральних цукрознижуючих препаратів та після призначення інсуліну, а також показники, що були отримані за результатами цього дослідження.
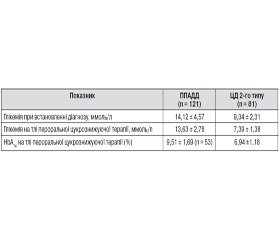
За результатами оцінки клініко-анамнестичних даних хворих із верифікованим діагнозом ППАДД встановлено, що, незважаючи на поступовий початок та помірну вираженість клінічних проявів у дебюті захворювання, показники глікемії на стадії виявлення ЦД у хворих цієї групи були вірогідно вищими за такі у хворих на ЦД 2-го типу (табл. 1). При цьому високий рівень глікемії (13,60 ± 4,72 ммоль/л) у хворих на ППАДД спостерігався навіть за умов випадкового виявлення захворювання. На виражену декомпенсацію в дебюті ЦД вказує також поєднання в 29 (23,97 %) осіб за розвитку ППАДД гіперглікемії з ацетонурією. Водночас серед хворих на ЦД 2-го типу ацетонурія, за даними анамнезу, виявлялася вірогідно рідше (df = 1; x2 = 15,645; р = 0,000): на наявність ацетонурії при виявленні ЦД вказали лише 2 пацієнти 3-ї групи спостереження. Отже, на стадії маніфестації захворювання у хворих з верифікованим у подальшому ППАДД визначалися більш значні порушення вуглеводного обміну, ніж у хворих на ЦД 2-го типу. Зазначене, вочевидь, слід розцінити як зниження інсулінпродукуючої функції бета-клітин у хворих на ППАДД уже в дебюті захворювання.
Недостатньо об’єктивний аналіз клінічних проявів та показників вуглеводного обміну призводив до встановлення в більшості хворих основної групи при виявленні захворювання діагнозу «ЦД 2-го типу» з відповідним призначенням пероральної цукрознижуючої терапії. При застосуванні таблетованих препаратів спостерігалося певне зниження рівня глікемії. Однак слід зазначити, що у 21 хворого суттєвої позитивної динаміки показників вуглеводного обміну встановлено не було, що стало підставою для зміни в даних випадках діагнозу «ЦД 2-го типу» на «ЦД 1-го типу». У решти хворих основної групи досягалася короткочасна суб- або компенсація вуглеводного обміну. Однак навіть на тлі відносно задовільних показників глікемії зберігалися діабетичні скарги, зокрема 83 (77,57 %) особи даної групи відзначали зниження маси тіла, що не можна було пов’язати тільки з дотриманням ними дієти. Стабільність маси тіла вважається одним із критеріїв компенсації вуглеводного обміну, а наведені дані стосовно негативної динаміки цього показника підтверджують відсутність досягнення задовільного метаболічного контролю у хворих на ППАДД на даному етапі захворювання. Незважаючи на постійну корекцію пероральної цукрознижуючої терапії, у строки 2,61 ± 1,60 року від появи перших скарг та 1,97 ± 1,59 року від моменту встановлення діагнозу у хворих 1-ї групи розвинулася стійка декомпенсація вуглеводного обміну. У 32 (29,91 %) із цих пацієнтів на тлі прийому пероральних цукрознижуючих препаратів розвиток декомпенсації вуглеводного обміну супроводжувався кетоацидозом. Переважна кількість хворих на ППАДД змогли вказати лише дані щодо цукру крові під час переведення на інсулін, які коливалися в діапазоні від 10,0 до 25,0 ммоль/л. Зазначені показники вірогідно відрізнялися (р < 0,0001) від таких у хворих 3-ї групи, які отримували аналогічну терапію протягом такого ж періоду (табл. 1). Крім того, жодного випадку виявлення ацетонурії у хворих на ЦД 2-го типу на тлі пероральної терапії встановлено не було.
Підтвердженням неефективності пероральної цукрознижувальної терапії був також рівень глікозильованого гемоглобіну на тлі цього виду лікування, який або оцінювався за даними анамнезу, або визначався в цьому дослідженні (табл. 1).
Неможливість досягнення метаболічного контролю на тлі пероральної терапії стала підставою для переведення хворих на ППАДД на інсулінотерапію. Застосування інсуліну хворими цієї групи супроводжувалося поліпшенням загального стану, меншою вираженістю та/або зникненням діабетичних скарг, стабілізацією маси тіла в поєднанні зі зниженням показників глікемії. Рівень глікозильованого гемоглобіну на тлі інсулінотерапії становив 7,84 ± 1,71 % проти 9,51 ± 1,69 % при застосуванні пероральної терапії.
З урахуванням показників вуглеводного обміну проведено аналіз рівня С-пептиду, який у клінічній практиці є одним із критеріїв вибору цукрознижуючої терапії. За даним показником з використанням критерію Краскела — Уолліса встановлено значущі відмінності між групами спостереження (Н = 54,708; р < 0,001).
Визначено вірогідне зниження вмісту С-пептиду в крові у хворих на ППАДД та ЦД 1-го типу порівняно з його значенням у хворих на ЦД 2-го типу. Водночас за відсутності вірогідної різниці за даним показником між хворими на ППАДД та ЦД 1-го типу, незважаючи на суттєві зміни рівня С-пептиду у хворих на ППАДД, встановлено лише тенденцію до зниження С-пептиду у хворих на ППАДД порівняно з контролем, а між хворими на ЦД 2-го типу та контролем за даним показником вірогідна різниця не визначалася. Вказані дані щодо рівня С-пептиду у хворих на ППАДД слід пояснити результатами певних досліджень. Отже, особливістю ППАДД вважається маніфестація захворювання при меншому рівні руйнування бета-клітин внаслідок сполучення автоімунного процесу з інсулінорезистентністю [11]. Крім того, визначення концентрації С-пептиду в плазмі крові також не завжди дає можливість навіть при класичних варіантах перебігу захворювання диференціювати ЦД 1-го та 2-го типу [12].
Результати комплексного обстеження свідчили, що, на відміну від хворих на ЦД 1-го та 2-го типу, у хворих на ППАДД за наявності досить короткого діабетичного анамнезу зафіксовано виражені мікросудинні ускладнення, а саме проліферативну ретинопатію, протеїнуричну стадію нефропатії. Встановлено, що факторами впливу на розвиток діабетичної ретинопатії у хворих на ППАДД є час із моменту появи перших скарг та час із моменту встановлення діагнозу, тобто тривалість захворювання, а також термін до призначення інсулінотерапії як від моменту появи перших скарг, так і від моменту встановлення діагнозу. Останні два чинники відображають термін перебування хворих у стані нестабільної субкомпенсації або декомпенсації вуглеводного обміну на тлі пероральної цукрознижуючої терапії [13]. Ранній розвиток та прогресування зазначених хронічних діабетичних ускладнень у хворих на ППАДД слід пов’язати з феноменом так званої метаболічної пам’яті [14]. Даним феноменом визначається ушкоджуюча дія гіперглікемії, що зберігається навіть після досягнення задовільного метаболічного контролю.
Незважаючи на безліч питань щодо ППАДД, на сьогодні загальноприйнято, що патоморфологічним субстратом даної форми захворювання є автоімунний інсуліт. Саме тому верифікація ППАДД ґрунтується на визначенні позитивного титру автоантитіл до структурних компонентів бета-клітин підшлункової залози [15]. Автоімунна деструкція острівцевих клітин призводить зрештою до зниження інсулінпродукуючої функції підшлункової залози, що клінічно проявляється розвитком вираженої декомпенсації вуглеводного обміну у хворих на ППАДД в середньому в терміни від 0,5 року до 3–5 років від маніфестації захворювання [16].
Отримані нами результати свідчать, що за умов дослідження всіх трьох антитіл (GAD ab, ІСА ab, IA-2 ab) наявність ізольованого позитивного титру лише одного виду спостерігалася тільки у 28 хворих (24,14 %) на ППАДД. У більшості пацієнтів даної групи визначалися позитивні титри 2–3 антитіл. Зазначене вказує на досить високий ступінь автоагресії. Одним з обґрунтувань раннього призначення інсулінотерапії хворим на ППАДД є протекторна дія екзогенного інсуліну на бета-клітини за розвитку автоімунного інсуліту, що дозволяє знизити інтенсивність їх руйнування, а значить, зберегти залишкову функціональну активність [17].
Отже, ступінь декомпенсації вуглеводного обміну на етапі маніфестації ППАДД, відсутність адекватного метаболічного контролю при застосуванні пероральної цукрознижуючої терапії, розвиток за цих умов виражених мікросудинних ускладнень у хворих цієї групи, а також зниження на тлі автоімунного інсуліту інсулінпродукуючої функції бета-клітин, що встановлено за вмістом С-пептиду, який був співвідносний з таким за ЦД 1-го типу, — усе це обґрунтовує доцільність якомога раннього призначення інсуліну хворим на ППАДД.
Водночас навіть на тлі інсулінотерапії в окремих випадках поєднання ППАДД та метаболічного синдрому (МС) не вдавалося знизити показники глікемії. Про можливість поєднання ППАДД та МС свідчать дані низки робіт [18]. За результатами цього дослідження, ознаки МС (ожиріння за абдомінальним типом розподілу підшкірно-жирової клітковини, артеріальна гіпертензія, дисліпідемія з підвищенням вмісту в крові ТГ та ХС-ЛПДНЩ у поєднанні зі значущим зниженням рівня ХС-ЛПВЩ) встановлені у 25 хворих (20,66 %) на ППАДД. Додаткове до препаратів інсуліну призначення метформіну в дозі 500–1000 мг/добу призводило до вірогідного зниження показників середньодобової глікемії — з 10,53 ± 2,02 ммоль/л до 9,21 ± 1,99 ммоль/л (р < 0,05). Отже, наявність у хворих на ППАДД кластерів МС обґрунтовує доцільність призначення додатково до інсуліну метформіну.
Висновки
1. Дані аналізу стану вуглеводного обміну на етапі маніфестації ППАДД, відсутність досягнення адекватного метаболічного контролю при застосуванні пероральної цукрознижуючої терапії, що призводить у хворих цієї групи за умов нетривалого терміну захворювання до розвитку виражених мікросудинних ускладнень, а також зниження на тлі автоімунного інсуліту інсулінпродукуючої функції бета-клітин — усе це обґрунтовує необхідність призначення інсуліну на стадії виявлення даної форми ЦД.
2. За наявності у хворих на ППАДД кластерів МС є цілком виправданим у даних випадках призначення метформіну додатково до інсуліну.
1. Diagnosis and Classification of Diabetes Mellitus // Diabetes Care. — 2013. — 36 (1). — S67–S74.
2. Наказ від 22.05.2009 № 356 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Ендокринологія». — 56 с.
3. Laiteerapong N., John P.M., Public A.G. et al. Public health implications of recommendations to individualize glycemic targets in adults with diabetes [Text] / N.Laiteerapong, P.M. John, A.G. Nathan [et al.] // Diabetes Care. — 2013. — 36 (1). — Р. 84–89.
4. Nambam B., Aggarwal S., Jain A. et al. Latent autoimmune diabetes in adults: A distinct but heterogeneous clinical entity [Text] / B. Nambam, S. Aggarwal, A. Jain [et al.] // Wld J. Diabetes. — 2010. — 15 (1). — Р. 111–115.
5. Naik R.G. Latent autoimmune diabetes in adults [Text] / R.G. Naik, B.M. Brooks-Worrell, J.P. Palmer // J. Clin. Endocrinol. Metab. — 2009. — 94 (12). — Р. 4635–4644.
6. Brophy S., Davies H., Mannan S. et al. Interventions for latent autoimmune diabetes (LADA) in adults // Cochrane Database Syst. Rev. — 2011. — 7 (9): CD006165. doi: 10.1002/14651858.CD006165.pub3.
7. Poudel R.R. Latent autoimmune diabetes of adults: From oral hypoglycemic agents to early insulin [Text] // Indian J. Endocrinol. Metab. — 2012. — 16(1). — S41–S46.
8. Zhao Y., Xiang Y.L.Y., Liu L., et al. Dipeptidyl peptidase 4 inhibitor sitagliptin maintains β-cell function in patients with recent-onset latent autoimmune diabetes in adults: one year prospective study [Text] // J. Clin. Endocrinol. Metab. — 2014. — 99 (5). — E876–E880.
9. Поздняк А.О. Латентный аутоиммунный диабет взрослых (LADA): вопросы и перспективы лечения [Tекст]/ А.О. Поздняк // Український медичний альманах. — 2008. — № 4. — С. 170–172.
10. Otto-Buczkowska E. Тype LADA diabetes — іnterrogation points [Text] / Е. Otto-Buczkowska // Przegl. Lek. — 2013. — 70 (1). — Р. 25–27.
11. Никонова Т.В. Сахарный диабет 1-го типа и латентный аутоиммунный диабет взрослых (LADA): клинические, иммунно-генетические и гормонально-метаболические аспекты [Tекст]: Автореф. дис. … д-ра мед. наук : 14.01.02 / Т. В. Никонова; Эндокринол. науч. центр Минздравсоцразвития РФ. — М., 2011. — 38 с.
12. Дрыгин А.Н. Клинико-лабораторные критерии метаболической гетерогенности сахарного диабета 1-го и 2-го типов [Текст] / А.Н. Дрыгин // Міжнародний ендокринологічний журнал. — 2010. — № 8. — С. 18–26.
13. Тихонова Т.М. Формування мікросудинних ускладнень у хворих на повільно прогресуючий автоімунний діабет дорослих [Текст] / Т. М. Тихонова // Клінічна ендокринологія та ендокринна хірургія. — 2014. — 1. — С. 47–52.
14. Aschner P.J., Ruiz A.J. Metabolic memory for vascular disease in diabetes [Text] / P.J. Aschner, A.J. Ruiz // Diabetes Technol. Ther. — 2012. — 14 (1). — Р. 68–74.
15. Characteristics and Prevalence of Latent Autoimmune Diabetes in Adults (LADA) [Text] / P.P. Brahmkshatriya, A.A. Mehta, B.D. Saboo, R.K. Goyal // ISRN Pharmacol. — 2012. doi: 10.5402/2012/580202.
16. Seok H. Latent Autoimmune Diabetes in Adults: Autoimmune Diabetes in Adults with Slowly Progressive β-cell Failure [Text] / H. Seok, B.W. Lee// Diabetes Metab. J. — 2012. — 36(2). — 116–119.
17. Cernea S., Buzzetti R., Pozzilli P. Beta-cell protection and therapy for latent autoimmune diabetes in adults [Text] / S. Cernea, R. Buzzetti, P.Pozzilli // Diabetes Care. — 2009. — 32 (2). — S246–S252.
18. Zhou J. Study on prevalence of latent autoimmune diabetes in adults and its relationship with metabolic syndrome [Text] / J. Zhou, X. J. Ma, Y. Q. Bao [et al.] // Zhonghua Yi Xue Za Zhi. — 2009. — 89 (18). — Р. 1250–1254.

/30/30.jpg)