Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Досвід застосування левотироксину та антиоксидантів при терапії неплідності в чоловіків, хворих на гіпотиреоз
Авторы: Бондаренко В.О. - ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків; Співак Ж.С. - КЗ «Обласна клінічна лікарня», м. Суми
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Метою роботи було встановлення характеру змін рівнів гонадотропінів, тестостерону, а також параметрів спермограм у неплідних чоловіків із гіпофункцією щитоподібної залози під впливом монотерапії левотироксином, а також при лікуванні селеновмісним препаратом цефаселем і вітаміном Е разом із левотироксином.
Матеріали та методи. Було обстежено 84 неплідні чоловіки із гіпофункцією щитоподібної залози віком 22–44 роки. Хворі на первинний гіпотиреоз залежно від терапії були розподілені на три групи: пацієнти першої групи (12 чоловіків, у яких гіпотиреоз мав місце на тлі суттєвого зростання антитіл до тиреоїдної пероксидази) крім левотироксину отримували протягом трьох місяців цефасель та вітамін Е; друга група (20 осіб) отримувала аналогічну терапію; третя група (17 хворих) отримувала монотерапію тільки левотироксином. Неплідні із субклінічним гіпотиреозом також розподілені на дві групи: 21 чоловіка лікували тільки левотироксином, 14 хворим застосовувалась комплексна терапія. До та після лікування досліджувались рівні лютеїнізуючого та фолікулостимулюючого гормонів, тестостерону, тиреотропного гормону та тироксину вільного, аналізувались параметри спермограм.
Результати. Після терапії, незалежно від її варіанту, у всіх групах хворих відбувалася компенсація тиреоїдного статусу, вірогідне зростання рівня тестостерону в крові без посилення секреції гонадотропінів. Аналіз параметрів спермограм після лікування показав, що в неплідних як при первинному, так і при субклінічному гіпотиреозі частота їх нормалізації була суттєво вищою при застосуванні комплексної терапії.
Висновки. Проведені дослідження свідчать, що компенсація тиреоїдного статусу в неплідних чоловіків із гіпофункцією щитоподібної залози є головним чинником, що сприяє посиленню секреції тестостерону. Для покращення фертилізаційної здатності сперми та нормалізації сперматогенезу даному контингенту хворих разом із левотироксином доцільно призначати антиоксидантну терапію (цефасель та вітамін Е).
Целью работы было установление характера изменений уровней гонадотропинов, тестостерона, а также параметров спермограмм у бесплодных мужчин с гипофункцией щитовидной железы под влиянием монотерапии левотироксином, а также при лечении селенсодержащим препаратом цефасель и витамином Е вместе с левотироксином.
Материалы и методы. Были обследованы 84 бесплодных мужчины с гипофункцией щитовидной железы в возрасте 22–44 года. Больные первичным гипотиреозом в зависимости от терапии были разделены на три группы: пациенты первой группы (12 мужчин, у которых гипотиреоз был на фоне существенного повышения уровня антител к тиреоидной пероксидазе) кроме левотироксина получали в течение трех месяцев цефасель и витамин Е; вторая группа (20 человек) получала аналогичную терапию; третья группа (17 больных) получала монотерапию одним левотироксином. Бесплодные мужчины с субклиническим гипотиреозом также разделены на две группы: 21 человек лечился только одним левотироксином, у 14 больных применялась комплексная терапия. До и после лечения исследовались уровни лютеинизирующего, фолликулостимулирующего гормона, тестостерона, тиреотропного гормона и тироксина свободного, анализировались параметры спермограмм.
Результаты. После терапии, независимо от ее варианта, во всех группах больных происходила компенсация тиреоидного статуса, достоверный рост уровня тестостерона в крови без усиления секреции гонадотропинов. Анализ параметров спермограмм после лечения показал, что у бесплодных как при первичном, так и при субклиническом гипотиреозе частота их нормализации была существенно выше при применении комплексной терапии.
Выводы. Проведенные исследования показывают, что компенсация тиреоидного статуса у бесплодных мужчин с гипофункцией щитовидной железы является главным фактором, способствующим усилению секреции тестостерона. Для улучшения фертилизационной способности спермы и нормализации сперматогенеза данному контингенту больных вместе с левотироксином целесообразно назначение антиоксидантной терапии (цефасель и витамин Е).
The aim of the study was to establish the nature of changes in levels of gonadotrophins, testosterone and semen parameters in infertile men with thyroid gland hypofunction under the influence of Levothyroxine monotherapy and selenium-containing Cefasel and vitamin E together with Levothyroxine.
Materials and methods. 84 infertile men with thyroid hypofunction aged 22–44 years old were examined. The patients with primary hypothyroidism were divided into three groups: the first group (12 men), who has hypothyroidism against the background of a significant increase in antibodies to thyroid peroxidase, received cefasel and vitamin E in addition to levothyroxine within three months; the second group (20 persons) received a similar treatment; the third group (17 patients) received levothyroxine monotherapy. Sterile men with subclinical hypothyroidism were divided into two groups: 21 persons were treated with only levothyroxine and 14 patients used combined therapy. Levels of luteinizing hormone, follicle-stimulating, testosterone, thyrotropic hormone and free thyroxine were investigated and semen parameters were analyzed before and after treatment.
Results. After treatment, regardless of its kind, in all groups of patients compensation of thyroid status, growth of testosterone levels without gonadotropin secretion increasing were found. Analysis of the semen after treatment showed that in infertile men both with primary and subclinical hypothyroidism the frequency of normalization is significantly higher in combined therapy using.
Conclusions. Our studies show that thyroid status compensation in infertile men with hypofunction of the thyroid gland is a main factor that contributes the increasing of testosterone secretion. To improve the fertilization ability of sperm and to normalize the spermatogenesis in this group of patients it is appropriate to use antioxidant therapy, which consists of cefasel and vitamin E in addition to levothyroxine.
гіпотиреоз, неплідність, левотироксин, цефасель, вітамін Е.
гипотиреоз, бесплодие, левотироксин, цефасель, витамин Е.
hypothyroidism, infertility, levothyroxine, cefasel, vitamin E.
Статья опубликована на с. 35-39
Попередні наші дослідження свідчать, що майже в половини неплідних чоловіків із гіпофункцією щитоподібної залози (ЩЗ) розвиток патоспермій відбувається на тлі інкреторної недостатності яєчок. При цьому в більшості хворих гіпоандрогенний статус формується за типом нормогонадотропного гіпогонадизму, коли рівні лютеїнізуючого (ЛГ) та фолікулостимулюючого (ФСГ) гормонів знаходяться в межах референтних значень норми [1, 2]. Якщо відсутня гіпоандрогенемія в чоловіків із маніфестним та субклінічним гіпотиреозом (СГ), порушення фертилізаційної здатності сперми, ймовірно, буде обумовлене розвитком оксидативного стресу в яєчках [3].
У зв’язку з цим неплідним чоловікам із гіпофункцією ЩЗ, окрім препаратів L-тироксину, виправдане призначення антиоксидантів. Доцільним є застосування препаратів, які містять мікроелемент селен, що входить до складу ферменту глутатіонпероксидази, активність якої при гіпотиреозі суттєво знижена [4, 5]. Крім того, селен перешкоджає накопиченню перекису водню в ЩЗ, бере участь в обміні гормонів у ЩЗ, виявляє імунокоригувальні властивості [6, 7]. Селеновмісні препарати сприяють зниженню рівня антитіл до тиреоїдної пероксидази (ТПО) у хворих на автоімунний тиреоїдит (АІТ) [8, 9] і за рахунок цього, ймовірно, зменшують феномен аглютинації сперматозоїдів при неплідності в чоловіків на тлі АІТ [10].
Як і селен, відомий антиоксидант вітамін Е широко застосовується при терапії неплідності в чоловіків [11–13]. Крім антиоксидантної, вітаміну Е також притаманна властивість неспецифічного стимулятора системи «гіпофіз — статеві залози» [14]. У той же час на сьогодні не відомо, яким чином використання даних антиоксидантів разом з L-тироксином впливає на функціональний стан гіпофізарно-гонадної системи в неплідних чоловіків із гіпофункцією ЩЗ.
Мета дослідження — встановити характер змін рівнів гонадотропінів, тестостерону (Т), а також параметрів спермограм у неплідних чоловіків із гіпофункцією ЩЗ під впливом монотерапії левотироксином, а також при лікуванні селеновмісним препаратом цефасель і вітаміном Е разом з левотироксином.
Матеріали та методи
Були обстежені 84 неплідних чоловіки з гіпофункцією ЩЗ віком 22–44 роки. На підставі проведеного клінічного та сонографічного обстеження, визначення в крові рівнів тиреотропного гормону (ТТГ), тироксину вільного (Т4вільн.) та антитіл до ТПО в 49 пацієнтів був встановлений первинний гіпотиреоз (ПГ) та в 35 хворих — СГ. Неплідні з ПГ були розподілені на три групи: перша група (12 чоловіків, у яких гіпотиреоз був на тлі суттєвого зростання рівня антитіл до тиреоїдної пероксидази) крім левотироксину отримувала протягом трьох місяців селеновмісний препарат цефасель та вітамін Е; друга група (20 осіб) отримувала аналогічну терапію; третя група (17 хворих) отримувала тільки монотерапію левотироксином.
Пацієнти із СГ були також розподілені на дві групи: першу групу (21 чоловік) лікували тільки левотироксином; друга група (14 хворих) отримувала вищезазначену комплексну терапію.
Левотироксин призначався в дозі 50–100 мкг на добу, цефасель — у дозі 100 мкг, вітамін Е — по 200 мг на добу. Доза левотироксину коригувалась через місяць та два місяці лікування залежно від компенсації тиреоїдного статусу.
У неплідних чоловіків до та після завершення терапії проводили дослідження параметрів спермограм та їх оцінку згідно з критеріями ВООЗ [15], визначали в крові рівні ТТГ, Т4вільн., ЛГ, ФСГ та тестостерону імуноферментним методом, використовуючи набори фірми «Алкор-Био» (Російська Федерація). У хворих на ПГ першої групи аналізувались також рівні антитіл до ТПО до та після лікування.
Статистична обробка отриманих даних проводилась за допомогою стандартного пакета статистичних розрахунків Statistica версії 6.0. Вірогідність розбіжностей середніх величин визначали за t-критерієм Стьюдента. Розбіжності вважалися значущими при р < 0,05. При порівняльному аналізі відносних величин використовували критерій x2.
Результати та їх обговорення
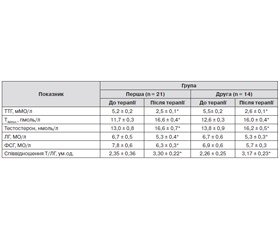
Після завершення лікування в пацієнтів всіх трьох груп із ПГ відбувалася нормалізація показників тиреоїдного статусу (табл. 1). Паралельно в них вірогідно зростали середні значення рівня тестостерону в крові. При цьому посилення секреції андрогену відбувалося не за рахунок стимуляції секреції ЛГ. У хворих спостерігалося навіть деяке зменшення середніх величин рівня ЛГ, але ці зміни були вірогідні тільки в групах, що отримували комплексне лікування. Рівень ФСГ у неплідних чоловіків, хворих на ПГ, вірогідно не змінювався, але в них відзначалася тенденція до зменшення середніх значень гормону. Необхідно вказати, що зміни гонадотропінів після завершення тримісячного терміну лікування пацієнтів відбувалися в межах референтних значень норми і не досягали показників, характерних для хворих на гонадотропний гіпогонадизм. У свою чергу, застосування цефаселю разом із вітаміном Е сприяло зростанню середніх величин коефіцієнта Т/ЛГ, що свідчить про посилення впливу ЛГ на сім’яники [16].
Доречно також відзначити, що в осіб першої групи спостерігалося зниження середніх величин антитіл до ТПО з 279,0 ± 27,3 МО/мл до 123,1 ± 11,9 МО/мл (р < 0,001) та зменшення феномену аглютинації сперматозоїдів із 2,1 ± 0,3+ до 0,6 ± 0,1+ (р < 0,001).
Аналогічно відбувалася компенсація тиреоїдного статусу після завершення лікування й у пацієнтів із СГ (табл. 2). При цьому посилення секреції тестостерону, середні величини якого суттєво зросли після терапії, також не обумовлене активацією продукції ЛГ. Як і у хворих на ПГ, фіксувалося навіть зменшення середніх значень ЛГ незалежно від варіанту призначеного лікування. Рівні ФСГ у групах також не зростали. У той же час в обох групах відбувалося збільшення середніх величин показника реалізації дії ЛГ на клітини Лейдіга — співвідношення Т/ЛГ.
Усе це вказує, що головним чинником, який сприяє зростанню рівня тестостерону в неплідних чоловіків із гіпофункцією ЩЗ, є насамперед нормалізація тиреоїдного статусу. Відомо, що при гіпотиреозі відбувається зниження активності ферментів, які відповідають за синтез тестостерону в сім’яниках [17]. Ймовірно, ліквідація стану недостатності тиреоїдних гормонів відновлює процеси біосинтезу тестостерону в яєчках.
Аналіз параметрів спермограм після завершення терапії показав, що серед пацієнтів другої групи з ПГ нормалізація всіх параметрів спермограм згідно з критеріями ВООЗ (НЗС) відбувалася у 80,0 % спостережень (табл. 3). У третій групі (хворі отримували монотерапію левотироксином) НЗС була встановлена в 41,2 % випадків. При цьому частота констатації НЗС у пацієнтів третьої групи була суттєво меншою, ніж у неплідних чоловіків другої групи, які отримували комплексне лікування (χ2 = 4,35, р < 0,05). У групах хворих із ПГ, яким призначалась антиоксидантна терапія (перша та друга групи), вірогідної різниці в частоті нормалізації параметрів спермограм не виявлено (χ2 = 1,9, р > 0,05).
У хворих на СГ при використанні комплексного лікування компенсація всіх параметрів спермограм відмічалась у 92,9 % осіб; у випадках, коли призначався один левотироксин, — у 52,4 % пацієнтів. Аналіз методом χ2 виявив вірогідну відмінність щодо нормалізації сперматогенної функції яєчок у хворих на СГ, яким разом з левотироксином призначалася антиоксидантна терапія (χ2 = 4,52, р < 0,05).
Необхідно зазначити, що до терапії основною ознакою патоспермій у неплідних чоловіків із гіпофункцією ЩЗ є астенозооспермія (АстЗС), при якій знижені рухливість сперміїв та їх життєздатність. До лікування АстЗС визначалась у 83,7 % хворих на ПГ та у 85,7 % чоловіків із СГ. Це свідчить, що при гіпотиреозі насамперед має місце порушення функціональної зрілості сперматозоїдів [13]. Призначення антиоксидантів, зокрема вітаміну Е та селену, при терапії неплідності в чоловіків призводить до посилення рухливості сперміїв та покращення їх фертилізаційної здатності [18]. Утім, ні селен, ні вітамін Е самі по собі не сприяють активації секреції тестостерону [16, 19], а застосування антиоксидантної терапії більш ефективне, коли до терапії в неплідних чоловіків відсутній андрогенодефіцит [20]. Тобто в осіб із гіпофункцією ЩЗ, у яких знижені рівні тестостерону в крові, необхідним є відновлення його продукції. А це можливо тільки за умов ліквідації недостатності тиреоїдних гормонів в організмі хворого.
Висновки
1. Компенсація тиреоїдного статусу в неплідних чоловіків із гіпофункцією щитоподібної залози є головним чинником, що сприяє посиленню секреції тестостерону.
2. Для покращення фертилізаційної здатності сперми та нормалізації сперматогенезу даному контингенту хворих разом із левотироксином доцільним є призначення як мінімум протягом трьох місяців антиоксидантної схеми терапії, що складається з селеновмісного препарату цефаселю та вітаміну Е.
1. Бондаренко В.А., Спивак Ж.С., Минухин А.С. Функциональное состояние системы гипофиз — гонады при бесплодии у мужчин, больных первичным гипотиреозом // Здоровье мужчины. — 2012. — № 2. — С. 174–176.
2. Спивак Ж.С. Состояние системы репродукции у мужчин с бесплодием, больных субклиническим гипотиреозом // Междунар. мед. журн. — 2012. — Т. 18, № 4. — С. 94–96.
3. Wajner S.M., Wagner M.S., Maia A.L. Clinical implications of altered thyroid status in male testicular function // Arg. Bras. Endocrinol. Metabol. — 2009. — Vol. 53, № 8. — P. 972–982.
4. Ramos A., Lane A.N., Hollingworth D. еt al. Secondary structure and stability of the selenocysteine insertion sequences (SECIS) for human thioredoxinreductaes and glutation peroxidase // Nucl. Acids Res. — 2004. — Vol. 32, № 5. — P. 1746–1755.
5. Abou-Eigait A.T., Rateb A., Mahmoud F.Y. et al. Effect of experimentally induced hypothyroidism during pregnancy and lactation on the retina of juvenile and adult albino rats and possible role of thyroid hormone supplementation // Egypt. J. Histol. — 2011. — Vol. 34. — P. 28–45.
6. Гончарова О.А., Ільїна І.М. Селен і автоімунний тиреоїдит // Міжнародний ендокринолічний журнал. — 2010. — № 6. — С. 71–74.
7. Панькив В.И. Проблема сочетанного дефицита йода и селена в развитии заболеваний щитовидной железы // Міжнародний ендокринологічний журнал. — 2014. — № 5. — С. 75–80.
8. Гончарова О.А., Ільїна І.М. Характеристика імунокоригуючого впливу препарату цефасель у жінок з аутоімунним тиреоїдитом постменопаузального віку // Ендокринологія. — 2012. — Т. 17, № 1. — С. 22–23.
9. Drutel A., Archmbeaud F., Caron P. Selenium and the thyroid gland // Clin. Endocrinol. — 2013. — Vol. 78, № 2. — P. 155–164.
10. Співак Ж.С., Бондаренко В.О., Мірошниченко А.В. Динаміка функціонального стану сім’яників у неплідних чоловіків, хворих на автоімунний тиреоїдит, під впливом антиоксидантно-імунокоригуючої терапії // Журн. клініч. та експерим. досліджень. — 2013. — Т. 1, № 2. — С. 144–148.
11. Isidory A.M., Pozza C., Qianfrilli D. Medical treatment to improve spermquality // Reproductive Bio Medicine Online. — 2006. — Vol. 12, Comp. 1. — P. 23–32.
12. Rahul S., Geeta J. Selenium in Health and Disease // Kuwait Med. J. — 2007. — Vol. 39, № 1. — P. 10–18.
13. Карпенко Н.О., Бондаренко В.О., Кавок Н.С., Боріков О.Ю. Дозрівання сперматозоїдів: події, наслідки, можливі шляхи контролю // Фізіол. журн. — 2007. — Т. 53, № 1. — С. 91–103.
14. Имшинецкая Л.П. Неотложные вопросы детской андрологии // Здоровье мужчины. — 2003. — № 1. — С. 59–61.
15. Cooper T.G., Noonan E., Von Eckardstein S. et al. World Health Organization reference values for human semen characteristics // Human Reprod. Update. — 2010. — Vol. 16, № 3. — P. 231–245.
16. Бондаренко В.О. Стан репродуктивної та сексуальної функцій при недостатності пубертату у чоловіків, механізми розвитку та терапія їх порушень: Автореф. дис… д-ра мед. наук: 14.01.14; Інститут проблем ендокринної патології ім. В.Я. Данилевського. — Харків, 2004. — 36 с.
17. Wagner M.S., Wajner S.M., Maia A.L. The role of thyroid hormone in testicular development and function // J. Endocrinol. — 2008. — Vol. 199, № 3. — P. 351–365.
18. Agarwal A., Sekhon L.H. The role of antioxidant therapy in the treatment of male infertility // Human Fertility. — 2010. — Vol. 13, № 4. — P. 217–225.
19. Hawkes W.C., Turek P.J. Effect of dietary selenium of sperm motility in healthy men // J. Andrology. — 2001. — Vol. 22, № 5. — P. 764–772.
20. Бондаренко В.О., Карпенко Н.О., Кожем’яка В.А., Мінухін А.С. Досвід застосування комплексу карбонат — вітамін Е при лікуванні гіпофертильності невизначеного ґенезу в чоловіків // Пробл. ендокрин. патології. — 2007. — № 3. — С. 28–33.

/36/36.jpg)
/37/37.jpg)