Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Современный взгляд на патогенетическую терапию диабетической полинейропатии
Авторы: Перцева Н.О., Михайлинчик И.Н. - ГУ «Днепропетровская медицинская академия МЗ Украины»
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Статья посвящена лечению диабетической полинейропатии с применением препарата Актовегин. Приведены результаты исследования эффективности этого препарата у 200 пациентов с сахарным диабетом (возраст — от 19 до 88 лет). В результате патогенетической терапии Актовегином удалось уменьшить выраженность диабетической полинейропатии — 32 % лиц с выраженной диабетической полинейропатией перешли в группу пациентов с умеренной диабетической полинейропатией.
Стаття присвячена лікуванню діабетичної полінейропатії із застосуванням препарату Актовегін. Наведено результати дослідження ефективності цього препарату у 200 пацієнтів із цукровим діабетом (віком від 19 до 88 років). Внаслідок патогенетичної терапії Актовегіном вдалося зменшити вираженість діабетичної полінейропатії — 32 % осіб із вираженою діабетичною полінейропатією перейшли до групи пацієнтів із помірною діабетичною полінейропатією.
The article deals with the treatment of diabetic polyneuropathy (DPN) using Actovegin. The results of research on the effectiveness of this drug in 200 patients with diabetes mellitus (aged from 19 to 88 years) are provided. As a result of pathogenetic therapy with Actovegin, it was able to reduce the severity of DPN — 32 % of patients with severe diabetic neuropathy moved to a group of patients with moderate DPN.
диабетическая полинейропатия, патогенетическая терапия, Актовегин.
діабетична полінейропатія, патогенетична терапія, Актовегін.
diabetic polyneuropathy, pathogenetic therapy, Actovegin.
Статья опубликована на с. 85-89
Сахарный диабет (CД) — важная медицинская и социальная проблема современного общества, что обусловлено значительным ростом распространенности этого заболевания. Значительный рост заболеваемости СД во всем мире стимулирует развитие современных медицинских технологий, способствующих увеличению продолжительности жизни пациентов с данной патологией. Другой стороной этого процесса является увеличение количества осложнений СД, ведущая роль которых принадлежит диабетической полинейропатии (ДПН).
Распространенность ДПН среди лиц, длительно страдающих сахарным диабетом, составляет около 50 % [1–3]. При этом примерно у половины пациентов с ДПН не отмечается явных симптомов, и только тщательное клиническое обследование позволяет установить диагноз. ДПН, особенно при наличии болевого синдрома, связана со значительным ухудшением качества жизни пациентов [3, 4].
ДПН определяется наличием симптомов поражения нервных волокон у лиц с СД при отсутствии других причин нейропатии. В настоящее время существует несколько видов классификаций ДПН. Одна из наиболее распространенных и часто применяемых — классификация, предложенная P.K. Thomas, которая включает три основные формы: острую, генерализованную симметричную полинейропатию и координационные, или мультифокальные, нейропатии [4].
Наиболее часто в клинической практике встречается дистальная симметричная сенсомоторная полинейропатия как один из вариантов генерализованной симметричной нейропатии.
Наиболее значимыми этиологическими факторами развития ДПН являются тяжесть и длительность СД, недостаточный гликемический контроль, ожирение, артериальная гипертензия (АГ), возраст, курение, дислипидемия [5, 12].
Пусковым механизмом в развитии патогенеза ДПН считается поражение нервных волокон, возникающее вследствие токсического действия гипергликемии на метаболические процессы в них. Поражение миелиновой оболочки является причиной нарушения проведения возбуждения по нервному волокну [6, 7]. Все это приводит к снижению чувствительности дистальных отделов нижних конечностей, а также является одной из главных причин возникновения язвы стопы и последующей ампутации конечности [7, 8].
Доказано, что наличие диабетической нейропатии повышает риск ампутации в 1,7 раза, в сочетании с деформациями риск возрастает в 12 раз, а при наличии язв в анамнезе — в 36 раз [9, 10]. В целом диабетические язвы стоп в течение жизни развиваются у 15 % пациентов и наблюдаются у 6–20 % госпитализированных больных [13, 14].
Высокие цифры выявляемых осложнений ДПН связаны с недостаточным уровнем ранней диагностики и лечения таких пациентов. В клинической практике для выявления ДПН, наряду с оценкой жалоб и осмотром пациента, определяют следующие виды чувствительности: вибрационную, тактильную, температурную и болевую.
Ввиду того, что наиболее ранним и характерным проявлением ДПН является снижение порога вибрационной чувствительности (ПВЧ), целесообразно проводить его оценку ежегодно при помощи биотензиометра или градуированного камертона с частотой 128 Гц. Однако в отличие от камертона, который является качественным методом определения порога вибрационной чувствительности, биотензиометр относится к объективным количественным исследованиям чувствительности. Необходимо отметить, что существует возрастное увеличение порога вибрационной чувствительности, которое ни в коей мере не свидетельствует о развитии периферической нейропатии и не дает предпосылок к постановке диагноза ДПН у лиц с СД, однако является дополнительным фактором риска поражения стоп у данных пациентов [12].
D.V. Coppini и др. опубликовали данные о том, что такой диагностический параметр ДПН, как порог вибрационной чувствительности, может служить маркером повышения риска смертности у больных СД [9]. C.A. Abbott в своих работах показал, что повышенный порог вибрационной чувствительности (> 25 В) хотя бы на одной стопе в семь раз увеличивает риск развития язвы стопы по сравнению с теми пациентами, у которых ПВЧ < 15, что является одной из наиболее распространенных причин для госпитализаций и ампутаций ног у больных СД [10].
Исследование тактильной чувствительности проводят с помощью волосковых монофиламентов весом 10 г. При проведении исследования следует избегать зон гиперкератоза и изъязвлений. Снижение тактильной чувствительности выявляется на поздних стадиях ДПН и свидетельствует о довольно значимых расстройствах. Определение порога болевой и температурной чувствительности проводят с помощью укола иглой и термического наконечника Tipterm в области тыльной поверхности большого пальца стопы, тыла стопы, медиальной поверхности лодыжки и голени.
ДПН ухудшает течение СД, поэтому необходимо как можно раньше выявлять данное осложнение и начинать терапию, а также профилактические мероприятия. В качестве патогенетической терапии пациентов с ДПН, согласно рекомендациям МЗ Украины, используются лекарственные препараты, обладающие антиоксидантными, нейротропными, антигипоксическими свойствами, которые должны приводить к оптимизации деятельности нервной системы и увеличению энергетического потенциала нервных клеток [15].
В настоящее время большой интерес вызывает широкое применение Актовегина в патогенетическом лечении осложнений СД. Применение Актовегина является уже традиционным в современной медицине, а также накоплен достаточный опыт его использования при ДПН.
Материалы и методы исследования
Нами было обследовано 200 пациентов с СД в возрасте от 19 до 88 лет (115 женщин и 85 мужчин). Все пациенты находились на стационарном лечении в эндокринологическом отделении ОСП «Клиника медицинской академии» ГУ «Днепропетровская медицинская академия МЗ Украины». У 189 (94,5 %) обследуемых диагностирован СД 2-го типа, и у 11 (5,5 %) пациентов — СД 1-го типа. Средний возраст пациентов — 62,0 ± 3,4 года. Средний стаж заболевания СД — 8,00 ± 1,32 года. Средний уровень HbА1с — 7,9 ± 0,3 %. Всем пациентам было проведено определение ИМТ, рассчитанного по формуле:
ИМТ = m/h2,
где m — масса тела (в килограммах), h — рост человека (в метрах). Средний ИМТ составлял 32,5 ± 3,4 кг/м2. Клиническая характеристика пациентов представлена в табл. 1.
/86/86.jpg)
Всем пациентам проводились тщательный осмотр нижних конечностей, а также оценка диабетической нейропатии: определение вибрационной, тактильной, температурной, болевой чувствительности.
Оценку клинического обследования пациентов проводили при помощи шкалы нейропатического дисфункционального счета (Neuropathy Disability Score — NDS) — для анализа изменений нарушения болевой, тактильной, температурной, вибрационной чувствительности [11] (табл. 2).
По результатам исследования, из 200 обследуемых у 148 (74 % от общего числа) определяется ДПН разной степени выраженности процесса: 111 (55,5 %) пациентов 2-й группы с умеренной ДПН и 37 (18,5 %) пациентов 3-й группы с выраженной ДПН (рис. 1).
/87/87.jpg)
У 52 (26 %) обследованных признаков ДПН не выявлено. Эти пациенты составили 1-ю группу. Клиническая характеристика пациентов представлена в табл. 3.
Всем обследованным, у которых была выявлена ДПН (111 пациентов 2-й группы и 37 пациентов 3-й группы), было назначено лечение по следующей схеме: 10 внутривенных инфузий 2000 мг Актовегина ежедневно с последующим пероральным приемом препарата по 1200–1800 мг/сут в течение трех месяцев.
Результаты и их обсуждение
Результаты исследования показали, что ДПН развилась у 148 больных (74 % от общего числа) с разной степенью выраженности процесса: 111 пациентов с умеренной ДПН и 37 пациентов с выраженной ДПН, что соответствует данным литературы. Тяжесть ДПН коррелировала с длительностью СД: средний стаж диабета — 3,35 ± 0,64 года в 1-й группе, 7,4 ± 1,8 года — во 2-й группе, 14,2 ± 3,2 года — в 3-й группе (р < 0,05). У пациентов 1-й группы (с отсутствием ДПН) уровень HbA1c оказался значительно меньшим, чем у пациентов 2-й и 3-й групп (с наличием ДПН): 6,8 % в 1-й группе, 7,5 % — во 2-й группе, 8,8 % — в 3-й группе. Таким образом, нами установлена прямая корреляционная связь ДПН и HbA1c (р < 0,05). Также выявлено, что в 1-й группе обследованных наблюдается повышенный уровень ИМТ (29,5 кг/м2), тогда как во 2-й и 3-й группах уже отмечается ожирение (ИМТ в 1-й группе — 32,8 кг/м2, во 2-й — 36,7 кг/м2).
Особое внимание уделялось нами определению ПВЧ. Так, во 2-й и 3-й группах пациентов с наличием ДПН было отмечено значительное снижение порога вибрационной чувствительности (32 вольта во 2-й группе и 46 вольт в 3-й группе). Снижение тактильной, температурной и болевой чувствительности в этих группах выражено намного меньше.
После завершения патогенетической терапии пациентов с ДПН препаратом Актовегин мы провели контрольное повторное обследование. Клиническая характеристика пациентов представлена в табл. 4.
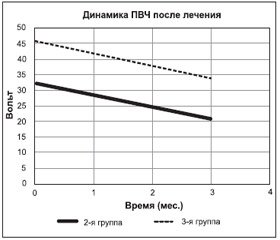
После завершения патогенетической терапии (Актовегин) у пациентов с ДПН отмечено снижение выраженности ДПН как во 2-й, так и в 3-й группе (р < 0,05). Средний уровень ПВЧ (исследование биотензиометром) во 2-й группе снизился с 32 вольт до 21 вольта, в 3-й группе — с 46 вольт до 34 вольт (рис. 2).
/88/88_2.jpg)
На фоне проведенной патогенетической терапии 32 % обследованных 3-й группы, у которых до лечения была выявлена выраженная ДПН (согласно шкале NDS), перешли во 2-ю группу с умеренной степенью выраженности ДПН и, таким образом, у них изменились исходные показатели выраженности ДПН. Во 2-й группе отмечается улучшение тактильной чувствительности: до лечения — 2 балла, после лечения — 1 балл, температурной чувствительности: до лечения — 1 балл, после лечения — 0 баллов. В 3-й группе пациентов тактильная чувствительность до лечения составляла 3 балла, после лечения снизилась до 2 баллов. Также мы наблюдали улучшение показателей температурной и болевой чувствительности у пациентов 3-й группы: 3 и 2 балла — до проведения патогенетической терапии, 2 и 1 балл — после лечения (p < 0,001). Средний уровень HbA1c статистически достоверно снизился после лечения во 2-й группе пациентов с 7,5 до 7,3 %, в 3-й группе — до лечения 8,8 %, после лечения — 8,6 % (p < 0,005).
В ходе проведенного исследования нами не наблюдалось аллергических реакций и других побочных эффектов терапии, что свидетельствует о благоприятном профиле безопасности и удовлетворительной индивидуальной переносимости Актовегина у пациентов с СД.
Выводы
1. Порог вибрационной чувствительности является независимым фактором риска и ранним предиктором развития синдрома диабетической стопы у пациентов с сахарным диабетом.
2. Выявлено наличие диабетической полинейропатии у 74 % обследованных больных с СД, что соответствует данным литературы.
3. Выраженность диабетической нейропатии коррелирует с уровнем гликированного гемоглобина, длительностью сахарного диабета и индексом массы тела пациентов.
4. Патогенетическое лечение пациентов с СД препаратом Актовегин позволяет уменьшить выраженность ДПН (32 % пациентов с выраженной диабетической полинейропатией перешли в группу пациентов с умеренной ДПН) и, как результат, позволяет снизить риск развития синдрома диабетической стопы.
5. Патогенетическая терапия Актовегином показала хороший профиль переносимости и безопасности, что позволяет рекомендовать этот препарат для лечения диабетической нейропатии у пациентов с сахарным диабетом.
1. Ziegler D., Rathmann W., Dickhaus T., Meisinger C., Mielck A., KORA Study Group. revalence of polyneuropathy in pre-diabetes and diabetes is associated with abdominal obesity and macroangiopathy: the MONICA/KORA Augsburg Surveys S2 and S3 // Diabetes Care. — 2008. — 31. — 464–9.
2. Демидова И.Ю., Храмилин В.Н., Игнатова О.Ю., Диабетическая дистальная полинейропатия // Эндокринная хирургия. — 2008. — № 1. — С. 29.
3. Маньковский Б.Н. Диабетическая нейропатия: цели терапии и возможности достижения // Здоров’я України. — 2008. — № 22. — С. 28–29.
4. Dyck P.J., Thomas P.K. Diabetic neuropathy. — 2nd ed. — Philadelphia: W.B. Saunders, 1999. — P. 481–503.
5. Shaw J.E., Zimmet P.Z., Gries F.A., Ziegler D. Epidemiology of Diabetic Neuropathy // Textbook of diabetic neuropathy / Ed. by F.A. Gries, N.E. Cameron, P.A. Low, D. Ziegler. — Stuttgart/New York: Thieme, 2003. — 64–82.
6. Галстян Г.Р. Диабетическая нейропатия: классификация, диагностика и лечение // Міжнародний ендокринологічний журнал. — 2006. — № 3(5).
7. Jack M., Wright D. Role of advanced glycation endproducts and glyoxalase I in diabetic peripheral sensory neuropathy // Transl. Res. — 2012. — Vol. 159, № 5. — Р. 355–365.
8. Bokan V. Muscle weakness and other late complications of diabetic polyneuropathy // Acta Clin. Croat. — 2011. — Vol. 50, № 3. — Р. 351–355.
9. Coppini D.V., Bowtell P.A., Weng C. et al. Showing neuropathy is related to increased mortality in diabetic patients — a survival analysis using an accelerated failure time model // J. Clin. Epidemiol. — 2000. — 53. — 519–23.
10. Abbott C.A., Vileikyte L., Williamson S. et al. Multicenter study of the incidence of and predictive risk factors for diabetic neuropathic foot ulceration // Diabetes Care. — 1998. — 21. — 1071–5.
11. Ziegler D. Diagnosis and Management of Diabetic Peripheral Neuropathy // Diabetic Medicine. — 1996. — Vol. 13, S. 1. — P. 34–38.
12. Котов С.В., Калинин А.П., Рудакова И.Г. Диабетическая нейропатия. — 2-е изд., перераб. и доп. — М.: ООО «Издательство «Медицинское информационное агентство», 2011. — 440 с.
13. Palumbo P.Y., Melton L.Y. Peripheral vascular disease and diabetes // Diabetes in America / Ed. by M.I. Harris, R.F. Hamman. — NIH Pub. No 85–1468. — Washington, 1985. — XV. — 1–21.
14. Borssen B., Bergenheim T., Lithner F. The epidemiology of foot lesions in diabetic patients aged 15–50 years // Diabetic. Med. — 1991. —7. — 438–15.
15. Наказ МОЗ України від 21.12.2012 р. № 1118 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при цукровому діабеті 2 типу».
16. Аметов А.С., Строков И.А., Диабетическая полинейропатия: настоящее и будущее // Рос. мед. вести. — 2001. — № 1. — С. 35–40.
17. Строков И.А., Баринов А.Н., Новосадова М.В. и др. Лечение диабетической нейропатии // РМЖ. — 2001. — Т. 9, № 78. — С. 314–317.
18. Тронько М.Д. та ін. Епідеміологія цукрового діабету в Україні // Здоров’я України. — 2005. — № 18. — С. 15.

/87/87_2.jpg)
/88/88.jpg)