Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Особливості розподілу жирової тканини у хворих на цукровий діабет 2-го типу з ожирінням та артеріальною гіпертензією з супутньою дисліпідемією
Авторы: Зуєв К.О. – Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Розвиток атерогенної дисліпідемії у хворих на цукровий діабет (ЦД) 2-го типу й артеріальну гіпертензію є важливим фактором ризику серцево-судинних захворювань і часто асоціюється з ожирінням.
Мета. Вивчити зв’язок між надлишковим відкладенням жиру в різних компартментах тіла зі змінами рівня ліпідів крові.
Матеріали і методи. Обстежені 53 пацієнти (25 чоловіків) віком 55,90 ± 2,15 року з ЦД 2-го типу, гіпертонічною хворобою І–ІІ стадії 2-го ступеня й ожирінням І–ІІІ ступеня (45 ≥ ІМТ ≥ 30 кг/м2). Всім хворим визначався рівень ліпідів плазми крові і проводилося дослідження структури тіла за допомогою рентгенівської двофотонної абсорбціометрії з визначенням загальної маси жирової тканини (МЖТз), вмісту жиру в абдомінальній (МЖТа) і глютеофеморальній (МЖТг) ділянках. Був проведений регресійний аналіз взаємозв’язку показників ліпідного спектра й маси жирової тканини з урахуванням її розподілу.
Результати. Рівень загального холестерину був статистично значимо асоційований із масою жирової тканини в абдомінальній ділянці (r = 0,27; p = 0,04). Рівень холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ) був позитивно асоційований з МЖТз (r = 0,34; p = 0,01). При цьому основний внесок у цю асоціацію робив абдомінальний компартмент, бо залежність ХС ЛПНЩ від МЖТа (r = 0,38) була статистично значущою (p = 0,01). Рівень тригліцеридів був позитивно асоційований із МЖТз (r = 0,49; p = 0,001), а також з МЖТа (r = 0,39; p = 0,01) і МЖТг (r = 0,32; p = 0,02). Рівень холестерину ліпопротеїдів низької щільності (ХС ЛПВЩ) був негативно асоційований із МЖТз (r = –0,36; p = 0,01).
Висновки. У хворих із ЦД 2-го типу з ожирінням і артеріальною гіпертензією розвиток атерогенної дисліпідемії з підвищенням рівня загального холестерину, тригліцеридів і ХС ЛПНЩ, а також зі зниженням рівня ХС ЛПВЩ пов’язаний із підвищенням загальної кількості жирової тканини, а також із надлишковим відкладенням жиру в абдомінальній ділянці.
Развитие атерогенной дислипидемии у больных с сахарным диабетом (СД) 2-го типа и артериальной гипертензией является важным фактором риска сердечно-сосудистых заболеваний и часто ассоциируется с ожирением.
Цель. Изучить связь между избыточным отложением жира в различных компартментах тела с изменениями уровня липидов крови.
Материалы и методы. Обследованы 53 пациента (25 мужчин) в возрасте 55,90 ± 2,15 года с СД 2-го типа, гипертонической болезнью І–ІІ стадии 2-й степени и ожирением І–ІІІ степени (45 ≥ ИМТ ≥ 30 кг/м2). Всем больным определялся уровень липидов плазмы крови и проводилось исследование структуры тела при помощи рентгеновской двухфотонной абсорбциометрии с определением общей массы жировой ткани (МЖТо), содержания жира в абдоминальной (МЖТа) и глютеофеморальной (МЖТг) области. Был проведен регрессионный анализ взаимосвязи показателей липидного спектра и массы жировой ткани с учетом ее распределения.
Результаты. Уровень общего холестерина был статистически значимо ассоциирован с МЖТа (r = 0,27; p = 0,04). Уровень холестерина липопротеидов низкой плотности (ХС ЛПНП) был положительно ассоциирован с МЖТо (r = 0,34; p = 0,01). При этом основной вклад в эту ассоциацию вносил абдоминальный компартмент, так как зависимость ХС ЛПНП от МЖТа (r = 0,38) была статистически значима (p = 0,01). Уровень триглицеридов был позитивно ассоциирован с МЖТо (r = 0,49; p = 0,001), а также с МЖТа (r = 0,39; p = 0,01) и МЖТг (r = 0,32; p = 0,02). Уровень холестерина липопротеидов высокой плотности (ХС ЛПВП) был отрицательно ассоциирован с МЖТо (r = –0,36; p = 0,01).
Выводы. У больных с СД 2-го типа с ожирением и артериальной гипертензией развитие атерогенной дислипидемии с повышением уровня общего холестерина, триглицеридов и ХС ЛПНП, а также со снижением уровня ХС ЛПВП связано с повышением общего количества жировой ткани, а также с избыточным отложением жира в абдоминальной области.
Introduction. The development of atherogenic dyslipidemia in patients with diabetes mellitus (DM) type 2 and hypertension is an important risk factor for cardiovascular diseases and is often associated with obesity.
Objective. To examine the relationship between excess fat deposits in various compartments of the body and altered levels of blood lipids.
Materials and Methods. The study involved 53 patients (25 men) aged 55.90 ± 2.15 years with DM type 2, essential hypertension of stage I–II grade 2 and obesity of I–III degree (45 ≥ body mass index ≥ 30 kg/m2). In all patients we have determined plasma lipid levels and carried out a study of body structure using dual X-ray absorbtiometry with the determination total body fat (TBF) mass, android fat (AF) mass and gynoid fat (GF) mass. The regression analysis of the correlation between lipid profile parameters and fat mass based on its distribution has been carried out.
Results. Total cholesterol level was significantly associated with AF mass (r = 0.27; p = 0.04). Low-density lipoprotein cholesterol (LDL-cholesterol) level was positively associated with TBF (r = 0.34; p = 0.01). Herewith, the main contribution into this association was made by abdominal compartment, as the dependence of LDL-cholesterol on AF (r = 0.38) was statistically significant (p = 0.01). Triglyceride level was positively associated with TBF (r = 0.49; p = 0.001), as well as with AF (r = 0.39; p = 0.01) and GF (r = 0.32; p = 0.02). High-density lipoproteins (HDL) level was negatively associated with TBF (r = –0.36; p = 0.01).
Conclusions. In patients with DM type 2 with obesity and hypertension, the development of atherogenic dyslipidemia with elevated levels of total cholesterol, triglycerides and LDL-cholesterol, as well as with decreased level of HDL-cholesterol, is associated with an increase in the total amount of adipose tissue, and also with an excessive fat deposition in the abdominal region.
ліпіди крові, двофотонна рентгенівська абсорбціометрія, цукровий діабет 2-го типу, артеріальна гіпертензія, ожиріння.
липиды крови, двухфотонная рентгеновская абсорбциометрия, сахарный диабет 2-го типа, артериальная гипертензия, ожирение.
blood lipids, dual X-ray absorptiometry, diabetes mellitus type 2, hypertension, obesity.
Статья опубликована на с. 112-117
Сучасне уявлення про цукровий діабет (ЦД) 2-го типу як про важливий фактор ризику серцево-судинних захворювань істотно доповнилося в останній час розумінням важливості впливу прогресування атеросклеротичного ураження судин на підвищення рівня ліпідів у плазмі крові [1]. Атерогенний характер дисліпідемії при ЦД 2-го типу характеризується підвищенням у плазмі крові факторів, що сприяють прогресуванню артеріосклерозу, до яких зараховують насамперед підвищення рівня холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), а також тригліцеридів (ТГ) і загального холестерину (ЗХС), та зниженням фактора, що перешкоджає появі і дестабілізації атеросклеротичної бляшки — холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) [2].
Хворі на ЦД 2-го типу нерідко страждають від надлишкової маси тіла чи ожиріння з переважним відкладанням жиру в абдомінальній ділянці [3]. Ланцюгом, що пов’язує абдомінальне ожиріння та атерогенну дисліпідемію у хворих на ЦД 2-го типу, є розвиток інсулінорезистентності, підвищення рівня вільних жирних кислот у плазмі крові, збільшення рівня адипокінів (лептину, резистину, вісфатину та ін.), і, як наслідок цього, поява порушень ліпідного обміну [4, 5].
Використання сучасних методик оцінки структури тіла людини (комп’ютерної томографії, магнітно-резонансної томографії та ін.) дозволяє уточнити низку суперечливих питань про характер відкладання жирової тканини та розвиток багатьох метаболічних порушень у хворих на ЦД 2-го типу з супутнім ожирінням та артеріальною гіпертензією (АГ). Впровадження в клінічну практику високоточного й безпечного методу визначення розподілу жирової тканини в тілі людини за допомогою двофотонної рентгенівської абсорбціометрії (ДРА) істотно розширило наші можливості у вивченні особливостей ожиріння в цієї категорії пацієнтів [6].
Метою дослідження було вивчити особливості ліпідного обміну у хворих на ЦД 2-го типу з ожирінням та артеріальною гіпертензією, а також оцінити залежність між показниками ліпідного спектра та вмістом жиру в окремих частинах (компартментах) тіла.
Матеріали і методи
У дослідження були включені 53 пацієнти (25 чоловіків і 28 жінок) віком 55,90 ± 2,15 року з ЦД 2-го типу, гіпертонічною хворобою І–ІІ стадії 2-го ступеня й ожирінням І–ІІІ ступеня (45 ≥ ІМТ ≥ 30 кг/м2), які знаходилися на амбулаторному і/або стаціонарному лікуванні у відділі профілактики ендокринних захворювань Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України.
Діагноз ЦД 2-го типу встановлювався відповідно до критеріїв ВООЗ (2007 р.). Діагноз АГ встановлювався згідно з рекомендаціями Української асоціації кардіологів 2008 г.: офісний систолічний артеріальний тиск (АТ) ≤ 179 і ≥ 140 мм рт.ст., а офісний діастолічний АТ ≤ 109 і ≥ 90 мм рт.ст. [7]. Вимірювали офісний АТ на апараті фірми Omron НЕМ-907 (Японія). Вимірювання проводилося тричі в положенні сидячи після п’ятнадцяти хвилин відпочинку на плечовій артерії на стороні, де показник АТ був більш високим, із подальшим обчисленням середнього арифметичного з трьох показників.
Визначення ступеня ожиріння проводилося відповідно до рекомендацій ВООЗ (1997 р.) із розрахунку індексу маси тіла за формулою: ІМТ = маса тіла/ріст2 [кг/м2]. Надлишкова маса тіла визначалася при ІМТ 25,0–29,9 кг/м2, ожиріння I ступеня — при ІМТ 30,0–34,9 кг/м2, ожиріння II і III ступеня встановлювали при значеннях цього показника 35,0–39,9 кг/м2 і ≥ 40 кг/м2 відповідно. Вимірювання антропометричних показників (росту і маси тіла пацієнта) проводили звичайними методами за допомогою ростоміра і ваг.
Окрім того, проводилося визначення структури тіла методом ДРА на апараті Lunar Prodigy Primo фірми General Electric (США). У своїй роботі ми визначали показники кількості загального жиру в організмі (МЖТз), а також в окремих ділянках: абдомінальній (МЖТа) і глютеофеморальній (МЖТг) (рис. 1).
Всі вимірювання проводилися з дотриманням усіх вимог до подібних вимірювань, а також із дотриманням вимог виробників апаратури для отримання вірогідних результатів. Дослідження проводилося як відкрите, неінтервенційне. Усі пацієнти перед участю в дослідженні підписали інформовану згоду на участь у дослідженні із дотриманням принципів Гельсінської декларації.
Порівняння незалежних вибірок проводили за допомогою дисперсійного аналізу. При статистичному аналізі даних спочатку проводили перевірку розподілу кількісних ознак на відповідність закону Гауса. Залежно від типу розподілу даних використовували параметричний критерій Стьюдента чи непараметричний критерій Вілкоксона — Манна — Уїтні.
Статистичні характеристики антропометричних вимірювань і показники, отримані за допомогою ДРА, подано у вигляді середнього арифметичного (M) і стандартної похибки (± SE), а також 95% довірчого інтервалу (95% СІ).
Асоціація між залежними (ІМТ) та незалежними змінними (МЖТз, МЖТа, МЖТг, МЖТа/МЖТг) аналізувалась методом регресійного аналізу. Результати регресійного аналізу наведено у вигляді графіків, коефіцієнтів регресії (r) та рівнів їх значущості (p). Статистичний аналіз даних виконано за допомогою комп’ютерної програми SPSS 9.0.
Результати та їх обговорення
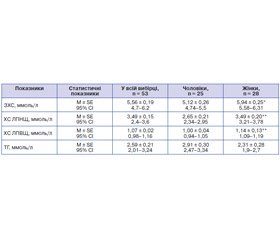
За результатами дослідження ліпідного обміну у хворих на ЦД 2-го типу з ожирінням та АГ I–II ступеня був проведений статистичний аналіз показників ліпідного спектра (табл. 1). Двомодальний характер розподілу деяких показників став підставою для перевірки впливу гендерного фактора на варіабельність початкових даних. За допомогою дисперсійного аналізу були виявлені статистично значущі відмінності у підгрупах чоловіків і жінок. Так, середній рівень ЗХС у жінок був статистично значуще вищим, ніж у чоловіків (р < 0,05) (табл. 1).
Ґрунтуючись на сучасних клінічних рекомендаціях з оцінки серцево-судинного ризику, хворих на ЦД 2-го типу зараховували до групи високого чи надто високого ризику, цільовими значеннями ліпідів крові для них є: ЗХС ≤ 4,5 ммоль/л, ХС ЛПНЩ — ≤ 1,8 ммоль/л, ХС ЛПВЩ — ≥ 1,0 ммоль/л для чоловіків та ≥ 1,2 ммоль/л для жінок, а рівень ТГ — ≤ 1,7 ммоль/л. З огляду на ці цільові рівні ліпідів крові у популяції досліджуваних нами пацієнтів можна констатувати, що гіперхолестеринемія спостерігалася у 68 % чоловіків (у 17 з 25 осіб) і у 89,2 % жінок (у 25 з 28 осіб). Середній рівень ХС ЛПНЩ і ХС ЛПВЩ у жінок також був вищим, ніж у чоловіків (р < 0,01) (табл. 1). Слід зауважити, що підвищений відповідно до сучасних рекомендацій рівень ХС ЛПНЩ (≥ 1,8 ммоль/л) спостерігався у 100 % жінок і 80 % чоловіків (x2 = 4,06; р = 0,04). Крім того, низький рівень ХС ЛПВЩ спостерігався в 44 % чоловіків і в 60,7 % жінок. У той же час гіпертригліцеридемія (≥ 1,7 ммоль/л) спостерігалася в 44 % чоловіків і в 60,7 % жінок.
Неабиякий інтерес становило з’ясувати можливий зв’язок рівня окремих фракцій ліпідів крові і загальної маси жирової тканини (МЖТз), а також її вміст в абдомінальному (МЖТа) і глютеофеморальному (МЖТг) компартментах, ґрунтуючись на даних, отриманих за допомогою ДРА.
За даними обстеження за допомогою ДРА було також виявлено низку статистично значущих відмінностей, пов’язаних зі статтю пацієнтів: більш високі середні значення загальної маси жирової тканини (МЖТз), а також жирової тканини, локалізованої в абдомінальній (МЖТа) та глютеофеморальній (МЖТг) ділянках тіла, у жінок порівняно з чоловіками (р < 0,001) (табл. 2).
До того ж середній індекс співвідношення МЖТа й МЖТг у чоловіків виявився статистично значуще більш високим (р < 0,001), ніж у жінок (1,31 ± 0,03 і 1,09 ± 0,03 відповідно). Андроїдний тип ожиріння (індекс МЖТа/МЖТг > 1) спостерігався у 92 % чоловіків (23 з 25) та у 89 % жінок (25 із 28). Цей факт може свідчити про переважно андроїдний тип ожиріння в обстежених пацієнтів із ЦД 2-го типу з ожирінням та АГ.
Був проведений регресійний аналіз взаємозв’язку показників ліпідного спектра й маси жирової тканини з урахуванням її локалізації.
За результатами аналізу рівень ЗХС не був статистично значуще асоційований ані з МЖТз, ані з масою жирової тканини, локалізованої у глютеофеморальній ділянці. Був виявлений тільки лінійний взаємозв’язок ЗХС із масою жирової тканини в абдомінальній ділянці (r = 0,27; p = 0,04). Ця асоціація спостерігалася переважно в жінок.
Рівень ХС ЛПНЩ був позитивно асоційований із МЖТз (r = 0,34; p = 0,01) (рис. 2). Основний внесок у цю асоціацію робив абдомінальний компартмент, бо залежність ХС ЛПНЩ від МЖТа (r = 0,38) була статистично значущою (p = 0,01), тоді як внесок глютеофеморального компартменту у збільшення рівня ХС ЛПНЩ мав тенденцію до залежності від МЖТг (r = 0,23; p = 0,09).
Взаємозв’язок між рівнем ТГ і МЖТз мав позитивний характер (r = 0,49; p = 0,001) (рис. 3). Спостерігався також подібний характер асоціації ТГ із МЖТа (r = 0,39; p = 0,01) і МЖТг (r = 0,32; p = 0,02).
За нашими даними, рівень ХС ЛПВЩ був негативно асоційований із МЖТз (r = –0,36; p = 0,01) (рис. 4). Негативна асоціація рівня ХС ЛПВЩ з масою жирової тканини в окремих компартментах МЖТг (r = –0,26; p = 0,05) і з МЖТа (r = –0,24; p = 0,08) мала лише тенденцію.
Висновки
На підставі проведеного аналізу в обстежених нами хворих на ЦД 2-го типу з ожирінням та АГ ми можемо зробити висновок, що показники ліпідного спектра узгоджуються з відомими даними літератури про те, що в цієї категорії пацієнтів спостерігається дисліпідемія атерогенної спрямованості.
Залежніст рівня різних фракцій холестерину від вмісту жирової тканини в різних компартментах характеризує типові зміни, характерні для пацієнтів з ЦД 2-го типу і наявністю абдомінального ожиріння.
1. Farmer J.A. Diabetic dyslipidemia and atherosclerosis: evidence from clinical trials // Curr. Diab. Rep. — 2008. — 8. — Р. 71–77.
2. Куликова А.Н. Облитерирующий атеросклероз артерий нижних конечностей на фоне сахарного диабета 2-го типа / А.Н. Куликова // Международный эндокринологический журнал. — 2009. — № 2. — С. 109–115.
3. Després J.P., Lemieux I., Bergeron J. et al. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk // Arterioscler. Thromb. Vasc. Biol. — 2008. — 28. — Р. 1039–49.
4. Garvey W.T., Kwon S., Zheng D. et al. Effects of insulin resistance and type 2 diabetes on lipoprotein subclass particle size and concentration determined by nuclear magnetic resonance // Diabetes. — 2003. — 52. — Р. 453–462.
5. Kim Y.L., Kim T.K., Cheong E.S. et al. Relation of absolute or relative adiposity to insulin resistance, retinol binding protein-4, leptin, and adiponectin in type 2 diabetes // Diabetes Metab. J. — 2012. — 36. — Р. 415–21.
6. Albanese C.V., Diesel E., Genant H.K. A review: clinical application of body composition measurements using DXA // J. Clin. Densit. — 2003. — Vol. 6. — Р. 161–172.
7. Рекомендації Української Асоціації кардіологів з профілактики та лікування артеріальної гіпертензії. Посібник до Національної програми профілактики і лікування артеріальної гіпертензії. — К.: ПП ВМБ, 2008. — 80 с.
8. Perk J., De Backer G., Gohlke H. et al. European guidelines on cardiovascular disease prevention in clinical practice (version 2012): the fifth joint task force of the European society of cardiology and other societies on cardiovascular disease prevention in clinical practice (constituted by representatives of nine societies and by invited experts) // Eur. Heart J. — 2012. — 33(13). — P. 1635–1701.
9. European Association for Cardiovascular Prevention & Rehabilitation, Reiner Z., Catapano A.L., De Backer G. et al. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS) // Eur. Heart J. — 2011. — 32(14). — P. 1769–1818.

/114/114.jpg)
/114/114_2.jpg)
/115/115.jpg)
/115/115_2.jpg)