Международный эндокринологический журнал 7 (63) 2014
Вернуться к номеру
Значение применения вопросника «Качество жизни взрослых с дефицитом гормона роста» у больных с неактивными аденомами гипофиза и с различными образованиями хиазмально-селлярной области в до- и послеоперационном периоде
Авторы: Урманова Ю.М., Шакирова М.Ю., Алиева Д.А. — Республиканский специализированный научно-практический медицинский центр эндокринологии МЗ РУз; Ташкентский педиатрический медицинский институт, кафедра эндокринологии, детской эндокринологии, Республика Узбекистан
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Авторами обследовано 136 больных с дефицитом гормона роста (ДГР) различного генеза (опухоли гипофиза и ишемическая болезнь сердца — группа сравнения). Исследование качества жизни на основе вопросника ДГР QoL-AGHDA у 136 больных выявило, что во всех группах средний балл был выше нормы (в норме < 11), причем наиболее достоверно это наблюдалось у больных первой, третьей, четвертой групп и второй подгруппы пятой группы. Достоверная корреляционная связь между низкими базальными значениями СТГ, ИФР-1 плазмы крови и средними значениями вопросника ДГР QoL-AGHDA была найдена в первой, второй, третьей, четвертой группах и второй подгруппе пятой группы пациентов, что подтверждает высокую эффективность использования вопросника ДГР QoL-AGHDA у больных с ДГР различного генеза. У 36 пациентов через 3 месяца после ТГЭ отмечалось достоверное повышение среднего балла по вопроснику ДГР на фоне снижения средних значений СТГ и ИФР-1. Это показывает, что в раннем послеоперационном периоде у пациентов возрастает степень выраженности гипопитуитаризма и встает вопрос о назначении заместительной гормональной терапии.
Авторами обстежено 136 хворих із дефіцитом гормона росту (ДГР) різного генезу (пухлини гіпофіза та ішемічна хвороба серця — група порівняння). Дослідження якості життя на основі питальника ДГР QoL-AGHDA у 136 хворих виявило, що у всіх групах середній бал був вищий від норми (в нормі < 11), причому найбільш вірогідно це спостерігалося у хворих першої, третьої, четвертої груп і другої підгрупи п’ятої групи. Вірогідний кореляційний зв’язок між низькими базальними значеннями СТГ, ІФР-1 плазми крові та середніми значеннями питальника ДГР QoL-AGHDA був знайдений у першій, другій, третій, четвертій групах і другій підгрупі п’ятої групи пацієнтів, що підтверджує високу ефективність використання питальника ДГР QoL-AGHDA у хворих із ДГР різного генезу. У 36 пацієнтів через 3 місяці після ТГЕ відмічалося вірогідне підвищення середнього бала за питальником ДГР на фоні зниження середніх значень СТГ і ІФР-1. Це показує, що в ранньому післяопераційному періоді в пацієнтів зростає ступінь вираженості гіпопітуїтаризму і постає питання про призначення замісної гормональної терапії.
The authors have examined 136 patients with growth hormone deficiency (GHD) of various origins (pituitary tumors and ischemic heart disease — comparison group). The investigation of the quality of life on the basis of GHD questionnaire «Quality of Life Assessment of Growth Hormone Deficiency in Adults» (QoL-AGHDA) in 136 patients showed, that in all groups the average score was higher than normal one (normal < 11), and most significantly it was observed in patients of first, third and fourth groups and second subgroup of the fifth group. Reliable correlation between low basal levels of somatotropic hormone (STH), insulin-like growth factor-1 (IGF-1) of blood plasma and average score by GHD questionnaire QoL-AGHDA was found in the first, second, third, and fourth groups of the second subgroup of the fifth group of patients, that confirms high efficacy of using GHD questionnaire QoL-AGHDA in patients with GHD of various origins. 36 patients in 3 months after transnasal hypophysectomy reported reliable increase in the average score by GHD questionnaire on the background of decreased levels of STH and IGF-1. This shows that in the early postoperative period in patients the severity of hypopituitarism increases and the question of the prescription of hormone replacement therapy arises.
дефицит гормона роста, аденомы гипофиза, трансназальная селективная гипофизэктомия.
дефіцит гормона росту, аденоми гіпофіза, трансназальна селективна гіпофізектомія.
growth hormone deficiency, pituitary adenomas, transnasal selective hypophysectomy.
Статья опубликована на с. 118-124
Введение
Известно, что гипопитуитаризм — это недостаточность секреции одного или нескольких гормонов гипофиза (МКБ.10. E23.0. Гипопитуитаризм). Клиника гипопитуитаризма возникает, если повреждено не менее 75 % клеток аденогипофиза.
Пангипопитуитаризм, в свою очередь, развивается вследствие разрушения не менее 90 % клеток гипофиза. Межуточно-гипофизарная недостаточность представляет собой присоединение к пангипопитуитаризму недостаточности вазопрессина (несахарный диабет).
Основная причина гипопитуитаризма — опухоли гипофиза (более 70 %), среди которых по частоте доминируют неактивные аденомы гипофиза (НАГ). Наиболее вероятным механизмом, лежащим в основе развития гипопитуитаризма, является, во-первых, сдавление портальных сосудов в гипофизарной ножке, во-вторых — рост массы опухоли или повышение инстраселлярного давления [1].
Гипопитуитаризм условно подразделяется на первичный и вторичный. Первичный гипопитуитаризм является следствием отсутствия или разрушения секретирующих клеток гипофиза и встречается при аденомах гипофиза, а вторичный обусловлен дефицитом стимулирующих влияний на секрецию гипофизарных гормонов, нарушением сосудистых и/или нервных связей с мозгом на уровне ножки гипофиза, гипоталамуса (опухоли гипоталамуса, лучевая терапия, операции, травма, нервная анорексия и др.).
Таким образом, дефицит гормона роста (ДГР) при опухолях гипофиза является первичным, в то время как ДГР после селективной аденомэктомии и лучевой терапии — вторичным. При астроцитомах, краниофарингиомах, менингиомах ДГР также носит вторичный характер [1].
Наибольшему риску развития ДГР подвержены те пациенты, у которых наблюдается недостаток большинства гормонов гипофиза. Чем больше гипофизарный дефицит соматотропного гормона (СТГ), тем больше выражено снижение концентрации IGF-I в плазме и средняя пиковая реакция на провокационный тест. Согласно двум исследованиям, тяжелые формы ДГР наблюдались у 87–91 % пациентов, которые имели дефицит двух или более гормонов гипофиза. Новые данные подтверждают предположения об увеличении распространенности ДГР у взрослых, возникшего в результате опухолей, образовавшихся в детстве, и их лечения, в частности как следствие долговременной выживаемости [14].
Среди причин развития соматотропной недостаточности у взрослых могут быть оперативные вмешательства [3, 4, 6, 9, 10] по поводу аденом гипофиза, краниофарингиомы, травматическое поражение срединных структур головного мозга, лучевая терапия, синдром Шиена [2, 15]. Ведение больных с развившимся гипопитуитаризмом, в том числе со вторичным ДГР, после селективной гипофизэктомии является актуальной проблемой нейроэндокринологии [7, 8].
При обследовании группы пациентов, оперированных по поводу объемных образований селлярной области, в 80 % случаев было подтверждено наличие соматотропной недостаточности [20].
Длительные наблюдения за пациентами после хирургического лечения и облучения показывают, что дефицит гормонов гипофиза обычно развивается в определенной последовательности. В первую очередь при аденомах гипофиза выпадает или снижается секреция гормона роста (ГР), а затем по мере роста опухоли — и других тропных гормонов: ЛГ, ФСГ, ТТГ и в последнюю очередь — АКТГ [1].
Авторы из Миланского университета [21] показали динамику ГР у 34 пациентов с синдромом Кушинга, подвергнутых аденомэктомии, в течение 2–20 лет (в среднем 3,3 года). Исследования показали, что у 22 больных (65 %) уровни ГР в отдаленном постоперационном периоде были субнормальными, парциальный дефицит ГР (пик ГР < 16,5 микрог/л) был выявлен у 11 больных и у 11 — тотальный дефицит ГР (пик ГР < 9 микрог/л). Авторы рекомендуют исследование ГР в такой группе больных и терапию препаратами ГР.
По данным исследования, посвященного изучению развития гипопитуитаризма у 500 больных с синдромом Кушинга после селективной гипофизэктомии, — Long-Term Post-Operative Follow-Up of Cushing Syndrome (США) — риск развития гипопитуитаризма в раннем послеоперационном периоде у этих больных неизвестен [19]. При этом частота рецидива кортикотропиномы составляет в среднем 5–10 %, в связи с чем большинство больных подвергаются также и лучевой терапии. В отдаленном периоде у этих пациентов основными осложнениями гиперкортизолемии являются остеопения, гипогонадизм и гипергликемия.
Согласно данным проводившегося с 2008 по 2011 г. многоцентрового исследования, посвященного изучению кардиоваскулярных факторов риска при ДГР у 80 больных (от 18 до 25 лет) с несекретирующими опухолями гипофиза после трансфеноидальной гипофизэктомии (ТГЭ), — Assessment of Cardiovascular Risk in Patients with Growth Hormone Deficiency Following Transsphenoidal Surgery for Nonsecreting Pituitary Adenomas (США) — в раннем послеоперацинном периоде у этих больных, в отличие от тех, кто не был подвергнут ТГЭ, наблюдались маркеры кардиоваскулярного риска: дислипидемия и др. [5].
Облучение черепа также является весомой причиной гипопитуитаризма, тяжесть которого зависит от дозы и времени облучения [11]. Гипоталамус, как полагают, является более чувствительным к облучению, чем передний отдел гипофиза [12], и недостаток ГР является обычно первым и часто единственным гормональным проявлением гипопитуитаризма, вызванного облучением [17]. Риск развития недостатка ГР после комбинации операции и облучения аденом гипофиза через 5 лет составляет 90 % [18]. Больные с гипопитуитаризмом лечатся традиционно кортикостероидами, гормонами щитовидной железы и половыми стероидными гормонами. Только недавно препараты ГР были предложены для лечения в случаях, когда имеется подтвержденный недостаток этого гормона [13].
По данным итальянских авторов из Института Св. Рафаэля, изучавших состояние гипоталамо-гипофизарной оси у 26 больных с экстраселлярными аденомами гипофиза, подвергнутых лучевой терапии в дозе 41,8 Gy, через 3 года в 38 % случаев был выявлен постлучевой гипопитуитаризм: в 29 % — ДГР, в 22 % — дефицит АКТГ, в 14 % — ТТГ, в 4 % — ЛГ, ФСГ [23].
Исследователи из Университета Вирджинии провели анализ отдаленных результатов радиохирургической терапии гамма-ножом 418 больных с различными опухолями селлярной области [24]. По их данным, ремиссия наступила через 48,9 месяца. Вместе с тем в этот период наблюдения у 24,4 % пациентов был обнаружен послелучевой гипопитуитаризм. Ученые подчеркивают, что ремиссия быстрее наступала у больных с небольшими опухолями, однако облучение повышает риск возобновления гипопитуитаризма.
По данным американских исследователей, представивших результаты лечения гамма-ножом 43 пациентов с различными опухолями селлярной области, длительность наблюдения после лечения составила в среднем 36 месяцев (от 12 до 108 мес.). Максимальная доза облучения равнялась 40 Gy. У 20 пациентов (47 %) после радиохирургии отмечена нормализация гормонального профиля в среднем через 14 мес. (12–44 мес.), при этом корреляции между типом опухоли и лечением не обнаружено [22]. Питуитарная недостаточность передней доли гипофиза впервые развилась у 7 больных (16 %). Авторы указывают на необходимость разработки радиопротективных препаратов.
В табл. 1 приведены результаты пяти исследований частоты гипопитуитаризма при аденомах гипофиза после лучевой и хирургической терапии [14].
Актуальность данной проблемы послужила причиной выполнения данного исследования.
Цель исследования — изучить значение применения вопросника «Качество жизни взрослых с дефицитом гормона роста» у больных с неактивными аденомами гипофиза и с различными образованиями хиазмально-селлярной области в до- и послеоперационном периодах.
Материал и методы исследования
За период с 2008 по 2013 г. нами было обследовано 136 взрослых больных с ДГР, обусловленным функционально-неактивными образованиями хиазмально-селлярной области (НАГ). Средний возраст мужчин составил 44,2 года, женщин — 46,4 года. Давность заболевания колебалась в пределах от двух месяцев до 25 лет.
Оперативное лечение (трансназальная селективная гипофизэктомия) было выполнено 36 (26,5 %) больным на базе отделения нейрохирургии РНЦЭМП МЗ РУз и РСНПМЦ эндокринологии МЗ РУз (отделение нейрохирургии), одному больному — бифронтальная краниотомия. 20 здоровых лиц составили группу контроля.
Применялись такие методы исследования: общеклинические (исследование эндокринного, неврологического статусов, антропометрия — рост, вес, ОТ, ОБ, ИМТ, оценка ДГР по вопроснику); инструментальные (периметрия на все цвета, глазное дно, острота зрения, ЭКГ, денситометрия, КТ/МРТ турецкого седла и надпочечников, УЗИ половых органов и др.); гормональные исследования крови (СТГ, ИФР-1, ЛГ, ФСГ, пролактин, ТТГ, АКТГ, тестостерон, эстрадиол, прогестерон, кортизол, Т3, Т4) — в лаборатории гормональных исследований РСНПМЦ эндокринологии МЗ РУз (зав. лаб. канд. мед. наук А.М. Абдурахманова) с использованием радиоиммунного метода наборами фирмы IMMUNOTECH (Республика Чехия); биохимические исследования крови (ЛПНП, ЛПВП, холестерин, триглицериды, кальций и др.).
Для оценки качества жизни пациентов был использован вопросник, разработанный специально в рамках проекта KIMS (Wallymahmed M.E., Foy P., MacFarlane I.A.: The quality of life of adults with growth hormone deficiency: Comparison with diabetic patients and control subjects. Clin Endocrinol (Oxf). 1999. — 51. — 333–338) для пациентов с дефицитом ГР, — QoL-AGHDA (Quality of Life — Assessment of Growth Hormone — Deficiency in Adults) и содержащий 25 вопросов (перевод с англ.). Наличие положительных ответов, в сумме дающих более 11 баллов, расценивается как признак вероятности ДГР у взрослых.
Полученные данные обрабатывали с помощью компьютерных программ Microsoft Excel и STATISTICA 6. Достоверность различий количественных показателей (n > 12) определялась по методу Вилкоксона для несвязанных диапазонов; для определения достоверности малых выборок (n < 12) использовался непараметрический критерий рандомизации компонент Фишера для независимых выборок, для качественных значений использовался точный критерий Фишера — Ирвина. Различия между группами считали статистически значимыми при р < 0,05. Вычислялись средние значения (М), стандартные отклонения средних (m).
Достоверность различий между группами оценивалась по величине доверительного интервала и критерию Стьюдента (р). Различия считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
У 136 обследованных больных были выявлены различные образования селлярной области: НАГ — у 67 (49,2 %) больных, акромегалия (у этих больных отмечался ДГР на фоне терапии) — у 17 (12,5 %), пролактинома — у 12 (8,8 %), краниофарингиома — у 10 (7,4 %), болезнь Иценко — Кушинга — у 5 (3,7 %), пинеалома — у 1 (0,7 %), астроцитома — у 1 (0,7 %), менингиома — у 1 (0,7 %), герминома — у 1 (0,7 %). Пациенты были распределены на 5 групп следующим образом:
— первая группа — 67 (48,5 %) больных с различными аденомами гипофиза, получавших консервативную терапию (бромкриптин, каберголин);
— вторая группа — 36 (26,5 %) больных с различными аденомами гипофиза, подвергнутых ТГЭ и другим методам лечения;
— третья группа — 4 (2,9 %) больных с различными аденомами гипофиза, получивших лучевую терапию;
— четвертая группа — 8 (5,8 %) больных с различными аденомами гипофиза, получивших комбинированную терапию (ТГЭ + лучевая терапия);
— пятая группа — 21 (15,4 %) больной с ишемической болезнью сердца (ИБС) и ДГР. Эта группа была подразделена на две подгруппы: первая подгруппа (А) — пациенты с ИБС. Стенокардия напряжения. ФК II — 4 больных (19,0 %). Вторая подгруппа (Б) — пациенты с ИБС. Стенокардия напряжения. ФК III — 17 (81,0 %).
В зависимости от размеров аденомы встречались следующие изменения гипофиза, выявленные на КТ/МРТ: микроаденомы (< 10 мм) — 11 больных (15,2 %), мезоаденомы (11–20 мм) — 11 больных (15,2 %), макроаденомы (до 30 мм) — 16 больных (22,2 %), гигантские (более 30 мм) — 34 больных (47,2 %).
Распределение больных по топографоанатомической классификации стороны роста аденомы гипофиза (Кадашев Б.А., 2007 г.) показало, что наиболее часто наблюдались аденомы гипофиза с эндосупраселлярным ростом — 27 больных (37,5 %), с инфраселлярным ростом — 2, с латероселлярным ростом — 3, с антеселлярным ростом — 1, с ретроселлярным ростом — 1, с тотальным вариантом роста — 21 больной (29,1 %).
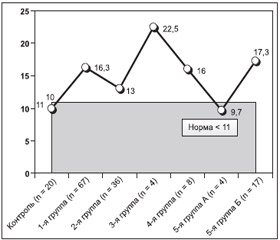
В табл. 3 приведены результаты опроса больных по вопроснику ДГР у взрослых по группам до операции. Всего было обследовано 136 пациентов (100 %).
Как видно из табл. 3, во всех группах средние значения вопросника превышали норму (11 баллов), при этом наиболее достоверно это наблюдалось у больных первой, третьей, четвертой групп и второй подгруппы пятой группы больных.
Таким образом, исследование качества жизни на основе опросника ДГР QoL-AGHDA у 136 больных выявило, что во всех группах средний балл был выше нормы (в норме < 11). Эти данные представлены на рис. 1.
/122/122_2.jpg)
Далее на основе вопросника ДГР QoL-AGHDA нами была изучена степень корреляции показателей качества жизни у 136 больных с базальными значениями СТГ и ИФР-1 крови. Эти данные представлены в табл. 4.
Как видно из табл. 4, достоверная корреляционная связь между низкими базальными значениями СТГ, ИФР-1 плазмы крови и средними значениями вопросника ДГР QoL-AGHDA была найдена в первой, второй, третьей и четвертой группах и второй подгруппе пятой группы пациентов, что подтверждает целесообразность использования вопросника ДГР QoL-AGHDA у больных с ДГР различного генеза.
Далее нами была изучена динамика показателей данного вопросника при оценке качества жизни 36 оперированных больных второй группы через 6 месяцев после операции ТГЭ. Как видно из данных, представленных в табл. 5, у 36 пациентов через 3 месяца после ТГЭ отмечалось повышение среднего балла по вопроснику ДГР на фоне снижения средних значений СТГ и ИФР-1. Это показывает, что в раннем послеоперационном периоде у пациентов возрастает степень выраженности гипопитуитаризма.
Выводы
1. Исследование качества жизни на основе вопросника ДГР QoL-AGHDA у 136 больных выявило, что во всех группах средний балл был выше нормы (в норме < 11), при этом наиболее достоверно это наблюдалось у больных первой, третьей, четвертой групп и второй подгруппы пятой группы больных.
2. Достоверная корреляционная связь между низкими базальными значениями СТГ, ИФР-1 плазмы крови и средними значениями вопросника ДГР QoL-AGHDA была найдена в первой, второй, третьей, четвертой группах и второй подгруппе пятой группы пациентов, что подтверждает высокую эффективность использования вопросника ДГР QoL-AGHDA у больных с ДГР различного генеза.
3. У 36 пациентов через 3 месяца после ТГЭ отмечалось достоверное повышение среднего балла по вопроснику ДГРВ на фоне снижения средних значений СТГ и ИФР-1. Это показывает, что в раннем послеоперационном периоде у пациентов возрастает степень выраженности гипопитуитаризма (ДГР) и встает вопрос о назначении заместительной гормональной терапии.
1. Дедов И.И., Мельниченко Г.А. Эндокринология. Национальное руководство. — М., 2009. — 597 с.
2. Марова Е.И. Нейроэндокринология. Клинические очерки. — М., 1999. — С. 380–401.
3. Agrawal D., Mahapatra A.K. Visual outcome of blind eyes in pituitary apoplexy after transsphenoidal surgery: a series of 14 eyes // Surg. Neurol. — 2005. — 63. — 42–46.
4. Anderson D., Faber P., Marcovitz S. Pituitary tumors and the ophthalmologist // Ophthalmology. — 1983. — 90. — 1265–1270.
5. Assessment of Cardiovascular Risk in Patients with Growth Hormone Deficiency Following Transsphenoidal Surgery for Nonsecreting Pituitary Adenomas. Verified by: Columbia University, April 2011. First Received: March 25, 2008 / Last Updated: April 22, 2011 / Phase: N/A / Start Date: March 2008 Link to the current ClinicalTrials.gov record. http://clinicaltrials.gov/show/NCT00646308. Study ID Number: AAAB9681. ClinicalTrials.gov Identifier: NCT00646308. Health Authority. — United States: Institutional Review Board.
6. Black P.M, Zervas N.T, Candia G. Management of large pituitary adenomas by transsphenoidal surgery // Surgical Neurology. — 1988. — 29. — 443–447.
7. Bertella L., Mori I., Grugni G. et al. Quality of life and psychological well-being in GH-treated, adult PWS patients: a longitudinal study // J. Intellect. Disabil. Res. — 2007 Apr. — 51 (Pt. 4). — 302–11.
8. Baldelli R., Bianchi A., Diacono F. et al. Characteristics of adult patients with growth hormone deficiency who underwent neurosurgery for functioning and non-functioning pituitary adenomas and craniopharyngiomas // J. Endocrinol. Invest. — 2005 Feb. — 28 (2). — 157–61.
9. Cohen A.R., Cooper P.R., Kupersmith M.J. Visual recovery after transsphenoidal removal of pituitary adenomas // Neurosurgery. — 1985. — 17. — 446–452.
10. Comtois R., Beauregard H., Somma M. The clinical and endocrine outcome to trans-sphenoidal microsurgery of nonsecreting pituitary adenomas // Cancer. — 1991. — 68. — 860–866.
11. Clayton P.E., Shalet S.M. Dose dependency of time of onset of radiation-induced growth hormone deficiency // J. Pediatr. — 1991. — 18. — 2.
12. Chrousos G.P., Poplack D., Brown T. et al. Effects of cranial radiation on hypothalamic-adenohypophyseal function: Abnormal growth hormone secretory dynamics // J. Clin. Endocrinol. Metab. — 1982. — 54. — 1135–1139.
13. Growth Hormone Research Society (GRS): Consensus guidelines for the diagnosis and treatment of adults with GH deficiency: Summary statement of the GRS workshop on adult GHD // J. Clin. Endocrinol. Metab. — 1998. — 34. — 379–381.
14. Jorgensen J.O. Christiansen L. GHD in adults // Denmark, Frontiers of Hormone research / Ed. by A.B. Grossman. — 2005. — Vol. 33. — Р. 22.
15. Fitzek M.M, Linggood R.M, Adams J. Combined proton and photon irradiation for craniopharyngioma: long-term results of the early cohort of patients treated at Harvard Cyclotron Laboratory and Massachusetts General Hospital // Int. J. Radiat. Oncol. Biol. Phys. — 2006 Apr 1. — 64 (5). — 1348–54.
16. Kendall-Taylor P., Jönsson P.J., Abs R. The clinical, metabolic and endocrine features and the quality of life in adults with childhood-onset craniopharyngioma compared with adult-onset craniopharyngioma // Eur. J. Endocrinol. — 2005 Apr. — 152 (4). — 557–567.
17. Kirk J.A, Raghupathy P., Stevens M.M. et al. Growth failure and growth-hormone deficiency after treatment for lymphoblastic leukaemia // Lancet. — 1987. — 190–193.
18. Littley M.D., Shalet S.M., Beardwell C.G. et al. Hypopituitarism following external radiotherapy for pituitary tumors in adults // Q. J. Med. — 1988. — 262. — 145–160.
19. Long Term Post Operative Follow-Up of Cushing Syndrome. Verified by: National Institutes of Health Clinical Center (CC), September 2004. First Received: January 26, 2002 / Last Updated: March 3, 2008 / Phase: N/A / Start Date: July 1993. Link to the current ClinicalTrials.gov record.http://clinicaltrials.gov/show/NCT00029952. Study ID Number: 930169. ClinicalTrials.gov Identifier: NCT00029952. Health Authority: United States: Federal Government.
20. Mortini P., Losa M., Barzaghi R. Results of transsphenoidal surgery in a large series of patients with pituitary adenoma // Neurosurgery. — 2005. — 56. — 1222–1233.
21. Pecori Giraldi F., Andrioli M., De Marinis L. et al. Significant GH deficiency after long-term cure by surgery in adult patients with Cushing's disease // Eur. J. Endocrinol. — 2007 Feb. — 156 (2). — 233–239.
22. Pollock B.E., Nippoldt T.B., Stafford S.L. et al. Results of stereotactic radiosurgery in patients with hormone-producing pituitary adenomas: factors associated with endocrine normalization // J. Neurosurg. — 2002 Sep. — 97 (3). — 525–530.
23. Sara M., Claudio F., Marco L. et al. Time course of hypothalamic-pituitary deficiency in adults receiving cranial radiotherapy for primary extrasellar brain tumors // Radiother Oncol. — 2011 Apr. — 99 (1). — 23–8.
24. Sheehan J.P., Pouratian N., Steiner L. Gamma Knife surgery for pituitary adenomas: factors related to radiological and endocrine outcomes // J. Neurosurg. — 2011 Feb. — 114 (2). — 303–309.

/120/120.jpg)
/121/121.jpg)
/122/122.jpg)