Международный эндокринологический журнал 8 (64) 2014
Вернуться к номеру
Вплив фіксованої комбінації йоду і селену на перебіг автоімунного тиреоїдиту в йододефіцитному регіоні
Авторы: Москва Х.А., Кіхтяк О.П., Макар Р.Д. — Львівський національний медичний університет імені Данила Галицького
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Останнім часом з’явились повідомлення про причетність недостатності селену до розвитку автоімунного тиреоїдиту. Проведено клінічне дослідження впливу фіксованої комбінації 150 мкг йоду і 75 мкг селену. Встановлено, що після шести місяців терапії вірогідно збільшується концентрація вільного тироксину і зменшується рівень концентрації антитіл до пероксидази. Проведене порівняння з групою монотерапії йодом 150 мкг/добу також виявило вірогідну відмінність за показниками концентрації антитіл до пероксидази на користь призначення комбінації йоду й селену. Збільшення рівня вільного тироксину поряд із виявленою тенденцією до зменшення тиреотропного гормона можна розглядати як можливий позитивний вплив фіксованої комбінації йоду й селену (препарат ЙоСен®) на функціональний статус щитоподібної залози. Указаний ефект виявлений уперше і потребує подальшого вивчення.
В последнее время появились сообщения о причастности недостатка селена к развитию аутоиммунного тиреоидита. Проведено клиническое исследование влияния фиксированной комбинации 150 мкг йода и 75 мкг селена. Установлено, что после шести месяцев терапии достоверно увеличивается концентрация свободного тироксина и уменьшается уровень концентрации антител к пероксидазе. Проведенное сравнение с группой монотерапии йодом 150 мкг/сутки также выявило достоверное отличие по данным концентрации антител к пероксидазе в пользу назначения комбинации йода и селена. Увеличение уровня свободного тироксина наряду с обнаруженной тенденцией к уменьшению тиреотропного гормона можно рассматривать как возможное положительное влияние фиксированной комбинации йода и селена (препарат ЙоСен®) на функциональный статус щитовидной железы. Указанный эффект обнаружен впервые и требует дальнейшего изучения.
Recently, there were reports about the involvement of selenium deficiency in the development of autoimmune thyroiditis. A clinical study of the effect of the fixed combination of 150 µg of iodine and 75 µg of selenium has been carried out. It was found that after six months of therapy the concentration of free thyroxine significantly increases and the concentration of antibodies to peroxidase decreases. A comparison with the group of monotherapy using iodine 150 µg/day also showed a significant difference according to peroxidase antibodies concentration in favor of administration of iodine and selenium combination. Increased levels of free thyroxine, along with a trend towards thyroid stimulating hormone decrease, can be considered as a possible positive effect of the fixed combination of iodine and selenium (IoSen®) on the functional status of the thyroid gland. This effect was found for the first time and requires further study.
автоімунний тиреоїдит, йод, селен, концентрація антитіл до пероксидази.
аутоиммунный тиреоидит, йод, селен, концентрация антител к пероксидазе.
autoimmune thyroiditis, iodine, selenium, peroxidase antibodies concentration.
Статья опубликована на с. 38-42
Хронічний автоімунний тиреоїдит і його підвид — хронічний лімфоцитарний тиреоїдит Хашимото — поширене ендокринне захворювання, яке часто призводить до порушення функції щитоподібної залози (ЩЗ). Етіологія тиреоїдиту Хашимото достеменно не з’ясована, але загалом відомо, що до причин його розвитку мають відношення генетична схильність і фактори зовнішнього середовища. Європейські дані свідчать, що у 85 % хворих, які страждають від автоімунного тиреоїдиту (АІТ), розвивається гіпотиреоз. Наприклад, у Данії щороку фіксують виникнення АІТ у 47,2/100 000 пацієнтів. Приблизне співвідношення частоти виникнення хвороби в чоловіків і жінок перебуває в межах від 1 : 5 до 1 : 10 [16]. Лікарям загальної практики та ендокринологам добре відомо, як реагують пацієнти на високі концентрації антитіл до пероксидази та тиреоглобуліну в їхніх лабораторних дослідженнях. Занепокоєння пацієнтів цілком можна зрозуміти, адже функція ЩЗ за умови наявного АІТ поступово згасає (приблизно 5 % на рік) аж до розвитку маніфестного гіпотиреозу [9]. Враховуючи останнє, найпоширенішим варіантом лікування є призначення левотироксину з метою компенсації дефіциту тиреоїдних гормонів, усунення клінічних проявів гіпотиреозу та підтримання еутиреоїдного стану. Крім того, хвилювання хворих можна також пояснити спостереженням, у якому виявили позитивну кореляцію між рівнем антитіл до пероксидази та загальними симптомами нездужання (дистресу) [28]. Водночас узгодженого лікування автоімунних змін не розроблено.
До останніх більш вивчених етіологічних факторів зараховують вагітність, хромосомні відхилення, генетичні зміни, недостатність вітаміну D, тютюнопаління, зловживання алкоголем, низький уміст селену.
Під час вагітності концентрація антитиреоїдних антитіл знижується, що пов’язано з виробленням материнських регуляторних Т-клітин для підтримання толерантності до алоантигенів плода і запобігання процесам відторгнення. Але після пологів виникає ефект рикошету зі швидким підйомом рівня автоантитіл. У випадку, якщо післяпологовий тиреоїдит все ж розвивається, це часто слугує передвісником розвитку автоімунного гіпотиреозу в майбутньому [19].
У соматичних клітинах жінки одна з двох Х-хромосом знаходиться в інактивованому стані з часу ембріонального розвитку. Отже, спостерігається мозаїчність, сформована з двох клітинних ліній, а саме від батьківської Х-хромосоми й активної Х-хромосоми матері. За відсутності паритету (50 : 50) у випадковому порядку виникає асиметричність ролі певної Х-хромосоми у більше ніж 80 % клітин. Це призводить до того, що власні антигени однієї з хромосом не експресуються в достатній кількості в тимусі чи на периферії, спричиняючи запуск автоімунних реакцій.
Дослідження близнюків виявили, що в 70 % із них хвороба пов’язана з генетичними факторами (більшою мірою гени HLA-класу), тоді як у 30 % — спричинена факторами зовнішнього середовища [5]. Вважають також, що слід вивчати не лише взаємодію типу «ген — навколишнє середовище», але і взаємодії «ген — ген». Все частіше висловлюється думка про призначення персоніфікованих лікарських засобів залежно від чутливості і переважання тих чи інших задіяних у хворобі генів.
Як відомо, куріння — вагомий фактор розвитку хвороби Грейвса — Базедова, особливо тиреотоксичної офтальмопатії [26]. На противагу цьому отримано дані про те, що куріння може зменшувати ризик розвитку автоімунного гіпотиреозу [3]. Анатабін — алкалоїд тютюну, який має таку саму структуру, як і нікотин, знижує частоту й тяжкість АІТ в експериментальних дослідженнях [8]. Водночас Датський національний регістр показав, що, зменшуючи ризик розвитку гіпотиреозу, куріння підвищує ризик розвитку гіпертиреозу на прикладі аналізу даних жінок-курців [2].
Щодо алкоголю існують протиріччя. З одного боку, дослідження вказують на протективний ефект помірного вживання алкоголю щодо розвитку АІТ, а з іншого — відомий його прямий токсичний вплив на ЩЗ [20].
Багато імунокомпетентних клітин (моноцити, макрофаги, Т-лімфоцити, В-лімфоцити та ін.) експресують вітамін D-активні ферменти і вітамін D-рецептори. Активна форма гормона 1,25 (OH)2D зв’язується зі своїм рецептором і модулює як уроджений, так і набутий імунітет [15]. З низьким умістом вітаміну D пов’язують розвиток цукрового діабету типу 1, хвороби Крона, ревматоїдного артриту, розсіяного склерозу. Останнім часом з’ясовано, що дефіцит вітаміну D асоціюється з підвищенням рівня антитіл до пероксидази (АТ/ПО) і її розвитком АІТ [22, 24].
Стрес часто розглядають як вагомий фактор ініціації розвитку хвороби Грейвса — Базедова, але щодо розвитку АІТ у дослідженні Amsterdam AITD такої асоціації не виявили.
До відомих причин розвитку АІТ зараховують такі фактори, як інфекції, призначення певних лікарських засобів, надмірне споживання йоду. До інфекційного захворювання, яке асоціюється з АІТ, зараховують вірусний гепатит С [5]. Ентеровіруси також розглядають як тригери тиреоїдиту Хашимото [14]. До медикаментів, що спричиняють розвиток АІТ, включають інтерферон, антиретровірусні засоби. Як не дивно, але саме надмірна кількість йоду в зовнішньому середовищі (воді, ґрунті, повітрі, продуктах харчування) частіше поєднується з розвитком автоімунного гіпотиреозу, підвищеними рівнями антитиреоїдних антитіл, ніж йодна недостатність. Наприклад, збагачення йодом продуктів харчування в Данії супроводжувалось зростанням частоти розвитку автоімунних форм гіпотиреозу [7]. Незважаючи на таку особливість впливу йоду, йодна профілактика обов’язкова для населення, яке проживає в ендемічних щодо зоба регіонах. Вважається, що профілактичні дози у 100–150 мкг/добу (для вагітних і годуючих 200–250 мкг/добу) не здатні спричинити ні хвороб ЩЗ, ні їх загострень.
Ролі селену надають останнім часом особливого значення, оскільки це саме той фактор зовнішнього середовища, на який легше за все вплинути. Глутатіонпероксидази і тіоредоксинредуктази є селенопротеїнами, які задіяні в регуляції редокс-системи та захисті від оксидантного стресу. З’ясувалось, що саме ЩЗ містить більше селену з розрахунку на 1 г тканини, ніж інші органи, а низький рівень селену асоціюється з імунною дисфункцією [11, 21]. Проведена низка досліджень із метою поглибити знання щодо цієї особливості. Експериментальне вивчення щурів Lewis, яким викликали АІТ шляхом підшкірного введення свинячого тиреоглобуліну, показало, що більш серйозні ураження ЩЗ спостерігаються в групах недостатності селену [23]. Результати трьох із шести рандомізованих клінічних досліджень виявили, що селен порівняно з плацебо вірогідно знижує рівень АТ/ПО [10, 13, 25]. Сьогодні вважають, що специфічне зниження АТ/ПО на тлі додавання селену спостерігається в регіонах із вираженим дефіцитом йоду. Важливою умовою успіху є також тривалість селенотерапії, яка повинна надаватися хворим понад 6 місяців. Недостатність йоду спричиняє посилення оксидантного стресу у тканині ЩЗ, а вживання селену запобігає цим шкідливим процесам [12]. Але не будь-який рівень умісту селену в крові безпечний. У згаданих вище дослідженнях уміст селену в крові становив 95 мкг/л на тлі лікування порівняно з початковими даними (73 мкг/л). У випадках, коли концентрація селену в крові досягає позначки 122 мкг/л або перевищує (безпечний граничний рівень < 122 мкг/л), зростає ризик розвитку цукрового діабету 2-го типу [17]. Водночас вищі концентрації селену, такі як 130–150 мкг/л, також можуть бути прийнятні для людини, адже це пов’язано з індивідуальною потребою організму в селені через поліморфізм селеновмісних генів. У більшості досліджень добова доза селену до 200 мкг розглядається як максимально припустима та безпечна. Незважаючи на вищенаведені дані, Кохранівський систематичний огляд усе ж стверджує, що сьогодні немає достатньої доказової бази даних, щоб узгодити загальні принципи призначення селену хворим на тиреоїдит Хашимото.
Зважаючи на особливу актуальність ролі селену в розвитку АІТ (за даними багатьох літературних джерел), було вирішено провести власне клінічне дослідження з метою з’ясувати вплив комбінованого препарату ЙоСенТМ у хворих на АІТ без маніфестного гіпотиреозу, які виросли і проживають на території, ендемічній по зобу.
Матеріали і методи дослідження
В обстеженні взяли участь 53 жінки з АІТ без маніфестного гіпотиреозу, середній вік яких становив 21,23 ± 2,71 року. Діагноз верифікували на підставі клінічної картини, а також за даними загальноклінічних, біохімічних, інструментальних методів дослідження. Умовами включення в дослідження були: згода пацієнта на участь в обстеженні та лікуванні, відсутність маніфестного гіпотиреозу, цукрового діабету чи інших тяжких супутніх захворювань, постійне проживання на Прикарпатті. Пацієнтів відбирали на амбулаторному прийомі у Львівському обласному ендокринологічному диспансері та під час консультацій на кафедрі ендокринології Львівського національного медичного університету імені Данила Галицького. Середня тривалість захворювання перебувала в межах 3–5 років. Усі відібрані хворі проживають на Прикарпатті від народження (ендемічна зона щодо зоба). Обрана когорта пацієнтів отримувала профілактичне лікування препаратами йоду під час навчання у школі, деякі з жінок — у період вагітності. Упродовж останніх 6–8 років хворі не приймали жодних препаратів йоду чи селену. У випадковому порядку хворі були поділені на дві групи, які відрізнялися тактикою профілактичної допомоги. У першій групі, яка налічувала 28 осіб, призначали ЙоСен® один раз на добу незалежно від прийому їжі. Одна таблетка препарату ЙоСен® містить 0,253 мг калію йодату (що еквівалентно 150 мкг йоду) і 0,121 мг натрію селеніту (що еквівалентно 75 мкг селену). До другої групи увійшли 25 пацієнтів, яким також призначали препарат один раз на добу, що містив 150 мкг калію йодиду.
До і після терапії, що тривала 193 ± 16 діб (близько шести місяців), визначали рівні тиреотропного гормона гіпофіза (ТТГ), вільного тироксину (вТ4), вільного трийодтироніну (вТ3), тиреоглобуліну (ТГ), концентрацію антитіл до тиреоглобуліну (АТ/ТГ), до пероксидази, вміст глікованого гемоглобіну (HbA1c). HbA1c вивчали з метою виключити наявність цукрового діабету.
Рівні ТТГ, вТ3, вТ4 визначали імуноферментним методом на автоматичному мікропланшетному зчитувачі Sunrise Tecan, концентрацію антитіл (АТ/ТГ, АТ/ПО) і вміст ТГ обчислювали імунохімічним методом з електрохемілюмінісцентною детекцією на аналізаторі COBAS-600, концентрацію HbA1c вивчали на біохімічному аналізаторі COBAS INTEGRA 400 plus.
Параметричні дані представлені як М ± m (М — середнє значення, m — стандартна похибка середнього), оскільки розподіл показників був нормальним. Статистична обробка даних проводилась варіаційно-статистичним методом за допомогою програмного забезпечення Excel (Microsoft Office, США) і Statistica 7.0 (Statsoft, США) [1].
Результати дослідження та їх обговорення
Після шести місяців терапії з використанням ЙоСену® в пацієнтів з АІТ виявлено вірогідні зміни показників вТ4 і АТ/ПО (табл. 1, рис. 1, 2). Рівень вТ4 підвищився (р = 0,03) з 1,02 ± 0,03 нг/дл до 1,12 ± ± 0,04 нг/дл, залишаючись у межах референтних значень (0,93–1,7 нг/дл). Показники АТ/ПО також зазнали вірогідних змін (р = 0,03) і знизились із 163,90 ± 6,69 до 146,36 ± 4,84, прямуючи до величини норми (< 34,0). Отже, наші спостереження узгоджуються з низкою згаданих вище досліджень, у яких вважається за доцільне додавання селену до лікування АІТ. Висловлюється навіть припущення, що лікування селеном може не лише призупинити патологічний процес розвитку АІТ, але й запобігти його появі [4].
На тлі прийому ЙоСену® виявили тенденцію до вірогідних змін за показниками ТТГ та ТГ (р = 0,09 і р = 0,08 відповідно) (рис. 1, 3). Цікавою знахідкою була поява тенденції вірогідних змін (р = 0,07) за даними HbA1c після піврічного використання ЙоСену® (від 5,91 ± 0,10 % до 5,69 ± 0,09 %) (рис. 3). Хоча зміни не були вірогідними, було вирішено провести наукову розвідку. За даними D. Rendina і співавт., вдалося встановити зв’язок між метаболічним синдромом, а точніше, проявами інсулінової резистентності і появою багатовузлового нетоксичного зоба в регіонах із помірною йодною недостатністю [18]. Відповідно, йодна та селенова недостатність може відігравати певну невивчену досі роль у розвитку інсулінової резистентності і порушень вуглеводного обміну.
/41/41_3.jpg)
Під впливом шестимісячного прийому калію йодиду не спостерігали жодних змін за результатами досліджуваних показників (табл. 2). Ймовірно, монотерапія йодидом калію потребує більш тривалого спостереження для отримання виражених змін.
Водночас статистичний аналіз початкових даних обох груп вказує на їх однорідність до лікування. Не відзначено також вірогідних змін чи тенденції до змін між групами дослідження до лікування.
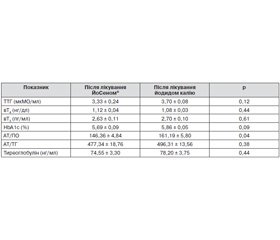
Порівняння даних груп між собою на шостий місяць терапії виявило вірогідні зміни за показниками АТ/ПО (р = 0,04) між значеннями групи калію йодиду і групи ЙоСену® відповідно: 161,19 ± 5,80 і 146,36 ± 4,84. Зафіксували також і тенденцію до змін (р = 0,09) між групою ЙоСену® і калію йодиду за показниками HbA1c (5,69 ± 0,09 % і 5,86 ± 0,05 % відповідно) після завершення терапії (табл. 3). Така особливість виявлена вперше, і ця клінічна знахідка потребує більш глибокого вивчення.
Висновки
1. Призначення ЙоСену® хворим на АІТ сприяло зниженню АТ/ПО, АТ/ТГ і підйому вТ4 після шести місяців профілактичної терапії.
2. Аналіз даних після лікування двох груп хворих на АІТ виявив вірогідну відмінність за рівнем АТ/ПО на користь комбінованого призначення 150 мкг йоду і 75 мкг селену у вигляді препарату ЙоСен®.
3. Одночасна тенденція до змін за рівнем ТТГ, тиреоглобуліну і вірогідне зростання вТ4 у хворих першої групи вказують на доцільність призначення ЙоСену® хворим на АІТ у йододефіцитному регіоні.
4. Фізіологічні дози йоду не погіршували перебіг АІТ у хворих групи контролю.
5. Тенденція до вірогідних змін за даними HbA1c у першій групі спостереження потребує більш глибокого вивчення стосовно зв’язку порушень вуглеводного обміну з йодною і селеновою недостатністю.
Список літератури знаходиться в редакції

/40/40.jpg)
/41/41.jpg)
/41/41_2.jpg)
/42/42.jpg)