Международный эндокринологический журнал 8 (64) 2014
Вернуться к номеру
Сучасний стан діагностики та лікування медулярного раку щитоподібної залози
Авторы: Кваченюк А.М., Рейзін Д.В. – ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ; Київська міська клінічна лікарня № 8
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 45-61
Останніми роками особливу увагу онкологів серед різних морфологічних форм злоякісних пухлин щитоподібної залози (ЩЗ) привертає медулярний рак щитоподібної залози (МРЩЗ) [11, 12, 20, 22, 34, 54, 78, 93, 134]. Цьому, безсумнівно, сприяють досягнення, пов’язані з розшифровкою генетичних основ тиреоїдного канцерогенезу, перш за все вивченням походження МРЩЗ і особливо його форм [23, 28, 47, 69, 138].
МРЩЗ був уперше описаний у літературі як «злоякісний зоб з амілоїдом» у 1906 році [106]. У 1959 році захворювання було описане з гістологічної точки зору [93]. У 1968 р. англійський гістолог Е. Пірс запропонував концепцію існування в організмі APUD-системи — особливої високоорганізованої дифузної системи клітин, специфічною функцією якої є продукція біогенних амінів і пептидних гормонів. Будь-який тип клітин, що входить в APUD-систему, може слугувати джерелом розвитку пухлини [155].
Причини виникнення пухлин, що виходять із клітин APUD-системи та мають гормональну активність, до сьогодні ще не з’ясовані. Встановлено, що в ряді випадків ці пухлини мають сімейно-спадковий характер [1]. Серед усіх апудом МРЩЗ характеризується своєрідною гістологічною будовою і клінічним перебігом [155]. Встановлено, що МРЩЗ розвивається з парафолікулярних С-клітин ЩЗ, які є частиною APUD-системи та синтезують кальцитонін і походять із неврального гребінця [31, 35, 36, 57, 88, 95, 155, 203, 204]. У деяких випадках пухлина має здатність секретувати й інші пептидні гормони (простагландини, гістамін, серотонін, адренокортикотропний гормон тощо) [22, 89].
За даними різних авторів, захворюваність на МРЩЗ становить 3–15 % від усіх злоякісних новоутворень ЩЗ [7, 44, 54, 57, 77–79, 89, 108, 117, 134]. Розрізняють спорадичну і спадкову форми МРЩЗ. Спорадична становить 70–80 % випадків МРЩЗ, спадкова — 20–30 % [7, 8, 57, 95, 108, 117, 119, 125]. Ці форми суттєво розрізняються за особливостями походження, клінічними проявами тощо [7, 27, 34, 38, 125, 126]. Співвідношення чоловіків і жінок при спорадичному виникненні пухлини становить 1 : 1,4; у генетично зумовлених випадках — 1 : 1 [7, 12, 181].
Спорадична форма МРЩЗ розвивається у хворих 40–60 років і характеризується однофокусним ураженням ЩЗ [8, 22, 25, 30]. У третини пацієнтів відмічається стійка діарея, що викликана підсиленою секрецією і роботою шлунково-кишкового тракту внаслідок дії гормона, що виділяє МРЩЗ [30, 38].
Спадкова форма (множинна ендокринна неоплазія 2-го типу, МЕН 2) уражає приблизно 1 з 30 000 осіб до 30 років [20, 22, 33, 35, 38, 168] і представлена трьома клінічними варіантами: сімейним МРЩЗ (СМРЩЗ) та МРЩЗ у складі синдромів множинних ендокринних неоплазій — МЕН 2А (синдром Сіппла) і МЕН 2Б [28, 88, 136, 141, 187]. Критичний регіон генетичної схильності для всіх цих форм знаходиться на 10-й хромосомі [12, 143, 176]. Причому приблизно у 5 % уражених виявляється нова мутація. Для МЕН 2Б ця частка становить майже 50 % [168].
МРЩЗ при синдромах МЕН 2 у носіїв специфічних мутацій гена RET розвивається з вірогідністю до 100 % і є найчастішою причиною летальності [30, 128].
Сімейна форма (СМРЩЗ) успадковується за автосомно-домінантним типом і становить 25 % від усіх захворювань на МРЩЗ. Ця форма найчастіше буває однобічною і має найсприятливіший перебіг [30, 57, 77, 79, 108]. Нині СМРЩЗ розглядається як варіант синдрому МЕН 2А, за якого в багатьох поколінь єдиним проявом виступає МРЩЗ, але в подальшому не виключається і розвиток феохромоцитоми чи гіперпаратиреозу [26, 28, 35, 69].
Синдром Сіппла є найпоширенішим серед МЕН 2 з характерним двобічним ураженням ЩЗ або С-клітинною гіперплазією, феохромоцитомою (до 50 % хворих) і гіперпаратиреозом (20–30 %), частота його сягає понад 90 % [12, 30, 69, 187]. Ця форма МРЩЗ відрізняється агресивністю, пенетрантність якої становить 100 % [12, 78], частіше розвивається в осіб до 30-річного віку [7, 8, 26, 30, 48, 49, 74, 136].
Найагресивніший перебіг МРЩЗ при синдромі МЕН 2Б спостерігається майже у 5 % випадків [12] та зазвичай виникає у пацієнтів віком до 5–10 років [13, 22, 30]. Серед особливостей фенотипу — виникнення у дітей до однорічного віку [30, 74, 92, 142]. При цьому особи чоловічої і жіночої статі уражаються з однаковою частотою. На момент встановлення діагнозу ранні регіонарні метастази виявляють у 80 % пацієнтів, а віддалені — у 20 % [28, 39]. Характерною ознакою цього синдрому є множинні слизові гангліоневроми й деформація скелета, як при синдромі Марфана [12, 30, 47, 48].
Унаслідок різноманітності форм та особливостей фенотипу МРЩЗ характеризуються швидкою маніфестацією — ростом первинної пухлини, раннім метастазуванням, швидкою генералізацією захворювання [14, 15, 36, 46, 47, 88, 109].
З урахуванням аналізу літературних даних для клініцистів вкрай важливою є своєчасна диференціація спорадичних та спадково-генетичних форм МРЩЗ для більш ретельного скринінгу родини хворого. З огляду на високу смертність при діагностуванні СМРЩЗ є необхідність, на нашу думку, більш радикального лікування хворого (більший обсяг втручання, ніж наведено у протоколах) та виконання в разі генетичного підтвердження навіть профілактичного хірургічного лікування родини. Лікування спорадичних форм, на нашу думку, може бути менш агресивним та спиратися на клінічну стадію, пухлинні маркери й перебіг хвороби, що і стало метою цієї роботи.
Діагностика МРЩЗ, метастазів та виявлення резидуальної пухлини або рецидиву захворювання. Діагностика МРЩЗ, оцінка поширеності пухлинного процесу здійснюється на доопераційному етапі і доповнюється у процесі хірургічного лікування при експрес-гістологічному дослідженні пухлини та регіонарних лімфатичних колекторів та імуногістохімічному дослідженні видаленого препарату в післяопераційному періоді [4, 7, 8, 31, 117, 191].
Клінічна діагностика базується на даних анамнезу, скарг, виявленні специфічних симптомів, особливо це стосується МЕН 2. Ряд авторів підкреслюють важливість ретельного обстеження ЩЗ (змін контурів ЩЗ, щільності пухлини, темпів росту), особливо під час профоглядів та поліклінічних прийомів ендокринолога [4, 13, 22, 129, 137, 156, 178].
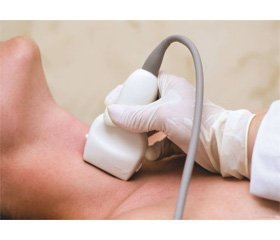
На сьогодні основними методами діагностики МРЩЗ є ультразвукове дослідження (УЗД), тонкоголкова аспіраційна пункційна біопсія (ТАПБ), визначення кальцитоніну в сироватці крові, молекулярно-генетичні дослідження [12, 44, 81, 98–100, 102, 103, 114, 117].
Важливим діагностичним етапом є доопераційне визначення метастазів, оскільки, за даними деяких авторів, метастази в лімфатичні вузли при МРЩЗ спостерігаються у більше ніж 75 % пацієнтів [16, 101]. Крім того, згідно з останніми клінічними рекомендаціями саме визначення регіонарного метастазування є показанням для розширення оперативного прийому. Також є не дослідженим на сьогодні вплив профілактичних втручань на регіонарних колекторах лімфовідтоку на частоту рецидивування та виживаність хворих залежно від клінічної стадії захворювання.
Ультразвукова діагностика. При УЗД МРЩЗ виявляються гіпоехогенні ділянки неоднорідної структури з чіткими контурами, у 75–90 % — з дрібними точковими гіперехогенними включеннями. Ці включення корелюють із відкладенням кальцію, який оточений амілоїдом, що є наслідком підвищеної секреторної активності С-клітин [10, 13, 133, 198–200]. Збільшення інтенсивності ехо-сигналів, що відображають ділянки тканини МРЩЗ, пов’язують із реактивним фіброзом, наявністю осередків окостеніння, відкладенням мікро-/макрокальцифікатів тощо [4, 5, 198, 200]. При УЗД вогнищ медулярного раку в основному візуалізуються ознаки, що характерні для інших типів раку ЩЗ: гіпоехогенні зони різного розміру і форм з вогнищами підвищеної акустичної щільності та нерівними контурами з характерною особливістю — солідною будовою [5, 31, 198, 199].
За даними S. Lee і співавт. [133], для МРЩЗ характерними є частіші кістозні зміни та їх великий розмір. Проте низька специфічність УЗД МРЩЗ унеможливлює диференціальну діагностику його видів, а також виявлення найменших лімфатичних метастазів [5, 99].
Деякі дослідники вважають, що на підставі вивчення співвідношень гіпоехогенних зон і ділянок із різко підвищеною інтенсивністю ехо-сигналів можна визначити стадію розвитку МРЩЗ [4, 199, 200].
Зростання акустичної щільності ЩЗ, а також поява гіперехогенних локусів без чітких меж у шийних лімфатичних вузлах свідчить про наявність метастазів МРЩЗ [31, 133]. З огляду на те, що ультразвукові критерії ураження лімфатичних вузлів не дуже специфічні, лікар-сонографіст повинен мати високу кваліфікацію [38, 46, 99, 198].
Саме через неспецифічність ряду УЗ-критеріїв для визначення стадії процесу є нагальна потреба в комплексній оцінці поширення пухлини, перш за все за допомогою онкологічних маркерів (кальцитоніну, раково-ембріонального антигену).
Тонкоголкова аспіраційна пункційна біопсія. Основним методом, що дозволяє верифікувати діагноз, вважають прицільну ТАПБ вузла ЩЗ або ж змінених лімфатичних вузлів під контролем УЗД із подальшим цитологічним дослідженням [38, 67, 86, 165, 172, 199]. За умови виконання імуногістохімічних досліджень це дозволяє виявити МРЩЗ до операції [27, 81, 87, 118, 165].
T. Chang і співавт. [67], порівнюючи результати цитологічного і гістологічного досліджень даних 34 пацієнтів із доведеним МРЩЗ, відмітили чутливість цього дослідження на рівні 82,4 %. Аналогічні дані (чутливість при діагностиці МРЩЗ 99 і 89 %; 91 і 63 %) отримані й іншими авторами [55, 118, 149]. Проте деякі дослідники вважають, що МРЩЗ за допомогою ТАПБ із подальшим цитологічним дослідженням можна встановити лише у 32 % хворих [102]. Таку різницю в показниках пояснюють тим, що при дослідженні вузлового зоба виникають труднощі у виборі вузлів для ТАПБ; неточності в діагностиці нетипових форм; при новоутвореннях розміром менше 5 мм не можна як адекватно візуалізувати, так і точно відібрати біоптат [102]. Покращує точність діагностики визначення кальцитоніну в матеріалі, взятому з лімфатичного вузла або ж вузла ЩЗ [53, 60, 61]. Таким чином, ТАПБ дозволяє верифікувати діагноз МРЩЗ, але для ретельного дослідження поширення пухлини та оцінки можливості застосування адекватного лікування необхідна розробка комплексного алгоритму з використанням топічних та лабораторних показників.
Визначення рівня кальцитоніну в сироватці крові хворих на МРЩЗ. Оскільки патогномонічним симптомом МРЩЗ є різке зростання кальцитоніну в сироватці крові, для вірогідності встановлення діагнозу використовують визначення його рівня [5, 50, 76, 78, 107, 157, 164].
Значну діагностичну та прогностичну цінність має визначення кальцитоніну у хворих, у яких МРЩЗ верифіковано цитологічно [4, 7, 10, 58, 62, 107, 114, 157, 196].
Низка авторів вважають, що чутливість цього методу для діагностики МРЩЗ становить 98 % [96, 98, 102, 103]. Рутинне дослідження кальцитоніну сприяє значному покращенню прогнозу хворих на медулярний рак, що виявлений на ранній стадії [64, 76, 107, 162, 182, 189, 196].
Доопераційний рівень кальцитоніну нижче від 50 пг/мл є предиктором його нормалізації в післяопераційному періоді, а отже, курабельності захворювання (у 98 % випадків). При доопераційному вмісті кальцитоніну понад 50 пг/мл нормалізація його після операції спостерігається тільки в 41,7 % випадків [102].
Референтні значення концентрації кальцитоніну коливаються залежно від статі, маси тіла пацієнта, рівня кальцію в крові, шкідливих звичок (куріння тощо) [5, 38, 39, 103, 173].
Норма кальцитоніну у чоловіків порівняно з жінками вища [5, 22, 34, 38, 103]. Machens і співавт. [103] з урахуванням наявності більшого пулу С-клітин у чоловіків запропонували різні критерії діагностики МРЩЗ залежно від статі. Виявлено, що в жінок концентрація стимульованого кальцитоніну при пробі з пентагастрином понад 250 пг/мл має 89% чутливість і 100% специфічність. У чоловіків 100% специфічність спостерігається при рівні стимульованого кальцитоніну 500 пг/мл, при концентрації 100 пг/мл чутливість найвища, а специфічність становить 53 % [5].
Датськими вченими при аналізі даних 959 пацієнтів із реєстру захворювань ЩЗ при МРЩЗ було виявлено 100% чутливість кальцитонінового тесту сироватки крові та 95,3% специфічність, що підтверджує його важливу роль поряд з іншими клінічними дослідженнями [51].
При діагностиці МРЩЗ потрібно враховувати, що гіперкальцитонінемія може спостерігатися і при інших захворюваннях — нейроендокринних пухлинах легень та підшлункової залози, нирковій недостатності, автоімунних захворюваннях ЩЗ, гіпергастринемії; в осіб, які застосовують інгібітори протонної помпи, зловживають алкоголем, курінням; при септичних станах, а також при наявності антитіл до кальцитоніну [22, 23, 98, 173].
Виявлена закономірність кореляції між доопераційним рівнем кальцитоніну та розміром пухлини, причому ця залежність більш виражена для сімейної форми медулярного, ніж спорадичного раку. Так, рівень кальцитоніну понад 1000 пг/мл відповідає середньому розміру пухлини — 25 мм. Рівень кальцитоніну менший від 1000 пг/мл є характерним для пухлин середнього розміру (7 мм), а при його рівні до 100 пг/мл — 3 мм [70]. Тобто підвищений рівень кальцитоніну (як базальний, так і після стимуляції пентагастрином) корелює з розмірами пухлини та кількістю метастазів [20, 120, 123].
G. Chambon і співавт. [196] досліджували кальцитонін у сироватці крові 2733 пацієнтів, які були направлені на хірургічне лікування з приводу вузлового зоба. У 12 пацієнтів із розміром пухлини до 1 см базальний рівень кальцитоніну був понад 10 пг/мл, у 5 з них після ТАПБ медулярний рак не виявлено. Завдяки виконанню експрес-гістологічного дослідження під час оперативного втручання було виявлено МРЩЗ. Причому в одного з них спостерігалося метастатичне ураження лімфатичних вузлів центральної зони, а у трьох — мікрофокуси МРЩЗ у контралатеральній частці. Дослідження підтвердило необхідність проведення цього аналізу, оскільки відсутність настороженості може призвести до неадекватного оперативного втручання та його негативних наслідків.
За даними Американської асоціації клінічних ендокринологів (ААСЕ)/Італійської асоціації клінічних ендокринологів/Європейської тиреоїдної асоціації (ЕТА) [45–48], оцінка рівня кальцитоніну повинна виконуватись у всіх пацієнтів із вузловим зобом, яким показане хірургічне лікування. Проте показання та необхідність обстеження всіх пацієнтів із вузловим зобом не визначені, оскільки поширеність МРЩЗ серед пацієнтів цієї патології низька і становить від 0,4 до 1,4 % [48, 51, 102, 160].
A. Machens і співавт. відмічають, що віддалені метастази з’являються при передопераційних базальних рівнях кальцитоніну в сироватці крові понад 150 пг/мл [170].
Після первинного хірургічного втручання рівень кальцитоніну залишається найчутливішим тестом виявлення пролонгації захворювання. Приховані вогнища захворювання можуть не виявлятись протягом багатьох років, однак вірогідність виявлення пов’язана безпосередньо з прогресуючим підвищенням кальцитоніну [9, 99, 132].
Отже, визначати кальцитонін необхідно після хірургічного лікування хворих із метою виявлення рецидиву захворювання і метастазів [13, 14, 24, 50, 58, 63, 79, 83, 117].
Н.І. Бойко та співавт. у своїх дослідженнях наголошують на ефективності цього методу при обстеженні членів сім’ї з множинною ендокринною неоплазією — синдромом МЕН 2: він дозволяє діагностувати метастази в лімфовузли середостіння, що не визначаються при ультрасонографічному обстеженні. Згідно з дослідженнями цих авторів, при множинних регіонарних і віддалених метастазах в 11 хворих був виявлений рівень кальцитоніну, що перевищував 100 пг/мл. Такий високий рівень гормона прогностично несприятливий для пацієнтів [1].
Більш вірогідним вважається визначення рівня стимульованого кальцитоніну. У здорових осіб рівень базального гормона кальцитоніну менший 10 пг/мл. Після введення пентагастрину, який є стимулятором секреції кальцитоніну, рівень кальцитоніну, нижчий за 30 пг/мл, відмічають у 96 % здорових людей, від 30 до 50 пг/мл — у 4 %. Тест вважається позитивним, якщо рівень кальцитоніну після введення стимулятора становить у чоловіків > 110 пг/мл; у жінок > 30 пг/мл[159]. Отже, показник кальцитоніну 30–100 пг/мл є сумнівним і може свідчити про С-клітинну гіперплазію та МРЩЗ, а рівень стимульованого кальцитоніну понад 100 пг/мл констатує МРЩЗ [44, 45, 159].
Все більшого значення набуває кальцієвий тест [44, 45, 160, 164, 166, 172]: внутрішньовенно вводять 2 мг глюконату кальцію на кілограм маси тіла, кальцитонін визначають через 5 і 10 хв. Тест вважають позитивним, якщо рівень кальцитоніну після введення стимулятора: у чоловіків — понад 190 пг/мл; у жінок — 130 пг/мл [71].
Найефективнішою вважається стимуляція кальцитоніну з одночасним введенням пентагастрину й іонів кальцію 0,5 і 2 мг/кг відповідно. Кальцитонін визначають через 1, 2 і 5 хв. Тест вважають позитивним, якщо рівень кальцитоніну після введення стимулятора становить: у чоловіків понад 350 пг/мл через 1 або 2 хв і понад 244 пг/мл через 5 хв; у жінок понад 94 пг/мл через 1 або 2 хв і понад 76 пг/мл через 5 хв [38, 71]. Ці методи нині широко використовують для скринінгу з метою виявлення сімейного МРЩЗ [3, 44].
Дані досліджень, що виконані рядом авторів, із виявлення інформативності визначення кальцитоніну в матеріалі, отриманому при ТАПБ, суперечливі [55, 59, 61]. Одні автори заявляють про 100% чутливість та специфічність цього методу в діагностиці МРЩЗ [61], інші не бачать переваг [61, 55].
У всіх пацієнтів із діагнозом МРЩЗ необхідно визначати рівень не тільки кальцитоніну, але й раково-ембріонального антигену (РЕА) [44, 58, 123, 126, 164]. Проте необхідно враховувати, що даний показник підвищений не тільки при МРЩЗ, а й при багатьох інших захворюваннях, до яких належать рак товстого кишечника, доброякісні і злоякісні пухлини шлунка, легень, молочних залоз, яєчників. На його величину впливають шкідливі звички (куріння тощо), наявність інфекційного процесу, панкреатит і цироз печінки [123, 173]. Швидкість наростання рівня пухлинних маркерів як кальцитоніну, так і РЕА може бути додатковим прогностичним параметром щодо поширеності пухлинного процесу. Є твердження, що за показниками РЕА та КТ вірогідність виявлення МРЩЗ становить понад 95 % [44, 58, 83, 102, 156, 172].
Отже, за зниженням рівня кальцитоніну в післяопераційному періоді судять про радикальність проведеного лікування; його підвищення свідчить про наявність рецидиву або метастазування. Але до сьогодні залишається недостатньо визначеним рівень кальцитоніну в діагностиці післяопераційного локального рецидиву та дисемінації процесу.
Молекулярно-генетичне дослідження гена RET та його мутації. Роль спадкового компонента в розвитку МРЩЗ стала безсумнівною з відкриттям гермінальної мутації в протоонкогені RET [30, 49, 66, 108, 121, 194].
На сьогодні розроблений алгоритм діагностики МРЩЗ, у системі якого молекулярно-генетичні методи діагностики дозволяють не тільки встановити характер мутаційних змін та підтвердити діагноз, а й, зважаючи на спадковий характер МРЩЗ, прослідкувати можливу трансмісію мутацій у сім’ї хворого та вчасно виконати тиреоїдектомію як превентивний захід [12, 83, 88, 104, 144, 176, 205].
Цьому обстеженню підлягають усі хворі на МРЩЗ, оскільки у 4–10 % пацієнтів, навіть із негативним сімейним анамнезом, можна виявити RET-мутацію [28, 113, 161, 193].
Скринінгові обстеження передбачають збір анамнезу, генетичний аналіз RET-протоонкогена за допомогою полімеразної ланцюгової реакції або ж прямої секвестрації ДНК лімфоцитів крові у всіх хворих на МРЩЗ [66, 186]. Якщо не виявлені RET-мутація, негативний сімейний анамнез і відсутні фенотипові ознаки, які характерні для МЕН 2Б, обстеження родичів пацієнта не здійснюють. Проте майже в 3 % випадків спадкового МРЩЗ при генетичному обстеженні не вдається виявити мутацію в гені RET [28].
До сьогодні часу у світовій літературі описано понад 50 гермінальних мутацій гена RET, що знаходяться у 97 % пацієнтів із МЕН 2А та у 95 % з МЕН 2Б і у 86 % із СМРЩЗ [28, 54, 95, 194]. Клінічною агресивністю і ранніми термінами маніфестації відрізняється спадковий МРЩЗ, близько 90 % всіх мутацій розташовані в 609, 611, 618, 620, 630, 634 і 918-му кодонах, причому в усіх випадках йдеться про заміну цистеїну (TGC) на серин (ТСС) [28, 65, 91, 95, 115]. У 60 % пацієнтів мутації локалізуються в 618-му і 620-му кодоні екзону 10 і у 30 % — у 634-му кодоні екзону 11. У носіїв мутації в кодоні 634 необхідно ретельно відслідковувати пухлини прищитоподібних і/або надниркових залоз [20, 91, 95, 135]. До 10 % мутацій розташовані в екзонах 13 (кодони 768, 790, 791), 14 (кодони 804, 844) і 15 (кодон 891), що кодують структуру внутрішньоклітинного домену рецептора [28, 40, 54, 143, 177]. Є повідомлення про рідкісні мутації — дуплікацію 9 пар основ в екзоні 8 і заміну гліцину на цистеїн в домені кодона 533, екзон 8 при СМРЩЗ [42].
СМРЩЗ діагностують лише в тому випадку, коли в родині налічується понад 10 носіїв RET-мутацій (хворих і клінічно здорових), причому декілька носіїв старші за 50 років і в жодного немає інших компонентів синдрому МЕН, крім МРЩЗ [137].
Більшість мутацій, що обумовлені розвитком МЕН 2А, локалізуються в 634-му кодоні екзону 11 — 70–87 % всіх спостережень [129, 193, 194]. Крім цього, при МЕН 2А мутації можуть знаходитися в 609, 611, 618 і 620-му кодонах екзону 10. У поодиноких випадках при цьому синдромі описані мутації в 768, 790 і 791-му кодонах екзону 13 [43, 54, 129, 193], у 624-му кодоні екзону 10 [41].
У 95 % пацієнтів із МЕН 2Б ідентифіковані мутації в 918-му кодоні [27, 28]. Предиктором розвитку метастазів у лімфатичні вузли є носії мутації кодона 918 екзону 16 при позитивному показнику 80–100 %, а у пацієнтів віком понад 20 років — 50 % [115].
Нечасті мутації призводять до зміни структури внутрішньоклітинного домену у 883-му кодоні екзону 15 [92, 188], 912, 918 і 922-му кодонах екзону 16 [190], у 768-му кодоні екзону 13 і у 804-му, 806-му кодонах екзону 14 [28, 193, 197].
Перебудова в 609, 618 або 620-му кодонах спостерігається при поєднанні синдрому МЕН 2А і СМРЩЗ із хворобою Гіршпрунга [52, 74, 111, 137, 173, 193].
Американською тиреоїдною асоціацією [45, 46, 123] розроблена класифікація мутації гена RET, що враховує кореляцію генотипу і фенотипу. Найнесприятливіший прогноз із маніфестацією захворювання на першому році життя спостерігається в пацієнтів із мутаціями у 918, 883 та 804-му кодоні, що лежать в основі синдрому МЕН 2Б (група ризику D). Мутацію в 634-му кодоні синдрому МЕН 2А зараховують до групи ризику С. Ця мутація також характеризується раннім початком МРЩЗ і агресивним перебігом. Решта мутацій відрізняються сприятливішим прогнозом з маніфестацією через 20 років [5, 47, 95].
Т.П. Казубська та співавт. проаналізували взаємозв’язок між агресивністю захворювання (фенотипом) і позицією мутації в гені RET. Серед родичів хворих із МЕН 2А пряме тестування гена RET виявило 8 безсимптомних носіїв гермінальних мутацій цього гена у пацієнтів віком від 3,5 до 42 років. Виявленим носіям мутації гена RET було запропоноване і в 6 з них виконане профілактичне хірургічне втручання. Післяопераційне спостереження від 1,5 до 8 років (у середньому 4,8 року) показало, що тиреоїдектомія, виконана на доклінічному рівні захворювання, дозволяє уникнути метастазування, що свідчить про сприятливіший перебіг захворювання. Виконаний клініко-генетичний аналіз хворих із 18 родин із діагнозом МРЩЗ дозволив диференціювати у чотирьох із них синдром МЕН 2А, у шести — синдром МЕН 2Б і у трьох — сімейний МРЩЗ. Вік клінічної діагностики МРЩЗ при цих синдромах коливався і в середньому становив: при МЕН 2А — 25 років, при МЕН 2Б — 8,6 року, а при сімейному МРЩЗ — 30 років [30].
У.В. Румянцева та співавт. обстежили 56 хворих на МРЩЗ і 45 їхніх родичів. Усім пацієнтам із метою виключення спадкової природи захворювання виконане молекулярно-генетичне дослідження на наявність гермінальних точкових мутацій в екзонах 10, 11, 13, 14, 15, 16 RET-онкогена. Мутації гена RET виявлені у 33 осіб: у 16 хворих на МРЩЗ (у трьох із них із клінічно діагностованим спорадичним раком) і в 17 родичів. Виявлені RET-мутації локалізовані в кодоні 634 у 21 випадку, у кодоні 620 — у 7, у кодоні 791 — у 2, у кодонах 611, 804 і 918 — по одному випадку. У результаті порівняльного аналізу простежена залежність клініко-морфологічних особливостей медулярної карциноми від локалізації RET-мутації [20].
Навіть за умов відсутньої можливості виконання генетичного скринінгу медулярної карциноми і синдрому МЕН 2 застосування клініко-генеалогічного методу, ретельний збір загального і сімейного анамнезу пацієнтів, використання лабораторного контролю кальцитоніну, паратгормону, кальцію, катехоламінів крові, підвищення точності морфологічної діагностики за допомогою імуноцитологічної реакції на кальцитонін дозволяють суттєво поліпшити ефективність діагностики МРЩЗ, верифікувати до операції спадкову і спорадичну форми захворювання, активно виявляти хворих родичів, своєчасно виконувати радикальні втручання при МРЩЗ і синдромі МЕН 2 [37, 49].
Генетичне тестування мутацій гена RET відкриває можливості допологової діагностики синдрому МЕН 2 в сім’ях із високим ризиком народження хворої дитини [30, 48].
Отже, генетичний скринінг повинен ввійти в рутинний алгоритм обстеження при підозрі на спадковий характер захворювання, а виявлення взаємозв’язку генотипу й фенотипу при цій патології повинно враховуватися при виборі клінічної тактики ведення пацієнтів.
Інші методи діагностики. У виявлені МРЩЗ можуть допомогти дані оглядової рентгенографії та комп’ютерної томографії (КТ) шиї, оскільки як первинна, так і вторинна метастатична пухлина має схильність до розвитку кальцифікатів [13, 34, 38, 39, 72, 110, 169].
Як стверджує більшість авторів, доопераційний рівень кальцитоніну понад 400 пг/мл потребує візуалізації шиї і грудної клітки за допомогою КТ з контрастуванням, а також МРТ черевної порожнини. Від виявлення віддалених метастазів залежить тактика і необхідність хірургічного втручання, оскільки пацієнтів із віддаленими метастазами розглядають як некурабельних [5, 47, 170].
При базальному рівні кальцитоніну в сироватці крові 15 000 пг/мл та діаметрі первинної пухлини 50 мм виявлення віддалених метастазів радіографічним методом перевищує 50 % і зі збільшенням його рівня понад 100 000 пг/мл сягає до 100 % [170].
КТ належить до чутливих методів променевої діагностики метастатичного ураження легень, лімфатичних вузлів і середостіння [38, 39, 75, 99, 123].
Оскільки віддалені метастази уражають кістки/кістковий мозок, печінку, МРТ із контрастуванням є найчутливішим методом для виявлення даних метастазів [83, 97, 126, 180, 184].
Протонна емісійна томографія (ПЕТ) із фтордезоксиглюкозою є чутливішою, ніж КТ, при виявленні метастазів лімфовузлів шиї та середостіння і може бути включена до діагностичного алгоритму [38, 75, 80, 100, 180, 184].
Для первинної діагностики пухлини, а також для спостереженням за перебігом МРЩЗ застосовують поєднання метаболічних (99mTc(V)-DMSA) і рецепторних (111In-DTPA-[D-Phel-I-pentreotiole]) радіофармпрепаратів, що є чутливими при візуалізації [9, 15, 153].
Найінформативнішими для виявлення метастатичного ураження лімфатичних вузлів шиї і середостіння, що характеризуються повільнішим темпом прогресування, є зображення з 111Іn-октретидом, а також 131I мета-йодо-бензилгуанідом (131I-MIBG), що мають здатність зв’язуватись із рецепторами соматостатину С-клітин [9, 89, 153, 169, 179, 184].
ПЕТ або ПЕТ/КТ із РПФ — 18F-флуородопаміном є чутливішою при швидкопрогресуючому процесі [179], що відповідає 100% чутливості у пацієнтів із базальним кальцитоніном понад 150 пг/мл [68, 72]. Найефективнішими для ПЕТ є РПФ-18F-флуородопамін та 68Gа-DOTA NOC [9, 169].
Проте невеликі за розміром метастази в печінку чи легені не можуть бути виявлені і, на жаль, жоден окремо взятий метод не забезпечує оптимальну візуалізацію.
Незважаючи на значний арсенал наявних діагностичних методів і засобів, що використовуються з метою диференціальної діагностики новоутворень ЩЗ, проблема діагностики МРЩЗ і досі остаточно не вирішена. Саме тому, на нашу думку, важливою є розробка критеріїв рецидивування та післяопераційного поширення пухлини з використанням рівня кальцитоніну.
Лікування медулярного раку щитоподібної залози
Хірургічне лікування МРЩЗ. Хірургічне втручання є провідним та єдиним ефективним методом лікування МРЩЗ, а тому велике значення має правильний вибір обсягу операції на ЩЗ і регіонарному лімфоколекторі [11, 88, 105, 108, 122, 186, 189, 191].
Велику роль для визначення хірургічної тактики має виявлення носіїв RET-мутацій, ознак первинного гіперпаратиреозу, феохромоцитоми, наявності шийних або віддалених метастазів, які можуть змінити підхід до втручання [34, 69, 88, 161].
Більшість дослідників при маніфестних формах МРЩЗ без доведеної інвазії первинної пухлини та без діагностованого ураження шийних лімфатичних вузлів рекомендують у первинний обсяг оперативного втручання включати тотальну тиреоїдектомію і профілактичне видалення центральної клітковини шиї (видалення лімфовузлів VІ рівня) [9, 11, 15, 33, 38, 108, 170].
У процесі оперативного втручання здійснюється візуальна оцінка макропрепарату, наявності чи відсутності в пухлини власної капсули, її проростання пухлиною, капсули ЩЗ, оточуючих тканин; визначення додаткових вогнищ пухлинного росту в тканини залози, метастазів у лімфатичних вузлах шиї. Важливу роль у підтвердженні та уточненні діагнозу, визначенні обсягу хірургічного втручання, а також у з’ясуванні клінічно не з’ясованих випадків відіграють інтраопераційні експрес-дослідження [34, 39, 48, 120, 201].
Комплексний аналіз поширеності МРЩЗ здійснюється після гістологічного дослідження у парафіні і необхідних імуногістохімічних тестів макропрепарату. Оцінка поширеності пухлинного процесу проводиться відповідно до Міжнародної класифікації РЩЗ — (p)TNM (UICC, 1997).
Стосовно профілактичної дисекції латеральних колекторів шиї у пацієнтів із метастазами в лімфатичні вузли та первинною пухлиною великого розміру через низьку ймовірність біохімічної курабельності погляди дослідників розходяться [73, 122, 170]. І, як свідчать деякі дослідники, дисекція латеральних колекторів шиї (рівні ІІА, ІІІ, ІV, V) є найбільш виправданою в пацієнтів із позитивними результатами передопераційної візуалізації [47, 138, 191].
Дослідження останніх років доводять необхідність виконання тиреоїдектомії та компартмент-орієнтованої дисекції шиї за наявності доведених метастазів у відповідних колекторах, або за обґрунтованої підозри щодо їх наявності, або за підвищення рівня кальцитоніну в крові понад 400 пг/мл [15, 16, 33, 47, 94, 138, 146, 154, 168, 170].
Хірургічна операція з приводу місцево-регіонарно-рецидивуючого або персистуючого МРЩЗ у пацієнтів без віддалених або за мінімально віддалених метастазів повинна включати компартмент-орієнтовану дисекцію уражених груп лімфатичних вузлів у центральній (VІ рівень) або бічній (рівні ІІА, ІІІ, ІV, V) частинах шиї. Слід уникати видалення окремих метастазів або збільшених лімфовузлів [34, 54, 120, 123].
Деякі автори при диференційованих варіантах МРЩЗ у випадках, коли розмір пухлини до 2 см, вік хворого до 30 років і стать хворого жіноча, рекомендують виконувати щадні за обсягом хірургічні втручання — гемітиреоїдектомію з резекцією перешийка [31, 35, 48, 170]. Після гемітиреоїдектомії слід зробити аналіз на RET-онкоген, контролювати рівень кальцитоніну та УЗД [48].
Коли при гістологічному дослідженні виявляються багатофокусне ураження, С-клітинна гіперплазія, поширення за межі ЩЗ, а результати діагностичних досліджень вказують на підозру наявності вогнищ пухлини в контралатеральній частці ЩЗ або центральній чи бічних ділянках шиї, при мутації RET-онкогена або в разі сімейного анамнезу синдрому МЕН 2, необхідно виконувати додаткові аналізи, включаючи в лікування повну остаточну тиреоїдектомію та дисекцію центральних лімфовузлів [46, 47, 120, 168].
Аналіз хірургічного лікування, проведеного протягом 1995–2005 рр. 155 хворим (110 жінок і 45 чоловіків) на МРЩЗ, що узгоджується з рекомендаціями Американської тиреоїдної асоціації, наводять А.М. Кваченюк та співавт. Середній вік пацієнтів — 47,2 ± 1,3 року, тривалість післяопераційного спостереження — 6,7 ± 1,1 року. У 70 хворих була проведена тотальна екстрафасціальна тиреоїдектомія (ТЕ); у 29 хворих тиреоїдектомію доповнювали двобічною латеральною дисекцією югулярних колекторів лімфовідтоку (ТЕ + 2ЛД); у 22 — однобічною латеральною дисекцією (ОД); у 20 — центральною (серединною) дисекцією шиї (СД); у 7 хворих тиреоїдектомію поєднували з серединною та двобічною латеральною диcекцією (ТЕ + СД + 2ЛД); у 4 — з центральною дисекцією та однобічною дисекцією (СД + ОД); одному хворому виконана операція Крайля; двом — тиреоїдектомія з двобічною латеральною дисекцією югулярних колекторів лімфовідтоку (ТЕ + 2ЛД) та видаленням пухлинного тромбу з югулярної вени. У 5 випадках серединна та латеральна диcекція доповнювалась проведенням медіастинальної при пухлинному ураженні лімфовузлів середостіння. Частота рецидивування була найвищою при ТЕ + ОД — 9 хворих (40,9 ± 10,5 %); при ТЕ рецидиви виникали у 22 хворих (31,4 ± 5,5 %); при ТЕ + 2ЛД — у 7 (24,1 ± 8,0 %); ТЕ + СД + 2ЛД — в 1 (14,3 ± 13,2 %). Найрідкіснішими були рецидиви у хворих після ТЕ + СД — 1 випадок (5,0 ± 4,9 %). Найчастіше рецидивування відбувалося в лімфовузли центральної групи (VІ рівень) — 31 випадок (68,9 ± 6,9 %), у лімфовузли югулярної групи (ІІ–V рівні) — 12 (26,7 ± 6,6 %) та в ложі первинної пухлини — 2 (4,4 ± 3,1 %). Даний аналіз підтверджує, що хворим на МРЩЗ або з підозрою на нього без доведеної інвазії первинної пухлини та з доведеними метастазами в шийні лімфовузли й віддаленими метастазами необхідно виконувати тиреоїдектомію та профілактичну серединну дисекцію шиї [11].
Щадні, менш радикальні втручання, виконують за наявності віддалених метастазів. Це тиреоїдектомія, дисекція VІ рівня та латеральна дисекція шиї [34, 54, 138].
За наявності повторних рецидивів захворювання або ж великих віддалених метастазів необхідно приділяти увагу зменшенню ускладнень: гіпопаратиреозу, збереженню нормального голосу і ковтання [47, 120, 123, 180].
При асимптоматичному перебігу захворювання (після первинного втручання) з низьким рівнем метастазування і повільним прогресуванням за даними променевих методів діагностики або при терміні подвоєння базальної концентрації кальцитоніну і РЕА менше двох років застосування агресивних методів лікування не показано [38, 46].
Паліативне хірургічне лікування виконують у таких ситуаціях: у разі виявлення метастазів МРЩЗ у ділянці шиї, що супроводжуються больовим синдромом, резистентних до медикаментозної терапії, коли видалення може зменшити вираженість болю; метастази механічно стискають спинний мозок або стравохід і дихальні шляхи; наявність діарейного синдрому — хірургічне втручання зменшить об’єм пухлини і сприятиме покращенню стану [38, 39, 153].
Велика зацікавленість і широка дискусія, що триває багато років, обумовлює доцільність профілактичного хірургічного лікування безсимптомних носіїв мутації гена RET [30, 104, 115, 161, 167].
Питання щодо термінів та обсягу хірургічного втручання повинне вирішуватись з урахуванням не тільки стадії захворювання, але й локалізації виявленої мутації, і це викликає занепокоєння багатьох дослідників [7, 95, 110, 114].
При гермінальних мутаціях, що обумовили МРЩЗ у рамках синдрому МЕН 2, існує чіткий взаємозв’язок між конкретною мутацією і ступенем агресивності медулярної карциноми [38, 95, 120, 123]. Знання точки мутації визначає лікувальну тактику в різному діапазоні: від профілактичної тиреоїдектомії у перші місяці життя при найагресивнішій формі до циторедуктивного варіанта лікування й динамічного спостереження при інших формах захворювання [38, 39, 114, 167, 168, 176, 180, 183].
Пацієнтам із синдромом МЕН 2Б рекомендується виконувати превентивну тиреоїдектомію (ПТЕ) на першому році життя дитини [28, 46, 120, 131], бажано до 6 місяців, а за даними М. Brandi і співавт., протягом першого місяця життя або відразу ж після встановлення діагнозу [74], що пояснюється ранньою маніфестацією захворювання.
Деякі автори доводять, що профілактичну дисекцію VІ рівня лімфовузлів центральної частини шиї в дітей першого року життя з синдромом МЕН 2Б виконувати не потрібно у зв’язку з ризиком розвитку гіпопаратиреозу та складністю його лікування [47, 48, 120].
Якщо ж клінічно чи візуально доведена наявність метастазів у лімфовузли або вузли ЩЗ понад 5 мм чи базальний рівень кальцитоніну в дитини віком понад 6 місяців перевищує 40 пг/мл, цим пацієнтам потрібне додаткове обстеження та відповідне хірургічне лікування [47, 127, 130, 142, 146, 170, 172].
У носіїв мутації RET-протоонкогена з МЕН 2А та сімейною формою ПТЕ виконується з 3–5-річного віку [28, 42, 85, 111, 112, 131, 152, 170].
Більшість практичних лікарів доводять перевагу визначення базального рівня кальцитоніну в сироватці крові в пацієнтів із синдромом МЕН 2А та сімейною формою віком понад 3–5 років [111, 170, 202]. Якщо рівень кальцитоніну нижчий 40 пг/мл, а вузол ЩЗ менший 5 мм, наявність метастазів малоймовірна [111, 112, 120]. Відповідним лікуванням є тотальна тиреоїдектомія без дисекції центральної частини шиї [47, 111, 112, 152, 170].
Якщо ж базальний рівень кальцитоніну перевищує 40 пг/мг, а вузол у ЩЗ понад 5 мм, потрібно провести оцінку хірургічного втручання з метою збереження прищитоподібних залоз і зворотного нерва [45–47].
Передопераційний скринінг на феохромоцитому потрібно розпочинати з 5–8-річного віку в пацієнтів із синдромом МЕН 2Б і мутаціями в кодоні 634 і 630 RET-онкогену [28, 48, 84].
При аналізі літератури були виявлені такі тенденції: чим старший вік, у якому виконана ПТЕ, тим частіше виявляються вогнища МРЩЗ при гістологічному дослідженні тканини ЩЗ [109, 185]; при ПТЕ на тлі підвищеного вмісту кальцитоніну частіше виявляється С-клітинна гіперплазія, а при гістологічному дослідженні — МРЩЗ; агресивність перебігу захворювання пов’язана не тільки з формою захворювання, перш за все з локалізацією й характером мутації в гені RET [56, 109, 120].
Є автори, які для лікування спадкових форм МРЩЗ рекомендують два тактичних підходи. Перший — очікувальний, при якому щорічно визначають стимульований кальцитонін у сироватці крові. При виявленні підвищення його показників виконують хірургічне лікування. Проте необхідно враховувати, що в 50 % пацієнтів на момент визначення підвищеного рівня кальцитоніну уже є мікро- або макроскопічні вогнища МРЩЗ [20, 178]. Застосування цієї тактики забезпечує виліковування приблизно у 90 % хворих, але суттєвим її недоліком є вірогідність пухлинного ураження ЩЗ до моменту оперативного втручання і, як наслідок, високий ризик розвитку регіонарних метастазів, що збільшує вірогідність рецидиву [20, 178].
Другий підхід зі спадковим МРЩЗ — превентивний, що полягає у виконанні тиреоїдектомії на основі позитивного результату генетичного аналізу. Перевагою цієї тактики є найменша вірогідність пухлинної трансформації С-клітин і розвитку метастазів до оперативного втручання [20, 74, 91, 178].
На користь ранніх тиреоїдектомій свідчать результати аналізів 260 випадків ПТЕ у хворих із синдромом МЕН 2, у яких частка ранніх ПТЕ становила 16 % [178]. Доведено, що МРЩЗ в осіб із мутаціями в цистеїнових екзонах 10 або 11 маніфестує в більш ранньому віці і має агресивніший перебіг порівняно з МРЩЗ у хворих, які мають мутації у нецистеїнових екзонах 13 або 14 [143].
Інші автори залежно від ураженого кодона і з огляду на оптимальний час проведення тиреоїдектомії за умови нормального рівня стимульованого кальцитоніну виділяють 3 класи ризику і вважають, що вони є визначальними для планування хірургічного втручання [168, 194].
Найвищий ризик — клас 3, RET-кодон 922, 918, 883 — мутації цього класу проявляють найагресивніший перебіг серед усіх типів МЕН 2. Уже новонароджені мають С-клітинну гіперплазію і навіть маніфестний МРЩЗ. Тому тиреоїдектомію бажано виконувати до 6-місячного віку.
Середній ризик (високий) — клас 2, RET-кодон 634, 630, 620, 618, 611, 609 — рекомендують застосовувати профілактичну тиреоїдектомію у дітей до 1–5 років.
Низький ризик — клас 1, RET-кодон 891, 804, 791, 790, 768. За цих передумов маніфестний МРЩЗ спостерігається у пацієнтів після 10 років. Більшість дослідників рекомендують виконувати профілактичну операцію у віці 5–10 років [74, 168].
Висока агресивність захворювання не завжди дозволяє за допомогою хірургічного втручання отримати радикальний ефект. У зв’язку з цим розробка ефективної ад’ювантної терапії є важливою проблемою. Наявність сімейних форм потребує вивчення кожного конкретного випадку МРЩЗ для виключення спадкового характеру захворювання [8].
Крім того, до сьогодні залишається невизначеним питання щодо доцільності виконання латеральної шийної лімфатичної дисекції при негативних даних топічних методів діагностики. З одного боку, згідно з рекомендаціями Американської тиреоїдної асоціації латеральна шийна лімфатична дисекція виконується лише при підозрі на метастатичне ураження колектора. З іншого — наявність мікрометастазів МРЩЗ може бути не виявлена сучасними методами топічної і лабораторної діагностики, а з огляду на агресивність захворювання це може суттєво погіршити прогноз лікування і виживаність хворих. Отже, наявність суперечливих питань хірургічного прийому при МРЩЗ і лягла в основу проведення даного дослідження.
Нехірургічні методи лікування. Метою паліативного лікування захворювання є забезпечення контролю за захворюванням, послаблення симптомів гормонального надлишку (діарея, синдром Кушинга), зменшення симптоматики, зокрема болю, контроль за віддаленими метастазами, що можуть спричинити бронхіальну обструкцію, перелом кісток, стиснення головного мозку тощо [46, 47, 120, 123, 140].
Зважаючи на те, що С-клітини не концентрують йод-131 і не залежать від дії тиреотропного гормона, лікування медулярного раку радіоактивним йодом, а також променевою та хіміотерапією неефективне при радикальній терапії [120, 140].
Проте агресивний характер захворювання обумовлює паліативне лікування — застосування хіміотерапевтичних препаратів і дистанційної гамма-терапії, особливо при поширених формах захворювання, генералізації процесу з поширенням у кістки, легені і печінку при неможливості застосування хірургічного лікування [12, 126, 132, 145].
Клінічні дослідження із застосування хіміотерапії в пацієнтів зі стійким або рецидивуючим МРЩЗ показали обмежену короткотривалу ефективність із найкращими результатами щодо часткової ремісії в межах 10–20 %. До цих препаратів зараховують дакарбазин, фторурацил, доксорубіцин [45, 48, 126]. Деякі лікарі надають перевагу комбінованій хіміотерапії з включенням похідних платини, антрациклінів та ін. [126, 150]. Якщо метастази в кістки супроводжуються болем, лікарі вважають ефективним призначення бісфосфонатів [123, 150].
Незважаючи на те, що в деяких випадках хіміотерапія має протипухлинний ефект, значна токсичність препаратів, дискомфорт при лікуванні й незначне збільшення тривалості життя призводять до обмеження її застосування [35, 45, 48, 120].
Роль зовнішньопроменевої терапії для лікування МРЩЗ суперечлива [158, 195]. При метастазах у кістки, що супроводжуються болем і не підлягають оперативному втручанню, можливим є застосування зовнішньопроменевої терапії [124].
Методи цільової молекулярної терапії інгібіторами тирозинкінази ефективні тільки в окремих пацієнтів [9, 49], а лікування аналогами соматостатину або інтерфероном не показало переконливих доказів щодо стабілізації або регресу пухлини [48].
Основним же лікуванням при МРЩЗ залишається радіонуклідна терапія аналогами соматостатину [9]. Оскільки тільки частина клітин МРЩЗ містить рецептори соматостатину, а 30 % накопичують метайодбензилгуанідин мічений (І131MIBG), для визначення можливості застосування радіонуклідної терапії і вибору оптимального радіофармпрепарату у пацієнтів із високим рівнем кальцитоніну, при МЕН 2 і сімейних формах необхідне виконання комбінованого діагностичного дослідження з використанням октреотиду і І-131MIBG [9, 147].
Ефективність застосування І131MIBG при лікуванні МРЩЗ є сумнівною [45–47], хоча, за даними деяких авторів, паліативний ефект досягається у 50–60 % [35, 153, 171, 196].
Досвід використання молекул, мічених радіоактивними ізотопами, для опромінення ракових клітин обмежений через значну гематологічну та ниркову токсичність [174].
Про проблеми ефективності різних терапевтичних технологій лікування рецидивів і метастазів МРЩЗ, що залежать від розміру, поширеності та біологічної агресивності пухлини, пишуть багато авторів [9, 124, 196].
Останнім часом тривають розробки та впроваджуються принципово нові препарати для лікування МРЩЗ. Так, одним із найбільш перспективних препаратів для лікування неоперабельного МРЩЗ визнається мультикіназний інгібітор вандетаніб, торгова назва — капрелса, розроблений компанією «АстраЗенека». У квітні 2011 року орфанний таблетований препарат вандетаніб був схвалений Управлінням із контролю за якістю харчових продуктів і лікарських засобів США (FDA) для лікування неоперабельного місцевопоширеного МРЩЗ та метастатичних неоперабельних пухлин МРЩЗ.
У червні 2012 року американська компанія «Екселіксіс» (Exelixis) завершила процес передачі на реєстрацію в Управлінні із контролю за якістю продуктів і лікарських засобів США нового лікарського препарату кабозантиніб (cabozantinib) для лікування пацієнтів із прогресуючим неоперабельним місцевопоширеним або метастатичним МРЩЗ. Кабозантиніб — таргетний інгібітор MET, судинного ендотеліального фактора росту 2 (VEGFR2) і RET. У жовтні 2011 року компанія подала результати даного дослідження, у якому була досягнута первинна точка — поліпшення показника виживаності без прогресування захворювання. Порівняно з плацебо кабозантиніб збільшив медіану виживання без прогресування захворювання на 7,2 місяця.
Таким чином, наявність великої кількості ад’ювантних методів лікування МРЩЗ говорить про відсутність їх переконливої ефективності порівняно насамперед із хірургічним втручанням, яке може бути радикальним лише на певних початкових стадіях хвороби. Але аналіз ефективності даних методик для кожного індивідуального випадку МРЩЗ може бути корисним при розробці комплексного лікування цього захворювання.
Післяопераційне ведення хворих та віддалені наслідки хірургічного лікування пацієнтів із МРЩЗ. Хворим, яких прооперовано з приводу МРЩЗ, для підтримання фізіологічно нормального рівня тиреотропіну призначається замісна терапія тироксином [10, 116]. Контроль і корекція рівня тиреотропного гормона в сироватці крові здійснюється через 2 місяці після початку прийому препарату.
Подальша схема ведення хворих передбачає клінічне обстеження, ехографію шиї, променеве дослідження легень, печінки, кісток, визначення базального рівня кальцитоніну [21].
Довгострокове спостереження за пацієнтами, у яких досягнута повна біохімічна ремісія, повинне включати визначення базального рівня кальцитоніну не менше одного разу на півроку протягом перших 5 років, надалі проводиться щорічна оцінка концентрації кальцитоніну в сироватці крові [10, 38, 39].
Якщо в пацієнта рівень кальцитоніну перевищує 150 пг/мл, окрім УЗД, призначають додаткові методи візуалізації з метою виявлення віддалених метастазів [139].
Прогностичними показниками післяопераційного прогресування пухлини є збільшення вдвічі кальцитоніну та РЕА [81, 143, 145].
При виявленні місцевого або регіонарного рецидиву рекомендують хірургічне лікування: при віддалених метастазах, якщо наявна клінічна симптоматика — хірургічне або симптоматичне лікування; при віддалених метастазах без клінічної симптоматики — динамічне спостереження або в разі необхідності — хірургічне лікування. При дисемінації МРЩЗ рекомендоване симптоматичне лікування з паліативною метою — дистанційна променева терапія і хіміотерапія [10, 140, 153].
Виживаність пацієнтів чітко пов’язана з наявністю або відсутністю рецидиву протягом моніторингового періоду: виникнення рецидиву або наявність залишкової тканини після хірургічного втручання скорочує тривалість життя [9].
За даними більшості авторів, 2-річне виживання після тиреоїдектомії з дисекцією лімфовузлів спостерігається в 91 %, 5-річне — у 74,6–90 % [2, 3, 11, 16, 79, 90, 104, 121, 163, 164], 10–річне — у 55–80 % пацієнтів [10, 15, 78, 86, 113, 142]. Крім того, рівень 10-річного виживання у чоловіків у 2 рази вищий, ніж у жінок [1].
При локальних стадіях МРЩЗ після хірургічного лікування 10-річне виживання (за нормалізації кальцитоніну і біомаркерів) становить 95 %, без нормалізації кальцитоніну і біомаркерів — 80 % [148].
Після резекційних органозберігаючих операцій ці показники становлять 75–80 % і 45–60 % відповідно, а частота післяопераційного регіонарного та віддаленого метастазування сягає відповідно 66–77 % і 40–50 % [8, 16, 124, 163].
Динамічні спостереження за хворими після тиреоїдектомії з двосторонньою лімфодисекцією показали, що при збільшенні післяопераційної базальної концентрації кальцитоніну за менше ніж 6 місяців у два рази і більше 5- і 10-річне виживання становить 25 і 8 % відповідно; від 6 міс. до 2 років — 92 і 37 %; понад 2 роки — 100 % [38, 45, 151, 164].
Ж.-Ф. Анрі та співавт. проаналізували виліковуваність серед пацієнтів (51 особа) з урахуванням проведення тотальної тиреоїдектомії та стадії захворювання і встановили, що цей показник становить 76,5 %. Виліковуваність при І стадії становила 100 % (25 із 25), при ІІ стадії — 91,6 % (11 із 12, 1 недостатній результат), при ІІІ стадії — 33 % (3 із 9) та при ІV стадії — 0 %. Серед хворих, у яких рівень КТ був єдиним критерієм МРЩЗ (31 особа), 20 мали І стадію (нормалізація рівня КТ у всіх), 6 — ІІ стадію (нормалізація рівня КТ у 5, 1 відсутній результат), 5 — ІІІ стадію (нормалізація КТ у двох осіб) [24].
Віддалені результати 93 первинних хірургічних втручань із приводу МРЩЗ, які виконані за період 1995–2009 рр., простежені дослідниками Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин. У 67 хворих (72,1 %) на МРЩЗ мала місце спорадична форма, у 26 (27,9 %) — спадкова. Хворим виконали тиреоїдектомію з центральною дисекцією лімфатичних вузлів, що за показаннями доповнювалася одно- або двобічною модифікованою радикальною лімфодисекцією. Критеріями одужання вважали дані клініко-лабораторного та інструментального обстеження. Найкращі віддалені результати отримані в групі хворих із неінвазивною пухлиною без регіонарних метастазів на момент втручання. Частота одужань та ремісій захворювання становила близько 71 %, рецидиви у вигляді регіонарних метастазів розвинулися у 28,6 % випадків. Автори дійшли висновку, що спадкові форми МРЩЗ агресивніші; при спорадичній формі віддалені метастази — у 31 проти 21 %. Через 8–15 років після втручання летальність при спорадичній формі становила 6 %, при синдромі МЕН 2 — 12 % [14, 16].
Більшість дослідників вважають, що МРЩЗ у 40–75 % випадків метастазує в шийні лімфатичні вузли [33, 123, 168], у 5–30 % віддалені метастази виявляють у легенях, печінці та кістках [7, 8, 27, 28, 120].
Отже, аналіз літератури показав, що проблемі дослідження МРЩЗ в Україні не приділяється належна увага. Незважаючи на широке впровадження в клінічну практику високоінформативних лабораторних та інструментальних методів обстеження, МРЩЗ, як і 10 років тому, більше ніж у 50 % випадків діагностується на 3-й і 4-й стадіях (Kloos R., 2009).
Показання та необхідність обстеження всіх пацієнтів із вузловим зобом не визначені, оскільки поширеність МРЩЗ серед пацієнтів із даною патологією низька. Питання щодо впровадження в практику вимірювання рівня кальцитоніну серед хворих із вузловою патологією для раннього виявлення МРЩЗ постійно дискутується, і донині воно не введене в алгоритм обстеження пацієнтів. Відсутні чіткі критерії за кальцитоніном післяопераційного рецидиву та дисемінації процесу.
Наразі в Україні майже відсутня можливість систематичного генетичного тестування всіх пацієнтів і членів їх родин із фінансових обставин (дороге обстеження).
Все ще остаточно не вирішена проблема лікування МРЩЗ. Вибір тактики лікування залежить від характеру патології, ступеня поширеності пухлинного процесу, віку хворого, його фізичного стану та інших факторів. У літературі немає єдиної точки зору щодо обсягу втручання на ЩЗ і лімфоколекторах шиї залежно від розміру пухлини та рівня кальцитоніну в крові, а також стосовно комбінованого лікування при МРЩЗ. Крім того, при рецидивуючих і залишкових пухлинах питання вибору найбільш раціональної тактики лікування також залишається відкритим.
1. Апудоми: медулярний рак щитоподібної залози — клініка, діагностика, лікування / Н.І. Бойко, Ю.І. Шаваров, О.Р. Дуда [та ін.] // Львівський медичний часопис. — 2010. — Т. 16, № 4. — С. 135–138.
2. Бойко Н.І. Медулярний рак щитоподібної залози: клініка, діагностика, лікування / Н.І. Бойко, М.П. Павловський, О.Р. Дуда // Шпитальна хірургія. — 2003. — № 1. — С. 56–58.
3. Бойко Н.І. Медулярний рак щитоподібної залози (огляд літератури) / Н.І. Бойко, М.П. Павловський, О.Р. Дуда // Проблеми ендокринної патології. — 2003. — № 1. — С. 3–7.
4. Бржезовский В.Ж. Диагностика и лечение медуллярного рака щитовидной железы / В.Ж. Бржезовский, В.Л. Любаев // Практическая онкология. — 2007. — Т. 8, № 1. — С. 29–34.
5. Диагностика медуллярного рака щитовидной железы и тактика ведения пациентов при отсутствии лабораторной ремиссии / Д.О. Газизова, Д.Г. Бельцевич, А.Н. Тюльпакова [и др.] // Пробл. эндокринол. — 2011. — Т. 57, № 6. — С. 45–51.
6. Длительное наблюдение за больной медуллярным раком щитовидной железы с метастазами в легкие и печень / Г.М. Жаринов, Л.Г. Малышева, Н.Ю. Некласова [и др.] // Вопросы онкологии. — 2011. — Т. 57, № 3. — С. 378–381.
7. Ильин А.А. Диагностика и лечение семейного варианта медуллярного рака щитовидной железы / А.А. Ильин, П.О. Румянцев // Пробл. эндокринол. — 2000. — Т. 46, № 4. — С. 19–22.
8. Ильин А.А. Спорадический и семейный варианты медуллярного рака щитовидной железы / А.А. Ильин, П.О. Румянцев, П.А. Исаев // Пробл. эндокринол. — 2003. — Т. 49, № 5. — С. 45–47.
9. 131I-MIBG в діагностиці і терапії медулярного раку щитоподібної залози (стан проблеми) / Г.Г. Сукач, О.І. Солодянникова, Н.Ю. Войт, Д.Л. Саган // Український радіологічний журнал. — 2011. — № 3. — С. 324–326.
10. Исаев П.А. Медуллярный рак щитовидной железы (комплексная лучевая диагностика и лечение): Автореф. дис… канд. мед. наук: спец. 14.00.19 «Лучевая диагностика, лучевая терапия», 14.00.14 «Онкология» / П.А. Исаев. — Обнинск, 2004. — 21 с.
11. Кваченюк А.М. Тактика ведення хворих з медулярною карциномою щитовидної залози / А.М. Кваченюк, М.Ю. Болгов, К.В. Негрієнко // Ендокринологія. — 2010. — Т. 15, № 2. — С. 325–326.
12. Клінічно-діагностичні та генетичні аспекти медулярного раку щитоподібної залози / О.І. Кашин, О.Р. Дуда, Д.В. Заставна, Н.І. Бойко // Львівський медичний часопис. — 2006. — Т. 12, № 1. — С. 187–190.
13. Коваленко А.Е. Медуллярный рак щитовидной железы / А.Е. Коваленко // Здоров’я України. — 2008. — № 17/1. — С. 42–44.
14. Ларін О.С. Результати хірургічного лікування спорадичного та спадкового медулярного раку щитоподібної залози у віддалений післяопераційний період / О.С. Ларін, О.П. Нечай, С.М. Черенько // Клінічна ендокринологія та ендокринна хірургія. — 2008. — № 3(24). — С. 35–37.
15. Медуллярный рак щитовидной железы. Клиника, течение, прогноз / Н.И. Афанасьева, О.Н. Астапьева, А.В. Мужичук [и др.] // Онкология. — 2004. — Т. 6, № 1. — С. 41–44.
16. Медулярний рак щитоподібної залози з місцевими та віддаленими метастазами: тактика лікування та спостереження / О.С. Ларін, С.М. Черенько, О.П. Нечай, М.С. Черенько // Клінічна ендокринологія та ендокринна хірургія. — 2011. — № 3 (36). — С. 20–23.
17. Множественная эндокринная неоплазия 2-го типа / М.Ю. Юкина, Н.П. Гончаров, Д.Г. Бельцевич, Е.А. Трошина // Пробл. эндокринол. — 2011. — № 6. — С. 21–26.
18. Молекулярная диагностика мутаций протоонкогена RET при различных формах медуллярного рака щитовидной железы / М.В. Немцова, Д.В. Залетаев, П.О. Румянцев [и др.] // Молекулярная медицина. — 2004. — № 2. — С. 54–60.
19. Нечай О.П. Роль скринінгових досліджень у діагностиці та лікуванні хворих на медулярний рак щитовидної залози / О.П. Нечай, О.С. Ларін, С.М. Черенько // Клінічна ендокринологія та ендокринна хірургія. — 2007. — № 1 (18). — С. 16–19.
20. Новые подходы к диагностике и лечению наследственных форм медуллярного рака щитовидной железы / У.В. Румянцева, А.А. Ильин, П.О. Румянцева [и др.] // Российский онкологический журнал. — 2007. — № 4. — С. 4–7.
21. Определение содержания тиреокальцитонина в пунктате лимфатических узлов шеи для диагностики метастазов медуллярного рака щитовидной железы / П.А. Исаев, В.С. Медведев, А.А. Ильин [и др.] // Вопросы онкологии. — 2004. — Т. 50, № 1. — С. 46–49.
22. Паньків В.І. Практична тиреоїдологія / В.І. Паньків. — Донецьк: Видавець Заславський О.Ю., 2011. — 224 с.
23. Пинский С.Б. Диагностика и лечение медуллярного рака щитовидной железы / С.Б. Пинский, В.В. Дворниченко, О.Р. Репета // Сибирский медицинский журнал. — 2008. — № 2. — С. 22–27.
24. Результати хірургічного лікування спорадичного медулярного раку щитоподібної залози при рутинному дослідженні рівня кальцитоніну в крові / Ж.Ф. Анрі, Е. Міраллі, М. Якобон, Ф. Себаг // Клінічна ендокринологія та ендокринна хірургія. — 2002. — № 1 (1). — С. 16–17.
25. Романчишен А.Ф. Выбор тактики лечения больных спорадическим медуллярным раком щитовидной железы / А.Ф. Романчишен, О.В. Лисовский // Вестник хирургии им. И.И. Грекова. — 2006. — Т. 165, № 4. — С. 46–49.
26. Романчишен А.Ф. Хирургический вариант профилактики семейного медуллярного рака щитовидной железы / А.Ф. Романчишен, О.В. Лисовский, А.А. Богатиков // Вестник хирургии им. И.И. Грекова. — 2011. — Т. 170, № 2. — С. 100.
27. Румянцев П.О. Диагностика и лечение семейного варианта медуллярного рака щитовидной железы / П.О. Румянцев, А.А. Ильин // Пробл. эндокринол. — 2000. — № 4. — С. 19–23.
28. Румянцева У.В. Клинико-генетические аспекты диагностики и лечения наследственных форм медуллярного рака щитовидной железы / У.В. Румянцева, А.А. Ильин, П.О. Румянцев // Пробл. эндокринол. — 2006. — Т. 52, № 2. — С. 21–27.
29. Семейная форма медуллярного рака щитовидной железы / Д.Л. Ротин, В.Ж. Бржезовский, А.И. Павловская [и др.] // Архив патологии. — 2003. — № 3. — С. 79.
30. Синдромы множественных эндокринных неоплазий и медуллярный рак щитовидной железы / Т.П. Казубская, В.М. Козлова, Ф.А. Амосенко [и др.] // Российский онкологический журнал. — 2008. — № 1. — С. 4–9.
31. Современное состояние проблемы диагностики и лечения медуллярного рака щитовидной железы / В.Ж. Бржезовский, В.В. Шенталь, В.Л. Любаев [и др.] // Современная онкология. — 2002. — Т. 4, № 3. — С. 23–26.
32. Спорадический и семейный варианты медуллярного рака щитовидной железы / А.А. Ильин, П.А. Румянцев, П.А. Исаев [и др.] // Пробл. эндокринол. — 2003. — Т. 49, № 5. — С. 45–47.
33. Стернюк Ю.М. Досвід лікування медулярного раку щитоподібної залози / Ю.М. Стернюк, Б. Нідерле // Практична медицина. — 2007. — Т. 13, № 2. — С. 31–36.
34. Тиреоїдна хірургія / За ред. С.Й. Рибакова, В.О. Шідловського, І.В. Комісаренка, М.П. Павловського. — Тернопіль: ТДМУ, 2008. — 424 с.
35. Тонковид О.А. Медулярний рак щитоподібної залози: клініка, діагностика, лікування, прогноз (Огляд літератури та власні дослідження) / О.А. Тонковид, А.Є. Коваленко // Ендокринологія. — 2007. — Т. 12, № 1. — С. 136–150.
36. Черенько С.М. Медуллярный рак щитовидной железы: современное состояние проблемы в свете новейших клинических рекомендаций. Американской тиреоидной ассоциации / С.М. Черенько // Здоров’я України (медична газета). — 2009. — № 20/1. — С. 38–39.
37. Черенько С.М. Медуллярный рак щитовидной железы: современное состояние проблемы и результаты собственных исследований / С.М. Черенько, А.С. Ларин, А.П. Нечай // Проблеми ендокринної патології. — 2002. — № 1. — С. 10–15.
38. Эндокринная хирургия / Под ред. И.И. Дедова, Н.С. Кузнецова, Г.А. Мельниченко. — М.: Литтерра, 2011. — 352 с.
39. Эндокринная хирургия / Под ред. С.С. Харнаса. — М.: ГЭОТАР-Медиа, 2010. — 496 с.
40. A new hot spot for mutations in the ret protooncogene causing familial medullary thyroid carcinoma and multiple endocrine neoplasia type 2A / I. Berndt, M. Reuter, B. Saller [et al.] // J. Clin. Endocrinol. Metab. — 1998. — Vol. 83. — P. 770–774.
41. A novel case of multiple endocrine neoplasia type 2A associated with two de Novo mutations of the RET protooncogene / A. Tessitore, A.A. Sinisi, D. Pasquali [et al.] // J. Clin. Endocrinol. Metab. — 1999. — Vol. 84. — P. 3522–3527.
42. A novel germ-line point mutation in RET exon 8 (Gly533Cys) in a large kindred with familial medullary thyroid carcinoma / Adriana M. Álvares Da Silva, Rui M.B. Maciel, Magnus R. Dias Da Silva [et al.] // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 5658–5671.
43. A novel point mutation in the intracellular domain of the ret protooncogene in a family with medullary thyroid carcinoma / R.M.W. Hofstra, O. Fattoruso, L. Quadro [et al.] // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — P. 4176–4178.
44. Ahmed S.R. Incidentally discovered medullary thyroid cancer: diagnostic strategies and treatment / S.R. Ahmed, D.W. Ball // J. Clin. Endocrinol. Metab. — 2011. — Vol. 96, № 5. — P. 1237–1245.
45. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules / H. Gharib, E. Papini [et al.] // Endocr. Pract. — 2010. — Vol. 16, Suppl. 1. — P. 1–43.
46. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: executive summary of recommendations / H. Gharib, E. Papini, R. Paschke [et al.] // Endocr. Pract. — 2010. — Vol. 16, № 3. — P. 468–475.
47. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: Executive Summary of recommendations / H. Gharib, E. Papini, R. Paschke [et al.] // J. Endocrinol. Invest. — 2010. — Vol. 33, № 5. — P. 287–291.
48. Ball D.W. American Thyroid Association guidelines for management of medullary thyroid cancer: an adult endocrinology perspective / D.W. Ball // Thyroid. — 2009. — Vol. 19, № 6. — P. 547–550.
49. Ball D.W. Management of medullary thyroid cancer / D.W. Ball // Minerva Endocrinol. — 2011. — Vol. 36, № 1. — P. 87–98.
50. Basal and stimulated calcitonin and procalcitonin by various assays in patients with and without medullary thyroid cancer / J. Kratzsch, A. Petzold, F. Raue [et al.] // Clin. Chemistry. — 2011. — Vol. 57, № 3. — P. 467–474.
51. Benefit of measuring basal serum calcitonin to detect medullary thyroid carcinoma in a Danish population with a high prevalence of thyroid nodules / M. Hasselgren, L. Hegedus, C. Godballe, S.J. Bonnema // Head Neck. — 2010. — Vol. 32, № 5. — P. 612–618.
52. Biological properties of Ret with cysteine mutations correlate with multiple endocrine neoplasia type 2A, familial medullary thyroid carcinoma, and hirschsprung’s disease phenotype / S. Ito, T. Iwashita, N. Asai [et al.] // Cancer Res. — 1997. — Vol. 57. — P. 2870–2872.
53. Borget I. Editorial. Calcitonin determination in patients with nodular thyroid disease / I. Borget, G. De Pouvourville, M. Schlumberger // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 425–427.
54. Braverman L. The thyroid: fundamental and clinical text. — Philadelphia: Lippincott, 2000. — P. 930–943.
55. Bugalho M.J. Preoperative diagnosis of medullary thyroid carcinoma: fine needle aspiration cytology as compared with serum calcitonin measurement / M.J. Bugalho, J.R. Santos, L. Sobrinho // J. Surg. Oncol. — 2005. — Vol. 91, № 1. — P. 56–60.
56. C618R mutation in exon 10 of the RET proto-oncogene in a kindred with multiple endocrine neoplasia type 2A and Hirschsprung’s disease / P. Caron, T. Attie, D. David [et al.] // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81. — P. 2731–2733.
57. Cakir M. Medullary thyroid cancer: molecular biology and novel molecular therapies / M. Cakir, A.B. Grossman // Neuroendocrinology. — 2009. — Vol. 90, № 4. — P. 323–348.
58. Calcitonin and carcinoembryonic antigen doubling times as prognostic factors in medullary thyroid carcinoma: a structured meta-analysis / J.A. Meijer, S. le Cessie, W.B. van den Hout [et al.] // Clin. Endocrinol. (Oxf.). — 2010. — Vol. 72, № 4. — P. 534–542.
59. Calcitonin assay in wash-out fluid after fine-needle aspiration biopsy in patients with a thyroid nodule and borden-line value of the hormone / F. Massaro, M. Dolcino, R. Degrandi [et al.] // J. Endocrinol. Inv. — 2009. — Vol. 32, № 4. — P. 308–312.
60. Calcitonin measurement in the evaluation of thyroid nodules in the United States: a cost-effectiveness and decision analysis / K. Cheung, S. A. Roman, T.S. Wang [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93. — P. 2173–2180.
61. Calcitonin measurement in wash-out fluid from fine needle aspiration of neck masses in patients with primary and metastatic medullary thyroid carcinoma / F. Boi, I. Maurelli, G. Pinna [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 2115–2118.
62. Calcitonin screening and pentagastrin testing: predictive value for the diagnosis of medullary carcinoma in nodular thyroid disease / B.L. Herrmann, K.W. Schmid, R. Goerges [et al.] // Eur. J. Endocrinol. — 2010. — Vol. 162. — P. 1141–1145.
63. Calculation and validation of a plasma calcitonin limit for early detection of medullary thyroid carcinoma in nodular thyroid disease / T. Rink, P.N. Truong, H.J. Schroth [et al.] // Thyroid. — 2009. — Vol. 19. — P. 327–332.
64. Can procalcitonin be useful for medullary thyroid cancer? / K. Kaczka, S. Mikosinski, W. Fendler [et al.] // Endokrynol. Pol. — 2010. — Vol. 61, № 5. — P. 430–436.
65. CDKN1B V109G polymorphism a new prognostic factor in sporadic medullary thyroid carcinoma / D. Pasquali, L. Circelli, A. Faggiano [et al.] // Eur. J. Endocrinol. — 2011. — Vol. 164. — P. 397–404.
66. Cerrato A. Molecular genetics of medullary thyroid carcinoma: the quest for novel therapeutic targets / A. Cerrato, V. De Falco, M. Santoro // J. Molec. Endocrinology. — 2009. — Vol. 43. — P. 143–155.
67. Chang T.C. Medullary thyroid carcinoma: pitfalls in diagnosis by fine needle aspiration cytology and relationship of cytomorphology to RET proto-oncogene mutations / T.C. Chang, S.L. Wu, Y.L. Hsiao // Acta Cytol. — 2005. — Vol. 49, № 5. — P. 477–482.
68. Clinical value of 18-fluorine-fluorodihydroxyphenylalanine positron emission tomography/computed tomography in the follow-up of medullary thyroid carcinoma / M. Luster, W. Karges, K. Zeich [et al.] // Thyroid. — 2010. — Vol. 20, № 5. — P. 527–533.
69. Codon-specific development of pheochromocytoma in multiple endocrine neoplasia type 2 / A. Machens, M. Brauckhoff, H.-J. Holzhausen [et al.] // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90. — P. 3999–4003.
70. Cohen M.S. Surgical treatment of medullary thyroid carcinoma / M.S. Cohen, J.F. Moley // J. Intern. Med. — 2003. — Vol. 253, № 6. — P. 616–626.
71. Comparison of calcium and pentagastrin tests for the diagnosis and follow-up of medullary thyroid cancer / C. Colombo, U. Verga, C. Mian [et al.] // J. Clin. Endocrinol. Metabol. — 2012. — Vol. 97, № 3. — P. 905–913.
72. Complementary roles of 18F-DOPA PET/CT and 18F-FDG PET/CT in medullary thyroid cancer / S. Kauhanen, C. Schalin-Jäntti, M. Seppänen [et al.] // J. Nucl. Med. — 2011. — Vol. 52, № 12. — P. 1855–1863.
73. Complete surgical lymph node resection does not prevent authentic recurrences of medullary thyroid carcinoma / S. Franc, P. Niccoli-Sire, R. Cohen [et al.] // Clin. Endocrinol. (Oxf.). — 2001. — Vol. 55, № 3. — P. 403–409.
74. Consensus: Guidelines for diagnosis and therapy of MEN type 1 and type 2 / M.L. Brandi, R.F. Gagel [et al.] // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 5658–5671.
75. Correlation between calcitonin levels and [(18)F]FDG-PET/CT in the detection of recurrence in patients with sporadic and hereditary medullary thyroid cancer / E. Skoura, I.E. Datseris, P. Rondogianni [et al.] // ISRN Endocrinol. — 2012. — P. 375–231.
76. Costante G. Early diagnosis of medullary thyroid carcinoma: is systematic calcitonin screening appropriate in patients with nodular thyroid disease? // G. Costante, S. Filetti // Oncologist. — 2011. — Vol. 16, № 1. — P. 49–52.
77. Dackiw A.P. The surgical management of medullary thyroid cancer / A.P. Dackiw // Otolaryngol. Clin. North Am. — 2010. — Vol. 43, № 2. — P. 365–374.
78. Daniels G.H. Screening for medullary thyroid carcinoma with serum calcitonin measurements in patients with thyroid nodules in the United States and Canada / G.H. Daniels // Thyroid. — 2011. — Vol. 21, № 11. — P. 1199–1207.
79. Dequanter D. Medullary thyroid cancer: surgical results and prognostic factors / D. Dequanter, P. Lothaire // Rev. Med. Liege. — 2010. — Vol. 65, № 7–8. — P. 450–452.
80. Detection rate of recurrent medullary thyroid carcinoma using fluorine-18 fluorodeoxyglucose positron emission tomography: a meta-analysis / G. Treglia, M.F. Villani, A. Giordano, V. Rufini // Endocrine. — 2012.
81. Diagnosis of medullary thyroid carcinoma by calcitonin measurement in fine-needle aspiration biopsy specimens / T. Kudo, A. Miyauchi, Y. Ito [et al.] // Thyroid. — 2007. — Vol. 17. — P. 635–638.
82. Early malignant progression of hereditary medullary thyroid cancer / A. Machens, P. Niccoli-Sire, J. Hoegel [et al.] // N. Engl. Med. — 2003. — № 349. — P. 1517–1525.
83. Elisei R. Advances in the follow-up of differentiated or medullary thyroid cancer / R. Elisei, A. Pinchera // Nat. Rev. Endocrinol. — 2012.
84. Estimated risk of pheochromocytoma recurrence after adrenal-sparing surgery in patients with multiple endocrine neoplasia type 2A / R. Asari, C. Scheuba, K. Kaczirek, B. Niederle // Arch. Surg. — 2006. — Vol. 141, № 12. — P. 1199–1205.
85. Evaluation of efficacy and clinical impact of (18)F-FDG-PET in the diagnosis of recurrent medullary thyroid cancer with increased calcitonin and negative imaging test / P. Gomez-Camarero, A. Ortiz-de Tena, I. Borrego-Dorado [et al.] // Rev. Esp. Med. Nucl. — 2011.
86. Fine needle aspiration cytology of medullary carcinoma of the thyroid with a focus on rare variants: a review of 78 cases / S. Kaushal, V.K. Iyer, S.R. Mathur, R. Ray // Cytopathology. — 2011. — Vol. 22, № 2. — P. 95–105.
87. FNAC diagnosis of medullary carcinoma thyroid: A report of three cases with review of literature / G. Mehdi, V. Maheshwari, H.A. Ansari [et al.] // J. Cytol. — 2010. — Vol. 27, № 2. — P. 66–68.
88. Fujita T. The treatment of medullary thyroid cancer / T. Fujita, M. Fujimori // Gan To Kagaku Ryoho. — 2009. — Vol. 36, № 10. — P. 1627–1631.
89. Functional nuclear medicine imaging of medullary thyroid cancer / M.F. Bozkurt, O. Ugur, E. Banti [et al.] // Nucl. Med. Commun. — 2008. — Vol. 29, № 11. — P. 934–942.
90. Genetic classification of benign and malignant thyroid follicular neoplasia based on a three-gene combination / F. Weber, L. Shen, M.A. Aldred [et al.] // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90. — P. 2512–2521.
91. Genetic testing for familial cancer. Consequences of RET proto-oncogene mutation analysis in multiple endocrine neoplasia, type 2 / D.L. Learoyd, D.J. Marsh, A.L. Richardson [et al.] // Arch. Surg. — 1997. — Vol. 132, № 9. — P. 1022–1025.
92. Germline dinucleotide mutation in codon 883 of the retprotooncogene in multiple endocrine neoplasia type 2b without codon 918 mutation / O. Gimm, D.J. Marsh, S.D. Andrew [et al.] // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82. — P. 3902–3904.
93. Hazard J.B. Medullary (solid) carcinoma of the thyroid / J.B. Hazard, W.A. Hawk, G.Jr. Crile // J. Clin. Endocrinol. Metab. — 1959. — Vol. 19. — P. 152–161.
94. Hereditary medullary thyroid carcinoma in patients greater than 50 years old / F.J. Quayle, R. Benveniste, M.K. DeBenedetti [et al.] // Surgery. — 2004. — Vol. 136, № 6. — P. 1116–1121.
95. Hereditary medullary thyroid carcinoma: the management dilemma / P. Zhou, J. Liu, S.W. Cheng, B. Wang [et al.] // Fam. Cancer. — 2011.
96. High-dose calcium and pentagastrin tests in patients with cured or persistent medullary thyroid cancer and in controls: comparison of the efficacy and the tolerance / C. Colombo, U. Verga, M. Perrino [et al.] // Proc. 14th Annual International Thyroid Congress. — Paris, 2010 (Abstract P-0923).
97. High frequency of bone/bone marrow involvement in advanced medullary thyroid cancer / E. Mirallié, J.P. Vuillez, S. Bardet [et al.] // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90. — P. 779–788.
98. Hypercalcitoninemia is not pathognomonic of medullary thyroid carcinoma / S.P. Toledo, D.M. Jr. Lourenço, M.A. Santos [et al.] // Clinics (Sao Paulo). — 2009. — Vol. 64. — P. 699–706.
99. Imaging medullary thyroid carcinoma with persistent elevated calcitonin levels / A.L. Giraudet, D. Vanel, S. Leboulleux [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — 4185–4190.
100. Impact of (18)F-FDG PET/CT for detecting recurrence of medullary thyroid carcinoma / E. Ozkan, C. Soydal, O.N. Kucuk [et al.] // Nucl. Med. Commun. — 2011. — Vol. 32, № 12. — P. 1162–1168.
101. Impact of modified radical neck dissection on biochemical cure in medullary thyroid carcinomas / T. Weber, T. Schilling, K. Frank-Raue [et al.] // Surgery. — 2001. — Vol. 130, № 6. — P. 1044–1049.
102. Impact of routine measurement of serum calcitonin on the diagnosis and outcome of medullary thyroid cancer: experience in 10,864 patients with nodular thyroid disorders / R. Elisei, V. Bottici, F. Luchetti [et al.] // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89. — P. 163–168.
103. Importance of gender-specific calcitonin thresholds in screening for occult sporadic medullary thyroid cancer / A. Machens, F. Hoffmann, C. Sekulla, H. Dralle // Endocr. Relat. Cancer. — 2009. — Vol. 16. — P. 1291–1298.
104. Influence of lymph node metastases on survival in pediatric medullary thyroid cancer / M.V. Raval, C. Sturgeon, D.J. Bentrem [et al.] // J. Pediatr. Surg. — 2010. — Vol. 45, № 10. — P. 1947–1954.
105. Initial lymph node dissection increases cure rates in patients with medullary thyroid cancer / D.Y. Greenblatt, D. Elson, E. Mack [et al.] // Asian J. Surg. — 2007. — Vol. 30. — P. 108–112.
106. Jaquet A.J. Ein fall von metastasierenden amyloidtumoren (lymphosarcoma) / A.J. Jaquet // Virchows Archiv. — 1906. — Vol. 185. — P. 251–267.
107. Karges W. Calcitonin determination for early diagnosis of medullary thyroid cancer / W. Karges // Chirurg. — 2010. — Vol. 81, № 7. — P. 620–626.
108. Krysiak R. Medullary thyroid cancer — the present state of art / R. Krysiak, B. Marek, B. Okopien // Endokrynol. Pol. — 2008. — Vol. 59, N5. — P. 446–455.
109. Lips C.J.M. Medullary thyroid carcinoma: role of genetic testing and calcitonin measurement / C.J.M. Lips, J.W.M. Höppener, J.H.H. Thijssen // Ann. Clin. Biochem. — 2001. — Vol. 38. — P. 168–179.
110. Localization of medullary thyroid carcinoma after surgery using (11) C-methionine PET/CT: comparison with (18)F-FDG PET/CT / H.W. Jang, J.Y. Choi, J.I. Lee [et al.] // Endocr. J. — 2010. — Vol. 57, № 12. — P. 1045–1054.
111. Long segment and short segment familial Hirschsprung’s disease: variable clinical expression at the RET locus / P. Edery, A. Pelet, L.M. Mulligan [et al.] // J. Med. Genet. — 1994. — Vol. 31. — P. 602–606.
112. Long-term outcome in 46 gene carriers of hereditary medullary thyroid carcinoma after prophylactic thyroidectomy: impact of individual RET genotype / K. Frank-Raue, H. Buhr, H. Dralle [et al.] // Eur. J. Endocrinol. — 2006. — Vol. 155. — P. 229–236.
113. Low frequency of germline mutations in the RET proto-oncogene in patients with apparently sporadic medullary thyroid carcinoma / C. Eng, L.M. Mulligan, D.P. Smith [et al.] // Clin. Endocrinol. (Oxf.). — 1995. — Vol. 43, № 1. — P. 123–127.
114. Machens A. Biomarker-based risk stratification for previously untreated medullary thyroid cancer / A. Machens, H. Dralle // J. Clin. Endocrinol. Metabol. — 2010. — Vol. 95, № 6. — P. 2655–2663.
115. Machens A. Individualization of lymph node dissection in RET (rearranged during transfection) carriers at risk for medullary thyroid cancer: value of pretherapeutic calcitonin levels / A. Machens, K. Lorenz, H. Dralle // Ann. Surg. — 2009. — Vol. 250, № 2. — P. 305–310.
116. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer / D.S. Cooper, G.M. Doherty, B.R. Haugen [et al.] // Thyroid. — 2006. — Vol. 16, № 2. — P. 109–142.
117. Marchisotta S. Diagnosis of medullary thyroid cancer / S. Marchisotta, F. Pacini // F1000 Med. Rep. — 2009. — Vol. 1.
118. Measuring calcitonin in washout of the needle in patients undergoing fine needle aspiration with suspicious medullary thyroid cancer / P. Trimboli, F. Rossi, R. Baldelli [et al.] // Diagn. Cytopathol. — 2012. — Vol. 40, № 5. — P. 394–398.
119. Medullary Carcinoma / R.M. Tuttle, D.W. Ball, D. Byrd [et al.] // J. Natl. Compr. Canc. Netw. — 2010. — Vol. 8. — P. 512–530.
120. Medullary thyroid cancer: are practice patterns in the United States discordant from American Thyroid Association guidelines? / B. Panigrahi, S.A. Roman, J.A. Sosa // Ann. Surg. Oncol. — 2010. — Vol. 17, № 6. — P. 1490–1498.
121. Medullary thyroid cancer: clinico-pathological profile and outcome in a tertiary care center in North India / P.K. Mehrotra, A. Mishra, S.K. Mishra [et al.] // World J. Surg. — 2011. — Vol. 35, № 6. — P. 1273–1280.
122. Medullary thyroid cancer: It is a pain in the neck? / M.A. Guerrero, S. Lindsay, I. Suh [et al.] // J. Cancer. — 2011. — Vol. 2. — P. 200–205.
123. Medullary thyroid cancer: management guidelines of the American Thyroid Association / R.T. Kloos, C. Eng, D.B. Evans [et al.] // Thyroid. — 2009. — Vol. 19. — P. 565–612.
124. Medullary thyroid cancer: multivariant analysis of prognostic factors influencing survival / S.L. Hyer, L. Vini, R. Hern, C. Harmer // Eur. J. Surgery Onc. — 2000. — Vol. 26, № 7. — P. 686–690.
125. Medullary thyroid cancer: RET testing of an archival material / C. Godballe, G. Jorgensen, A.M. Gerdes [et al.] // Eur. Arch. Otorhinolaryngol. — 2010. — Vol. 267, № 4. — P. 613–617.
126. Medullary thyroid carcinoma / F. Pacini, M.G. Castagna, C. Cipri, M. Schlumberger // Clin. Oncol. (R. Coll. Radiol.). — 2010. — Vol. 22, № 6. — P. 475–485.
127. Medullary thyroid carcinoma as part of a multiple endocrine neoplasia type 2B syndrome: influence of the stage on the clinical course / S. Leboulleux, J.P. Travagli, B. Caillou [et al.] // Cancer. — 2002. — Vol. 94, № 1. — P. 44–50.
128. Medullary thyroid carcinoma cell lines contain a self-renewing CD133+ population that is dependent on Ret proto-oncogene activity / Wen Zhu, Tao Hai, Lei Ye, Gilbert J. Cote // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95, № 1. — P. 439–444.
129. Medullary thyroid carcinoma identified within the first year of life in children with hereditary multiple endocrine neoplasia type 2A (codon 634) and 2B / D. Zenaty, Y. Aigrain, M. Peuchmaur [et al.] // Eur. J. Endocrinol. — 2009. — Vol. 160. — P. 807–813.
130. Medullary thyroid carcinoma in children with multiple endocrine neoplasia types 2A and 2B / M.A. Skinner, M.K. DeBenedetti, J.F. Moley [et al.] // J. Pediatr. Surg. — 1996. — Vol. 31, № 1. — P. 177–82.
131. Medullary thyroid carcinoma in multiple endocrine neoplasia types 2A and 2B / D.S. O’Riordain, T. O’Brien [et al.] // Surgery. — 1994. — Vol. 116, № 6. — P. 1017–1023.
132. Medullary thyroid carcinoma: a 20-year experience from a centre in South India / P. Finny, J.J. Jacob, N. Thomas [et al.] // ANZ J. Surg. — 2007. — Vol. 77, № 3. — P. 130–134.
133. Medullary thyroid carcinoma: comparison with papillary thyroid carcinoma and application of current sonographic criteria / S. Lee, J.H. Shin, B.K. Han, E.Y. Ko // Am. J. Roentgenol. — 2010. — Vol. 194, № 4. — P. 1090–1094.
134. Medullary thyroid carcinoma: long-term outcomes of surgical treatment / D.T. Abraham, T.H. Low, M. Messina [et al.] // Ann. Surg. Oncol. — 2011. — Vol. 18, № 1. — P. 219–225.
135. Medullary thyroid carcinoma: the comparison of the hereditary and sporadic types of cancer / Z. Wygoda, M. Oczko-Wojciechowska, E. Gubala [et al.] // Endokrynol. Pol. — 2006. — Vol. 57, № 4. — P. 407–414.
136. Milan S.A. Current management of medullary thyroid cancer / S.A. Milan, J.A. Sosa, S.A. Roman // Minerva Chir. — 2010. — Vol. 65, № 1. — P. 27–37.
137. Molecular analysis of the RET and GDNF genes in a family with multiple endocrine neoplasia type 2a and hirschsprung disease / S. Borrego, C. Eng, B. Sánchez [et al.] // J. Clin. Endocrinol. Metab. — 1998. — Vol. 83. — P. 3361–3364.
138. Molecular basis of medullary thyroid carcinoma: The role of RET polymorphisms / L. Ceolin, D.R. Siqueira, M. Romitti [et al.] // Int. J. Mol. Sci. — 2012. — Vol. 13, № 1. — P. 221–239.
139. Moley J.F. Evidence-based approach to the management of sporadic medullary thyroid carcinoma / J.F. Moley, E.A. Fialkowski // World J. Surg. — 2007. — Vol. 31, № 5. — P. 946–956.
140. Moley J.F. Medullary thyroid carcinoma: management of lymph node metastases / J.F. Moley // J. Natl. Compr. Canc. Netw. — 2010. — Vol. 8. — P. 549–556.
141. Morrison P.J. Genetic aspects of familial thyroid cancer / P.J. Morrison, A.B. Atkinson // The Oncologist. — 2009. — Vol. 14, № 6. — 571–577.
142. Multiple endocrine neoplasia type 2B: more than an endocrine disorder / D.S. O’Riordain, T. O’Brien, T.B. Crotty [et al.] // Surgery. — 1995. — Vol. 118, № 6. — P. 936–942.
143. Mutation of RET codon 768 is associated with the FMTC phenotype / L.M. Boccia, J.S. Green, C. Joyce [et al.] // Clin. Genet. — 1997. — Vol. 51, № 2. — P. 81–85.
144. Mutational screening of RET, HRAS, KRAS, NRAS, BRAF, AKT1, and CTNNB1 in medullary thyroid carcinoma / H.-J. Schulten, J.Al-Maghrabi, K. Al-Ghamdi [et al.] // Anticancer Research. — 2011. — Vol. 31, № 12. — P. 4179–4183.
145. Nagi R. Highly penetrant hereditary cancer syndromes / R. Nagy, K. Sweet, C. Eng // Oncogene. — 2004. — Vol. 23, № 38. — P. 6445–6470.
146. Natural history, diagnosis, treatment and outcome of medullary thyroid cancer: 37 years experience on 157 patients / M.R. Pelizzo, I.M. Boschin, P. Bernante [et al.] // Eur. J. Surg. Oncol. — 2007. — Vol. 33, № 4. — P. 493–497.
147. New therapeutic approaches to treat medullary thyroid carcinoma / M. Schlumberger, F. Carlomagno, E. Baudin [et al.] // Nat. Clin. Pract. Endocrinol. Metab. — 2008. — Vol. 4. — P. 22–32.
148. Niccoli-Sire P., Contedevolx B. Medullary thyroid carcinoma / P. Niccoli-Sire, B. Contedevolx // Ann. Endocrinol. — 2007. — Vol. 68. — P. 325–331.
149. Ogilvie J.B. Indication and timing of thyroid surgery for patients with hereditary medullary thyroid cancer syndromes / J.B. Ogilvie, E. Kebebew // J. Natl. Compr. Canc. Netw. — 2006. — Vol. 4. — P.139–147.
150. Pamidronate improves the quality of life and induces clinical remission of bone metastases in patients with thyroid cancer / G. Vitale, F. Fonderico, A. Martignetti [et al.] // Br. J. Cancer. — 2001. — Vol. 84, № 12. — P. 1586–1590.
151. Panigrahi B. Medullary thyroid cancer: are practice patterns in the United States discordant from American Thyroid Association guidelines? / B. Panigrahi, S.A. Roman, J.A. Sosa // Ann. Surg. Oncol. — 2010. — Vol. 17, № 6. — P. 1490–1498.
152. Papaparaskeva K. Cytologic diagnosis of medullary carcinoma of the thyroid gland / K. Papaparaskeva, H. Nagel, M. Droese // Diagn. Cytopathol. — 2000. — Vol. 22. — P. 351–358.
153. Pasieka J.L. The palliative role of 131I-MIBG and 111In-octreotide therapy in patients with metastatic progressive neuroendocrine neoplasms / J.L. Pasieka, A.J. McEwan, O. Rorstad // Surgery. — 2004. — Vol. 136, № 6. — P. 1218–1226.
154. Pattern of nodal metastasis for primary and reoperative thyroid cancer / A. Machens, R. Hinze, O. Thomusch, H. Dralle // World J. Surg. — 2002. — Vol. 26, № 1. — P. 22–28.
155. Pearse A.G.E. The diffuse neuroendocrine system and the APUD concept / A.G.E. Pearse // Med. Biol. — 1977. — Vol. 55, № 3. — P. 149–156.
156. Penetrance of inherited medullary thyroid carcinoma and genotype-phenotype correlation in a large multiple endocrine neoplasia type 2A family with C634Y RET mutation / B. Gonzalez-Yebra, M.E. Medrano, A. Mantilla [et al.] // Endocr. Pathol. — 2003. — Vol. 14, № 1. — P. 71–80.
157. Persistent hypercalcitoninemia in patients with medullary thyroid cancer / C. Misso, F. Calzorali, E. Puxeddu [et al.] // Tumori. — 2009. — Vol. 95, № 4. — P. 484–487.
158. Postoperative radiotherapy for advanced medullary thyroid cancer — local disease control in the modern era / D.L. Schwartz, V. Rana, S. Shaw [et al.] // Head Neck. — 2008. — Vol. 30, № 7. — P. 883–888.
159. Predictive value of pentagastrin test for preoperative differential diagnosis between C-cell hyperplasia and medullary thyroid carcinoma in patients with moderately elevated basal calcitonin levels / F. Milone, V. Ramundo, M.G. Chiofalo [et al.] // Clin. Endocrinol. (Oxf.). — 2010. — Vol. 73, № 1. — P. 85–88.
160. Predictive value of serum calcitonin levels for preoperative diagnosis of medullary thyroid carcinoma in a cohort of 5817 consecutive patients with thyroid nodules / G. Costante, D. Meringolo, C. Durante [et al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 450–455.
161. Preventive thyroidectomy in patients with hereditary medullary thyroid carcinoma found heterozygote for mutant RET proto-oncogene / K. Evangelos, M.S. Theodoros, F. Theofanis [et al.] // Pediatr. Endocrinol. Rev. — 2010. — Vol. 8, № 2. — P. 108–113.
162. Procalcitonin levels predict clinical course and progression-free survival in patients with medullary thyroid cancer / M.A. Walter, C. Meier, T. Radimerski [et al.] // Cancer. — 2010. — Vol. 116, № 1. — P. 31–40.
163. Prognostic factors of survival without clinical recurrences in medullary thyroid carcinoma: apropos of 52 operated cases / P. Raffaitin, A. Hamy, E. Mirallie [et al.] // Ann. Endocrinol. (Paris). — 1999. — Vol. 60, № 6. — P. 435–442.
164. Prognostic impact of serum calcitonin and carcinoembryonic antigen doublin-time in patients with medullary thyroid carcinoma / J. Barbet, L. Campion, F. Kraeber-Bodere [et al.] // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90, № 11. — P. 6077–6084.
165. Prognostic value of clinical, histological and immunohistochemical features in medullary thyroid cancer / A. Rios, J.M. Rodriguez, B. Febrero [et al.] // Med. Clin. (Barc.). — 2011.
166. Progression of medullary thyroid carcinoma: assessment with calcitonin and carcinoembryonic antigen doubling times / A.L. Giraudet, A. Al-Ghulzan, A. Aupérin [et al.] // Eur. J. Endocrinol. — 2008. — Vol. 158. — P. 239–246.
167. Prophylactic thyroidectomy in multiple endocrine neoplasia type 2A / M.A. Skinner, J.A. Moley, W.G. Dilley [et al.] // N. Engl. J. Med. — 2005. — Vol. 353, № 11. — P. 1105–1113.
168. Prophylactic thyroidectomy in multiple endocrine neoplasia: the impact of molecular mechanisms of RET proto-oncogene / A. Frilling, F. Weber, C. Tecklenborg, C.E. Broelsch // Langenbecks Arch. Surg. — 2003. — Vol. 388, № 1. — P. 17–26.
169. Prospective evaluation of 68Ga-DOTA-NOC PET-CT in patients with recurrent medullary thyroid carcinoma: comparison with 18F-FDG PET-CT / N. Naswa, P. Sharma, S. Suman Kc [et al.] // Nucl. Med. Commun. — 2012.
170. Prospects of remission in medullary thyroid carcinoma according to basal calcitonin level / A. Machens, U. Schneyer, H.-J. Holzhausen, H. Dralle // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90. — P. 2029–2034.
171. Recent advances in radiological and radionuclide imaging and therapy of neuroendocrine tumours / G. Kaltsas, A. Rockall, D. Papadogias [et al.] // Eur. J. Endocrinol. — 2004. — Vol. 151. — P. 15–27.
172. Redding A.H. Normal preoperative calcitonin levels do not always exclude medullary thyroid carcinoma in patients with large palpable thyroid masses / A.H. Redding, S.N. Levine, M.R. Fowler // Thyroid. — 2000. — Vol. 10, № 10. — P. 919–922.
173. Reference range of serum calcitonin levels in humans: influence of calcitonin assays, sex, age, and cigarette smoking / M. d’Herbomez, P. Caron, C. Bauters [et al.] // Eur. J. Endocrinol. — 2007. — Vol. 157. — P. 749–755.
174. Response to [90Yttrium-DOTA]-TOC treatment is associated with long-term survival benefit in metastasized medullary thyroid cancer: a phase ii clinical trial / F. Iten, B. Müller [et al.] // Clin. Cancer Res. — 2007. — Vol. 13. — P. 6696–6702.
175. RET genetic screening in patients with medullary thyroid cancer and their relatives: experience with 807 individuals at one center / R. Elisei, C. Romei, B. Cosci [et al.] // J. Clin. Endocrinol. Metabol. — 2007. — Vol. 92. — P. 4725–4729.
176. RET genetic screening of sporadic medullary thyroid cancer (MTC) allows the preclinical diagnosis of unsuspected gene carriers and the identification of a relevant percentage of hidden familial MTC (FMTC) / C. Romei, B. Cosci, G. Renzini [et al.] // Clin. Endocrinol (Oxf). — 2011. — Vol. 74, № 2. — P. 241–247.
177. RET mutations in exons 13 and 14 of FMTC patients / A. Bolino, I. Schuffenecker, Y. Luo [et al.] // Oncogene. — Vol. 10, № 12. — P. 2415–249.
178. Review of multiple endocrine neoplasia type 2a in children: therapeutic results of early thyroidectomy and prognostic value of codon analysis / G. Szinnai, C. Meier, P. Komminoth, U.W. Zumsteg // Pediatrics. — 2003. — Vol. 111. — P. e132–e139.
179. Role of [(18)F]FDG-PET/CT in the detection of occult recurrent medullary thyroid cancer / E. Skoura, P. Rondogianni, M. Alevizaki [et al.] // Nucl. Med. Commun. — 2010. — Vol. 31, № 6. — P. 567–575.
180. Roman S. Medullary thyroid cancer: early detection and novel treatments / S. Roman, P. Mehta, J.A. Sosa // Curr. Opin. Oncol. — 2009. — Vol. 21, № 1. — P. 5–10.
181. Roman S. Prognosis of medullary thyroid carcinoma: demographic, clinical, and pathologic predictors of survival in 1252 cases / S. Roman, R. Lin, J.A. Sosa // Cancer. — 2006. — Vol. 107. — P. 2134–2142.
182. Routine measurement of serum calcitonin is useful for early detection of medullary thyroid carcinoma in patients with nodular thyroid diseases / J.R. Hahm, M.S. Lee, Y.K. Min [et al.] // Thyroid. — 2001. — Vol. 11, № 1. — P. 73–80.
183. Sakorafas G.H. The genetic basis of hereditary medullary thyroid cancer: clinical implications for the surgeon, with a particular emphasis on the role of prophylactic thyroidectomy / G.H. Sakorafas, H. Friess, G. Peros // Endocr. Relat. Cancer. — 2008. — Vol. 15. — P. 871–884.
184. Sensitivity and prognostic value of positron emission tomography with F-18-Fluorodeoxyglucose and sensitivity of immunoscintigraphy in patients with medullary thyroid carcinoma treated with anticarcinoembryonic antigen-targeted radioimmunotherapy / A. Oudoux, P.-Y. Salaun, C. Bournaud [at al.] // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 4590–4597.
185. Single missense mutation in the tyrosine kinase catalytic domain of the RET protooncogene is associated with multiple endocrine neoplasia type 2B / K.M. Carlson, S. Dou, D. Chi [et al.]. — PNAS. — 1994. — Vol. 91. — P. 1579–1583.
186. Sippel R.S. Current management of medullary thyroid cancer / R.S. Sippel, M. Kunnimalaiyaan, H. Chen // The Oncologist. — 2008. — Vol. 13, № 5. — P. 539–547.
187. Sipple H. Multiple endocrine neoplasia type 2 syndromes: historical perspectives / H. Sipple // Henry Ford Hosp. Med. J. — 1984. — Vol. 32, № 4. — P. 219–221.
188. Smith D.P. Germline mutation of RET codon 883 in two cases of de novo MEN 2B / D.P. Smith, C. Houghton, B.A. Ponder // Oncogene. — 1997. — Vol. 15, № 10. — P. 1213–1217.
189. Surgical management of sporadic medullary thyroid cancer / S. Noullet, C. Tresallet, G. Godiris-Petit [et al.] // J. Visc. Surg. — 2011. — Vol. 148, № 4. — P. e244–e249.
190. Surgical strategy in a kindred with a rare RET protooncogene mutation of variable penetrance with regard to multiple endocrine neoplasia / M. Colombo-Benkmann, J. Bramswig, W. Hoppner [et al.] // World J. Surg. — 2002. — Vol. 26, № 10. — P. 1286–1290.
191. Surgical treatment and prognosis analysis on medullary thyroid carcinoma / Z.X. Zhang, Z.J. Li, P.Z. Tang [et al.] // Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. — 2011. — Vol. 46, № 3. — P. 209–213.
192. Targeted radionuclide therapy for patients with metastatic medullary thyroid carcinoma / R. Gao, R. An, Y. X. Zhang, H.J. Biersack // honghua Zhong Liu Za Zhi. — 2006. — Vol. 28, № 8. — P. 621–624.
193. The relationship between specific RET proto-oncogene mutations and disease phenotype in multiple endocrine neoplasia type 2. International RET mutation consortium analysis / C. Eng, D. Clayton, I. Schuffenecker [et al.] // JAMA. — 1996. — Vol. 276, № 19. — P. 1575–1579.
194. The RET gene and medullary thyroid cancer: from mutations to the planning of therapy / G. Conzo, R. Ruggiero, A. Palazzo [et al.] // Chir. Ital. — 2009. — Vol. 61, № 5–6. — P. 531–538.
195. The role of radiotherapy in the management of elevated calcitonin after surgery for medullary thyroid cancer / N. Fersht, L. Vini, R. A’Hern, C. Harmer // Thyroid. — 2001. — Vol. 11, № 12. — P. 1161–1168.
196. The use of preoperative routine measurement of basal serum thyrocalcitonin in candidates for thyroidectomy due to nodular thyroid disorders: results from 2733 consecutive patients / G. Chambon, C. Alovisetti, C. Idoux-Louche [et al.] // J. Clin. Endocrinol. Metabol. — 2011. — Vol. 96, № 1. — P. 75–81.
197. Two germline missense mutations at codons 804 and 806 of the RET proto-oncogene in the same allele in a patient with multiple endocrine neoplasia type 2B without codon 918 mutation / A. Miyauchi, H. Futami, N. Hai [et al.] // Jpn. J. Cancer Res. — 1999. — Vol. 90, № 1. — P. 1–5.
198. Ultrasonographic features of medullary thyroid carcinoma and their diagnostic values / S. Cai, H. Liu, W.B. Li [et al.] // Chin. Med. J. (Engl.). — 2010. — Vol. 123, № 21. — P. 3074–3078.
199. Ultrasonographic findings of medullary thyroid cancer: differences according to tumor size and correlation with fine needle aspiration results / N. Choi, W.-J. Moon, J.H. Lee [et al.] // Acta Radiol. — 2011. — Vol. 52, № 3. — P. 312–316.
200. Ultrasonographic findings of medullary thyroid carcinoma: a comparison with papillary thyroid carcinoma / S.H. Kim, B.S. Kim, S.L. Jung [et al.] // Korean J. Radiol. — 2009. — Vol. 10. — P. 101–105.
201. Valle L. A. The prevalence of occult medullary thyroid carcinoma at autopsy / L.A. Valle, R. Kloos // J. Clin. Endocrinol. Metab. — 2011. — Vol. 96. — P. E109–E113.
202. When should thyroidectomy be performed in familial medullary thyroid carcinoma gene carriers with non-cysteine RET mutations? / P. Niccoli-Sire, A. Murat, [et al.] // Surgery. — 2003. — Vol. 134, № 6. — P. 1029–1036.
203. Williams E.D. Histogenesis of medullary carcinoma of the thyroid / E.D. Williams / J. Clin. Pathol. — 1966. — Vol. 19. — P. 114–118.
204. Williams E.D. Pathological and clinical findings in a series of 67 cases of medullary carcinoma of the thyroid / E.D. Williams, C.L. Brown, I. Doniach / J. Clin. Pathol. — 1966. — Vol. 19. — P. 103–113.
205. Wu L.S. Medullary thyroid cancer: an update of new guidelines and recent developments / L.S. Wu, S.A. Roman, J.A. Sosa // Curr. Opin. Oncol. — 2011. — Vol. 23, № 1. — P. 22–27.