Международный эндокринологический журнал 1 (65) 2015
Вернуться к номеру
Результаты динамического когортного наблюдения функции паращитовидных желез у пациентов с вторичным гиперпаратиреозом
Авторы: Карлович Н.В. - УО «Белорусский государственный медицинский университет»; УЗ «Городской эндокринологический диспансер», г. Минск
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
У 92 пациентов с терминальной стадией хронической болезни почек оценены сывороточные уровни паратгормона (ПТГ), витамина D3, показателей фосфорно-кальциевого обмена и маркеров костного метаболизма в динамике: исходно и по окончании периода динамического наблюдения длительностью от 6 до 24 месяцев. В целом по группе средний уровень ПТГ и частота встречаемости вторичного гиперпаратиреоза (ВГПТ) существенно не изменились. Уровень фосфора достоверно снизился, однако не достиг целевого уровня, что свидетельствует о недостаточной приверженности пациентов к выполнению врачебных рекомендаций по коррекции гиперфосфатемии. Установлено, что персистенцию высокого уровня ПТГ в ходе динамического наблюдения определяет высокий исходный уровень ПТГ, щелочной фосфатазы, остеокальцина и бета-кросслапс, а также молодой возраст пациентов. На усугубление ВГПТ наибольшее влияние оказывает персистенция гиперкальциемии и гиперфосфатемии. Результаты позволили заключить, что у пациентов со стабильными показателями фосфорно-кальциевого обмена на фоне отсутствия коррекции фосфорно-кальциевого обмена или применения диеты в сочетании с препаратами кальция и витамина D3 для контроля уровня ПТГ в большинстве случаев достаточно выполнять его определение 1 раз в год.
У 92 пацієнтів із термінальною стадією хронічної хвороби нирок оцінені сироваткові рівні паратгормону (ПТГ), вітаміну D3, показників фосфорно-кальцієвого обміну і маркерів кісткового метаболізму в динаміці: початково і після закінчення періоду динамічного спостереження тривалістю від 6 до 24 місяців. У цілому по групі середній рівень ПТГ і частота зустрічальності вторинного гіперпаратиреозу (ВГПТ) істотно не змінилися. Рівень фосфору вірогідно знизився, проте не досяг цільового рівня, що свідчить про недостатню прихильність пацієнтів до виконання лікарських рекомендацій щодо корекції гіперфосфатемії. Встановлено, що персистенцію високого рівня ПТГ в ході динамічного спостереження визначає високий вихідний рівень ПТГ, лужної фосфатази, остеокальцину та бета-кросслапс, а також молодий вік пацієнтів. На посилення ВГПТ найбільший вплив має персистенція гіперкальціємії і гіперфосфатемії. Результати дозволили зробити висновок, що у пацієнтів зі стабільними показниками фосфорно-кальцієвого обміну на тлі відсутності корекції фосфорно-кальцієвого обміну або застосування дієти в поєднанні з препаратами кальцію та вітаміну D3 для контролю рівня ПТГ у більшості випадків достатньо виконувати його визначення 1 раз на рік.
In 92 patients with end-stage chronic kidney disease we have evaluated serum levels of parathyroid hormone (PTH), vitamin D3, indicators of phosphorus and calcium metabolism and markers of bone metabolism: at baseline and at the end of dynamic follow-up period lasting from 6 to 24 months. In the whole group the mean PTH level and incidence of secondary hyperparathyroidism (SHPT) have not changed significantly. Phosphorus levels decreased significantly, but did not reach the target level, indicating the lack of patients’ adherence to medical recommendations on hyperphosphatemia correction. It was found that the persistence of high levels of PTH during follow-up is determined by high baseline levels of PTH, alkaline phosphatase, osteocalcin and beta-cross-laps, as well as the young age of the patients. Persistence of hypercalcemia and hyperphosphatemia has the greatest impact on SHPT aggravation. The findings allow us to conclude that in patients with stable parameters of phosphorus and calcium metabolism, with the absence of correction for calcium and phosphorus metabolism or use of diet in combination with calcium and vitamin D3 preparations, the measurement of PTH once a year in most cases is enough to control its levels.
вторичный гиперпаратиреоз, диализные пациенты.
вторинний гіперпаратиреоз, діалізні пацієнти.
secondary hyperparathyroidism, dialysis patients.
Статья опубликована на с. 13-18
Вторичный гиперпаратиреоз (ВГПТ) является универсальным осложнением хронической болезни почек (ХБП). ВГПТ наиболее широко распространен среди пациентов с терминальной стадией ХБП (тХБП). Частота встречаемости ВГПТ у пациентов с тХБП, получающих заместительную почечную терапию (ЗПТ) (ХБП–5Д), по данным разных авторов, варьирует от 17 до 40 % [3, 5, 6, 8, 10, 11].
Основными последствиями ВГПТ являются нарушения фосфорно–кальциевого обмена, костные нарушения, а также метастатическая кальцификация, в первую очередь — сосудистая. В итоге — снижение качества и продолжительности жизни в связи с развитием кожного зуда, болевого синдрома в костях, патологических переломов костей и прогрессии сердечно–сосудистой патологии [2, 4, 7, 12].
В настоящее время общепризнано, то уровень паратгормона (ПТГ) у пациентов с тХБП должен быть выше, чем в здоровой популяции, находиться на уровне 150–300 пг/мл [7, 8, 9, 12]. Однако единого мнения о целевом показателе уровня ПТГ нет. В наиболее широко цитируемых и применяемых в клинической практике рекомендациях Национального почечного фонда США K/DOQI [9] предлагается исследовать уровень ПТГ у всех пациентов с ХБП стадии 3, 4 и 5, рекомендуемая частота определения в динамике у диализных пациентов — 1 раз в 3 месяца. Насколько необходима с практической точки зрения такая частота определения ПТГ — вопрос открытый и требующий доказательств. Для выработки оптимального протокола ведения пациентов с ВГПТ на фоне тХБП важно оценить динамику функции паращитовидных желез у данных пациентов и факторов, влияющих на прогрессию болезни.
Цель исследования: оценить динамику функции паращитовидных желез у пациентов с терминальной стадией хронической болезни почек, получающих постоянную заместительную почечную терапию, за период наблюдения от 6 до 24 месяцев и выявить факторы, влияющие на прогрессию вторичного гиперпаратиреоза.
Материалы и методы
В исследование были включены 92 пациента (40 мужчин и 52 женщины) в возрасте от 20 до 70 лет (средний возраст — 47,2 ± 11,4 года, 95% доверительный интервал (ДИ) 44,9–49,6) с терминальной стадией ХБП, получающих постоянную заместительную почечную терапию методами гемодиализа (79 человек), перитонеального диализа (13 человек) (табл. 1).
Основной причиной тХПБ был хронический гломерулонефрит — 60 (65,2 %) человек. Среди других причин развития были врожденные аномалии развития мочевых путей (поликистоз почек, гипоплазия почек) — 15 человек (16,3 %); сахарный диабет — 7 человек (7,6 %); артериальная гипертензия — 5 человек (5,4 %); оставшиеся 5,4 % составили хронический пиелонефрит, мочекаменная болезнь, интерстициальный нефрит. Сеансы гемодиализа проводились на аппаратах «искусственная почка» по стандартной методике не менее 12 часов в неделю. Пациенты, находящиеся на перитонеальном диализе, получали лечение растворами CAPD–2, CAPD–4 или CAPD–3 (в зависимости от уровня гидратации) объемом 2,0 л 4 раза в сутки. Концентрация кальция в диализном растворе составляла 1,75 ммоль/л.
Пациенты были осмотрены и обследованы исходно и через 6–24 месяца динамического наблюдения. Осмотр включал опрос на наличие и выраженность кожного зуда и костных болей, уточнение дозировок и регулярности приема препаратов кальция и витамина D, осмотр на наличие подкожных кальцификатов и признаков кальцифилаксии. В сыворотке крови определяли: паратгормон, остеокальцин (ОК), бета–кросслапс (b–КЛ) — иммунохемилюминесцентным методом на анализаторе Modular лабораторными наборами Roche Diagnostics; кальций (Са), фосфор (Р), щелочную фосфатазу (ЩФ) — на автоматическом биохимическом анализаторе Hitachi 911. Исходно у пациентов также определяли уровень 25(ОН)–витамина D3 (25(ОН)D3).
Статистическая обработка данных проводилась с использованием методов описательной статистики, методов сравнения средних величин для связанных величин, долей признаков, корреляционный анализ, расчет отношения шансов. Различия считали статистически значимыми при р < 0,05.
Результаты и их обсуждение
Референсные границы нормы, результаты оценки показателей исходно и по окончании периода динамического наблюдения и их сравнительного анализа приведены в табл. 2.
Все включенные в исследование пациенты получили стандартную рекомендацию по соблюдению диеты с ограничением продуктов с высоким содержанием фосфатов, а также при наличии показаний и отсутствии противопоказаний — рекомендацию по приему кальция карбоната в качестве фосфатсвязывающего биндера. При этом многие пациенты принимали препарат кальция карбоната в сочетании с холекальциферолом. Препараты кальция карбоната в течение периода наблюдения принимали 74,4 %, препараты витамина D — 37,8 %.
В ходе сравнения уровня ПТГ, показателей фосфорно–кальциевого обмена и биохимических маркеров метаболизма кости исходно и по окончании периода наблюдения статистически значимые различия выявлены в отношении уровня фосфора, который снизился с 2,34 ± 0,67 ммоль/л до 2,14 ± 0,60 ммоль/л (p < 0,0003). Это является результатом проводимой работы по коррекции фосфорно–кальциевого обмена и указывает на ее недостаточную эффективность. Несмотря на достоверное снижение уровня фосфора, в среднем его значение осталось на уровне значительно выше рекомендуемого 1,78 ммоль/л.
Среди обследованных пациентов исходно гиперфосфатемию имели 80,7 % пациентов, по окончании периода наблюдения — 73,8 % пациентов; гипокальциемию — 10,7 % vs 4,8 %; гиперкальциемию — 65,5 % vs 74,7 %. Эти данные демонстрируют явную тенденцию к нормализации показателей фосфорно–кальциевого обмена и уменьшение доли пациентов с нарушениями. Вместе с тем статистически значимых изменений не произошло, распространенность гиперкальциемии и гиперфосфатемии сохранялась на высоком уровне. Достигнутые результаты свидетельствуют о недостаточности применяемых мер, что в значительной степени обусловлено неудовлетворительной приверженностью пациентов к выполнению врачебных рекомендаций по лечению кальция карбонатом в качестве фосфат–биндера. Почти 3/4 пациентов применяли данный препарат, при этом у 73,8 % гиперфосфатемия персистировала, то есть цель лечения не была достигнута, а у 74,7 % по окончании наблюдения зафиксирована гиперкальциемия, что является противопоказанием для применения кальция карбоната.
В целом по группе статистически значимого изменения уровня ПТГ в течение периода динамического наблюдения выявлено не было. Частота встречаемости нормального уремического уровня ПТГ, ВГПТ и относительного гипопаратиреоза исходно и по окончании периода наблюдения составила 20,7 % vs 21,7 %; 55,4 % vs 57,6 %; 23,9 % vs 20,7 %; различия статистически не значимы. Таким образом, можно констатировать сохранение исходного уровня ПТГ и структуры нарушений функции паращитовидных желез в течение периода наблюдения у рассматриваемой группы диализных пациентов.
Вместе с тем при сравнении уровня ПТГ до и по окончании периода наблюдения у пациентов с исходной гиперкальциемией (n = 55) выявлен статистически значимый рост ПТГ с 525,3 ± 548,4 пг/мл (95% ДИ 377,1–673,5) до 616,2 ± 646,2 пг/мл (95% ДИ 441,6–790,9; р = 0,030). Сравнительный анализ подгрупп пациентов с гиперфосфатемией, гипокальциемией исходно, а также у пациентов в подгруппах с нарушениями фосфорно–кальциевого обмена по окончании периода наблюдения не выявил статистически значимых различий ПТГ исходно и после динамического наблюдения. Фактором, лимитирующим результат сравнения уровня ПТГ в ходе динамического наблюдения у пациентов с гипокальциемией, является небольшая численность данной подгруппы.
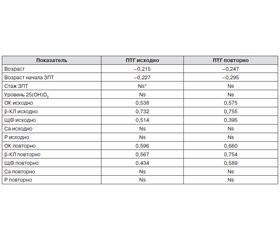
Были изучены корреляционные взаимосвязи уровней ПТГ исходно и по окончании периода наблюдения с демографическими данными, а также с показателями фосфорно–кальциевого обмена и биохимическими маркерами костного метаболизма (табл. 3). Уровень ПТГ по окончании периода наблюдения наиболее сильно коррелировал с исходным уровнем ПТГ (r = 0,837). Установлена также отрицательная корреляционная взаимосвязь исходного уровня ПТГ и динамики изменения уровня ПТГ в течение периода наблюдения (r = –0,258).
Выявлена слабая, но статистически значимая корреляционная взаимосвязь уровня ПТГ (исходно и повторно) с возрастом пациентов, возрастом на момент инициации ЗПТ, а также средней степени выраженности — с уровнями биохимических маркеров костного метаболизма.
В целом по группе у 40 пациентов (43,5 %) ПТГ за период наблюдения снизился в среднем на 204,6 ± ± 250,1 пг/мл (95% ДИ 124,6–284,6). У 52 пациентов (56,5 %) ПТГ вырос в среднем на 235,6 ± 274,5 (95% ДИ 230,1–340,4).
Нами выполнено сравнение всех тестируемых показателей, включая демографические данные, в подгруппах пациентов, у которых произошел рост и снижение ПТГ. Установлено, что подгруппы не отличаются по демографическим данным, показателям фосфорно–кальциевого обмена, биохимическим маркерам костного метаболизма. Однако в подгруппе тех, у кого произошло снижение ПТГ, исходно ПТГ был выше: 766,4 ± 634,3 пг/мл vs 400,6 ± 421,4 пг/мл (р = 0,005). Также данная подгруппа отличалась исходно более высокими цифрами ЩФ: 165,7 ± 255,2 Ед/мл vs 109,9 ± 114,6 Ед/мл(р = 0,070) и более низким уровнем фосфора крови по окончании периода наблюдения: 1,98 ± ± 0,46 ммоль/л vs 2,25 ± 0,66 ммоль/л (р = 0,057). В ходе анализа корреляционной взаимосвязи разницы между уровнем ПТГ в конце и в начале периода наблюдения и всех оцененных показателей установлена отрицательная корреляция с уровнем ПТГ (r = –0,258), а также положительная — с исходным уровнем Са (r = 0,228) и уровнем бета–кросслапс по окончании периода наблюдения.
Выполнены парные сравнения у пациентов различных возрастных групп и в подгруппах пациентов с различным стажем диализа. Анализ не выявил статистически значимых различий уровней ПТГ до и после окончания периода наблюдения. Отношение шансов для роста уровня ПТГ в ходе наблюдения у пациентов в возрасте 50 лет и старше по сравнению с теми, кому было менее 50 лет, составило 0,853 (95% ДИ 0,343–2,121).
Для оценки клинических проявлений ВГПТ и ассоциированных минеральных и костных нарушений проанализирована частота предъявления жалоб на кожный зуд и боли в костях, а также наличие подкожных кальцификатов и кальцифилаксии. Исходно кожный зуд беспокоил 60,2 % пациентов, костные боли — 67,0 %. По окончании периода наблюдения — 64,9 и 50,7 % соответственно. У пациентов с кожным зудом уровень ПТГ исходно был достоверно ниже: 460,2 ± 492,1 пг/мл vs 737,4 ± 623,0 пг/мл (р = 0,023), а уровень фосфора крови — выше: 2,47 ± 0,71 ммоль/л vs 2,12 ± 0,55 ммоль/л (р = 0,026). Также достоверны различия прироста уровня ПТГ в течение периода наблюдения: у пациентов с кожным зудом динамика составила +96,9 ± 336,1 пг/мл, а у лиц без жалоб на кожный зуд –45,2 ± 345,8 пг/мл (р = 0,025). Уровень фосфора крови в конце периода наблюдения у лиц с кожным зудом в начале наблюдения также достоверно выше: 2,31 ± 0,59 ммоль/л vs 1,85 ± 0,51 ммоль/л (р = 0,002), в то время как повторно измеренный уровень ПТГ — без статистически значимых различий.
Достоверных различий ПТГ у пациентов с костными болями не зарегистрировано. Подкожные кальцификаты были выявлены у 10,2 % vs 16,0 % и кальцифилаксия — у 3,4 % vs 4,2 % соответственно. При выявленной тенденции к увеличению доли лиц с клиническими проявлениями различия статистически не значимы.
При выполнении парных сравнений уровней ПТГ исходно и через период наблюдения до 6 месяцев, 9, 12 и более 12 месяцев статистически значимых различий не выявлено (табл. 4). При этом у пациентов с периодом наблюдения 6 и 9 месяцев при исходно практически идентичных показателях после окончания периода наблюдения данные практически не изменились. У пациентов с периодом наблюдения 1 год исходно уровни ПТГ были выше, чем в первых двух подгруппах, по окончании наблюдения — без динамики. В подгруппе пациентов с периодом наблюдения более года исходно разброс уровней ПТГ был значительным, по окончании наблюдения в целом произошло статистически незначимое снижение уровня ПТГ, а также уменьшился разброс значений ПТГ.
Таким образом, у пациентов со стабильными показателями фосфорно–кальциевого обмена и маркерами костного метаболизма, получающих стандартную диализную терапию, рекомендации по соблюдению гипофосфатной диеты и приему кальцийсодержащих фосфатсвязывающих препаратов и физиологические дозы витамина D3, рекомендуемое NKF–K/DOQI ежеквартальное определение уровня ПТГ является неоправданным, определение ПТГ достаточно делать 1 раз в 6–12 месяцев.
В доступных литературных источниках нами были найдены ряд статей, описывающих результаты оценки динамики функции паращитовидных желез у диализных пациентов после применения различных лечебных стратегий (применение кальцитриола, хирургическое лечение), и лишь одна статья с данными о динамическом наблюдении фосфорно–кальциевого обмена и функции паращитовидных желез у пациентов, не получающих лечения ВГПТ. В данной работе [1] целью было оценить реакцию паращитовидных желез на изменения в крови уровней Са и Р, то есть цель несколько отличалась от нашей. Вместе с тем было показано, что гиперкальциемия супрессирует секрецию ПТГ, а гипокальциемия и гиперфосфатемия — стимулируют. Нами были получены иные данные. У подавляющего большинства наших пациентов с гиперкальциемией одновременно регистрировалась и гиперфосфатемия. Таким образом, в нашем случае риск прогрессирования ВГПТ определялся выраженными сочетанными нарушениями минерального обмена.
Выводы
1. У пациентов с ВГПТ, получающих стандартную заместительную почечную терапию и по показаниям — препараты кальция и витамина D3, в течение периода наблюдения от 6 до 24 месяцев не произошло статистически значимых изменений уровня ПТГ вне зависимости от длительности периода наблюдения.
2. Применение препаратов кальция и витамина D3 в случае, когда это не приводит к существенным изменениям (нормализации) показателей фосфорно–кальциевого обмена, не оказывает статистически значимого влияния на уровень ПТГ в ходе динамического наблюдения.
3. Персистенцию высокого уровня ПТГ в ходе динамического наблюдения определяет высокий исходный уровень ПТГ, ЩФ, остеокальцина и бета–кросслапс, а также молодой возраст пациентов.
4. На усугубление ВГПТ наибольшее влияние оказывает персистенция гиперкальциемии и гиперфосфатемии.
5. Наличие кожного зуда ассоциировано с гиперфосфатемией вне зависимости от уровня ПТГ, пациенты с жалобами на кожный зуд имеют достоверно более высокий риск роста ПТГ в ходе динамического наблюдения.
6. У пациентов со стабильными показателями фосфорно–кальциевого обмена на фоне отсутствия коррекции фосфорно–кальциевого обмена или применения диеты в сочетании с препаратами кальция и витамина D3 для контроля уровня ПТГ достаточно выполнять его определение 1 раз в год, за исключением лиц молодого возраста с высокими исходными уровнями ПТГ, ЩФ, остеокальцина, бета–кросслапс и персистенцией гиперкальциемии и гиперфосфатемии.
1. Felsenfeld A.J., Rodrıguez M., Aguilera–Tejero E. Dynamics of Parathyroid Hormone Secretion in Health and Secondary Hyperparathyroidism // Clin. J. Am. Soc. Nephrol. — 2007. — Vol. 2. — P. 1283–1305.
2. Horl W.H. The clinical consequences of secondary hyperparathyroidism: focus on clinical outcomes // Nephrol. Dial. Transplant. — 2004. — Vol. 19, Suppl. 5. — V. 2–8.
3. Kidney Disease: Improving Global Outcomes (KDIGO) CKD–MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease–mineral and bone disorder (CKD–MBD) // Kidney International. — 2009. — № 76(Suppl. 113). — S1–S130.
4. Lim S., Gun N.T. Secondary hyperparathyroidism and calcium phosphate control in a hemodialysis population // Acta Med. Indones. — 2007. — Vol. 39(2). — P. 71–74.
5. Maduell F., Gorriz J.L., Pallardo L.M., Pons R., Santiago C. Assessment of phosphorus and calcium metabolism and its clinical management in hemodialysis patients in the community of Valencia // J. Nephrol. — 2005. — Vol. 18(6). — Р. 739–748.
6. Mereu M.C., Bolasco P.G., Pinna A., Carzedda L.G., Branca G.F., Di Lauro L., Cogoni G., Solinas R., Mureddu S. The treatment of osteodystrophy in dialyzed uremic patients: results of the first Sardinian audit // G. Ital. Nefrol. — 2004. — Vol. 21(4). — P. 362–370.
7. Moe S.M., Drueke T., Cunningham J. et al. Definition, evaluation, and classification of renal osteodystrophy: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO) // Kidney International. — 2006. — Vol. 69. — P. 1945–1953.
8. Moe S.M., Drueke T., Lameire N., Eknoyan G. Chronic kidney disease — mineral–bone disorder: a new paradigm // Adv. Chronic. Kidney Dis. — 2007. — Vol. 14(1). — P. 3–12.
9. National Kidney Foundation Dialysis Outcomes Quality Initiative (K/DOQI) guidelines // http://www.kidney.org/professionals/kdoqi/guidelines_bone/index.htm
10. Schomig M., Ritz E. Management of disturbed calcium metabolism in uraemic patients: use of vitamin D metabolites // Nephrol. Dial. Transplant. — 2000. — Vol. 15(Suppl. 5). — P. 18–24.
11. Schomig M., Ritz E. Management of disturbed calcium metabolism in uraemic patients: indications for parathyroidectomy // Nephrol. Dial. Transplant. — 2000. — Vol. 15(Suppl. 5). — P. 25–29.
12. Wei M., Taskapan H., Esbaei K., Jassal S.V., Bargman J.M., Oreopoulos D.G. K/DOQI guideline requirements for calcium, phosphate, calcium phosphate product, and parathyroid hormone control in dialysis patients: can we achieve them? // Int. Urol. Nephrol. — 2006. — Vol. 38(3–4). — P. 739–743.

/14/14.jpg)
/16/16.jpg)