Международный эндокринологический журнал 1 (65) 2015
Вернуться к номеру
Вплив субклінічного гіпотиреозу на репродуктивну функцію жінки та ефективність його корекції
Авторы: Пасєчко Н.В., Гнат С.В., Свистун І.І., Наумова Л.В. - Тернопільський державний медичний університет ім. І.Я. Горбачевського
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У статті наводяться результати дослідження, у якому взяла участь 21 жінка з безплідністю та порушенням функції щитоподібної залози (ЩЗ) (рівень тиреотропного гормона (ТТГ) перевищував 2,5 мкМО/мл). Жінки отримували замісну гормональну терапію L-тироксином у рекомендованих European Thyroid Association дозах. Під час дослідження завагітніли 9 жінок (42,85 %). Отримані результати дозволили нам зробити висновки: 1) визначення функціонального стану ЩЗ є вкрай необхідним при плануванні вагітності, безплідності, фізіологічній та патологічній вагітності; 2) замісна терапія L-тироксином є необхідною для жінок із безплідністю і жінок із рівнем ТТГ > 2,5 мкМО/мл, які планують вагітність, та при перевищенні максимальних значень ТТГ, рекомендованих European Thyroid Association у різні періоди вагітності.
В статье представлены результаты исследования, в котором приняла участие 21 женщина с бесплодием и нарушением функции щитовидной железы (ЩЖ) (уровень тиреотропного гормона (ТТГ) превышал 2,5 мкМЕ/мл). Женщины получали заместительную гормонотерапию L-тироксином. В ходе исследования забеременели 9 женщин (42,85 %). Полученные результаты позволили нам сделать выводы: определение функционального состояния ЩЖ крайне необходимо при планировании беременности, бесплодии, физиологической и патологической беременности; заместительная терапия L-тироксином необходима для женщин с бесплодием и женщин с уровнем ТТГ > 2,5 мкМЕ/мл, которые планируют беременность, и при превышении максимальных значений ТТГ, рекомендованных European Thyroid Association в разные периоды беременности.
The article presents the results of the study involved 21 women with infertility and thyroid dysfunction (thyroid stimulating hormone (TSH) level exceeded 2.5 µIU/mL). Women received hormone replacement therapy with L-thyroxine in doses recommended by European Thyroid Association. During the study, 9 (42.85 %) women became pregnant. The findings lead us to conclusions: 1) determining the functional state of the thyroid is essential when planning pregnancy, at infertility, physiological and pathological pregnancy; 2) replacement therapy with L-thyroxine is necessary for women with infertility and those planning pregnancy with TSH levels > 2.5 µIU/mL, and in exceeded maximum TSH values recommended by European Thyroid Association in different periods of pregnancy.
субклінічний гіпотиреоз, безплідність, вагітність, щитоподібна залоза, левотироксин.
субклинический гипотиреоз, бесплодие, беременность, щитовидная железа, тироксин.
subclinical hypothyroidism, infertility, pregnancy, thyroid gland, levothyroxine.
Статья опубликована на с. 98-101
Вступ
Безплідною подружньою парою вважається та, у якої клінічна вагітність відсутня після 12 та більше місяців регулярного статевого життя без використання засобів контрацепції [4]. Термін «первинна безплідність» застосовується у випадках, коли в анамнезі не відбувалося зачаття, «вторинна безплідність» — коли наявне зачаття в минулому [5]. За визначенням ВООЗ, первинна безплідність — це «нездатність жінки народити дитину через її нездатність або завагітніти, або доносити і народити живу дитину», і це визначається як «первинна стерильність». Отже, тих жінок, у яких вагітність закінчується спонтанним викиднем або народженням мертвої дитини, якщо у них ніколи не було живонародженої дитини, можна назвати первинно безплідними. Вторинна безплідність визначається як «нездатність жінки народити дитину через її нездатність або завагітніти, або доносити і народити живу дитину вже після того, як у неї була попередня вагітність та вона змогла доносити і народити живу дитину». Тому тих жінок, у яких відбувається спонтанний викидень або народжується мертва дитина, але при цьому в них була попередня вагітність або вони змогли раніше доносити і народити живу дитину, можна назвати вторинно безплідними.
За даними державних статистичних звітів, в Україні у 2012 році було зареєстровано 44 707 випадків жіночої (78,9 %) та 11 941 — чоловічої безплідності (21,1 %). Відомо, що в країнах Євросоюзу частота жіночої безплідності становить 30 %, чоловічої — також 30 %, поєднання — 30 % та нез’ясованого походження — 10 % [6]. Головні причини жіночої безплідності: ендокринні фактори — 35–40 %; трубний і перитонеальний фактори — 20–30 %; імунологічні фактори — 20 %; шийковий фактор — 5 %. Приблизно у 10–15 % випадків причина безплідності залишається нез’ясованою [5].
Репродуктивна система жінки регулюється сукупністю різноманітних органів, одним із яких є щитоподібна залоза (ЩЗ). Порушення функції ЩЗ виникають у жінок у 4–5 разів частіше, ніж у чоловіків, і превалюють у репродуктивному віці. Фази менструального циклу та розвиток вагітності можуть порушуватися внаслідок порушень тиреоїдного гомеостазу. Кожна жінка народжується з мільйонами примордіальних фолікулів, їх число прогресивно зменшується до близько 300 тис. овоцитів у пубертаті, і тільки 400–500 досягають овуляції впродовж репродуктивного віку, тоді як решта підлягає апоптозу та атрезії [1].
Гормони ЩЗ впливають на морфогенез, дозрівання та диференціацію овоцитів. Рецептори для всіх ізоформ тиреоїдних гормонів присутні в гранульозних клітинах та інших структурах. Можливо, саме так здійснюється вплив тиреоїдних гормонів на яєчники, статевий розвиток, менструальну функцію та фертильність. Тиреоїдні гормони також регулюють процеси розвитку, дозрівання, спеціалізації та оновлення майже всіх тканин, мають виняткове значення для закладки і розвитку головного мозку, формування інтелекту дитини, росту, розвитку кісткового скелета, статевої системи. Тому адекватний їх рівень є абсолютно необхідним для нормального ембріогенезу [1, 7–9].
Дуже часто в пацієнток із порушеним менструальним циклом (особливо олігоменореєю) діагностують відхилення у функціональній здатності ЩЗ, і це зовсім не дивно, враховуючи кількість різноманітних зв’язків між ЩЗ та репродуктивною системою. Також у пацієнток можлива гіперпролактинемія внаслідок зростання рівня тиреотропного гормона (ТТГ), що, у свою чергу, призводить до олігоменореї, аменореї та безплідності [2].
Адекватне забезпечення мікроелементами (особливо йодом і селеном) необхідне як для розвитку вагітності, так і для функціонування ЩЗ. Потреба в йоді значно зростає під час вагітності та лактації. У стані йодної недостатності ризик передчасних пологів, викиднів, мертвонародження зростає.
З 1990 р. численні дослідження вказують на зростання ризику спонтанних абортів у жінок із тиреоїдною дисфункцією, а гіпотиреоз виявляють у 2,5 % вагітних жінок. Найбільш вагомою причиною дисфункції ЩЗ є автоімунний тиреоїдит (АІТ), найчастіше при ньому виникає субклінічний гіпотиреоз [3]. Серед населення країн, що розвиваються, найбільш поширеною причиною гіпотиреозу є йодний дефіцит тяжкого ступеня, у той час як у розвинутих країнах основна причина — хронічний АІТ [14].
Частота різноманітних порушень менструального циклу в жінок із гіпотиреозом є в 3–4 рази вищою, ніж у жінок з еутиреозом, найбільш поширенішим порушенням є олігоменорея [16].
Гіпотиреоз — градуйоване явище: починаючи від дуже легких випадків, при яких біохімічні відхилення присутні, але людина навряд чи помічає симптоми та ознаки дефіциту гормонів ЩЗ, до дуже тяжких станів, при яких існує небезпека втратити життя. Класифікація первинного гіпотиреозу за ступенем тяжкості ґрунтується на даних лабораторної діагностики з урахуванням клінічних проявів [10]: субклінічний (концентрація ТТГ у крові підвищена, вільного тироксину — у межах норми; як правило, безсимптомний перебіг або тільки неспецифічні симптоми); маніфестний (концентрація ТТГ у крові підвищена, вільного тироксину — знижена; характерні симптоми гіпотиреозу зазвичай присутні, однак можливий і безсимптомний перебіг); ускладнений (розгорнута клінічна картина гіпотиреозу, тяжкі ускладнення: полісерозит, серцева недостатність, кретинізм, мікседематозна кома та ін.).
У новітніх методичних рекомендаціях указані бажані максимальні рівні ТТГ для кожного триместру вагітності окремо: І триместр — 2,5 мкМО/мл, ІІ триместр — 3,0 мкМО/мл, ІІІ триместр — 3,5 мкМО/мл [3].
Рекомендації ААСE/АТА 2012 року вказують на необхідність отримання левотироксину жінками з рівнем ТТГ > 2,5 мкМО/мл, а також жінками з підвищеним рівнем антитіл до тиреопероксидази (АТ–ТПО) у період планування вагітності [3]. Окремі дослідники рекомендують підтримувати рівень ТТГ на етапі планування вагітності < 1,5 мкМО/мл, щоб компенсувати збільшену потребу в гормонах ЩЗ, що характерне для цього періоду і може викликати гіпотиреоз [4].
Мета дослідження — визначення функціонального стану щитоподібної залози у жінок із безплідністю.
Матеріали і методи
Нами було обстежено 21 жінку з безплідністю та порушенням функції щитоподібної залози (рівень ТТГ перевищував 2,5 мкМО/мл), які планували вагітність. Всі пацієнтки підлягали анкетуванню та проведенню загальноклінічного обстеження. Досліджували рівні ТТГ, вільного тироксину, АТ–ТПО, йодурії, проводили ультразвукове дослідження (УЗД) ЩЗ. Жінки отримували замісну гормонотерапію L–тироксином в адекватній дозі. Контроль ТТГ, вільного тироксину проводили через кожні 4–6 тижнів для оцінки результатів та корекції дози. У період вагітності лікування L–тироксином із метою лікування гіпотиреозу продовжували. Даних про тератогенний або фетотоксичний ефект препарату в рекомендованих терапевтичних дозах немає. Отримані результати статистично оброблені за допомогою програми Statisticа, визначено середні показники (М ± m) та вірогідності відмінностей за критерієм Стьюдента.
Результати дослідження та їх обговорення
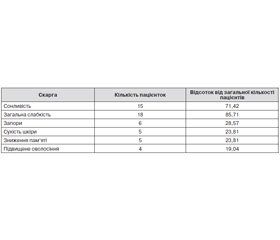
Під час проведення анкетування нами було виявлено найбільш типові скарги у жінок (табл. 1).
9 (42,85 %) жінок страждали від вторинної безплідності, їх середній вік становив 31,5 ± 5,5 року, у 4 із них в анамнезі були вагітності, що закінчувались терміновими пологами та живонародженням, у 7 — викидні або завмерлі вагітності в терміні до 10 тижнів. Середнє значення індексу маси тіла (ІМТ) у цій групі становило 26,60 ± 6,14 кг/м2.
12 (57,15 %) жінок страждали від первинної безплідності, їх середній вік становив 26,5 ± 2,5 року. В анамнезі в жодної жінки не було клінічної вагітності. Середнє значення ІМТ в цій групі становило 24,54 ± ± 7,14 кг/м2.
8 (38,1 %) пацієнток скаржились на різноманітні порушення менструального циклу: у 4 (19,05 %) жінок була олігоменорея, у 3 (14,29 %) жінок — гіпоменорея, а в 1 (4,76 %) жінки була гіперменорея. Окрім цього, 15 (71,42 %) жінок страждали від альгоменореї. Впродовж лікування скарги жінок зменшились, а якість життя покращилась (табл. 2).
У 6 жінок був підвищений рівень АТ–ТПО та ознаки АІТ згідно з результатами УЗД. В усіх досліджених нами пацієнток рівень ТТГ перед початком лікування становив > 2,5 мкМО/мл. Їм було відразу призначено замісну гормональну терапію L–тироксином. Через 6 місяців від початку лікування рівень ТТГ знизився до значень < 2,5 мкМО/мл у 17 (80,95 %) жінок. Середня доза L–тироксину, яку отримували жінки, була від 12,5 до 100 мкг/добу (табл. 3).
Побічні ефекти під час лікування L–тироксином у пацієнток не відзначалися. У трьох пацієнток виникли симптоми тиреотоксикозу, після чого доза препарату була знижена, і вони безслідно минули. Під час дослідження завагітніли 9 жінок (42,85 %) (р < 0,05) з ІМТ 22,12 ± 4,46 кг/м2. Середній рівень ТТГ на момент вагітності у них був 1,81 ± 0,70 мкМО/мл, тоді як при надходженні ТТГ дорівнював 4,95 ± 1,77 мкМО/мл (р < 0,05). Середня доза L–тироксину, при застосуванні якої настала вагітність, становила від 25 до 100 мкг/добу. Після настання вагітності доза L–тироксину зростала на 25–40 %. Корекцію дози L–тироксину проводили кожні 4–6 тижнів.
Висновки
Визначення функціонального стану ЩЗ є вкрай необхідним при плануванні вагітності, безплідності, фізіологічній та патологічній вагітності. Максимальний рівень ТТГ для жінок, які планують вагітність, не повинен перевищувати 2,5 мкМо/мл. Замісна терапія L–тироксином є необхідною для жінок із безплідністю та жінок із рівнем ТТГ понад 2,5 мкМО/мл, які планують вагітність, і позитивно впливає на настання та виношування вагітності, а також на врегулювання менструальної функції.
1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тироидология (руководство). — М.: Медицина, 2007. — 816 с.
2. Данилова Л.И. Болезни щитовидной железы и ассоциированные с ними заболевания. — Минск; Нагасаки, 2005. — 470 с.
3. Методические рекомендации Европейской тиреоидной ассоциации по ведению пациентов с субклиническим гипотиреозом в период беременности и в детском возрасте // Eur. Thyroid J. — 2014. — Vol. 3. — P. 76–94.
4. Фадеев В.В. Заместительная терапия гипотиреоза: нерешенные проблемы или предрассудки прошлого // Клиническая и экспериментальная тиреоидология. — 2010. — № 2. — С. 3–10.
5. Abalovich M., Nobuyuki A., Barbour L.A. et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metabol. — 2007. — Vol.92. — P. 1–47.
6. Canaris G.I., Manovitz N.R., Mayor G.M., Ridgway E.C. The Colorado thyroid disease prevalence study // Arch. Intern. Med. — 2000. — Vol. 160. — P. 526–534.
7. Cooper D.S. Clinical practice: subclinical hypothyroidism // N. Engl. J. Med. — 2001. — Vol. 354. — P. 260–265.
8. Glinoer, D. Gestational hypothyroxinemia and the beneficial effects of early dietary iodine fortification thyroid / D. Glinoer, J. Royet // Thyroid. — 2009. — Vol. 19, № 5. — P. 431–434.
9. Gudmundsdottir A., Schlechte J.A. Central hypothyroidism // Endocrinologist. — 2002. — Vol. 12. — P. 218–223.
10. Hueston W.J. Treatment of hypothyroidism // Am. Fam. Physician. — 2001. — Vol. 64. — P. 1717–1724.
11. Lind P., Langsteger W., Molnar M. et al. Epidemiology of thyroid diseases in iodine sufficiency // Thyroid. — 1998. — Vol. 8. — P. 1179–1183.
12. Martino E., Bartalena L., Pinchera A. Central hypothyroidism // Werner and Ingbars’ the Thyroid / Ed. by L.E. Braverman. — Philadelphia, 2000. — P. 762–771.
13. Nussey S.S., Whitehead S.A. Endocrinology. An integrated approach. — BIOS Scientific Publishers Limited, 2001. — 358 p.
14. Poppe K. Female infertility and the thyroid [Text] / K. Poppe, B. Volkeniers // Clin. Endocrinol. Metab. — 2004. — Vol. 18, № 2. — P. 153–165.
15. Soldin O.P. Therapeutic drug monitoring during pregnancy and lactation: thyroid function assessment in pregnancy–challenges and solutions // Therapeutic Drug Monitoring. — 2010. — Vol. 32, № 3. — P. 265–268.

/100/100.jpg)