Международный эндокринологический журнал 1 (65) 2015
Вернуться к номеру
Стан щитоподібної та молочних залоз у жінок із вторинною неплідністю та ранніми репродуктивними втратами в анамнезі
Авторы: Дубенко О.Д. - ДУ «Інститут педіатрії, акушерства та гінекології НАМН України», м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У статті викладені результати вивчення стану щитоподібної та молочних залоз у жінок (n = 203) із вторинною неплідністю та ранніми репродуктивними втратами в анамнезі (вагітні жінки із загрозою переривання вагітності, вагітність у яких закінчилась мимовільним викиднем в ранні терміни, жінки з викиднем, позаматковою (трубною) вагітністю) за результатами сонографічного обстеження молочних та щитоподібної залоз на етапах обстеження та лікування. Проведені дослі-
дження свідчать, що жінки з порушеною репродуктивною функцією на тлі ранніх репродуктивних втрат становлять групу з високою частотою тиреоїдної патології та значним ризиком виникнення дисгормональних змін у молочних залозах, що потребує проведення активних скринінгових сономамографічних обстежень для виявлення даної патології. Подальший підбір лікувальних схем та визначення лікувальної тактики після різноманітних репродуктивних втрат повинні проводитися при зіставленні очікуваного результату терапії та ступеня ризику можливих ускладнень із боку молочних залоз з урахуванням сонографічно верифікованої патології.
В статье изложены результаты изучения состояния щитовидной и молочных желез у женщин (n = 203) с вторичным бесплодием и ранними репродуктивными потерями в анамнезе (женщины, беременность у которых закончилась самопроизвольным выкидышем в ранние сроки, женщины с замершей беременностью, женщины с внематочной (трубной) беременностью) по результатам сонографического обследования молочных и щитовидной желез на этапах обследования и лечения. Проведенные исследования свидетельствуют, что женщины с нарушенной репродуктивной функцией на фоне ранних репродуктивных потерь составляют группу с высокой частотой тиреоидной патологии и значительным риском возникновения дисгормональных изменений в молочных железах, нуждаются в проведении активных скрининговых сономаммографических обследований для выявления данной патологии. Дальнейший подбор лечебных схем и определение лечебной тактики после различных репродуктивных потерь должны проводиться при сопоставлении ожидаемого результата терапии и степени риска развития возможных осложнений со стороны молочной железы с учетом сонографически верифицированной патологии.
The article presents the results of studying the thyroid and mammary glands in women (n = 203) with secondary infertility and early reproductive losses in past medical history (pregnant women with threatened miscarriage, in whom pregnancy resulted in spontaneous abortion in the early stages, women with miscarriage, ectopic (tubal) pregnancy) according to the findings of sonographic examination of mammary and thyroid glands at the stages of examination and treatment. Our studies indicate that women with impaired reproductive function on the background of early reproductive losses make a group with a high incidence of thyroid pathology and a significant risk of dishormonal changes in the mammary glands, which requires active screening sanomammographic surveys to identify this disease. Further selection of treatment regimens and therapeutic approach after various reproductive losses should be carried out by comparing the expected result of therapy and the risk of complications in mammary glands taking into account sonographically verified pathology.
репродуктивні втрати, молочні залози, щитоподібна залоза, неплідність, скринінг.
репродуктивные потери, молочные железы, щитовидная железа, бесплодие, скрининг.
reproductive losses, mammary glands, thyroid gland, infertility, screening.
Статья опубликована на с. 109-115
Відповідно до визначення Всесвітньої організації охорони здоров’я, викиднем вважають «вигнання або видалення із організму матері ембріона (або плода) масою 500 г і менше». Частота мимовільного переривання вагітності становить до 15–20 % від загального числа всіх виявлених вагітностей. У ранні строки вагітності (6–8 тижнів) відбувається 40–80 % усіх мимовільних викиднів. Переривання вагітності та вишкрібання стінок порожнини матки стає причиною подальшого розвитку запальних захворювань статевих органів, спайкового процесу, патології матки та маткових труб, звичного невиношування вагітності, неплідності та захворювань молочних залоз (МЗ) [1].
Як відомо, молочні залози належать до репродуктивної системи і є органами–мішенями для стероїдних гормонів, гормонів надниркових залоз, щитоподібної залози (ЩЗ), гіпофіза та різноманітних біологічно активних сполук та ростових факторів. Патологічні стимули, що виникають унаслідок порушення складного ланцюга гормональної взаємодії, можуть призвести до розвитку як гіпер–, так і гіпопластичних змін [2–4]. У структурі захворюваності жіночого населення, за даними різних авторів, патологічні процеси МЗ посідають провідне місце з частотою від 40 до 80 % [5, 6].
Згідно з даними американських дослідників J. та I. Russoу, у жінок відзначається морфологічна еволюція в процесі росту та розвитку МЗ з формуванням чотирьох типів часточок [7, 8]. У жінок, які не народжували, зазвичай спостерігаються недиференційовані структури (часточки 1–го та 2–го типів, рідко — 3–го типу), а у жінок, які народили, вони представлені диференційованими часточками третього типу, що становлять 70–90 % від їх загальної кількості, при цьому при досягненні 40–річного віку їх кількість зменшується. Встановлено, що у протоках часточок 1–го типу можуть спостерігатися пренеопластичні зміни, подібні до атипової гіперплазії, що можуть прогресувати в рак протоку та інвазивний рак молочних залоз (РМЗ) [7, 8]. У часточках 2–го типу можуть розвиватися часточкова атипова гіперплазія та рак, у часточках третього типу виникають секреторні аденоми, фіброаденоми, склерозуючий аденоз та апокрифові кісти [8]. Аналіз клітинної кінетики часточок різних типів показав, що жінки, які народили, менш схильні до ризику розвитку РМЗ. При застосуванні міченого ДНК було виявлено, що часточки 1–го та 2–го типів містять більшу кількість мітозів і ростуть швидше, ніж часточки 3–го типу. Повне диференціювання МЗ — це послідовний процес, що триває декілька років, і в деяких випадках, якщо вагітність не настала, ніколи не доходить до завершення. Отже, вагітність, що завершується пологами, та подальша лактація сприяють завершеному диференціюванню часточок [7, 8] і є засобом профілактики проліферативних процесів у МЗ.
В останні роки народжуваність знижується, що негативно впливає на збільшення частоти порушень репродуктивного здоров’я жінок. Можливо, це є однією з причин росту частоти захворювань МЗ [9]. Аналізуючи захворюваність жінок у регіонах різного рівня народжуваності, Л.Л. Юний (1986) виявив, що на території з низькою народжуваністю найчастішими є гормонозалежна патологія матки і МЗ [10]. Відсутність пологів, пологи після 35 років збільшують ризик розвитку доброякісних захворювань молочних залоз (ДЗМЗ) [11, 12]. Жінки, які народили двох дітей у віці до 25 років, мають втричі менший ризик розвитку захворювань МЗ порівняно з жінками, які мають одну дитину [13]. За літературними даними, переривання вагітності в першому й другому триместрах значно підвищує ризик розвитку патології МЗ. За наявності в анамнезі в жінок трьох медичних абортів і більше ризик розвитку ДЗМЗ у 7,2 раза вищий, ніж у жінок, які не мали медичних абортів [1]. Штучне переривання вагітності зупиняє проліферативні процеси в МЗ, гіперплазована залозиста тканина зазнає зворотного розвитку, частково заміщується жировою й сполучною тканиною, зменшується її васкуляризація й гідрофільність. Регресивні процеси в МЗ відбуваються не завжди одночасно та рівномірно, що може стати пусковим моментом для формування дифузних або вузлових змін тканини МЗ [14]. Важливе значення мають строки переривання вагітності, гормональний гомео–стаз до вагітності, психосоматичний стан та ін. [15, 16]. Тому штучний аборт у віці 20–24 роки збільшує ризик виникнення раку молочної залози вдвічі [12]. До 30 років кожна вагітність захищає жінку від виникнення РМЗ, тоді як кожна вагітність після цього віку збільшує ризик цього захворювання [16, 17]. Вивчаючи вплив термінів переривання вагітності на стан МЗ, автори виявили, що безпечнішим є ранній термін, оскільки проліферативні процеси в ці строки ще не настільки інтенсивні [16, 17]. Переривання вагітності в більш пізній строк може призвести до дегенеративних змін МЗ [17]. Хоча рандомізоване дослідження 1,5 млн жінок, виконане датськими вченими, показало, що штучний аборт загалом не впливає на ризик розвитку РМЗ [17].
Щитоподібна залоза як важлива ланка нейроендокринної системи справляє значний вплив на функцію репродуктивної системи та стан молочних залоз. Гормони ЩЗ опосередковано регулюють синтез та метаболізм статевих гормонів. Естрогени, у свою чергу, підвищують чутливість тиреотрофів до тиреоліберину, що призводить до посилення функції ЩЗ. Зниження концентрації тироксину, трийодтироніну обумовлює розвиток гіперпролактинемічних станів [18]. Дія тиреоїдних гормонів, основних регуляторів метаболічних процесів на рівні ядра клітин, найбільш активно виявляється у формуванні залозистого апарату і строми молочних залоз. Тиреоїдні гормони сприяють розвитку лобулярно–альвеолярних структур, розгалуженню і подовженню проток, а також посиленню лактозо–синтетазної активності L–лактальбуміну. Під їх впливом у молочній залозі регулюється рівень рецепторів епідермального фактора росту, що стимулює процеси проліферації епітеліальних клітин і гальмує їх функціональне диференціювання [18]. Збільшення частоти захворювань ЩЗ в останні роки, зокрема у молодих жінок, зумовлює збільшення кількості вагітних із цією патологією [11]. Значення тиреоїдних гормонів як фактора ризику розвитку патології МЗ визнається багатьма дослідниками [14]. У низці епідеміологічних досліджень у пацієнток із мастопатією доведена більша, ніж у популяції (50 % і більше), частота виявлення патології ЩЗ [9]. ЩЗ під час першого триместру збільшується в розмірах. Встановлено, що при вагітності підвищується кліренс тиреоїдних йодидів із захватом йоду. Ці зміни в основному обумовлені підвищенням ниркового кліренсу, що призводить до відносної йодної недостатності. Концентрація вільного тироксину та трийодтироніну залишається в межах норми, хоча вміст загального тироксину збільшується за рахунок естроген–стимульованого підвищення вмісту тироксин–зв’язуючого глобуліну (ТЗГ). Тиреотропні ефекти плаценти в ранні строки вагітності обумовлені високими концентраціями хоріонічного гонадотропіну людини (ХГл), що має слабку ТТГ–подібну активність. Саме тому в ранній період гестації стимуляція ХГл викликає явні біохімічні ознаки транзиторного тиреотоксикозу [14]. Фізіологічна адаптація ЩЗ до вагітності обумовлена трьома незалежними факторами. Підвищення ТЗГ відбувається під впливом естрогенів у І триместрі. Це призводить до транзиторного зниження активної гормональної фракції вільного тироксину (вТ4). За механізмом зворотного зв’язку збільшується вироблення ТТГ, що призводить до відновлення концентрації вільних гормонів. ХГЛ також безпосередньо стимулює ЩЗ жінки. У здорових жінок стимулюючий ефект ХГЛ на ЩЗ залишається мінімальним, без клінічних проявів. Але у 20 % випадків рівень ТТГ може транзиторно знижуватися до нижньої межі норми, що свідчить про пригнічення гіпофізарно–тиреоїдної системи. Крім того, у 10 % випадків із субнормальним рівнем ТТГ рівень вТ4 може перевищувати норму, що призводить до розвитку тиреотоксикозу в І триместрі. Дейодуюча активність плаценти (підвищення дейодування Т4) може бути пов’язана з пришвидшеним периферичним метаболізмом тироксину або з трансплацентарним переносом тиреоїдних гормонів матері.
Основною умовою планування вагітності є надійне підтримування стану еутиреозу. Репродуктивна система найчутливіша до впливу різноманітних зовнішніх факторів, тому закономірно, що за умов йодного дефіциту в жіночого населення в першу чергу страждає саме вона: порушується статеве дозрівання, менструальна функція, знижується фертильність, збільшується частота гінекологічної патології, ризик розвитку ускладнень перебігу вагітності та пологів, мимовільних абортів та мертвонароджень [18].
Слід зазначити, що в літературі багато уваги приділено питанням функціональної взаємодії тиреоїдної та репродуктивної системи [7], але практично відсутні дані про можливості розвитку та взаємозв’язок патології ЩЗ та ДЗМЗ у жінок із ранніми репродуктивними втратами (РРВ).
Мета дослідження: вивчити сонографічні особливості стану щитоподібної та молочних залоз у жінок із вторинною неплідністю та ранніми репродуктивними втратами в анамнезі.
Матеріали та методи
У світлі сучасних даних гіпофізарно–тиреоїдна система — до певної міри саморегулююча система, що підпорядковується механізму зворотного зв’язку. Тому всім пацієнткам із ранніми репродуктивними втратами було проведено клінічний скринінг із сонографічним обстеженням молочних та щитоподібної залоз.
Сонографічне дослідження МЗ і ЩЗ проводилося на 6–11–й день менструального циклу або в будь–який день за його відсутності за допомогою ультразвукових апаратів Siemens Sono Link G 40, Siemens Sono Lint SL–21 лінійним датчиком із частотою 7,5 МГц за розробленим протоколом усім жінкам із неплідністю (центр променевої діагностики НАМНУ, Український науково–практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ та відділення УЗД ІПАГ НАМНУ). Визначали наявність патологічних утворень, їх розмір, ехогенність, ширину молочних протоків, розмір та локалізацію лімфатичних вузлів. Ультразвуковими ознаками мастопатії були гіпертрофія строми у вигляді нерівних пластів, розширення та деформація молочних протоків, не–однорідність структури МЗ. За наявності вузлових та рідинних утворень за рекомендаціями мамолога проводилися рентген–мамологічне дослідження та пункційна біопсія. При ехографії ЩЗ вимірювали довжину, ширину, передньозадній розмір кожної частки і перешийка, а також оцінювали стан шийних лімфатичних вузлів, пацієнтки були консультовані ендокринологом.
Дослідження пацієнток проводилось за розробленою єдиною програмою, що включала як гінекологічне, так і мамологічне обстеження. З обов’язковим оглядом і мануальним дослідженням МЗ, при якому вивчався ступінь розвитку, форма, розміри, стан шкірних покривів, соска і регіональних лімфатичних вузлів. Визначалась наявність виділень із соска з подальшим цитологічним дослідженням. Проводилось визначення функціонального стану ЩЗ. З анамнезу життя пацієнток звертали увагу на сімейний анамнез, наявність порушень менструальної та репродуктивної функцій, гінекологічних захворювань та захворю–вань МЗ.
Для оцінки стану МЗ користувалися найбільш поширеною класифікацією М. Рожкової, за якою розрізняють такі форми мастопатії: а) дифузна залозисто–фіброзна мастопатія з переважанням залозистого компонента; б) дифузна фіброзно–кістозна мастопатія з переважанням фіброзного компонента; в) дифузна кістозно–фіброзна мастопатія з переважанням кістозного компонента; г) змішана форма дифузної фіброзно–кістозної мастопатії; д) вузлова фіброзно–кістозна мастопатія.
З урахуванням анамнестичних, клінічних і лабораторних даних та виду ранніх репродуктивних втрат усі пацієнтки (n = 203) були розподілені на 4 групи: перша група — вагітні жінки із загрозою переривання вагітності (n = 97); друга група — жінки, вагітність у яких закінчилась мимовільним викиднем у ранні строки (n = 12); третя група — жінки з викиднем, який не відбувся («завмерла вагітність») (n = 52); четверта група — жінки з позаматковою (трубною) вагітністю (n = 42). Середній вік обстежених жінок — 29,1 ± 4,1 року, що відповідає активному репродуктивному віку.
Результати досліджень та їх обговорення
З метою визначення сонографічних особливостей стану МЗ та ЩЗ було обстежено 203 (100,0 %) жінки. Залежно від виду репродуктивних втрат вони були розподілені на 4 групи. У 91 (44,8 %) жінки були виявлені різноманітні види доброякісної дисгормональної патології МЗ. При УЗД ЩЗ патологія виявлена у 70 (44,8 %) жінок. У 27 (13,3 %) пацієнток виявлена поєднана патологія МЗ і ЩЗ (табл. 1).
Найчастіше доброякісні захворювання молочних залоз траплялися в групі пацієнток із трубною вагітністю (62,2 %) та загрозою переривання вагітності (44,9 %), саме в цих групах також спостерігалася і патологія ЩЗ — 41,4 і 48,3 % відповідно. Поєднана патологія ЩЗ та МЗ також найчастіше (24,6 %) траплялася в жінок із першої групи. Високу частоту патології МЗ та ЩЗ можна пояснити тим, що 80 % жінок мали в анамнезі повторні нереалізовані вагітності (від двох до чотирьох випадків).
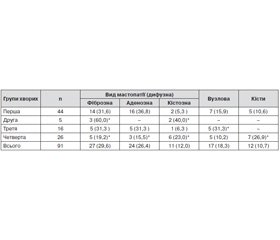
У табл. 2 наведені певні особливості: із 203 пацієнток із РРВ у 44,8 % обстежених були виявлені різноманітні форми мастопатії, у 62 (68,0 %) — різні форми дифузних мастопатій, у 12 (10,7 %) — кісти МЗ, у 17 (18,3 %) — вузлові форми. За наявності вузлових та рідинних утворень проводили рентген–мамологічне дослідження та пункційну біопсію з гістологічною верифікацією (атипія виявлена в одному випадку).
Найчастіше (у 29,6 % обстежених жінок) визначалася дифузна фіброзна мастопатія (ДФМ), у 24 (26,4 %) переважав залозистий компонент (аденоз), в 11 (12,0 %) виявлена кістозна форма масто–патії.
Залежно від виду РРВ виявлені такі особливості патології МЗ. У жінок першої групи із загрозою переривання вагітності траплялися всі види мастопатії, найчастіше (у 36,8 % пацієнток) — дифузна мастопатія з переважанням залозистого компо–нента.
У пацієнток другої групи з мимовільними викиднями визначалися лише дві форми дифузної мастопатії: 5 (60,0 %) випадків з переважанням фіброзного та 2 (40,0 %) — з переважанням кістозного компонентів.
У жінок з третьої групи із завмерлою вагітністю визначалися майже всі види мамологічної патології (крім кіст), з однаковою частотою — по 5 (19,2 %) випадків ДФМ, дифузна аденозна мастопатія та вузлові форми.
У жінок четвертої групи з трубною вагітністю з однаковою частотою траплялася різноманітна патологія: кісти — 7 (26,9 %), дифузна кістозна мастопатія — 6 (23,0 5%) випадків, залозиста та фіброзна мастопатія — по 5 (50,0 %) випадків. У 5 (19,2 %) жінок виявлені вузлові форми мамологічної патології.
Залежно від виду мастопатії також виявлено певні особливості: ДФМ найчастіше (60,0 %) визначалася у жінок другої групи; аденоз (або ДЗМЗ) у жінок із загрозою переривання вагітності — 36,8 %. Вузлова патологія частіше була виявлена у жінок першої та третьої груп.
Звертає на себе увагу кількість виявлених незмінених лімфатичних вузлів у 23 (26,4 %) жінок з РРВ, що потребує додаткового обстеження та осмислення порівняно з мікробіологічними, імунологічними та цитологічними даними виділень із МЗ у зв’язку з первинним бактеріальним фактором ушкодження [30, 31].
Структура МЗ представлена пластом залозистої тканини середньої ехогенності, на тлі якої визначаються молочні протоки, що в нормі розширені лише у вагітних та лактуючих жінок, шар премамарної жирової клітковини незначний. Ехографічними проявами мастопатії МЗ є кісти або розширені протоки (у нелактуючих жінок), гіперплазія залозистої тканини, що можна розцінити як кістозний, фіброзний, залозистий або змішаний вид мастопатії [9]. З метою об’єктивізації даних УЗД була використана методика вимірювання товщини шару залозистої тканини і показників її ехощільності. Всім пацієнткам проводилось вимірювання товщини залозистого шару в кожному секторі МЗ в напрямку радіальних ліній, які збираються в центрі соска, у місцях його найбільшої товщини. Слід зазначити, що ультразвукове зображення МЗ в різні вікові періоди змінюється. В нормі у здорових жінок (без клінічних проявів захворювань МЗ) спостерігається відповідність між УЗ–типом будови молочних залоз, товщиною залозистого шару, показником ехощільності і віком. Так, із віком виявляється тенденція до зменшення товщини залозистого шару, у той час як показники ехощільності зростають до максимальних значень. Отже, за показниками ехографії, нормальною МЗ можна називати ту, у якій збережена гармонія між фіброзною й залозистою тканиною і є фізіологічна відповідність віку. У нормальній молочній залозі товщина шару залозистої тканини не повинна перевищувати 14 мм, а показники ехощільності повинні відповідати віку. При аналізі ехографічних показників звертають на себе увагу більш високі показники товщини шару залозистої тканини у жінок із доброякісними дисплазіями молочних залоз (ДДМЗ), що корелює з підвищенням мамо– графічної щільності. При цьому вищі показники ехощільності відзначалися у жінок із фіброзними формами ДДМЗ. Таким чином, для жінок із дифузними формами ДЗМЗ характерним є підвищення рівня не тільки мамографічної щільності, але й ехощільності, особливо при переважанні фіброзних змін у МЗ. Найбільші показники товщини залозистого шару характерні для аденозних гіперпла–зій МЗ.
При порівнянні строків, що минули після останньої вагітності, зі станом МЗ встановлено, що в жінок, у яких минуло більше одного року після останньої вагітності, у 56,3 % випадків виявлені ДЗМЗ, у яких минув 1 рік — у 25 %, у яких обстежували МЗ під час госпіталізації з приводу репродуктивної втрати — у 18,8 % випадків визначалась мастопатія. Галакторея в обстежених жінок визначалась у 25 (27,3 %) випадках.
Головним клінічним проявом ДЗМЗ був біль або больові відчуття в МЗ, що посилювались за декілька днів до менструації і припинялися або зменшувалися після її закінчення. Біль мав різну інтенсивність і характер із поширенням в пахвову впадину, плече, лопатку в частини хворих. Одним із проявів захворювання був синдром передменструальної напруги, що виражався в нагрубанні залоз, збільшенні кровонаповнення, появі ущільнень у МЗ в лютеїнову фазу менструального циклу. У першій групі він траплявся у 18 (40,9 %), у третій — у 5 (30,8 %), у четвертій — у 12 (47,6 %) обстежених.
Жінки, які при госпіталізації мали вагітність, що не розвивається, самовільні викидні, вказували на помірний біль у 35 % випадків, ще в 65 % — незначний біль, але його зникнення в більшості випадків свідчило про відсутність прогресування вагітності.
Високий інфекційний та алергічний індекс до певної міри відображає стан імунної системи. Високий показник інфекційних захворювань впливає на процес становлення центрів регуляції функції репродуктивної системи, що викликає розлади менструального циклу, репродуктивної функції й розвиток нейроендокринних захворювань. Структура соматичної патології та її рівень за окремими класами хвороб вірогідно не відрізнялись між групами. Із цього випливає, що у всіх обстежених жінок був несприятливий преморбідний фон. На дитячі інфекційні захворювання (вітряна віспа, інфекційний паротит, кір, скарлатина, коклюш) хворіли 65 % пацієнток. При аналізі соматичної патології у жінок виявлено, що частіше за все траплялися хвороби органів кровообігу (31,1 %), дихання (25,3 %), нирок (18,6 %), органів травлення (22,6 %).
Дані літератури свідчать, що у 25 % жінок із мастопатією спостерігаються гепатит та холецистит. Захворювання печінки відіграють суттєву роль у виникненні патології молочних залоз і часто супроводжуються розвитком хронічної гіперестрогенії внаслідок повільної утилізації естрогенів у печінці, що призводить до розвитку гіперпластичних процесів у молочних залозах [16].
Звертає на себе увагу висока частота супутньої тиреоїдної патології, що виявлена в 70 (34,5 %) пацієнток при проведенні УЗД у жінок із РРВ (табл. 3).
При подальшому лабораторному обстеженні з визначенням гормонів підтверджена тиреоїдна патологія, що частіше траплялася в першій групі із загрозою переривання вагітності та в четвертій групі — із трубною вагітністю. Рідше патологія ЩЗ спостерігалася при мимовільних викиднях (лише 2 випадки вузлового зоба) та при завмерлих вагітностях: 2 вузлових зоби та 3 випадки тиреоїдиту. У 26 (37,1 %) жінок виявлені сонографічні ознаки тиреоїдиту та у 19 (27,1 %) — вузлового зоба. У 10 (14,3 %) виявлено дифузний зоб, що частіше траплявся при трубній вагітності, а у 15 (21,4 %) пацієнток виявлені кісти. Отримані результати узгоджуються з даними літератури [7], що підтверджує роль тиреоїдної дисфункції та йодного дефіциту в патогенезі ДДМЗ.
Становить інтерес той факт, що серед тиреоїдної патології було виявлено дуже незначну кількість тиреотоксикозу, що не збігається з літературними даними [11]. Проведені дослідження свідчать, що жінки з порушеною репродуктивною функцією на тлі ранніх репродуктивних втрат становлять групу з високою частотою тиреоїдної патології та значним ризиком виникнення дисгормональних захворювань МЗ, що потребує подальшого вивчення з метою диференційованого підходу до лікування репродуктивних порушень та профілактики мамологічної патології. Отже, значна частота патології ЩЗ та МЗ свідчить про єдині патогенетичні механізми органів–мішеней; необхідність проведення скринінгових мамографічних обстежень для формування груп ризику та виявлення мамологічної та тиреоїдної патології у жінок із РРВ; підбір лікувальних схем та визначення лікувальної тактики при різноманітних РРВ повинен проводитися при зіставленні результату терапії та ступеня ризику можливих ускладнень із боку МЗ з урахуванням верифікованої патології.
Сонографія МЗ та ЩЗ є методом вибору при скринінговому обстеженні жінок із РРВ репродуктивного віку.
Доцільне подальше вивчення механізмів формування поєднаної патології МЗ та ЩЗ у жінок із нереалізованими вагітностями для розробки патогенетично обумовлених методів лікування та скринінгових програм обстеження пацієнток з обтяженим репродуктивним анамнезом та поєднанням тиреоїдної та мамологічної патологій.
Висновки
1. Частота виявлення патології ЩЗ у жінок із ранніми репродуктивними втратами в поєднанні з доброякісними дисплазіями молочних залоз становила 27 випадків (13,3 %). ДДМЗ виявлені в 91 (44,6 %) жінки, а патологія ЩЗ — у 70 (34,5 %).
2. Вираженість клінічних проявів ДДМЗ збільшується залежно від кількості нереалізованих вагітностей та гормонального дисбалансу, обумовленого патологією ЩЗ.
3. Характер структурних змін у тканині МЗ при ДЗМЗ залежить від виду супутньої тиреоїдної патології.
4. Характер структурних змін у тканині МЗ та ступінь проявів мастопатії залежать від функціонального стану ЩЗ, обумовленого тиреоїдною патологією, гінекологічною основною патологією та кількістю репродуктивних втрат (нереалізованих вагітностей).
1. Радзинский В.Е. Неразвивающаяся беременность / В.Е. Радзинский, В.И. Димитрова, И.Ю. Майскова. — М.: Гэотар–Медиа, 2009. — 200 с.
2. Летягин В.П. Первичные опухоли молочной железы. Практическое руководство по лечению / Летягин В.П. — М.: Миклош, 2004. — 332 с.
3. Корнацька А.Г., Дубенко О.Д. Оптимизация комплексной современной терапии у женщин с трубно–перитонеальным бесплодием и доброкачественной дисплазией молочних желез // Здоровье женщины. — 2001. — № 1(37). — С. 43–48.
4. Ильин А.Б. Диагностика и лечение доброкачественных заболеваний молочных желез / Ильин А.Б., Цвелев Ю.В., Аболшен В.Г. — СПб., 2005. — С. 19–20.
5. Пашковська Н.В. Захворювання щитоподібної залози і вагітність / Н.В. Пашковська // Міжнародний ендокринологічний журнал. — 2012. — № 8 (48). — С. 53–61.
6. Пасєчко Н.В. Порушення репродуктивної функції жінки на тлі дисфункції щитоподібної залози / Н.В. Пасєчко, С.В. Гнат // Міжнародний ендокринологічний журнал. — 2014. — № 4 (60). — С. 97–102.
7. Russo J.J. In the progress in the management of the menopause / Russo J.J., Russo I.H. — Parthenon Publist, 1996. — 193 р.
8. Поликарпов А.Ф. Влияние щитовидной железы на развитие мастопатии. — М., 2003. — С. 267–268.
9. Ильин А.Б. Молочная железа как орган репродуктивной системы женщины / Ильин А.Б., Бескровный С.В. // Акушерство и женские болезни. — 2000. — № 2. — С. 54–57.
10. Манухин И.Б. Клинические лекции по гинекологической эндокринологии / Манухин И.Б., Тумилович Л.Г., Геворкян М.А. — М.: МИА, 2001. — С. 26–31.
11. Титенко Т.М. Функциональное состояние тиреоидной и репродуктивной системы при миоме матки // Репродуктивное здоровье женщины. — 2008. — № 4 (38). — С. 189–190.
12. Давыдова Ю.В. Эффективность прегравидарной подготовки у женщин с диффузным нетоксическим зобом / Ю.В. Давыдова, Л.М. Булик, И.В. Сидорова, Т.В. Волошина // Здоровье женщины. — 2010. — № 3 (49). — С. 198–201.
13. Основи репродуктивної медицини: Практичний посібник / Под ред. В.К. Чайки. — Донецк: Лавис, 2011. — 896 с.
14. Базисная и клиническая эндокринология / Дэвид Гарднер, Долорес Шобек / Пер. с англ. под ред. Г.А. Мельниченко. — М.: БИНОМ, 2011. — 695 с.
15. Харченко В.П. Клиническая маммология / В.П. Харченко, Н.И. Рожкова (Тематический сборник). — 2005. — 28 с.
16. Бурдина Л.М. Диагностика и лечение доброкачественных патологических изменений молочных желез / Л.М. Бурдина // Терапевтический архив. — 1998. — № 10. — С. 37–41.
17. Хасанов Р.Ш. Мастопатия / Хасанов Р.Ш., Гилязутдинов И.А. — Казань, 2006. — 234 с.
18. Татарчук Т.Ф. Дисгормональные заболевания молочных желез в практике гинеколога–эндокринолога / Татарчук Т.Ф., Ефименко О.А., Рось Н.В. — К., 2003.

/112/112.jpg)
/113/113.jpg)