Международный эндокринологический журнал 1 (65) 2015
Вернуться к номеру
Случай сочетания гипоплазии гипофиза и ахондроплазии у шестилетнего мальчика
Авторы: Ходжаева Ф.С., Урманова Ю.М., Рихсиева Н.Т. - Ташкентский педиатрический медицинский институт;
Республиканский специализированный научно-практический медицинский центр эндокринологии МЗ РУз, г. Ташкент, Республика Узбекистан
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Описан случай сочетания ахондроплазии и гипоплазии гипофиза у мальчика 6 лет. Пациентам с ахондроплазией рекомендовано проведение магнитно-резонансной томографии гипофиза с целью выявления его возможной гипо- или аплазии. При наличии гипопитуитаризма у пациентов с ахондроплазией необходима соответствующая заместительная гормональная терапия.
Описаний випадок поєднання ахондроплазії і гіпоплазії гіпофіза у хлопчика 6 років. Пацієнтам з ахондроплазією рекомендовано проведення магнітно-резонансної томографії гіпофіза з метою виявлення його можливої гіпо- або аплазії. При наявності гіпопітуїтаризму в пацієнтів з ахондроплазією необхідна відповідна замісна гормональна терапія.
A case of achondroplasia combined with pituitary hypoplasia in 6-year-old boy is described. It is recommended to carry out magnetic resonance imaging of hypophysis in patients with achondroplasia to identify its possible hypo- or aplasia. In the presence of hypopituitarism in patients with achondroplasia, it is necessary to carry out appropriate hormone replacement therapy.
ахондроплазия, гипоплазия гипофиза, близкородственный брак.
ахондроплазія, гіпоплазія гіпофіза, близькородинний шлюб.
achondroplasia, pituitary hypoplasia, consanguineous marriage.
Статья опубликована на с. 127-130
Ахондроплазия (диафизарная аплазия, болезнь Парро — Мари, врожденная хондродистрофия) — известное с древности наследственное заболевание человека, проявляющееся нарушением процессов энхондрального окостенения (вероятно, в результате дефектов окислительного фосфорилирования) на фоне нормального эпостального и периостального окостенения, что ведет к карликовости за счет недоразвития длинных костей. Ахондроплазия характеризуется наличием врожденных аномалий, в частности врожденного стеноза позвоночного канала. Заболевание наследуется по аутосомно–доминантному типу [1, 2].
Возросший в последние 20 лет интерес к давно известному ортопедам, рентгенологам, морфологам, генетикам наследственному заболеванию с преимущественным поражением костной системы — ахондроплазии обусловлен главным образом появившейся возможностью проводить эффективное симптоматическое ортопедическое лечение данных больных. Хирургическое лечение направлено на исправление деформаций костей, удлинение конечностей и восстановление пропорций тела [3–6].
Ахондроплазия относится к числу наследственных заболеваний с невыясненным первичным биохимическим дефектом. Подавляющее большинство моногенных наследственных болезней связано с неизвестным первичным биохимическим дефектом. Для многих из них установлены те или иные обменные нарушения в организме на уровне патологических метаболитов, однако остается неясным место обнаруживаемых биохимических отклонений в патогенезе болезни или последовательность отклонений. В других случаях нет никаких сведений о биохимических отклонениях в организме. Это дает основания надеяться на раскрытие в будущем биохимической основы многих мутаций, которые пока описываются на уровне клинических и патологоанатомических проявлений. К ним прежде всего относятся муковисцидоз, прогрессирующие мышечные дистрофии и ахондроплазия [7, 8].
Из–за сниженной способности больных иметь потомство в 80–95 % случаев ахондроплазия связана с заново возникающими мутациями [9, 10].
Как большинство доминантных мутаций, ахондроплазия встречается редко. Это одна из наследственных болезней костной системы, клиническая картина ее обусловлена аномальным ростом и развитием хрящевой ткани, главным образом в эпифизах трубчатых костей и основании черепа. Хрящевые зоны этих костей могут быть гипопластичными или аномально гиперплазированными, результатом чего является резкое недоразвитие костей в длину. О биохимической природе этой формы хондродистрофий ничего не известно, если не считать сведений о различных отклонениях активности ряда ферментов, значение которых остается пока неясным [12, 13].
Патология роста костей определяет характерную клиническую картину, полностью оформляющуюся в половозрелом возрасте: низкий рост (до 120 см) при сохранении нормальной длины туловища; бугристая мозговая часть черепа, характерное лицо; сильное укорочение верхних и нижних конечностей, особенно за счет бедренной и плечевой костей, деформированных и утолщенных. Ахондроплазия зачастую сочетается с пороками психики, нулевым уровнем интеллекта и умственной отсталостью. Основа болезни — нарушение процесса окостенения на границах эпифизов и диафизов костей. Ахондроплазия представляет собой пример наследственной болезни с твердо установленным доминантным типом наследования [14, 15].
Ниже описан случай сочетания гипоплазии гипофиза и ахондроплазии у мальчика. Под нашим амбулаторным наблюдением находился мальчик С. Абдулахатов, 2008 г. рождения, проживающий в г. Самарканде. Ребенок родился в близкородственном браке (дети сестер). Рост при рождении 50 см, вес 3000 г, закричал и взял грудь сразу. Психомоторное развитие — с опозданием. Постоянно находился под наблюдением педиатра, получал массаж. Впервые обратился к эндокринологу в 2014 г. В РСНПМЦ эндокринологии МЗ РУз пациенту проводился следующий спектр исследований, включавший общеклинические, биохимические, радиоиммунологические гормональные методы исследования крови (пролактин, ИФР–1, СТГ, ТТГ, кортизол, тироксин), ЭКГ, УЗИ внутренних органов, МРТ гипофиза, рентгенография кисти и позвоночника.
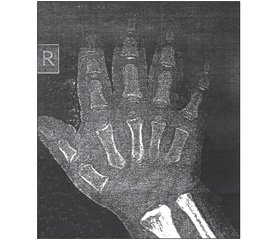
Со слов родителей, пациент жалуется на низкорослость, проблемы при ходьбе. При обследовании было установлено: рост 76,0 см, вес — 10,8 кг. Дефицит роста — 37 см, дефицит веса — 9 кг. Пубертатный статус: Ах0Рх0, testis 3,0 x 3,0 ml, penis длиной 1,0 см. Гормональные исследования: СТГ — 1,4 мМЕ/л (в норме у детей от 5 до 16 лет 2,10 ± 0,53 мМЕ/л, св. Т4 — 124 нмоль/л (60–160), ТТГ — 1,9 мМЕ/л (в норме 0,17–4,05), ИФР–1 — 101 нмоль/л. При МРТ турецкого седла (01.12.14) была обнаружена гипоплазия гипофиза: высота 0,1 см, переднезадний размер — менее 0,4, поперечник — до 0,4 см. На рентгенограмме кисти (02.12.14): костный возраст от трех до 24 мес., нарушение последовательности появления точек окостенения. Зоны роста открыты, сужены, укорочение всех фаланг пальцев. Заключение: муковисцидоз? гипохондроплазия? (рис. 1).
/128/128.jpg)
На рентгенограмме позвоночника (02.12.14) ось позвоночного столба S–образно деформирована в грудном отделе с торсией позвонков. Высота межпозвоночных пространств асимметричная. Межреберные промежутки асимметричные. Форма тел и высота позвонков не изменены. Контуры позвонков четкие. Замыкающие пластинки уплотнены. Расстояния между замыкающими пластинками не изменены. Рентгеновские углы позвонков соответствуют возрасту. Корни дуг асимметричные. Контуры дуг четкие. Кости таза и тазобедренные суставы — симметричные. Крылья подвздошных костей округлой формы, вогнутость латеральной поверхности над–ацетабулярной части тела подвздошных костей не выражена. Отмечается сращение U–образного хряща. Вертлужная впадина мелкая, крыша ее расположена косо под углом к горизонтальной плоскости справа 22, слева 22°. Контур крыши вертлужной впадины прямолинейный. Бедренные кости представлены проксимальной частью тела и основанием шейки, ядра окостенения головок не отмечаются. Наблюдается вывих обеих сторон. Заключение: S–образный сколиоз позвоночника. Дисплазия обоих тазобедренных суставов, осложненная вывихом бедренных костей с обеих сторон.
На рис. 2 дана схема родословной пациента.
В табл. 1 приводятся результаты оценки физического развития ребенка.
На основании вышеизложенного был выставлен клинический диагноз: ахондроплазия (основной диагноз). Гипоплазия гипофиза (сопутствующий диагноз). Задержка роста и скелетного развития. S–образный сколиоз позвоночника. Дисплазия обоих тазобедренных суставов, осложненная вывихом бедренных костей с обеих сторон (осложнения).
Пациенту было рекомендовано проведение заместительной гормональной терапии: левотироксин 50 мкг/сут, генно–инженерный гормон роста, препараты кальция, витамина D3.
Пациенту была также рекомендована консультация и лечение у ортопеда.
Благодаря прогрессу медицинской генетики и расширению представлений о характере наследования всевозможных заболеваний и влиянии факторов внешней среды на проявляемость мутантных генов, стали намного яснее пути лечения, а самое главное — профилактика наследственных заболеваний. Основные принципы лечения: исключение или ограничение продуктов, превращение которых в организме в отсутствие необходимого фермента приводит к патологическому состоянию; терапия замещения дефицитным в организме ферментом или нормальным конечным продуктом искаженной реакции; индукция дефицитных ферментов. Большое значение придается фактору своевременности терапии [16].
Терапию необходимо начинать еще до развития у больного выраженных нарушений в тех случаях, когда больной рождается еще фенотипически нормальным. Некоторые биохимические дефекты могут частично компенсироваться с возрастом или в результате вмешательства. В перспективе большие надежды возлагаются на генную инженерию, под которой подразумевается направленное вмешательство в структуру и функционирование генетического аппарата — удаление или исправление мутантных генов, замена их нормальными. Однако важнейшей задачей медицинской генетики остается профилактика наследственных заболеваний, своевременное предупреждение появления на свет больных детей. Профилактика наследственных заболеваний осуществляется в основном через медико–генетические консультации и областные диагностические центры.
Выводы
Пациентам с ахондроплазией рекомендовано проведение МРТ гипофиза с целью выявления возможной гипо– или аплазии гипофиза. При наличии гипопитуитаризма у пациентов с ахондроплазией необходима соответствующая заместительная гормональная терапия.
1. Ахондроплазия: Руководство для врачей / Под ред. А.В. Попкова, В.И. Шевцова. — М.: Медицина, 2001. — 352 с.
2. Илизаров Г.А. Некоторые вопросы теории и практики компрессионного и дистракционного остеосинтеза // Чрес–костный компрессионный и дистракционный остеосинтез: сб. науч. работ. — Курган, 1972. — Вып. 1. — С. 5–33.
3. Ильина В.К. Медико–генетическое консультирование при наследственных заболеваниях скелета / В.К. Ильина // Вестник травматологии и ортопедии. — 2000. — № 3. — С. 65–69.
4. Каттанео Р. Первые опыты в Италии по удлинению при ахондроплазии по методу Илизарова / Р. Каттанео, А. Вилла // Чрескостный остеосинтез в ортопедии: Материалы Всесоюз. симпоз. — Курган, 1983. — С. 198–201.
5. Новиков И. Актуальные вопросы лучевой диагностики в травматологии, ортопедии и смежных дисциплинах: Материалы Всерос. науч.–практ. конф. — Курган, 2003. — С. 52–53.
6. Козлова С.И. Наследственные симптомы и медико–генетическое консультирование. — М.: Медицина, 1988. — 218 с.
7. Королюк И.П. Рентгеноанатомический атлас скелета (норма, варианты, ошибки интерпретации). — М.: Видар, 1996. — 192 с.
8. Aldegheri R. Femoral callotasis // J. Pediatr. Orthop. — 1997. — Vol. 6, № 1. — P. 42–47.
9. Boor R. Abnormal subcortical somatosensory evoked potentials indicate high cervical myelopathy in achondroplasia // Eur. J. Pediatr. — 1999. — Vol. 158, № 8. — P. 662–667.
10. Mueller S.M. Achondroplasia and hydrocephalus. A computerized tomographic, roentgenographic, and psychometric study // Neurology. — 1977. — Vol. 27, № 5. — P. 430–434.
11. Oberklaid F. Achondroplasia and hypochondroplasia. Comments on frequency, mutation rate and radiological features in skull and spine // J. Med. Genet. — 1979. — Vol. 16, № 2. — P. 140–144.
12. Hamamci N. Achondroplasia and spinal cord lesion. Three case reports // Paraplegia. — 1993. — Vol. 31, № 6. — P. 375–379.
13. Tanaka K. Callus formation in femur and tibia during leg lengthening: 7 patients examined with DXA // Acta Orthop. Scand. — 1996. — Vol. 67, № 2. — P. 158–160.
14. Ong J.S. Case report: renal osteodystrophy in association with spinal stenosis in achondroplasia // Ir. J. Med. Sci. — 1996. — Vol. 165, № 3. — P. 155–156.
15. Prinster C. Diagnosis of hypochondroplasia: the role of radiological interpretation. Italian Study Group for Hypochondroplasia // Pediatr. Radiol. — 2001. — Vol. 31, № 3. — P. 203–208.
16. Shotelersuk V. Clinical and molecular characteristics of Thai patients with achondroplasia // Southeast. Asian. J. Trop. Med. Public. Health. — 2001. — Vol. 32, № 2. — P. 429–433.

/129/129.jpg)