Журнал «Боль. Суставы. Позвоночник» 1 (17) 2015
Вернуться к номеру
Вертеброгенний і суглобовий больовий синдром. Сучасна проблематика з позицій доказової медицини
Авторы: Колосова Т.В., Головченко Ю.І., Асауленко Є.І., Насонова Т.І. — НМАПО ім. П.Л. Шупика, кафедра неврології № 1, м. Київ
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 33-37
Незважаючи на значні досягнення в альгології, у практичній охороні здоров’я актуальними залишаються проблеми адекватного лікування больового синдрому. З позицій доказової медицини найбільш ефективними знеболювальними препаратами при ноцицептивних (гострих) і змішаних больових синдромах (поєднання гострих і хронічних болів) є нестероїдні протизапальні засоби (НПЗЗ). Механізм дії НПЗЗ пов’язаний з пригніченням одного з основних ферментів у каскаді біохімічних реакцій арахідонової кислоти — циклооксигенази (ЦОГ), у результаті чого різко знижується утворення простагландинів, що беруть участь в активації процесів запалення (синтезі медіаторів запалення, альгогенів).
Однак використання НПЗЗ спричиняє ряд побічних реакцій (ПР), що зустрічаються приблизно у 25 % випадків. При цьому в спектрі ПР переважають ураження шлунково-кишкового тракту (ШКТ), так звані НПЗЗ-гастропатії, що зустрічаються значно частіше в осіб літнього й старечого віку, їх частота варіює від 42 до 52,5 % (Дзяк Г.В. і співавт., 1999; Насонов Е.Л., 1996; Свінціцький А.С. і співавт., 2004; Champion G.D. et al., 1997). Тому застосування НПЗЗ обмежене не тільки відомими абсолютними протипоказаннями, а й рядом факторів ризику, поєднання яких також провокує розвиток серйозних ускладнень, у першу чергу з боку ШКТ.
Фактори ризику шлунково-кишкових ускладнень, пов’язаних із прийомом НПЗЗ (адаптовано за Henri D. et al., 1996) [12]
Фактори ризику, пов’язані зі станом пацієнтів:
— вік понад 60 років;
— виразкова хвороба в анамнезі.
Фактори ризику, пов’язані з прийомом препаратів:
— прийом відносно токсичних НПЗЗ;
— високі дози НПЗЗ (або прийом двох препаратів одночасно);
— одночасний прийом антикоагулянтів;
— одночасний прийом кортикостероїдів.
Імовірні фактори ризику:
— тривалий прийом НПЗЗ;
— жіноча стать;
— серцево-судинна патологія;
— інфекція, викликана Helicobacter pylori;
— паління;
— уживання алкоголю.
На підставі багаторічного досвіду застосування НПЗЗ розроблені заходи щодо покращання переносимості препаратів цієї групи, що включають: 1) поєднання терапії НПЗЗ з одночасним призначенням препаратів, що забезпечують цитопротекцію слизової ШКТ, — інгібіторів протонної помпи (омепразол); 2) використання селективних інгібіторів ЦОГ-2; 3) зміну тактики терапії НПЗЗ, а саме призначення малих доз на початку лікування або зниження дози при досягненні анальгетичного ефекту; використання кишковорозчинних форм препарату, проліків.
При призначенні коротких курсів запропоновані заходи дозволяють досягти бажаних результатів. Однак при тривалому застосуванні терапії НПЗЗ побічним ефектам не вдається запобігти, тому що НПЗЗ-гастропатія обумовлена системною реакцією організму на введення препарату (пригнічення ізоферменту ЦОГ-1).
Не випадково дедалі більший інтерес клініцистів викликає місцева терапія. Препарати топічної дії, проникаючи крізь шкірні покриви, здійснюють тільки локальний ефект у периферичних тканинах (зокрема, впливають на периферичні ноцицептори); їх концентрація в крові не досягає рівня, вимірюваного лабораторними тестами, вони не мають системних побічних ефектів; крім того, не вступають у реакції лікарської взаємодії (Новиков А.В., Яхно Н.Н., 2006). За даними ряду авторів, біодоступність місцевих НПЗЗ коливається в межах 5–10 % від аналогічного показника при їх системному застосуванні.
Ефективність місцевої терапії болю, зокрема терапії НПЗЗ, доведена багаторічною клінічною практикою. Найбільш масштабним є кількісний систематичний огляд R. Moore, M.R. Tramèr, D. Carroll et al. [13], що включав 86 рандомізованих контрольованих досліджень за участю 10160 пацієнтів. На підставі отриманих даних був зроблений висновок про ефективність місцевого застосування НПЗЗ у лікуванні гострого й хронічного болю. При цьому як локальні, так і системні побічні ефекти виникали вкрай рідко й були на рівні з такими плацебо-терапії. У метааналізі, виконаному Кокранівським співробітництвом (Derry S. et al., 2012), що включав 34 дослідження за участю 7688 пацієнтів із захворюваннями опорно-рухового апарату в стадії загострення, був підтверджений добрий знеболювальний ефект місцевої терапії НПЗЗ, зіставний із таким системних НПЗЗ, але без властивих їм гастроінтестинальних побічних ефектів. Відповідно до сучасних рекомендацій Європейської ліги проти ревматизму (EULAR) і Міжнародного товариства із вивчення остеоартрозу (OARSI) топічні НПЗЗ мають переваги порівняно з пероральними НПЗЗ при використанні в пацієнтів із легким і середньотяжким остеоартрозом із залученням невеликої кількості суглобів і/або в осіб із гіперчутливістю до пероральних НПЗЗ в анамнезі.
Таким чином, при гострому та хронічному суглобовому болі при остеоартриті, вертеброгенному больовому синдромі, тендиніті, бурситі, травмах опорно-рухового апарату (удари, вивихи, розтягнення м’язів і сухожиль тощо) ефективність локальних НПЗЗ можна вважати доведеною. Рутинне застосування локальних НПЗЗ дозволяє ефективно усувати місцевий больовий синдром і запалення, а у випадку комбінування із системною терапією НПЗЗ — значно підвищити ефективність лікування без шкоди для показників безпеки.
Останніми роками розроблені спеціальні вимоги щодо місцевого застосування препаратів:
— використовувати НПЗЗ із доведеною високою протизапальною й знеболювальною ефективністю;
— ураховувати концентрацію діючої речовини в даній лікарській формі;
— призначати оптимальну терапевтичну дозу, що забезпечує аналгетичний і протизапальний ефект. Низька концентрація активної речовини, слабке накопичення в зоні запалення визначають необхідність багаторазового нанесення препарату на уражену ділянку протягом доби. Численні клінічні дослідження (Чичасова Н.В., Насонов Є.Л. і співавт., 1999; Pohjolainen T., Jekunen A., Autio L. et al., 2000; Kinkade S., 2007; Rossignol M., Arsenault B., Dione C. et al., 2007) продемонстрували, що мінімальним є 4-разове нанесення місцевого засобу упродовж дня, а при активному запаленні, що супроводжується вираженим больовим синдромом, кратність може збільшуватися до 6 разів на добу. Кількість препарату, що наносять на суглоб, залежить від його величини: на ділянки великих суглобів (колінний, плечовий) однократно слід наносити смужку мазі або гелю довжиною від 5 до 10 см, на ділянку середніх суглобів (гомілковоступньовий, променево-зап’ястковий, ліктьовий) — від 3 до 5 см, на ділянку малих суглобів кистей і ступнів — 1–2 см;
— ураховувати стан шкіри в ділянці застосування засобу для місцевої терапії. За даними Е.С. Цвєткової, З.С. Алекберової і співавт. (1994), в осіб літнього віку проникність шкіри знижується, що служить підставою для збільшення кількості препарату, що наноситься на шкіру, або для збільшення кратності нанесення препарату.
Найбільш ефективною формою для протизапальної локальної терапії є гель. Наявність спиртових розчинників, використовуваних при виготовленні гелю, забезпечує швидке всмоктування лікарського засобу в шкіру. Застосування гелю є більш гігієнічним, ніж застосування мазей або кремів, економним, тому що максимальна кількість препарату, що наноситься, проникає крізь шкірний бар’єр. Крім того, до складу деяких гелів входять речовини, що забезпечують проведення діючої речовини крізь дерму й підлеглі тканини. До таких препаратів, зокрема, належить Фастум гель.
Ефективними препаратами визнані мазі й гелі, що містять кетопрофен, ібупрофен, піроксикам (Шостак Н.А., Шеметов Д.А., Клименко А.А., 2006). Надзвичайно важливими є дані про порівнянну ефективність різних місцевих НПЗЗ. Це питання досліджувалося у двох метааналізах, результати яких наведені на рис. 1. Як показник для оцінки протибольової ефективності був обраний індекс NNT (number needed to treat — число тих, хто потребує лікування), уведений у науково-дослідну практику більше десяти років тому завдяки його інтегральності й зручності застосування (Zapletal E., LeMaitre D. еt al., 1996). Індекс NNT обернено пропорційно пов’язаний з ефективністю: чим він менший, тим вища ефективність.
Як засвідчують дані масштабних метааналізів, найвищу протибольову ефективність демонструє місцева форма кетопрофену (NNT = 2,6). Цей показник на 58 % кращий, ніж в ібупрофену, на 80 % кращий, ніж у піроксикаму (NNT = 4,7), і майже вдвічі кращий (на 92 %), ніж у диклофенаку (NNT = 5,0).
У даний час кетопрофен — широко використовуваний у клінічній практиці НПЗЗ, що показав високу ефективність і добру переносимість у лікуванні гострого й хронічного болю як ревматичного, так і травматичного походження, а також в усуненні післяопераційного больового синдрому. Як і в інших НПЗЗ, механізм дії кетопрофену заснований на пригніченні метаболізму арахідонової кислоти. Кетопрофен — один із найбільш потужних інгібіторів циклооксигенази (Carabaza et al., 1996). Пригнічення ЦОГ і, відповідно, синтезу простагландинів забезпечує протизапальний й знеболюючий ефект кетопрофену місцевої дії. Крім того, кетопрофен — потужний інгібітор брадикініну, важливого медіатора болю й запалення. Також препарат стабілізує мембрани лізосом і тим самим запобігає їх осмотичному ушкодженню, що перешкоджає вивільненню лізосомальних ферментів, які опосередковують руйнування тканин при запальних реакціях.
Є докази того, що переваги кетопрофену місцевої дії обумовлені не тільки силою активної молекули, а й кращою здатністю даного НПЗЗ до проникнення в тканини суглобів і навколосуглобові структури, тобто в зону прикладання лікувальних властивостей. Так, у дослідженні C.M. Vincent et al. (1999) було порівняно декілька локальних форм НПЗЗ щодо швидкості дифузії через шкірні покриви в моделі.
Як видно з рис. 2, двопроцентна дифузія активної речовини досягається для місцевої форми кетопрофену через 4 години після нанесення на шкіру, для піроксикаму — через 11 годин, а для диклофенаку — через 23 години. Відповідно, швидкість пенетрації кетопрофену майже в 6 разів більша, ніж у диклофенаку гелю (23 проти 4). Препаратом кетопрофену, що використовувався в дослідженні, був Фастум гель виробництва компанії «Берлін-Хемі».
Загальний відсоток дифузії був максимальним у кетопрофену (Фастум гель). Через 24 години після нанесення на шкіру він становив 8 % проти 6 % для піроксикаму й 2,13 % для диклофенаку. Таким чином, загальний об’єм дифузії кетопрофену Фастум гель майже в 4 рази вищий, ніж у диклофенаку у формі гелю (8 % проти 2,13 %) (рис. 2).
/36/36.jpg)
В іншому дослідженні, виконаному японськими вченими, отримані аналогічні дані (Komatsu T., Sakurada T., 2012). Автори порівнювали протизапальну ефективність і шкірну проникність восьми нестероїдних протизапальних препаратів для місцевого застосування: кетопрофену, диклофенаку, флурбіпрофену й піроксикаму у формі пластиру і кетопрофену, диклофенаку, піроксикаму, ібупрофену у формі гелю. Протизапальна дія цих НПЗЗ оцінювалося на моделях гострого й хронічного запалення у щурів. За результатами дослідження кетопрофен продемонстрував найбільш потужний протизапальний ефект і високу проникність крізь шкіру порівняно з іншими НПЗЗ у формі пластиру і гелю. Це дозволило припустити, що найбільш потужна протизапальна активність і знеболювальна дія кетопрофену пов’язані у тому числі із кращим проникненням крізь шкіру.
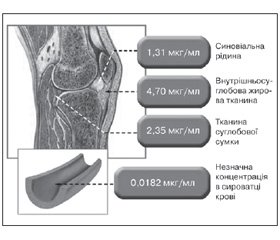
Від дифузії локальної форми препарату крізь шкіру також може залежати і його концентрація в плазмі крові, що, у свою чергу, повинно вплинути на ймовірність виникнення системних побічних ефектів. Тому з клінічної точки зору важливо розуміти, як розподіляється добре пенетруючий кетопрофен у тканинах і в системному кровотоку. Фармакокінетичне дослідження R. Ballerini et al. (1986) показало, що кетопрофен Фастум гель переважно накопичується в тканинах суглобів, де його концентрація до 258 разів перевищує сироваткову (рис. 3).
/36/36.jpg)
Препарат наносили на шкіру в ділянці колінного суглоба один раз на добу протягом трьох днів тим пацієнтам, у яких було заплановане хірургічне втручання. Концентрацію препарату в тканинах суглоба визначали інтраопераційно за допомогою високоефективної рідинної хроматографії. Концентрацію кетопрофену в плазмі крові контролювали в динаміці. Через 2 години після нанесення на шкіру концентрація кетопрофену в плазмі крові становила лише 0,0182 мкг/мл і, що важливо, залишалася постійною протягом 12 годин, у той час як препарат продовжував накопичуватися в тканинах суглоба. Таким чином, системна безпека топічного кетопрофену пояснюється його високою тропністю до тканин суглоба. Це обумовлює його селективне накопичення в суглобах і вкрай низьку концентрацію в плазмі крові при місцевому застосуванні.
Тропність кетопрофену до суглобових тканин підтверджується також у дослідженні J. Parier (1994). При внутрішньом’язовому введенні концентрація кетопрофену в синовіальній рідині порівнянна з такою при місцевому застосуванні.
Оскільки НПЗЗ має властивість накопичуватися в суглобах, важливо розуміти, наскільки він безпечний для суглобового хряща. Адже і запалення, і дегенеративні процеси при остеоартрозі самі по собі руйнують суглобовий хрящ. Тому застосування НПЗЗ із хондротоксичними властивостями (зокрема, ібупрофену або індометацину) небажане з урахуванням патогенезу цільової патології.
Хондробезпечність кетопрофену детально вивчалася нідерландськими авторами (Wilbrink B., Van der Veen M.J., Huber J., 1991). Було встановлено, що навіть в зміненому остеоартрозом суглобовому хрящі кетопрофен не впливає на синтез і вміст суглобового матриксу (протеогліканів). А в молодому хрящі препарат навіть здатний підвищувати синтез протеогліканів. Тому поряд із високою протизапальною й протибольовою ефективністю топічна форма кетопрофену як мінімум хондронейтральна, що дуже важливо при лікуванні суглобового й вертеброгенного больового синдрому.
Для виключення можливої фотосенсибілізації при застосуванні місцевого кетопрофену й протягом двох наступних тижнів пацієнту не слід піддавати оброблені ділянки шкіри впливу ультрафіолетового випромінювання (пряма інсоляція, солярій).
З огляду на наведені вище метааналізи доказової медицини, а також результати численних клінічних досліджень кетопрофен місцевої дії можна вважати препаратом вибору для ефективного й безпечного усунення запального й больового синдрому. А оскільки доступні дослідження транскутанної пенетрації й фармакокінетики проводилися на препараті Фастум гель, перевагу доцільно віддавати саме цій формі кетопрофену місцевої дії. Тому що не тільки властивості діючої речовини, але й склад, і характеристики гелю-носія радикально впливають на фармакодинаміку, фармакокінетику, ефективність і безпеку препарату. Зокрема, завдяки оригінальному складу Фастум гель створює мобільне депо препарату на шкірі, що дозволяє діючій речовині стабільно дифундувати. Відповідно до затвердженої інструкції Фастум гель може застосовуватися 1–2 рази на добу, що вигідно відрізняє його від інших препаратів, особливо у випадку призначення амбулаторним або працюючим пацієнтам.
Фастум гель може бути використаний у лікуванні больових синдромів як самостійно, так і в комплексній терапії, підсилюючи протизапальний і знеболювальний ефект НПЗЗ системної дії, що сприяє зниженню дози останніх, а отже, зменшує ймовірність ускладнень.
1. Новиков А.В., Яхно Н.Н. Невропатическая боль. Патофизиологические механизмы и принципы терапии // РМЖ. — 2006.
2. Чичасова Н.В., Насонов Е.Л., Алекберова З.С., Имаметдинова Г.Р., Каратеев Д.Е., Решетняк Т.М. Efficasy and tolerability of various ketoprophen forms in short-term and long-term treatmnt of patients with active rheumatoid arthritis // Ann. Rheum. Dis. — 1999. — 201(835). Abstract of XIV EULAR Congress.
3. Цветкова Е.С., Алекберова З.С., Балабанова Р.М., Иванова М.М., Насонов Е.Л., Чичасова Н.В. Диклонат при ревматоидном артрите // Терапевтический архив. — 1994. — № 5. — 69–72
4. Kinkade S. Evaluation and Treatment of Acute Low Back Pain // American Family Physician. — 2007. — Vol. 75, № 8. — P. 1181–1188.
5. Pohjolainen T., Jekunen A., Autio L. et al. Treatment of acute low back pain with the COX-2-selective anti-inflammatory drug nimesulide: results of a randomized, double-blind comparative trial versus ibuprofen // Spine. — 2000. — Vol. 25, № 12. — P. 1579–1585.
5. Rossignol M., Arsenault B., Dione C. et al. Clinic in low back pain in interdisciplinary practice (CLIP) guidelines. — Montreal: Direction de sante publique, Agence de la sante et des services sociaux de Montreal, 2007. — 41 р.
6. Zapletal E., LeMaitre D., Menard J. and Degoulet P. The Number Needed to Treat: a clinically useful nomogram in its proper context // BMJ. — 1996. — 312. — 426–9.
7. Vincent C.M. et al. // Arzneim. Forsch. Drug Res. — 1999. — 48. — 509–513.
8. Komatsu T., Sakurada T. Comparison of the efficacy and skin permeability of topical NSAID preparations used in Europe // Eur. J. Pharm. Sci. — 2012 Dec. — 18, 47(5). — 890–5.
9. Wilbrink B., Van der Veen M.J., Huber J., Van Roy J.L., Huber-Bruning O. In vitro influence of ketoprofen on the proteoglycan metabolism of human normal and osteoarthritis cartilage // Agents Actions. — 1991 Mar. — 32(3–4). — 154–9.
10. http://www.ncbi.nlm.nih.gov/pubmed/22972108
11. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2665568
12. Поворознюк В.В., Шеремет О.Б., Красий В.В. Нестероидные противовоспалительные препараты в лечении заболеваний костно-мышечной системы у людей различного возраста // Здоров’я України. — 2006.
13. Moore R., Tramèr M.R., Carroll D. et al. Quantitative systematic review of topically applied non-steroidal anti-inflammatory drugs // BMJ. — 1998 Jan 31. — 316(7128). — 333–338.
14. Mason L., Moore R.А., Edwards J.Е., Derry S., McQuay H. Topical NSAIDs for acute pain: a meta-analysis // BMC Family Practice. — 2004. — 5. — 10.
15. Derry S., Moore R.A., Rabbie R. Topical NSAIDs for chronic musculoskeletal pain in adults. Published in the Cochrane Library 2012, Issue 9.

/35/35.jpg)