Международный эндокринологический журнал 2 (66) 2015
Вернуться к номеру
Якісний і кількісний склад мікробіоти вмісту порожнини товстої кишки у пацієнтів із цукровим діабетом 1-го типу, хворих на хронічний гнійний гайморит
Авторы: Мазур О.О., Пашковська Н.В., Левицька С.А., Плаксивий О.Г., Калуцький І.В., Яковець К.І., Сапунков О.Д. – Буковинський державний медичний університет, м. Чернівці
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Проведено дослідження якісного та кількісного складу мікробіоти вмісту порожнини товстої кишки у 50 хворих на цукровий діабет (ЦД) 1-го типу та 47 хворих на хронічний гнійний гайморит із ЦД віком від 18 до 44 років. Отримані дані свідчать про те, що у пацієнтів із хронічним гайморитом, хворих на ЦД 1-го типу, домінантними мікроорганізмами є анаеробні бактероїди та аеробні кишкові палички. За популяційним рівнем, коефіцієнтом кількісного домінування та коефіцієнтом значущості встановлено суттєвий дефіцит найважливіших за представництвом у складі товстокишкового біоценозу людини та мультифункціональною роллю у підтримці мікроекологічного гомеостазу автохтонних облігатних анаеробних бактерій роду Bifidobacterium на 41,3 % та Lactobacillus на 51,3 %. На фоні вираженого дефіциту облігатних, фізіологічно корисних у біоценозі товстої кишки біфідо- та лактобактерій зростає популяційний рівень бактероїдів на 18,8 %, пептококів — на 64,9 %, клостридій — на 88,0 %, кишкових паличок — на 28,7 %, протеїв — на 57,0 %, стафілококів — на 71,1 %, дріжджоподібних грибів роду Candida — на 92,0 %. Бактерії, що контамінують порожнину товстої кишки пацієнтів із хронічним гайморитом, хворих на ЦД 1-го типу, — патогенні (E.coli Hly+ та ентеропатогенні штами) та умовно-патогенні ентеробактерії (Enterobacter, Citrobacter, Proteus) досягають високого популяційного рівня, в основному за рахунок ЦД 1-го типу, що сприяє порушенню провідних функцій мікрофлори товстої кишки.
Одержані результати є основою для вивчення клінічного перебігу та оптимізації лікування запальних захворювань лор-органів, зокрема хронічних гнійних та гнійно-поліпозних синуїтів, у пацієнтів на ЦД 1-го типу з використання біфідо- і лактовмісних пробіотиків.
Проведено исследование качественного и количественного состава микробиоты содержимого полости толстого кишечника у 50 пациентов с сахарным диабетом (СД) 1-го типа и 47 пациентов с хроническим гнойным гайморитом и СД 1-го типа в возрасте от 18 до 44 лет. Полученные данные свидетельствуют о том, что у больных с хроническим гайморитом и СД 1-го типа доминирующими микроорганизмами являются анаэробные бактероиды и аэробные кишечные палочки. По популяционному уровню, коэффициенту количественного доминирования и коэффициенту значимости установлен существенный дефицит важнейших по представительству в составе толстокишечного биоценоза человека и мультифункциональной роли в поддержке микроэкологического гомеостаза автохтонных облигатных анаэробных бактерий рода Bifidobacterium на 41,3 % и Lactobacillus на 51,3 %. На фоне выраженного дефицита облигатных, физиологически полезных в биоценозе толстой кишки бифидо- и лактобактерий растет популяционный уровень бактероидов на 18,8 %, пептококков — на 64,9 %, клостридий — на 88,0 %, кишечных палочек — на 28,7 %, протея — на 57,0 %, стафилококков — на 71,1 %, дрожжеподобных грибов рода Candida — на 92,0 %. Бактерии, которые контаминируют полость толстой кишки пациентов с хроническим гайморитом, больных СД 1-го типа, — патогенные (E.coli Hly+ и энтеропатогенные штаммы) и условно-патогенные энтеробактерии (Enterobacter, Citrobacter, Proteus) достигают высокого популяционного уровня, в основном за счет СД 1-го типа, что способствует нарушению ведущих функций микрофлоры толстой кишки.
Полученные результаты являются основой для изучения клинического течения и оптимизации лечения воспалительных заболеваний лор-органов, в том числе хронических гнойных и гнойно-полипозных синуитов, у пациентов с СД 1-го типа с использованием бифидо- и лактосодержащих пробиотиков.
There was performed a quantitative and qualitative assay of colonic content microbiota in 50 patients with diabetes mellitus (DM) type 1 and 47 patients with chronic purulent maxillary sinusitis and DM type 1 aged from 18 to 44 years old. The obtained data confirms that anaerobiotic bacteroides and aerobiotic coliform bacterium prevail in patients with chronic purulent maxillary sinusitis and DM type 1. by population level, quantitative majority coefficient and coefficient of importance there was determined a significant deficit of autochthon obligate Bifidobacterium and Lactobacillus in 41.3 and 51.3 %, respectively, by representation in human colonic biotic community and multiple role in microecological homeostasis support. Under the significant deficit of obligate physiologically useful for colonic biotic community Bifidobacteriums and Lactobacteriums there is determined the population increase of the level of bacteroides — 18.8 %, peptococcus — 64.9 %, clostridium — 88.0 %, coliform bacterium — 28.7 %, Proteus — 57 %, staphylococcus — 71.1 %, yeast-like fungiCandida — 92.0 %. Pathogenic (E.coli Hly+ and enteropathogenis strains) and opportunistic pathogenic bacterium (Enterobacter, Citrobacter, Proteus) contaminating colonic cavity in patients with chronic purulent maxillary sinusitis and DM type 1 achieve a high population level, mostly due to diabetes mellitus type 1 promoting the impairment of main colonic microflora functions.
The obtained results could be a basis for studying a clinical course and optimization of treatment of inflammatory diseases of ear, nose, throat, including chronic purulent and purulent polypous sinusitis in patients with DM type 1 using lacto- and bifidobacteriums.
нормальна мікрофлора, товста кишка, гайморит, цукровий діабет 1-го типу.
нормальная микрофлора, толстая кишка, гайморит, сахарный диабет 1-го типа.
health biotic community, colon, sinusitis, diabetes mellitus type 1.
Статья опубликована на с. 37-42
Вступ
Значна частина (більше ніж 60 %) мікрофлори тіла людини заселяє різні відділи шлунково-кишкового тракту [9]. Товста кишка — основний резервуар мікробіоти людини загалом та травного тракту зокрема. Склад нормальної мікрофлори товстої кишки надзвичайно складний (17 родин, 45 родів і понад 400 видів мікроорганізмів) [1]. Водночас стабільність видового складу й фізіологічних функцій підтримується складними механізмами симбіозу з мікроорганізмами, який сформувався у процесі тривалої адаптації спільного існування у вигляді єдиної екологічної системи [4].
У будь-якому біоценозі, зокрема в товстій кишці, завжди домінують «характеристичні» групи мікроорганізмів, кількість видів яких невелика, але у кількісному відношенні вони становлять основу біоценозу [6]. Це представники автохтонної облігатної (домінантної, головної, індигенної, резидентної) мікрофлори, яким відведена провідна роль у підтримці симбіотичних відносин між організмом людини та її мікрофлорою, а також у регуляції міжмікробних відносин. Ця мікрофлора — ключовий складник мікробіоценозу товстої кишки [7, 8].
Головна мікрофлора товстої кишки вміщує облігатні анаеробні бактерії родів Bifidobacterium, Bacteroides, Lactobacillus, Propionibacterium, Peptostreptococcus, а також факультативнi анаеробні та аеробні бактерії роду Escherichia, Enterococcus. До додаткової мікрофлори товстої кишки належать анаеробні бактерії роду Peptococcus, Clostridium, Eubacterium, Fusobacterium i факультативні анаеробні та аеробні бактерії роду Staphylococcus, Citrobacter, Proteus, Enterobacter, Pantotea, Edwardsiella, Klebsiella та інші ентеробактерії [7].
У товстій кишці наявні також у незначній кількості бактерії родів Corynebacterium, Veillonella, Acidominococcus, Campylobacter та багатьох інших родів і видів, що належать до залишкової мікрофлори товстої кишки, яка не завжди присутня.
Фізіологічні ефекти, яких набуває мікрофлора від сукупності видів головної мікробіоти, полягають у трофічній функції, представленій симбіотним травленням, що здійснюється ферментами мікрофлори. На цьому основане енергозабезпечення клітин епітеліальних тканин людини, яке базується на утилізації в межах циклу Кребса низькомолекулярних метаболітів, у першу чергу оцтової, пропіонової, молочної та інших кислот. Крім того, мікрофлора товстої кишки виконує понад 22 важливі функції [2, 5, 6].
Цукровий діабет (ЦД) 1-го типу характеризується порушеннями різного ступеня тяжкості обміну речовин, у першу чергу вуглеводного, а також тяжкими ускладненнями [3]. Перераховане вище засвідчує необхідність вивчення якісного та кількісного складу мікрофлори товстої кишки хворих на ЦД 1-го типу з метою вдосконалення діагностики та лікувальної тактики не тільки основного захворювання, а також супутніх захворювань, зокрема запальних процесів лор-органів, у тому числі хронічних гнійних та поліпозно-гнійних синуїтів, що є однією з актуальних проблем отоларингології [3, 8].
Мета дослідження: вивчити таксономічний склад і популяційний рівень головної та додаткової мікрофлори вмісту порожнини товстої кишки хворих на хронічний гнійний гайморит (ХГГ) на тлі цукрового діабету 1-го типу.
Матеріал і методи дослідження
Бактеріологічним і мікологічним методами проведено обстеження вмісту порожнини товстої кишки у 50 хворих на ЦД 1-го типу середнього ступеня тяжкості віком від 18 до 44 років, а також у 47 пацієнтів із ЦД 1-го типу, хворих на хронічний гнійний гайморит, у яких діагноз був верифікований на основі результатів клінічних, спеціальних та параклінічних обстежень (мікробіологічних, імунологічних та ін.). Пацієнтам із хронічним гнійним гайморитом проводилася рентгенографія приносових пазух, комп’ютерна томографія, ендоскопія порожнини носа, діагностично-лікувальні пункції гайморових пазух. Серед хворих на ЦД 1-го типу було 23 (46 %) чоловіки і 27 (54 %) жінок, основну групу становили 47 хворих на хронічний гнійний гайморит (22 (46,8 %) чоловіки і 25 (53,92 %) жінок). Проби вмісту порожнини товстої кишки зі стерильної емальованої тарілки набирали із середніх порцій автоклавованим дерев’яним шпателем у стерильні, ретельно вимиті пеніцилінові флакончики приблизно 3–5 г. Забраний матеріал негайно доставляли для бактеріологічного й мікологічного дослідження у лабораторію клінічної мікробіології кафедри клінічної мікробіології, вірусології та імунології Буковинського державного медичного університету. Результати враховували тільки в тих випадках, коли термін від взяття свіжого матеріалу до його бактеріологічного дослідження був не більше двох годин.
Вміст товстої кишки у стерильних умовах зважували на стерильному вощеному папері, відбирали 0,01 г у стерильну пробірку і додавали до нього 9,9 мл стерильного фізіологічного розчину натрію хлориду, одержуючи розведення матеріалу 1 : 10 (10–1). Із цієї суміші вмісту товстої кишки готували ряд послідовних серійних десятикратних розведень від 10–2 до 10–11 у стерильному ізотонічному розчині натрію хлориду. Одразу ж із кожного розведення відбирали стерильною мікропіпеткою 0,01 мл зависі мікробів та наносили на сектори твердого оптимального для кожного роду/виду мікроба поживного середовища і рівномірно розподіляли матеріал стерильним скляним шпателем на поверхні середовища.
Посіви виставляли для росту і розмноження мікроорганізмів. Факультативні анаеробні та аеробні мікроорганізми інкубували у термостаті (температура 37 °С) протягом 24–48 годин. Облігатні анаеробні бактерії вирощували у стаціонарному анаеростаті СО2 incubator T-125 фірми ASSAB (Швеція) протягом 5–7 діб, інколи — до 14 діб. Після цього підраховували типові і не зовсім типові підозрілі колонії для кожного таксону мікроорганізмів. Із колоній одержували чисті культури облігатних і факультативних анаеробних та аеробних мікроорганізмів. Для встановлення належності бактерій до відповідного роду або виду визначали їх основні властивості. Ці властивості стосуються мікроскопічної морфології, тинкторіальних особливостей, характеру колоній і культивування, процесів обміну речовин (біохімічної характеристики). При ідентифікації бактерій використовували «Определитель бактерий Берджи» (1997) та «Изменения в таксономии и номенклатуре бактерий» (2004).
Враховуючи те, що число бактерій та дріжджоподібних грибів роду Candida на одиницю маси (грам) вмісту порожнини товстої кишки сягає мільйонів, мільярдів мікробних одиниць, для зручності викладу матеріалу і математично-статистичного опрацювання використовували десяткові логарифми кількісного показника вирощених колоній мікроорганізмів (lg КУО/мл).
Ентеробактерії вирощували на селективних середовищах Ендо, Левіна, Плоскірева, стафілококи — на кров’яному м’ясо-пептонному агарі (КМПА), середовищі Чапмена — Бериса, жовтково-сольовому МПА за Чистовичем, молочно-сольовому МПА; ентерококи — на жовчно-кров’яному МПА Бєлєнького; дріжджоподібні гриби роду Candida — на твердому середовищі Сабуро та рисовому середовищі Левиної; анаероби — на кров’яному агарі Цейслера, кров’яному агарі для бактероїдів; лактобактерії — на середовищі Ленцнера; біфідобактерії — на середовищі Блаурока на печінковому відварі й на модифікованому середовищі Блаурока із додаванням до середовища азиду натрію (100 мг/л).
Одержані результати вивчення якісного і кількісного складу мікрофлори вмісту порожнини товстої кишки піддавалися математично-статистичному аналізу за допомогою стандартного пакета прикладних програм для медико-біологічних досліджень на персональному комп’ютері із застосуванням Microsoft office для Windows XP.
Результати досліджень та їх обговорення
Організм людини і його мікрофлора — єдина екологічна система, яка перебуває у стані динамічної рівноваги. Стан мікрофлори відносно постійний, незважаючи на вплив різноманітних чинників на організм людини. Мікрофлора шлунково-кишкового тракту є високочутливою індикаторною системою, яка реагує кількісними і якісними коливаннями на зміни стану здоров’я організму. При створенні особливо небезпечних умов для існування макроорганізму настають порушення в якісному і кількісному складі мікрофлори. Останнім часом виникло та інтенсивно вивчається поняття про дисбактеріоз кишечника як про стан, обумовлений зниженням захисних механізмів організму.
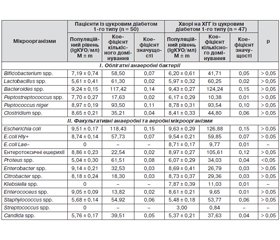
Виходячи із перерахованого вище і стану здоров’я організму людини, хворої на ЦД 1-го типу, нами вивчено якісний і кількісний склад мікрофлори вмісту порожнини товстої кишки хворих на ЦД 1-го типу в поєднанні з хронічним гнійним гайморитом у період загострення. Результати вивчення таксономічного складу мікрофлори вмісту порожнини товстої кишки у пацієнтів із ЦД 1-го типу, хворих на хронічний гнійний синуїт, наведені у табл. 1.
У хворих на ЦД 1-го типу у вмісті порожнини товстої кишки константними мікроорганізмами є автохтонні облігатні анаеробні бактерії роду Bacteroides, Lactobacillus, Bifidobacterium та умовно-патогенний пептокок. Серед факультативних анаеробних та аеробних мікроорганізмів константними виступають ентеробактерії роду Escherihia, у тому числі ентеротоксигенні ешерихії, гриби роду Candida. Додаткова мікрофлора за індексом постійності представлена анаеробними бактеріями роду Clostridium і факультативними анаеробними й аеробними ентеробактеріями роду Proteus, Citrobacter, які часто зустрічаються. Нечасто виявляють анаеробні облігатні пептострептококи, ентеробактер та ентерококи.
У хворих на хронічний гнійний гайморит із ЦД 1-го типу поглиблюються зміни автохтонних облігатних анаеробних і факультативних аеробних і анаеробних мікроорганізмів. Індекс постійності і частота виявлення біфідобактерій знижується на 12,94 і 13,33 % відповідно; лактобактерій — на 9,40 і 10 %, пептострептококів — на 5,23 % і вдвічі, ентерокока — на 3,49 %. Одночасно зростають індекс постійності і частота виявлення анаеробних бактерій роду Clostridium — на 7,57 і 25 % відповідно, умовно-патогенних ентеробактерій: протеїв — на 14,55 і 66,67 %, ентеробактера — на 7,43 і 50,0 %, цитробактера — на 5,53 і 50,0 %. Крім того, посилюється контамінація вмісту порожнини товстої кишки хворих на хронічний гнійний синуїт, асоційований із ЦД 1-го типу, умовно-патогенними ентеробактеріями — клебсієлами і лактонегативними ешерихіями.
Унаслідок змін індексу постійності і частоти виявлення змінена роль різних таксонів. Головна мікробіота вмісту порожнини товстої кишки хворих на хронічний гнійний синуїт із ЦД 1-го типу представлена бактероїдами, патогенними, ентеротоксигенними ешерихіями, умовно-патогенними пептококами, стафілококами, лактобактеріями, дріжджоподібними грибами роду Candida і біфідобактеріями. Додатковою мікробіотою виступають умовно-патогенні ентеробактерії (протей, ентеробактер, цитробактер та ін.).
Невід’ємною часткою вивчення мікроскопії будь-якого біотопу є дослідження популяційного рівня кожного асоціанта, що дає можливість здійснити характеристику співіснування представників екосистеми «макроорганізм — мікробіота» і прослідкувати спрямованість змін мікроекології порожнини товстої кишки при дестабілізації мікробіоти. Крім того, кількісний склад мікробіоти біотопу дає можливість характеризувати просторово-харчові ресурси та умови середовища існування мікроорганізмів в асоціації. Результати вивчення популяційного рівня, коефіцієнту кількісного домінування і коефіцієнту значущості кожного таксону в асоційованій мікробіоті вмісту порожнини товстої кишки хворих на хронічний гнійний гайморит у пацієнтів із ЦД 1-го типу наведені у табл. 2.
Показано, що розвиток і перебіг хронічного гнійного синуїту у хворих на ЦД 1-го типу супроводжується різнонаправленими змінами кількісного складу різних за значенням таксонів. При цьому знижується на 24,8 % популяційний рівень пептострептококів та зростає цей показник на 20,44 % в умовно-патогенних протеїв. Ентеробактерії, що контамінують порожнини верхньощелепних пазух хворих на хронічний гнійний синуїт, який розвинувся у хворих на ЦД 1-го типу із середнім ступенем тяжкості, досягають високого популяційного рівня (7,87 ± 0,39 — 8,71 ± 0,17 lgКУО/мл).
Розвиток і перебіг хронічного гнійного синуїту у хворих на ЦД 1-го типу призводить до зниження фізіологічної ролі у мікробіоценозі (за даними коефіцієнту кількісного домінування) біфідобактерій на 40,25 % і лактобактерій на 1,74 %, які мають виняткове значення у нормальному функціонуванні мікробної екосистеми. Зменшення у кишковому біоценозі рівня популяцій біфідо- і лактобактерій порушують процеси всмоктування поживних речовин, засвоєння заліза, кальцію, вітаміну D; синтезу та абсорбції екзогенних вітамінів; знижується активність ряду ферментів біологічно активних сполук, розвивається гіпопротеїнемія і знижується колонізаційна резистентність слизової оболонки шлунково-кишкового тракту, зокрема товстої кишки [9].
На такому фоні зростає кількість патогенних ентеробактерій (E.coli Hly+, ентеропатогенних ешерихій) на 5,68 % та умовно-патогенних ентеробактерій на 52,13 %. Облігатна анаеробна мікрофлора є ключовою складовою мікробіоценозу порожнини товстої кишки. Вона виконує регуляторну функцію, формує відношення з макроорганізмом і виконує основні фізіологічні функції. Облігатна анаеробна мікрофлора кількісним складом переважає факультативну анаеробну та аеробну флору у 10 і більше разів. У хворих на ЦД 1-го типу цей коефіцієнт дорівнює 0,66 ум.од., а у хворих на хронічний гнійний синуїт він зменшується на 32,0 %, що свідчить про глибокі порушення мікробіоценозу порожнини товстої кишки і потребує комплексного лікування із залученням засобів і заходів для корекції порушеного мікробіоценозу.
Висновки
1. У хворих на цукровий діабет 1-го типу настає контамінація порожнини товстої кишки патогенними (ентеротоксигенними та ентеротоксичними) та умовно-патогенними (бактеріями роду Enterobacter, Citrobacter, Proteus) ентеробактеріями, бактеріями роду Staphylococcus, Peptococcus, Bacteroides, Clostridium, дріжджоподібними грибами роду Candida; а також елімінація із цього біотопу у частині (14,0–36,0 %) хворих автохтонних облігатних анаеробних найважливіших за представництвом у мікробіоценозі та мультифункціональною роллю у підтримці мікроекологічного гомеостазу бактерій роду Bifidobacterium і Lactobacillus.
2. Головна (резидентна, індигенна) мікробіота порожнини товстої кишки у хворих на хронічний гнійний синуїт із ЦД 1-го типу представлена облігатними анаеробними бактеріями роду Bacteroides, Peptococcus niger, Lactobacillus і Bifidobacterium, а також факультативними анаеробними та аеробними бактеріями роду Escherichia, ентеропатогенними кишковими паличками, стафілококами, ентеротоксигенними ешерихіями (E.coli Hly+) і дріжджоподібними грибами роду Candida.
3. У хворих на хронічний гнійний синуїт на фоні цукрового діабету 1-го типу посилюється контамінація порожнини товстої кишки патогенними та умовно-патогенними ентеробактеріями, що може призводити до підвищення інтоксикації за рахунок ендо- та екзотоксинів цих мікроорганізмів.
4. За популяційним рівнем, коефіцієнтом кількісного домінування і коефіцієнтом значущості провідними мікроорганізмами у формуванні мікробіоценозу порожнини товстої кишки хворих на хронічний гнійний синуїт виступають анаеробні і аеробні кишкові палички, ентеротоксигенні ешерихії, аеробні бактероїди та пептококи.
Роль інших мікроорганізмів, у тому числі біфідо- і лактобактерій, суттєво знижена. Популяційний рівень анаеробних мікроорганізмів (коефіцієнт 0,5 ум.од.) знижений порівняно з факультативними анаеробними та аеробними бактеріями.
Перспективи подальших досліджень. Одержані результати є підставою для вивчення ефективності використання біфідо- і лактовмісних пробіотиків у комплексному лікуванні хворих на цукровий діабет 1-го типу, а також є основою для вивчення клінічного перебігу та оптимізації лікування запальних захворювань лор-органів, зокрема хронічних гнійних та гнійно-поліпозних синуїтів, у хворих на цукровий діабет з використанням пробіотиків.
1. Бактериально-грибковые ассоциации кишечника в условиях колонизации дрожжеподобными грибами рода Candida / О.В. Бухарин, А.В. Валышев, Н.Б. Перунова [и др.] // Журн. микробиологии. — 2002. — № 5. — С. 45–48.
2. Бондаренко В.М., Грачова Н.М., Мацулевич Т.В. Дисбактериозы кишечника у взрослых. — М.: Медицина, 2003. — 217 с.
3. Дисбіоз кишечнику в діабетології / [Сидорчук І.Й., Ляшук Р.П., Пашковська Н.В. та ін.]. — Чернівці: Мед. університет, 2006. — 120 с.
4. Дисбактериозы как гигиеническая проблема / [Савченков М., Рахманин Ю., Попкова С., Муратов В.] // Гигиена и санитария. — 2008. — № 2. — С. 43–46.
5. Ершова И.Б. Спорные проблемы дисбактериоза: советы практическому врачу / И. Ершова, А. Высоцкий, В. Ткаченко // Здоровье ребенка. — 2008. — № 2. — С. 74–76.
6. Митрохин С.Д. Дисбактериоз: современный взгляд на проблему / С.Д. Митрохин // Инфекц. и антимикробная терапия. — 2000. — № 5. — С. 144–148.
7. Характеристика микроорганизмов, колонизирующих кишечник человека / Б.А. Ефимов, Н.Н. Володин, Л.И. Кафарская [и др.] // Журн. микробиологии. — 2000. — № 5. — С. 98–104.
8. Шендеров Б.А. Медицинская микробная экология: некоторые итоги и перспективы исследований / Б.А. Шендеров // Вестник Российской АМН. — 2005. — № 12. — С. 13–17.
9. Широбоков В.П., Янковський Д.С., Димент Г.С. Мікробна екологія людини з кольоровим атласом (навчальний посібник). — К.: ТОВ «Червона Рута-Турс», 2009. — 312 с.

/39/39.jpg)
/40/40.jpg)