Международный эндокринологический журнал 2 (66) 2015
Вернуться к номеру
Зв’язок однонуклеотидних поліморфізмів гена VDR з рівнем остеоасоційованих гормонів при постменопаузальному остеопорозі
Авторы: Зябліцев Д.С. — Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
У плазмі крові 74 жінок у постменопаузальному періоді з остеопорозом (ОП) та без нього визначали рівні остеоасоційованих гормонів, макроелементів, інтерлейкінів, циклічних нуклеотидів та активність лужної фосфатази (ЛФ). Мінеральну щільність кістки (МЩК) і метакарпальний індекс оцінювали за даними остеоденситометрії. За допомогою полімеразної ланцюгової реакції виявляли алельні поліморфізми T61968С та G3731A гена рецептора вітаміну D (VDR). Мажорний гомозиготний генотип (СС) поліморфізму T61968С траплявся в групі без ОП в 3,4 раза частіше (p(F) = 0,03), знижуючи ризик розвитку захворювання в 5,5 раза (OR = 0,18; CI = 0,04–0,88). Мінорний гомозиготний генотип (ТТ) спостерігався в 3,4 раза частіше (p(F) = 0,04) за наявності ОП, збільшуючи ризик розвитку захворювання в 5,4 раза (OR = 5,42; CI = 0,98–29,92). Обидва варіанти вірогідно впливали на рівні в крові тестостерону (ТС) (F = 3,54; p = 0,48 та F = 5,27; p = 0,015) й інтерлейкіну-1β (F = 3,64; p = 0,04 та F = 2,37; p = 0,12), величину МЩК (F = 7,20; p = 0,0047 та F = 6,65; p = 0,0064). Мажорний гомозиготний генотип (АА) поліморфізму G3731A траплявся у жінок без ОП в 2,9 раза частіше (p(F) = 0,02), знижуючи ризик розвитку ОП в 5,3 раза (OR = 0,19; CI = 0,04–0,86); мінорний гомозиготний поліморфізм (GG) — у 5,4 раза частіше (p(F) = 0,04) за наявності ОП, збільшуючи ризик захворювання у 8 разів (OR = 8,00; CI = 0,88–72,70). Наявність генотипу (GG) асоційована зі збільшенням вмісту в крові паратгормону (F = 6,18; p = 0,0095), фосфору (F = 6,62; p = 0,0065), магнію (F = 5,44; p = 0,013), активності ЛФ (F = 13,85; p = 0,00014) і величини МЩК (F = 6,65; p = 0,0064) та зі зниженням вмісту в крові прогестерону (F = 10,99; p = 0,0006), ТС (F = 5,27; p = 0,015) і кальцію (F = 8,55; p = 0,0022).
В плазме крови 74 женщин в постменопаузальном периоде с остеопорозом (ОП) и без него определяли уровни остеоассоциированных гормонов, макроэлементов, интерлейкинов, циклических нуклеотидов и активность щелочной фосфатазы (ЩФ). Минеральную плотность кости (МПК) и метакарпальный индекс оценивали по данным остеоденситометрии. С помощью полимеразной цепной реакции определяли аллельные полиморфизмы T61968С и G3731A гена рецептора витамина D (VDR). Мажорный гомозиготный генотип (СС) полиморфизма T61968С встречался в группе без ОП в 3,4 раза чаще (p(F) = 0,03), снижая риск развития заболевания в 5,5 раза (OR = 0,18; CI = 0,04–0,88). Минорный гомозиготный генотип (ТТ) встречался в 3,4 раза чаще (p(F) = 0,04) при наличии ОП, увеличивая риск развития заболевания в 5,4 раза (OR = 5,42; CI = 0,98–29,92). Оба варианта достоверно влияли на уровни в крови тестостерона (ТС) (F = 3,54; p = 0,48 и F = 5,27; p = 0,015) и интерлейкина-1β (F = 3,64; p = 0,04 и F = 2,37; p = 0,12), величину МПК (F = 7,20; p = 0,0047 и F = 6,65; p = 0,0064). Мажорный гомозиготный генотип (АА) полиморфизма G3731A встречался у женщин без ОП в 2,9 раза чаще (p(F) = 0,02), снижая риск развития ОП в 5,3 раза (OR = 0,19; CI = 0,04–0,86); минорный гомозиготный полиморфизм (GG) — в 5,4 раза чаще (p(F) = 0,04) при наличии ОП, повышая риск заболевания в 8 раз (OR = 8,00; CI = 0,88–72,70). Наличие генотипа (GG) было ассоциировано с увеличением содержания в крови паратгормона (F = 6,18; p = 0,0095), фосфора (F = 6,62; p = 0,0065), магния (F = 5,44; p = 0,013), активности ЩФ (F = 13,85; p = 0,00014) и величины МПК (F = 6,65; p = 0,0064) и со снижением содержания в крови прогестерона (F = 10,99; p = 0,0006), ТС (F = 5,27; p = 0,015) и кальция (F = 8,55; p = 0,0022).
In the blood plasma of 74 postmenopausal women with osteoporosis (OP) and without it, we have determined the levels of osteoassociated hormones, macroelements, interleukins, cyclic nucleotides and activity of alkaline phosphatase (AP). Bone mineral density (BMD) and metacarpal index were estimated on base of osteodensitometry data. Using polymerase chain reaction, we have determined allelic polymorphisms T61968С and G3731A of vitamin D receptor gene. Major homozygous genotype (CC) of T61968C polymorphism was defined 3.4 times more often (p(F) = 0.03) in the group without OP, decreasing the risk of disease development by 5.5 times (odds ratio (OR) = 0.18; confidence interval (CI) = 0.04–0.88). Minor homozygous genotype (ТТ) was defined 3.4 times more often (p(F) = 0.04) in the presence of OP, increasing the risk of disease development by 5.4 times (OR = 5.42; CI = 0.98–29.92). The both variants had a significant impact on the blood testosterone (TS) (F = 3.54; p = 0.48, and F = 5.27; p = 0.015) and interleukin-1β levels (F = 3.64; p = 0.04, and F = 2.37; p = 0.12), BMD value (F = 7.20; p = 0.0047, and F = 6.65; p = 0.0064). Major homozygous genotype (AA) of G3731A polymorphism was detected 2.9 times more often (p(F) = 0.02) in women without OP, decreasing OP risk by 5.3 times (OR = 0.19; CI = 0.04–0.86); minor homozygous genotype (GG) — 5.4 times more often (p(F) = 0.04) in the presence of OP, increasing the risk of disease development by 8 times (OR = 8.00; CI = 0.88–72.70). Presence of genotype (GG) was associated with increased blood levels of parathyroid hormone (F = 6.18; p = 0.0095), phosphorus (Р) (F = 6.62; p = 0.0065), magnesium (F = 5.44; p = 0.013), AP activity (F = 13.85; p = 0.00014) and BMD value (F = 6.65; p = 0.0064) and with decreased blood concentrations of progesterone (F = 10.99; p = 0.0006), TS (F = 5.27; p = 0.015) and calcium (F = 8.55; p = 0.0022).
постменопаузальний остеопороз, ген VDR, поліморфізми T61968C та G3731A.
постменопаузальный остеопороз, ген VDR, полиморфизмы T61968C и G3731A.
postmenopausal osteoporosis, VDR gene, T61968C and G3731A polymorphisms.
Статья опубликована на с. 43-48
Вступ
Постменопаузальний остеопороз (ОП) — системне захворювання багатофакторної природи, що виникає у жінок в період постменопаузи як наслідок дефіциту статевих гормонів, насамперед естрогенів [2]. Захворювання характеризується зниженням кісткової маси, порушенням мікроархітектоніки кісткової тканини, що призводить до підвищення ламкості кістки [5]. Регулювання ремоделювання кісткової тканини здійснюється на місцевому (цитокіни і фактори росту) та системному (гормони) рівнях. [4, 8]. Основними гормонами — регуляторами кальцій-фосфорного обміну є паратгормон (ПТ) і кальцитонін (КТ), а маркером ремоделювання є специфічний білок кісткового матриксу — остеокальцин (ОК). Рівень кальцію (Са) в крові залежить від процесу його всмоктування у тонких кишках, що, у свою чергу, регулюється метаболітом вітаміну D з гормональною активністю — кальцитріолом, який активує ядерний рецептор до вітаміну D (VDR) шляхом підвищення експресії гена більше ніж у 30 органах-мішенях [1, 10, 11]. Саме фізіологічна транскрипція VDR повною мірою реалізує ефекти метаболітів вітаміну D на кісткову тканину, що притаманно для типових генетично детермінованих процесів [10, 13]. Ініціація трансляції здійснюється двома кодонами в ДНК послідовності VDR. Taq 1-поліморфізм у другому екзоні гена VDR виникає внаслідок заміни тиміну на цитозін у першому з двох сайтів ініціації трансляції. У результаті синтезується коротший на три амінокислоти білок (трансляція починається з другого сайту ініціації, який локалізовано на три кодони далі) [6, 13]. Це призводить до порушення абсорбції кальцію у тонких кишках і формуванню гіпокальціємії. Поліморфізм у сайті рестрикції Cdx2 гена VDR призводить до зниження мінеральної щільності кістки (МЩК) та збільшує ризик переломів [7, 9], впливає на варіації МЩК на всіх етапах ремоделювання кісткової тканини [12]. Відсутність Cdx2-поліморфізму гена VDR має протективне значення щодо розвитку остеопорозу [3, 9].
Метою даного дослідження стало визначення зв’язку однонуклеотидних поліморфізмів гена VDR Taq 1 (T61968C) та Cdx2 (G3731A) з ризиком розвитку ОП, рівнем остеоасоційованих гормонів (ОАГ) та біологічно активних речовин у жінок в постменопаузальному періоді.
Матеріал і методи
Під спостереженням перебували 74 жінки у постменопаузальному періоді, серед яких 30 пацієнток (40,5 %) без ОП становили контрольну групу генетичних досліджень (контроль). До групи дослідження (випадки) увійшли 44 жінки з проявами ОП (59,5 %). Використовуючи біохімічний аналізатор BS-200 (Китай), у сироватці крові вивчали активність лужної фосфатази (ЛФ), кальцію, фосфору (Р) та магнію (Mg) (La Chema, Чехія). Імуноферментним методом (ридер PR2100 Sanofi Diagnostic Pasteur, Франція) досліджували вміст у сироватці крові ПТ, КТ, ОК, а також естрадіолу (Е2), прогестерону (ПГ), тестостерону (ТС), кортизолу (КЗ), інсуліну (ІН), трийодтироніну (Т3), тетрайодтироніну (Т4), циклічного аденозинмонофосфату (цАМР), інтерлейкіну 1b (IL–1b) і фактора некрозу пухлини альфа (TNF-α) (набори ВАТ «Вектор-Бест», Росія; Amercham pharmacia biotech, Великобританія; DRG, США). Методом полімеразної ланцюгової реакції (ПЛР) виявляли однонуклеотидні поліморфізми T61968C та G3731A гена VDR (набір реагентів «ОстеоГЕН-М», Росія). ПЛР проводили за стандартом: виділення ДНК, проведення реакції ампліфікації зі специфічними праймерами, ферментативний гідроліз продуктів ампліфікації, електрофоретичне розподілення в поліакриламідному чи агарозному гелі, із подальшою реєстрацією отриманих фрагментів ДНК в УФ-світлі. Після проведення електрофорезу продуктів розщеплення — їх ферментативний гідроліз. Позитивний контроль відмічали при появі бендів, відповідних розмірам фрагментів амплікона. З метою реєстрації отриманих результатів ензиматичної рестрикції проводили електрофорез у 8% поліакриламідному або 2,5–3% агарозному гелі. Статистичні розрахунки здійснювали з використанням програми Statistiсa 7.0 (StatSoft, Inc.). Статистичну значущість різниць у розподіленні частот реєстрації генотипів між групами визначали з використанням точного методу Фішера (F). Вірогідність різниць у розподіленні генотипів і алелей між групами, а також відповідність розподілення до закону Харді — Вайнберга (HWE) оцінювали за допомогою аналізу таблиць зчеплення за критерієм x2. Розподіл генотипів у групах з ОП і без нього вважали вірогідним при відповідності до HWE для груп контролів і випадків.
Ступінь асоціації генотипів із наявністю ОП визначали за величиною відношення шансів (OR), що характеризує відносний ризик (шанси) розвитку захворювання в даному випадку залежно від алельного поліморфізму досліджуваного гена. Про вірогідне підвищення ризику свідчить величина OR більша за 1, за умови потрапляння до вірогідного інтервалу (CI = 95 %). На вірогідне зниження ризику вказує величина OR, менша за 1. Вірогідність впливу варіантів алельного поліморфізму на вміст у крові ОАГ, кальцію, фосфору, активності ЛФ і величини МЩК визначали з використанням однофакторного дисперсійного аналізу за критерієм F. Вірогідність різниць між середніми величинами розраховували за t-критерієм Стьюдента.
Результати та їх обговорення
Результати дослідження (рис. 1) показали, що частоти розподілення генотипів гена VDR (T61968C) вірогідно відрізнялися між групами хворих за наявності гомозиготних генотипів. Так, мажорний гомозиготний генотип (СС) траплявся в групі без ОП у 46,7 % випадків, а за наявності ОП — у 13,6 % (у 3,4 раза частіше, що було вірогідним за критерієм F). Мінорний гомозиготний генотип, навпаки, спостерігався частіше за наявності ОП — у 45,5 % випадків проти 13,3 % у групі без ОП (тобто у 3,4 раза частіше, що також було вірогідним за критерієм F). Частоти розподілення гетерозиготних генотипів не відрізнялися між собою.
/44/44.jpg)
Як видно з табл. 1, була виявлена залежність розподілення генотипів гена VDR (T61968C) від наявності або відсутності ОП (р(x2) = 0,04). HWE для групи без ОП і за наявності ОП таким для поліморфних варіантів гена VDR (T61968C) виконувався, оскільки, відповідно: x2 = 0,15; р = 0,97 і x2 = 0,18; р = 0,96. Наявність мажорної гомозиготи (СС) знижувала ризик розвитку ОП у 5,6 раза (OR = 0,18; CI = 0,04 0,88), тоді як гомозиготний стан мінорного генотипу (ТТ) збільшував ризик у 5,4 раза (OR = 5,42; CI = 0,98 29,92).
Таким чином, можна стверджувати, що у досліджуваних хворих наявність мажорної гомозиготи гена VDR (T61968C) — (СС) мала протективний ефект відносно до розвитку ОП, тоді як наявність мінорної гомозиготи, навпаки, сприяла розвитку ОП. Ризик розвитку ОП у першому випадку було знижено у 5,5 раза, а у другому — підвищено у 5,4 раза.
Зроблені висновки збігалися з даними, наведеними в табл. 1. Присутність в генотипі мінорної алелі (Т) підвищувала ризик розвитку ОП майже в 4 рази (OR = 3,87; CI = 1,45–10,33).
Поліморфізм гена VDR (T61968C) вірогідно впливав на рівень в крові ТС та IL-1β, а також на величину МЩК (табл. 3).
При цьому наявність у генотипі мінорної алелі (Т) асоціювалася з більш високим рівнем в крові IL-1β й більшим значенням величини МЩК. У той же час наявність мінорної алелі (Т) сприяла більш низькому рівню ТС. Це відображало біологічну роль цих факторів у процесі регуляції мінералізації кісткової тканини та узгоджувалося з раніше отриманими результатам [3, 6]. Найбільша величина F (F = 7,2; р = 0,0047) відзначалася для величини МЩК.
Поліморфізм у сайті зв’язку з транскрипційним фактором Cdx2 в промоторній ділянці гена VDR асоційований з рівнем всмоктування кальцію в кишечнику та з активацією рецепторів до вітаміну D [9]. У наших дослідженнях (рис. 2) показано, що мажорна гомозигота (АА) траплялася у жінок без ОП у 53,3 % випадків, а за наявності ОП — майже втричі рідше (у 18,2 % випадків). Іншими словами, генотип (АА) в групі без ознак ОП траплявся у 2,9 раза частіше, що є статистично значущим за критерієм Фішера. Мінорний гомозиготний генотип (GG), навпаки, спостерігався у 5,4 раза частіше: за наявності ОП — у 36,4 % випадків проти 6,7 % у групі без ОП, що також є статистично значущим за критерієм Фішера. Частоти розподілення гетерозиготних генотипів не відрізнялися між собою.
/46/46.jpg)
Як й у попередньому випадку (табл. 1), було виявлено залежність алелі гена VDR (G3731A) від наявності або відсутності ОП (р(x2) = 0,04;) (табл. 4). HWE для групи без ОП та за його наявності для поліморфних варіантів генотипу VDR (G3731A) виконувалося (відповідно x2 = 0,01; р = 1,04 і x2 = 0,08; р = 1,00). Наявність мажорної гомозиготи (АА) знижувала ризик розвитку ОП у 5,3 раза (OR = 0,19; СІ = 0,04–0,86), тоді як гомозиготний стан мінорної алелі (GG) збільшував ризик розвитку ОП у 8 разів (OR = 8,00; СІ = 0,88–72,70).
Відповідно, наявність гомозиготної мажорної алелі гена VDR (G3731A) — (AA) мала протективний ефект відносно до розвитку ОП, тоді як наявність мінорної гомозиготи, навпаки, сприяла розвитку ОП. Ризик розвитку ОП в першому випадку знижувався у 5,3 раза, а у другому — підвищувався в 8 разів. Це відповідало даним, отриманим щодо поліморфізму гена VDR (T61968C) [5].
Дані, наведені в табл. 5, підтверджували виявлену закономірність. Присутність в генотипі мінорної алелі (G) підвищувала ризик розвитку ОП майже у 4 рази (OR = 3,97; CI = 1,45–10,88).
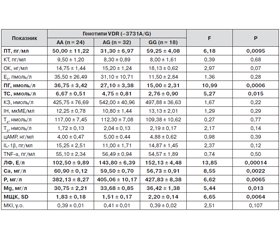
Поліморфізм генотипу гена VDR (G3731A) вірогідно впливав на рівні в крові ПТ, ПГ, ТС, кальцію, фосфору, магнію, активність ЛФ та величину МЩК (табл. 6).
Згідно з даними проведеного дисперсійного аналізу, наявність в генотипі мінорної алелі (G) асоціювалася зі збільшенням вмісту в крові ПТ, фосфору, магнію, активності ЛФ та величини МЩК. При цьому наявність алелі (G) призводило до зменшення вмісту в крові ПГ, ТС і кальцію. Найбільша величина F-критерію (F = 13,85; р = 0,00014) відзначалася для активності ЛФ, що також підтверджувало потенційну дію мінорної алелі (G) на процеси розвитку ОП.
Висновки
1. Генотип (СС) поліморфізму (Т61968С) гена VDR траплявся в групі без ОП в 3,4 раза частіше, ніж з ОП, тоді як генотип (ТТ) спостерігався у 3,4 раза частіше за наявності ОП. Наявність генотипу (СС) знижувала ризик розвитку ОП у 5,5 раза, а генотипу (ТТ) — збільшувала ризик у 5,4 раза. Наявність у генотипі мінорної алелі (Т) асоціювалася з більш високим рівнем в крові IL-1β, величини МЩК та більш низьким рівнем ТС.
2. Мажорна гомозигота поліморфізму G3731A гена VDR (АА) траплялася у жінок без ОП в 2,9 раза частіше, тоді як генотип (GG) — у 5,4 раза частіше за наявності ОП. Наявність мажорної гомозиготи (АА) знижувала ризик розвитку ОП в 5,3 раза, тоді як мінорна гомозигота (GG) збільшувала ризик у 8 разів. Наявність у генотипі мінорної алелі (G) асоціювалася зі збільшенням вмісту в крові ПТ, фосфору, магнію, активності ЛФ й величини МЩК та зі зниженням вмісту в крові ПГ, ТС і кальцію.
1. Поворознюк В.В., Масик Н.П., Пирогова Н.И. Маркеры костной ткани и их клиническое значение при хронической обструктивной болезни легких // Здоровье Казахстана. — 2015. — № 202/33.
2. Кулаков В.И., Манухина И.Б., Соловьева Г.М. Гинекология: национальное руководство. — М.: ГЭОТАР-Медиа, 2011. — 848 с.
3. Зяблицев Д.С., Пищулина С.В., Кишеня М.С., Чернобривцев А.П. Значение полиморфизмов гена рецептора витамина D в патогенезе остеодефицита у женщин постменопаузального периода // Вісник морфології. — 2014. — Т. 20, № 2. — С. 432–435.
4. Мищенко E.Б. Оценка значимости внешних и внутренних факторов риска развития остеопороза // Международный эндокринологический журнал. — 2011. — № 1(33). — С. 128–134.
5. Якушевская О.В., Юренева С.В. Патогенетические основы развития острой фазы ответа на внутривенное введение азотосодержащих бисфосфонатов // Акушерство и гинекология. — 2013. — № 11. — С. 19–23.
6. Casado-Dіaz А., Cuenca-Acevedo R., Navarro-Valverde С. [et al.] / Vitamin D status and the Cdx-2 polymorphism of the vitamin D receptor gene are determining factors of bone mineral density in young healthy postmenopausal women // Mol. Biol. — 2012. — Vol. 960, № 12. — P. 192–196.
7. Baig L., Mansuri F.A., Karim S.A. Association of menopause with osteopenia and osteoporosis: results from population based study done in Karachi // J. Coll. Physicians. Surg. Pak. — 2009. — Vol. 19, № 4. — P. 240–244.
8. Bischoff L., Derk C.T. Premenopausal osteoporosis // Minerva Med. — 2008. — Vol. 99, № 1. — P. 55–63.
9. Jia F., Sun R.F., Li Q.H. et al. // Genet. Test. Mol. Biomarkers. — 2013 Jan. — 17. — P. 30–34. Doi: 10.1089/gtmb.2012.0267.
10. Haussler M.R., Whitfield G.K., Kaneko I. [et al.]. Molecular mechanisms of vitamin D action // Calcif. Tissue Int. — 2013. — Vol. 92, № 2. — Р. 77–98.
11. Schunack W. Vitamin D3 — a prodrug of different D3-hormones // Med. Klin. — 2006. — Suppl. 1. — P. 20–24.
12. Xu H., Li S., Qiu J.Q. et al. The VDR gene Fok I polymorphism and ovarian cancer risk // Tumour. Biol. — 2013. — Vol. 3309. — P. 34–36.
13. Li W.F., Hou S.X., Yu B. [et al.]. Genetics of osteoporosis: accelerating pace in gene identification and validation // Hum. Genet. — 2010. — Vol. 127(3). — P. 249–285.

/45/45.jpg)
/46/46_2.jpg)
/47/47.jpg)