Международный эндокринологический журнал 2 (66) 2015
Вернуться к номеру
Патология щитовидной железы у женщин репродуктивного возраста: преконцепционная подготовка и тактика ведения во время беременности
Авторы: Луценко Л.А. — Киевский городской клинический эндокринологический центр
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Во время беременности меняется метаболизм йода и тиреоидных гормонов, что является важным фактором при диагностике и лечении патологии щитовидной железы (ЩЖ) у беременных и женщин, которые планируют беременность. Показано, что носительство антител к тиреоидной пероксидазе является фактором, снижающим нормальный функциональный ответ ЩЖ, необходимый для адекватного развития индуцированной беременности. Поэтому при любых нарушениях репродуктивной функции (бесплодие, невынашивание беременности) необходима оценка функции ЩЖ и определение антител к тиреоидной пероксидазе, а наступление беременности у женщин с патологией ЩЖ требует существенной коррекции проводимой терапии.
Під час вагітності змінюється метаболізм йоду і тиреоїдних гормонів, що є важливим чинником при діагностиці та лікуванні патології щитоподібної залози (ЩЗ) у вагітних і жінок, які планують вагітність. Показано, що носійство антитіл до тиреоїдної пероксидази є чинником, що знижує нормальну функціональну відповідь ЩЗ, необхідну для адекватного розвитку індукованої вагітності. Тому при будь-яких порушеннях репродуктивної функції (безпліддя, невиношування вагітності) необхідна оцінка функції ЩЗ і визначення антитіл до тиреоїдної пероксидази, а настання вагітності в жінок із патологією ЩЗ вимагає суттєвої корекції проваджуваної терапії.
During pregnancy, the metabolism of iodine and thyroid hormone changes that is an important factor in the diagnosis and treatment of thyroid diseases in pregnant women and women who are planning to become pregnant. It is shown that carriage of thyroid peroxidase antibodies is a factor reducing the normal thyroid functional response necessary for the adequate development of induced pregnancy. Therefore, in any violations of reproductive function (infertility, miscarriage), it is necessary to evaluate thyroid function and to measure thyroid peroxidase antibodies, and pregnancy in women with thyroid gland pathology requires a significant correction of the therapy.
щитовидная железа, беременность, преконцепционная подготовка, тактика ведения.
щитоподібна залоза, вагітність, преконцепційна підготовка, тактика ведення.
thyroid gland, pregnancy, preconception preparation, management.
Статья опубликована на с. 111-116
Регуляция репродуктивной функции женщин осуществляется различными органами, одним из которых является щитовидная железа (ЩЖ). Патология ЩЖ отрицательно влияет на течение беременности, развитие плода и адаптацию новорожденного [1].
Во время беременности меняется метаболизм йода и тиреоидных гормонов, что является важным фактором при диагностике и лечении патологии ЩЖ у беременных и женщин, которые планируют беременность. С первых недель беременности происходит изменение функционирования ЩЖ за счет влияния множества факторов, которые обладают стимулирующим эффектом. В первую очередь это гиперстимуляция ЩЖ хорионическим гонадотропином (ХГ), которая приводит к физиологическому снижению уровня тиреотропного гормона (ТТГ) в первом триместре (за счет перекрестной реактивности). Усиленная продукция ХГ, обладающего сходной структурой с ТТГ (одинаковые α-субъединицы), вызывает повышение уровня свободного тироксина (Т4) и в результате — супрессию ТТГ. В норме не менее чем у 20 % беременных в первом триместре определяется сниженный уровень ТТГ. При многоплодной беременности, сопровождающейся значительным повышением ХГ, диагностируют значительно сниженный уровень ТТГ. Кроме того, в печени увеличивается продукция тироксинсвязывающего глобулина (ТСГ), в результате которой повышается уровень тиреоидных гормонов (за счет общих фракций). Усиливается трансплацентарный перенос йода и его экскреция с мочой. В плаценте вырабатываются дейодиназы 3-го типа, превращающие тиреоидные гормоны в неактивные метаболиты, и дейодиназы 2-го типа, осуществляющие превращение Т4 в трийодтиронин (Т3), в результате которого повышается уровень более активного гормона — Т3. Таким образом, изменение функционирования ЩЖ у беременной женщины требует особого подхода к тактике ведения патологии ЩЖ.
Закладка ЩЖ у плода происходит с 3–4-й недели эмбрионального развития. Способность к захвату йода появляется с 10–12-й недели. Окончательное формирование ЩЖ у плода происходит к 15–16-й неделе — с момента синтеза и секреции тиреоидных гормонов. Поэтому развитие плода и формирование его ЩЖ в І и начале ІІ триместра происходит под 100% влиянием тиреоидных гормонов матери. В дальнейшем тиреоидный статус матери сохраняет свою значимость для развития плода.
Таким образом, актуальным является вопрос диагностики заболеваний ЩЖ и выбора правильной тактики ведения данной патологии у беременных женщин, особенно на ранних сроках, когда происходит формирование ЩЖ плода, и у женщин, которые планируют беременность.
Йодный дефицит
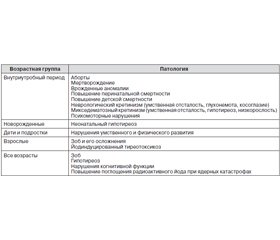
В литературе термином «йододефицитные состояния» обозначают патологические состояния, которые развиваются вследствие йодного дефицита и которые можно предотвратить путем нормализации потребления йода. Дефицит йода в организме приводит к нарушению синтеза и секреции тиреоидных гомонов. У беременных сниженное потребление йода приводит к гиперстимуляции ЩЖ и формированию зоба у матери и плода. Спектр возможной йододефицитной патологии определен в 2001 г. ВОЗ (табл. 1).
Восполнение дефицита йода в течение всего периода гестации предупреждает самопроизвольное прерывание беременности, развитие зоба у беременной и йододефицитной патологии у плода. Используются препараты йода (самостоятельно или в виде витаминных комплексов) в дозе 200 мкг/сут. Противопоказание для назначения препаратов йода — диффузный токсический зоб (ДТЗ).
Зоб
Распространенность узлового зоба (размер узлов по данным УЗИ ≥ 1 см) среди беременных составляет 4 % [2]. Основное условие планирования беременности у женщины с зобом — эутиреоидное состояние. При этом наличие у беременной женщины эутиреоидного зоба позволяет отнести ее к группе риска по развитию осложнений, связанных с возможной гипотироксинемией, что приводит к необходимости контроля функции ЩЗ — определению ТТГ и свободного Т4 в течение I и II триместров. Патологическое значение гипотироксинемии снижается в третьем триместре, поэтому важность контроля функции ЩЖ в этот период уменьшается.
Медикаментозное лечение эутиреоидного зоба (диффузного или узлового) в период гестации проводится в соответствии со стандартными подходами — терапия препаратами йода и L-тироксина (самостоятельно или в комбинации) с обязательным лабораторным контролем функции ЩЖ. Единственное показание к операции при узловом образовании во время беременности — обнаружение злокачественного результата при аспирационной пункционной биопсии или подозрение на злокачественность. При этом наиболее благоприятным для хирургического лечения является II триместр. При заключениях пункционной биопсии промежуточного характера (фолликулярная неоплазия) операция откладывается до послеродового периода.
Аутоиммунный тиреоидит
Наиболее частым осложнением аутоиммунного тиреоидита (АИТ) является гипотиреоз. Если диагностика последнего не вызывает особых сложностей, то при отсутствии снижения функции ЩЖ диагноз АИТ зачастую носит лишь вероятностный характер.
Уровень ТТГ > 2,5 мМЕ/л на ранних сроках беременности у женщин — носительниц антител к тиреоидной пероксидазе (ТПО) может косвенно свидетельствовать о снижении функциональных резервов ЩЖ и повышенном риске развития относительной гипотироксинемии [3, 4]. При этом, пребывая в эутиреоидном состоянии, женщины с АИТ имеют высокий риск развития гипотиреоза и должны контролировать уровень ТТГ каждые 4–6 нед. Для сохранения беременности и правильного развития плода важно сохранение эутиреоза на протяжении всей беременности. Нарушение тиреоидного статуса сопровождается угрозой выкидыша, преждевременных родов, развитием осложнений беременности.
Гипотиреоз
Распространенность гипотиреоза среди беременных составляет 2–3 % [5]. Поскольку некомпенсированный гипотиреоз оказывает негативное влияние на течение беременности и плод, диагностика состояния ЩЖ у беременной имеет огромное значение. Осложнения некомпенсированного гипотиреоза при беременности представлены в табл. 2 [6].
Клинические данные не являются критерием для постановки диагноза. Лабораторным подтверждением манифестного гипотиреоза считают повышение уровня ТТГ выше триместр-специфического референтного значения (табл. 3) и одновременное снижение свободного Т4 либо уровень ТТГ ≥ 10 мМЕ/л независимо от уровня свободного Т4. Основной диагностический критерий первичного гипотиреоза — повышенный уровень ТТГ.
С учетом риска прерывания беременности, преждевременных родов и гипотрофии плода при диагностике манифестного гипотиреоза во время беременности требуется безотлагательное назначение препаратов L-тироксина и нормализация ТТГ на уровне, установленном для данного триместра [7]. Гипотиреоз у беременных — абсолютное показание к назначению заместительной терапии. L-тироксин назначается в полной дозе без титрования [8].
Контроль уровня ТТГ осуществляют через 1 мес. после начала заместительной терапии, затем 1 раз в 1–1,5 мес.
У пациенток с гипотиреозом при наступлении беременности доза L-тироксина может увеличиться до 30 % [9]. Чаще это пациентки, получающие заместительную терапию L-тироксином, у которых до беременности выявлен уровень ТТГ > 1,2 мМЕ/л [10]. После родов доза L-тироксина чаще становится ниже той, что была до беременности.
Субклинический гипотиреоз
Распространенность субклинического гипотиреоза у беременных — 2–3 %. Риск спонтанного прерывания беременности в І триместре возрастает на 70 % при уровне ТТГ 2,5–5,0 мМЕ/л [11]. Диагностируют данное состояние исключительно при лабораторном обследовании. Повышенный ТТГ и нормальный свободный Т4 — показатели, которые подтверждают диагноз субклинического гипотиреоза. Скрининг субклинического гипотиреоза в настоящее время не рекомендован, но обсуждение данного вопроса продолжается. Выявление субклинического гипотиреоза до беременности требует преконцепционного назначения препаратов L-тироксина в дозе, позволяющей достичь уровня ТТГ ниже 2,5 мМЕ/л.
Согласно рекомендациям общества эндокринологов США (2012) лечение во время беременности рекомендовано при субклиническом гипотиреозе женщинам с повышенным титром антител к ТПО. Европейской тиреоидной ассоциацией рекомендовано лечение субклинического гипотиреоза при выявлении субклинического гипотиреоза до зачатия или во время беременности независимо от титра антител к ТПО.
Мониторинг ТТГ при лечении субклинического гипотиреоза должен проводиться каждые 4–6 нед. в первом триместре и один раз во втором и третьем триместрах [7].
Женщинам с субклиническим гипотиреозом (при ТТГ меньше 5 мМЕ/л), который диагностирован во время беременности, при отсутствии антител к ТПО L-тироксин после родов отменяют. Контроль ТТГ проводят через 6 недель после родов, в дальнейшем — через 6 и 12 мес. после родов [7].
Изолированная гипотироксинемия
Изолированная гипотироксинемия — состояние тиреоидного обмена, характеризующееся сниженным уровнем свободного Т4 при нормальном уровне ТТГ, обусловленное усиленной конверсией Т4 в Т3. Данная ситуация не является патологической и, как считалось ранее, не требует медикаментозной коррекции. В настоящее время доказано, что гипотироксинемия у матери ассоциируется с нарушением нейрофизиологического развития у потомства и требует лечения L-тироксином в І триместре [7]. Вопрос лечения изолированной гипотироксинемии решается врачом в каждой конкретной ситуации [12]. Необходим лабораторный контроль тиреоидного состояния пациентки с изолированной гипотироксинемией независимо от выбора тактики ведения (наблюдение или лечение L-тироксином).
Тиреотоксикоз
Распространенность тиреотоксикоза составляет 1–2 случая на 1000 беременностей [8]. Некомпенсируемый манифестный тиреотоксикоз повышает риск выкидыша, преждевременных родов, мертворождения, гипотрофии плода, артериальной гипертензии и сердечной недостаточности у матери [13]. Согласно рекомендациям Американской тиреоидной ассоциации (2011 г.) выявление уровня ТТГ < 0,1 мМЕ/л требует определения свободного Т4. Диагноз диффузного токсического зоба (ДТЗ) у беременных основывается на клинических данных и результатах инструментально-лабораторных исследований. Обязательно проведение ультразвукового исследования и определение уровней ТТГ и тиреоидных гормонов (свободного Т4, свободного Т3). Лабораторным подтверждением манифестного тиреотоксикоза считают снижение уровня ТТГ при повышенных уровнях свободных Т4 и Т3. Субклинический тиреотоксикоз диагностируют при снижении уровня ТТГ и нормальных уровнях свободных Т4 и Т3 [9, 12]. При этом аналитическая чувствительность тест-системы для определения ТТГ должна быть достаточно высокой (не ниже 3-го поколения), что даст возможность достоверно оценивать очень низкие концентрации ТТГ в крови и выявлять субклинические формы заболевания.
Наибольшее число диагностических ошибок связано с дифференциальной диагностикой ДТЗ и так называемого транзиторного гестационного гипертиреоза. Необходимость дифференциации обусловлена различным подходом к тактике ведения беременных, поскольку транзиторный гестационный гипертиреоз проходит самостоятельно с увеличением срока беременности и не требует лечения. Транзиторный тиреотоксикоз часто развивается при уровне ХГ выше 75 000 МЕ/мл [14].
Проведение дифференциальной диагностики причин тиреотоксикоза во время беременности требует учета ряда факторов: клинической картины, в том числе и наличия эндокринной офтальмопатии, изменения уровня тиреоидных гормонов, уровня антител к рецепторам ТТГ.
Дифференциальные (лабораторные) критерии ДТЗ и гестационного тиреотоксикоза представлены в табл. 4.
Лабораторным тестом, позволяющим провести дифференциальную диагностику ДТЗ и гестационного тиреотоксикоза, является определение антител к рецепторам ТТГ (рТТГ), которые являются специфическим маркером ДТЗ и выявляются у 99–100 % пациентов с данным заболеванием [15]. Необходимо учитывать метод определения антител к рТТГ, который должен обладать высокой аналитической чувствительностью.
Антитела к рТТГ обладают способностью проникать через плаценту, что указывает на необходимость определения данного показателя у беременных при подозрении на ДТЗ, при наличии ДТЗ в анамнезе. Определение анитител к рТТГ проводится до 22-й нед. беременности [12].
Согласно клиническому руководству общества эндокринологов США (2012 г.) показания для определения антител к рТТГ у беременных следующие:
— подозрение на ДТЗ на момент обследования;
— ДТЗ (с тиреоидэктомией или лечением радиоактивным йодом) до беременности;
— наличие ДТЗ у новорожденных от предыдущих беременностей;
— повышение уровня антител к рТТГ в анамнезе.
Прогностическая ценность определения антител к рТТГ (до операции) представлена в табл. 5 (С. Capelli et al., 2007).
Несмотря на низкую распространенность этого заболевания, лечение ДТЗ во время беременности — серьезная задача. У беременных общепринятым считается консервативный метод лечения тиреотоксикоза. Лечение радиоактивным йодом противопоказано, оперативное лечение проводится редко (по показаниям).
Принципы лечения тиреотоксикоза у беременных следующие:
— назначение минимальных, но эффективных (для достижения эутиреоза) доз тиреостатиков;
— контроль уровня свободного Т4 (предупрежедение гипотироксинемии) с целью подбора дозы тиреостатика. Уровень свободного Т4 удерживают на верхней границе нормы.
Схема «блокируй и замещай» у беременных не используется в связи с высоким риском блокирования ЩЖ плода на фоне больших доз тиреостатиков.
Рак ЩЖ
Планирование беременности у пациенток, получавших в прошлом лечение по поводу высокодифференцированного рака ЩЖ (тиреоидэктомия и I131), возможно, но не ранее чем через 6–12 мес. после приема радиоактивного йода. Женщинам рекомендуется назначение L-тироксина с целью поддержания супрессированного, но определяемого уровня ТТГ. Уровень свободного Т4 во время беременности не должен быть повышен [12]. Определять уровень тиреоглобулина (ТГ) у данной категории пациенток не следует, поскольку во время беременности происходит увеличение данного показателя.
Щитовидная железа и вспомогательные репродуктивные технологии
В настоящее время доказано, что эффективность вспомогательных репродуктивных технологий (ВРТ) напрямую связана с состоянием тиреоидного обмена женщины. Фолликулярный резерв у женщин с дисфункцией ЩЖ снижен. В программах ЭКО для получения максимального количества ооцитов проводят стимуляцию суперовуляции, которая сопровождается гиперэстрогенией в крови. При гиперэстрогении происходит повышение уровня тироксинсвязывающего глобулина в печени, что приводит к повышению уровня ТТГ. Прогностически благоприятными уровнями гормонов на этапе подготовки к ВРТ следует считать низконормальные показатели ТТГ и высоконормальные показатели уровня свободного Т4 [16].
О взаимосвязи носительства антитиреоидных антител и невынашивания беременности в настоящее время достоверных данных не существует. Однако считается, что изолированное носительство антитиреоидных антител без нарушения функции ЩЖ у женщин с бесплодием может являться предиктором неблагоприятных исходов программ ЭКО или ранних репродуктивных потерь [17]. Скрининг на антитела к ТПО у женщин с бесплодием позволит определить группу пациенток с низкой эффективностью программ ЭКО.
У женщин с носительством антител к ТПО при вступлении в программы ЭКО заместительная терапия L-тироксином показана при уровне ТТГ выше 2,5 мЕд/л с последующим контролем уровней ТТГ и свободного Т4 каждые 6–8 нед. Проведение программ ВРТ возможно только при условии достижения стойкой компенсации гипотиреоза (уровень ТТГ ниже 2,5 мЕД/л) [18].
Таким образом, поскольку носительство антител к ТПО является фактором, снижающим нормальный функциональный ответ ЩЖ, необходимый для адекватного развития индуцированной беременности, при любых нарушениях репродуктивной функции (бесплодие, невынашивание беременности) необходима оценка функции ЩЖ и определение антител к ТПО, а наступление беременности у женщин с патологией ЩЖ требует существенной коррекции проводимой терапии.
1. Glinoer D. The regulation of thyroid function in pregnancy pathways of endocrine adaptation from physiology to pathology / D. Glinoer // Endocr. Rev. — 1997. — Vol. 18, № 3. — P. 404–433.
2. Фадеев В.В. Беременность и заболевания щитовидной железы // В. Фадеев, С. Перминова, З. Ходжаева // Рос. мед. журн. — 2008. — № 2. — С. 38–41.
3. Фадеев В.В. Функциональное состояние щитовидной железы у беременных женщин — носительниц антител к тиреоидной пероксидазе / В. Фадеев, С. Лесникова, Г. Мельниченко // Пробл. эндокринол. — 2003. — № 5. — С. 23–29.
4. Glinoer D. Risk of subclinical hypothyroidism in pregnant women with asymptomatic autoimmune thyroid disorders / D. Glinoer, M. Riahi, J. Gruen [et al.] // J. Clin. Endocrinol. Metab. — 1994. — № 79. — Р. 197–204.
5. Stagnaro-Green A. Thyroid disorders in pregnancy / A. Stagnaro-Green, E. Pearce // Nature Reviews Endocrinology. — 2012. — Vol. 8. — P. 650–658.
6. Brent G.A. Maternal hypothyroidism: recognition and management // Thyroid. — 1999. — Vol. 99. — Р. 661–665.
7. Lazarus J. Методические рекомендации Европейской тиреоидной ассоциации по ведению пациентов с субклиническим гипотиреозом в период беременности и в детском возрасте 2014 / J. Lazarus, R. Brown, C. Daumeried [et al.] // Eur. Thyroid J. — 2014. — Vol. 3. — P. 76–94.
8. Фадеев В.В. Патология щитовидной железы и беременность / В. Фадеев, С. Перминова, Т. Назаренко [и др.] // Врач. — 2008. — № 5. — С. 11–16.
9. Stagnaro-Green A. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum / A. Stagnaro-Green, M. Abalovich, E. Alexander // Thyroid. — 2011. — Vol. 21, № 10. — P. 1081–1125.
10. VelascoI. Effect of iodine prophylaxis during pregnancy on neurocognitive development of children during the first two years of life / I. Velasco, M. Carreira, P. Santiago [et. al.] // J. Clin. Endocrinol. Metab. — 2009. — Vol. 94, № 9. — P. 3234–3241.
11. Negro R. Increased pregnancy loss rate in thyroid antibody negative women with TSH levels between 2.5 and 5.0 in the first trimester of pregnancy / R. Negro, A. Schwartz, R. Gismondi [et. al.] // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95, № 9. — P. 44–48.
12. DeGroot L. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society clinical practice guideline / L. DeGrot // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97, № 8. — P. 2543–2565.
13. Krassas G.E. Thyroid function and human reproductive health / G.E. Krassas, K. Poppe, D. Glinoer [et. al.] // Endocr. rev. — 2010. — Vol. 31, № 5. — P. 702–755.
14. Ольховик В.Л. Гестационный транзиторный тиреотоксикоз / В.Л. Ольховик // Междунар. мед. журнал. — 2008. — № 1. — С. 96–98.
15. Трошина Е.А. Федеральные (клинические) рекомендации по диагностике и лечению тиреотоксикоза с диффузным зобом (диффузный токсический зоб, болезнь Грейвса — Базедова), узловым/многоузловым зобом / Е.А. Трошина, Н.Ю. Свириденко, В.Э. Ванушко и др. // II Всероссийский конгресс с участием стран СНГ «Инновационные технологии в эндокринологии» (25–28 мая 2014 г.). — М., 2014. — 25 с.
16. Сохадзе Х. Реализация программы вспомогательных репродуктивных технологий у женщин с гиперпролактинемией и дисфункцией щитовидной железы / Х. Сохадзе, А. Сабуров, Н. Гаврилова // Фундаментальные исследования. — 2013. — № 9. — С. 734–743.
17. Станкович Е.Б. Роль нарушений функции щитовидной железы при реализации программ ЭКО у пациенток с бесплодием: Дис… канд. мед. наук / НЦАГиП РАМН; Е.Б. Станкович. — М., 2009. — 134 с.
18. Перминова С.Г. Бесплодие у женщин с патологией щитовидной железы: принципы диагностики, тактика ведения: Дис… д-ра мед. наук: 14.01.01 / НЦАГиП РАМН; С.Г. Перминова. — М., 2010. — 275 с.

/112/112.jpg)
/113/113.jpg)
/114/114.jpg)
/115/115.jpg)