Международный эндокринологический журнал 2 (66) 2015
Вернуться к номеру
Исследование влияния комбинированного применения йода и селена на течение наиболее частой патологии щитовидной железы
Авторы: Киселева И.А., Каминский А.В. - ГУ «Национальный научный центр радиационной медицины НАМН Украины», г. Киев
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
В статье рассмотрены вопросы существования микронутриентных дефицитных состояний в Украине, влияющих на эффективность работы щитовидной железы и развитие тиреоидной патологии. Представлен клинический опыт использования фиксированной комбинации микроэлементов йода и селена в физиологических дозах в профилактике таких нарушений. Доказана возможность влияния данной комбинации на стабилизацию имеющейся тиреоидной патологии и безопасность применения при аутоиммунных заболеваниях.
У статті розглядаються питання наявності мікронутрієнтних дефіцитних станів в Україні, що впливають на ефективність роботи щитоподібної залози та розвиток тиреоїдної патології. Наведено клінічний досвід використання фіксованої комбінації мікроелементів йоду та селену в фізіологічних дозах у профілактиці таких порушень. Доведені можливість впливу даної комбінації на стабілізацію існуючої тиреоїдної патології та безпека застосування при автоімунних захворюваннях.
In this paper we examine the presence of micronutrient deficiencies in Ukraine, influencing the efficacy of the thyroid gland functions and the development of thyroid pathology. A clinical experience of using a fixed combination of trace elements iodine and selenium in physiological doses for preventing such violations is described. The possibility of the impact of this combination on the stabilization of thyroid pathology and safety of application in autoimmune diseases is proved.
щитовидная железа, дефицит микроэлементов, йод, селен, диффузный нетоксический зоб, узловой зоб, аутоиммунный тиреоидит.
щитоподібна залоза, дефіцит мікроелементів, йод, селен, дифузний нетоксичний зоб, вузловий зоб, автоімунний тиреоїдит.
thyroid gland, micronutrient deficiency, iodine, selenium, diffuse nontoxic goiter, nodular goiter, Hashimoto’s thyroiditis.
Статья опубликована на с. 117-121
Щитовидная железа (ЩЖ) является важным органом, который синтезирует жизненно необходимые всем клеткам организма гормоны. От ее состояния и эффективности действия гормонов зависят общее здоровье, качество и продолжительность жизни. К сожалению, тиреоидная патология является очень частой. Она во многом зависит от генетической предрасположенности, факторов внешней среды — экологии, рациона питания, дефицита микроэлементов (йода, селена, железа) и витаминов (ретинола), зобогенных веществ, курения и др. На одни факторы мы можем влиять, на другие — нет. Например, дефицит витаминов и микроэлементов легко устранить, если ежедневно вводить их в качестве необходимых пищевых добавок. Поэтому Всемирная организация здравоохранения (ВОЗ) [1], Детский фонд Организации Объединенных Наций (ЮНИСЕФ) [2] совместно с Международным комитетом контроля за йододефицитными заболеваниями (МККЙДЗ) [3] сделали акцент на эффективной профилактике болезней ЩЖ в группах наибольшего риска (у детей, подростков, беременных и кормящих женщин), а также населения всех возрастов в целом. Такой подход хорошо зарекомендовал себя начиная с 20-х годов ХХ века, что позволило исключить ряд стран Европы (Швейцария, Австрия, Германия и др.) из числа тех, в которых йодный дефицит значительно влиял на здоровье населения, а Армения, Азербайджан, Туркменистан, Грузия, Беларусь и Казахстан сумели почти полностью решить эту проблему.
По данным карт ВОЗ (2006) [1] и МККЙДЗ (2014) [3], Украина относится к территориям с легким комбинированным дефицитом йода, хотя на значительной ее части имеется умеренный дефицит микроэлементов, а в западных регионах, бесспорно, — тяжелый.
Неэффективность или отсутствие государственных программ профилактики дефицита микронутриентов в Украине и странах СНГ на протяжении многих лет приводит к тому, что неинформированное население имеет часто встречающиеся болезни ЩЖ, молочной железы и других потребляющих йод органов и тканей, которых можно избежать в большинстве случаев.
Йодирование — это процесс обогащения йодом соли, предназначенной для потребления населением. ВОЗ/ЮНИСЕФ/МККЙДЗ делают акцент на том, что данная стратегия повышения поступления в организм йода в масштабах популяции является самым доступным и дешевым методом профилактики йодного дефицита при использовании йодированной соли не менее чем у 90 % населения [4, 5].
Однако неконтролируемое потребление соли населением Украины, превышающее рекомендуемые ВОЗ 5–6 г/сутки длительное время, может вызвать уже другие проблемы в ЩЖ, связанные с чрезмерным поступлением йода, несмотря на большую устойчивость тиреоцитов к его избытку, чем к недостатку. С учетом физиологической роли селена в периферической конверсии тироксина в активную форму трийодтиронин и аутоиммунитета одновременное восполнение йода и селена может снизить даже незначительный потенциальный риск возникновения нежелательных последствий при проведении йодной профилактики.
Селен участвует в синтезе, активации и метаболизме тиреоидных гормонов. Он был впервые открыт в 1817 году шведским химиком Берцелиусом. Биологическая роль селена была осознана достаточно недавно — лишь в 1980-х годах, когда было обнаружено, что добавление селенита натрия предотвращает или обращает вспять клинические признаки таких тяжелых состояний, как деформирующий эндемический остеоартроз (болезнь Кашина — Бека) и детская кардиомиопатия (болезнь Кешана). Он является облигатным микронутриентом, необходимым для синтеза ферментов, участвующих в активации и метаболизме тиреоидных гормонов, а его дефицит приводит к гибели тиреоцитов и замещению паренхимы ЩЖ соединительной тканью [1, 2].
ЩЖ является одним из органов с высоким содержанием селена, который образует в ней селенопротеины, являющиеся активными биоантиоксидантами, отвечающими за антиоксидантную оборону. Они важны для ферментативных систем (глутатионпероксидаз, тиоредоксинредуктаз, дейодиназ) ЩЖ, где находятся в больших концентрациях, участвуют в кодировании UGA кодона тРНК, в регуляции определенных факторов транскрипции (NF-κВ, Ref-1, Р53) и в экспрессии генов. Селенопротеины — депонированная форма селена в организме, запасы которых используются в условиях дефицита. Поэтому считается, что наилучшим маркером содержания селена в организме является селенопротеин Р. Обычно этот микроэлемент поступает в организм с продуктами питания в виде селеносодержащих аминокислот — селенометионина (Se-Met) и селеноцистеина (Se-Cys).
Дефицит селена сопровождается снижением иммунитета, усилением неблагоприятных свободнорадикальных процессов, риском активации тиреоидных аутоиммунных реакций, нарушением активации конверсии тироксина в трийодтиронин [6]. Последний феномен обусловлен тем, что он является эссенциальным компонентом фермента йодтиронин-5-дейодиназы, который катализирует данную конверсию [7, 8]. Gartner и соавторы (2002) установили, что в результате добавления в рацион соединений селена (в форме селенита или селената натрия) происходит угнетение воспаления и снижение титров антител при аутоиммунном тиреоидите (АИТ). Обнаружена патогенетическая взаимосвязь между отдельными случаями гипотиреоза у детей и недостаточностью этого микроэлемента [9]. Во французском исследовании SU.VI.MAX показано, что дефицит селена играет значимую роль в возникновении многоузлового зоба (но не одноузлового) [10].
Селен поступает в организм через кишечник и накапливается в печени, почках и мышечной ткани. Ряд исследований, проведенных за последние 10–15 лет, показал положительную динамику снижения титров антител к тиреоидной пероксидазе (ТПО) у пациентов с АИТ, получавших селен в физиологических дозах — около 80 мкг/день на протяжении 6–12 месяцев, а курение определено как его антагонист. В других исследованиях отмечено улучшение ультразвуковой картины [11–15]. Согласно рекомендациям Управления по контролю качества пищевых продуктов и лекарственных средств США (FDA), в организм взрослого человека селен должен поступать около 70 мкг/сутки — для мужчин и 55 мкг/сутки — для женщин. Большинство исследователей рассматривают дозу 350–400 мкг/сутки как предельно безопасную.
Селен является антиоксидантом, он защищает витамин Е от деградации, влияет на иммунную систему, способствует выведению свободных радикалов, участвует в контроле над выработкой антител. Его дефицит способствует возникновению аденомы простаты, мужского бесплодия, снижает подвижность сперматозоидов, повышает чувствительность к различным инфекционным заболеваниям. Чем меньше его потребление (концентрация селена в крови ниже 45 мкг/л), тем выше вероятность выявления случаев рака, прежде всего желудка, простаты, толстого кишечника, молочной железы. Селен укрепляет энергетические возможности клеток миокарда и снижает гипоксию, является антагонистом мышьяка, кадмия и ртути. В регионах с дефицитом селена встречается повышенная распространенность микседематозного кретинизма. Таким образом, соединения селена могут быть использованы с лечебной целью у пациентов с аутоиммунными заболеваниями, в том числе ЩЖ, — хроническим АИТ, диффузным токсическим зобом (ДТЗ), эндокринной офтальмопатией (исследование EUGOGO), послеродовым тиреоидитом, а также при других тиреоидных и нетиреоидных заболеваниях.
Исходя из физиологической важности соединений йода и селена для нормальной работы всех систем организма, а в особенности их синергичной роли в функционировании ЩЖ, в условиях природного дефицита может быть рекомендован дополнительный лечебно-профилактический прием этих микроэлементов.
Целью нашего исследования было оценить эффективность применения фиксированной комбинации йода и селена, ее влияние на клиническое течение наиболее распространенной патологии щитовидной железы.
Материалы и методы
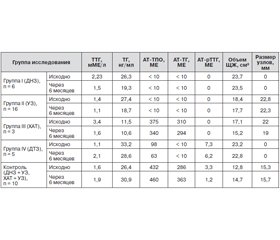
Основная группа состояла из 30 больных с различной патологией ЩЖ — диффузным нетоксическим зобом (ДНТ), узловым и многоузловым зобом (УЗ), хроническим аутоиммунным тиреоидитом (ХАТ), диффузным токсическим зобом в стадии компенсации. У всех пациентов исходно и через 6 месяцев проводили ультразвуковое исследование (УЗИ) ЩЖ с характеристикой ее объема (см3) по методике Брун, эхогенности, структурной однородности, наличия дополнительных образований (узлов); определяли концентрацию в сыворотке крови тиреотропного гормона (ТТГ) гипофиза — скрининг функции ЩЖ (норма — 0,4–4,0 мМЕ/л), тиреоглобулина (ТГ) — официального маркера йодного дефицита по критериям ВОЗ (1994) [16, 17] (норма — менее 10 мг/мл), антител к ТПО и ТГ, в некоторых случаях — к рецептору ТТГ (АТ-рТТГ). На протяжении всего периода исследования (6 месяцев) без перерывов пациенты основной группы получали фиксированную комбинацию йода (150 мкг) и селена (75 мкг) 1 раз в сутки в виде таблетированного препарата Йосен®. Они были распределены на группы в зависимости от нозологии: I группа (n = 6, средний возраст — 39,0 ± 2,1 года) — с ДНЗ; II группа (n = 16, средний возраст — 38,0 ± 2,1 года) — с узловым или многоузловым зобом; III группа (n = 3, средний возраст — 41,0 ± 2,1 года) — с ХАТ; IV группа (n = 5, средний возраст — 48,0 ± 2,1 года) — с ДТЗ. Контрольная группа состояла из больных ДНЗ и ХАТ в сочетании с узловым зобом (n = 10, средний возраст — 41,0 ± 2,1 года).
Статистическая обработка проводилась с применением методов вариационной статистики путем расчета средних значений (М ± m, t-критерия Стьюдента). При расчете статистической значимости уровень р ≤ 0,05 считали статистически достоверным. В малочисленных выборках для определения ассоциированности данных по величине использовали непараметрический коэффициент ранговой корреляции Спирмена.
Результаты исследования
В процессе использования препарата Йосен® наибольший интерес представляла безопасность его применения, в том числе на фоне уже существующей тиреоидной патологии, так как вопрос применения препаратов йода при аутоиммунных заболеваниях остается дискутабельным. Исследование показало, что применение фиксированной комбинации йода и селена является безопасным не только при наличии йододефицитной патологии ЩЖ, но и при аутоиммунных заболеваниях. Во всех подгруппах отсутствовало нарастание титра антитиреоидных антител (табл. 1).
Применение фиксированной комбинации йода (150 мкг) с селеном (75 мкг) во всех подгруппах в течение 6 месяцев у пациентов с различной тиреоидной патологией позволило стабилизировать клиническое течение заболевания. За время наблюдения отсутствовали нарастание титра антител, увеличение объема ЩЖ и размера узлов, появление новых узлов. Наблюдалось умеренное снижение уровня ТТГ ближе к середине идеального значения, а также уровня ТГ (табл. 1).
Восполнение йода в физиологическом количестве (150 мкг/сутки) сопровождается постепенным восстановлением его метаболизма в ЩЖ, без дальнейшего ухудшения ее функции, что подтверждается достоверным снижением уровня ТГ в сыворотке крови за 6 месяцев с умеренного йодного дефицита до легкого у подавляющего большинства пациентов (рис. 1).
/120/120.jpg)
Использование препарата йода в фиксированной дозировке позволяет надежно доставить в организм известное его количество, благодаря чему отсутствовала прогрессия имеющейся тиреоидной патологии: ДНЗ, УЗ, ДТЗ, ХАТ (рис. 2, 3).
/120/120_2.jpg)
Добавление селена в физиологическом количестве (75 мкг) позволяет не только обеспечить восполнение его дефицита, но и дополнительно улучшить усвоение йода и избежать каких-либо негативных влияний на аутоиммунные процессы в ЩЖ, одновременно потенцируя их контроль.
Таким образом, применение фиксированной комбинации йода с селеном является безопасным и эффективным мероприятием.
Выводы
1. Применение фиксированной комбинации йода и селена в физиологических дозах (Йосен®) является безопасным не только при наличии йододефицитной патологии ЩЖ, но и при аутоиммунных заболеваниях, что подтверждается стабилизацией и отсутствием нарастания титра антитиреоидных антител.
2. Использование препарата йода в фиксированной дозировке позволяет надежно доставить в организм известное его количество, благодаря чему отсутствовала прогрессия имеющейся тиреоидной патологии: ДНЗ, УЗ, ДТЗ, ХАТ.
3. Восполнение йода в физиологическом количестве (150 мкг/сутки) сопровождается постепенным восстановлением его метаболизма в ЩЖ, что подтверждается достоверным снижением уровня тиреоглобулина в сыворотке крови.
4. Добавление селена в физиологическом количестве (75 мкг/сутки) позволяет не только обеспечить восполнение его дефицита, но и дополнительно улучшить усвоение йода и избежать каких-либо негативных влияний на аутоиммунные процессы в ЩЖ, одновременно потенцируя их контроль.
1. WHO. Assessment of the Iodine Deficiency Disorders and monitoring their elimination: a guide for programme managers, 3rd ed. [Text] / WHO. — Geneva, 2007. — P. 1–98.
2. UNICEF Ukraine. AWP: Micronutrient malnutrition Project: Elimination of Iodine Deficiency: Request for Applications // UNICEF Ukraine. — 2009. — Р. 22. — Доступ: http://www.unicef.org/ukraine.doc.
3. ICCIDD: The Iodine Global Network. — 2015. — Доступ: http://www.ign.org.
4. Дзахмишева И.Ш. Профилактика йододефицита функциональными продуктами питания // Фундаментальные исследования. — 2013. — № 10. — С. 2418–2421. — Доступ: http://rae.ru/fs/pdf/2013/10–11/32806.pdf/
5. Факти для життя. Довідковий посібник. Розроблено спільно Представництвами Дитячого фонду ЮНІСЕФ в Україні, Білорусії та Російській Федерації. Київ — Мінськ — Москва, березень 2008 р. — 192 с. — Доступ: http://www.unicef.org/ukraine/ukr/6_FFL_Chernobyl_Edition.pdf/
6. Karanikas G. No immunological benefit of selenium in consecutive patients with autoimmune thyroiditis / G. Karanikas, M. Schuetz, S. Kontur et al. // Thyroid. — 2008. — № 18. — Р. 7–12.
7. Pizzulli A. Selenium deficiency and hypothyroidism. A new etiology in the differential diagnosis of hypothyroidism in children [Text] / A. Pizzulli, A. Ranjbar // Biological Trace Element Research. — 2000. — Vol. 77, № 3. — P. 199–208.
8. Emerson C.H. A Personalized Medicine Month in Minneapolis, Minnesota [Text] / C.H. Emerson // Thyroid. — 2010. — V. 20, № 4. — P. 355–356.
9. Hercberg S. The SU.VI.MAX Study: a randomized, placebo-controlled trial of the health effects of antioxidant vitamins and mineral / S. Hercberg, P. Galan, P. Preziosi et al. // Arch. Intern. Med. — 2004. — Vol. 164, № 21. — Р. 2335–2342.
10. Duntas L.H. Environmental factors and autoimmune thyroiditis / L.H. Duntas // Nature Clinical Practice Endocrinology and Metabolism. — 2008. — № 4. — Р. 454–460.
11. Toulis K.A. Selenium supplementation in the treatment of Hashimoto’s thyroiditis: a systematic review and a meta-analysis / K.A. Toulis, A.D. Anastasilakis, T.G. Tzellos et al. // Thyroid. — 2010. — № 20. — Р. 1163–1173.
12. Turker O. Selenium treatment in autoimmune thyroiditis: 9-month follow-up with variable doses / O. Turker, K. Kumanlioglu, I. Karapolat et al. // Journal of Endocrinology. — 2006. — 190. — Р. 151–156.
13. Gärtner R. Selenium in the treatment of autoimmune thyroiditis / R. Gärtner, B.C.H. Gasnier // BioFactors. — 2003. — № 19. — Р. 165–170.
14. Mazokopakis E.E. Effects of 12 months treatment with L-selenomethionine on serum anti-TPO Levels in Patients with Hashimoto’s thyroiditis / E.E. Mazokopakis, J.A. Papadakis, M.G. Papadomanolaki et al. // Thyroid. — 2007. — № 17. — Р. 609–612.
15. Nacamulli D. Influence of physiological dietary selenium supplementation on the natural course of autoimmune thyroiditis / D. Nacamulli, C. Mian, D. Petricca et al. // Clinical Endocrinology. — 2010. — Vol. 73. — Р. 535–539.
16. WHO/ICCIDD/UNICEF. Indicators for Assessing Iodine Deficiency Disorders and Their Control Through Salt Iodization. — Geneva, Switzerland: World Health Organization; 1994.
17. Thyroglobulin іs a Sensitive Measure of Both Deficient and Excess Iodine Intakes in Children and Indicates No Adverse Effects on Thyroid Function in the UIC Range of 100–299 µg/L: A UNICEF/ICCIDD Study Group Report / M.B. Zimmermann, I. Aeberli, M. Andersson et al. // J. Clin. Endocrinol. Metab. — 2013. — № 98(3). — Р. 1271–80.

/119/119.jpg)