Международный эндокринологический журнал 2 (66) 2015
Вернуться к номеру
Цитологічна діагностика аспіратів вузлів щитоподібної залози
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 164-179
Методичні рекомендації
Установа-розробник:
Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ
Автори:
Ларін О.С. — д.м.н., професор, директор Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України
Хоперія В.Г. — д.м.н., завідувач відділу ендокринної патоморфології
Гузь О.О. — науковий співробітник відділу ендокринної патоморфології
Гирявенко О.Я. — к.б.н., старший науковий співробітник
Белемець Н.І. — молодший науковий співробітник відділу ендокринної патоморфології
Вступ
Тонкоголкова аспіраційна пункційна біопсія (ТАПБ) стала домінуючим методом у діагностиці захворювань щитоподібної залози (ЩЗ). ТАПБ — це швидкий, надійний, безпечний, мінімально інвазійний, економічний і високоефективний метод скринінгу вузлів ЩЗ [1]. За результатами цитологічного дослідження вірогідність діагнозу раку ЩЗ (РЩЗ) становить понад 90 % [22]. Застосування ТАПБ дозволяє зменшити на 25–50 % кількість хірургічних втручань з приводу доброякісних утворень ЩЗ [24] і збільшити відсоток операцій з приводу злоякісних пухлин органа більше ніж на 50 % [20]. Проте навіть за умов дослідження адекватних цитологічних препаратів даний метод має певні обмеження, що призводить до появи невизначених результатів у 13–30 % усіх випадків [4, 5]. У таких цитологічних препаратах ознаки доброякісних і злоякісних пухлин ЩЗ є схожими, що ускладнює цитологічний аналіз і призводить до діагностичних помилок: хибнопозитивних і хибнонегативних результатів. Питання оптимальної передопераційної діагностики в пацієнтів із цитологічно підозрілими або сумнівними вузлами ЩЗ за даними ТАПБ залишається актуальним вже понад 15 років [28]. Сумнівна цитологічна категорія включає такі варіанти: атипія непевного значення, фолікулярна/Б-клітинна неоплазія, підозра на неоплазію, клітинне фолікулярне утворення, неможливо виключити неоплазію, атипова фолікулярна проліферація, гіперпластичний фолікулярний вузол. Диференціальна діагностика цих варіантів включає фолікулярну аденому, атипову аденому, фолікулярний рак і фолікулярний варіант папілярного раку (ПР) ЩЗ. За відсутності адекватних, чітко описаних цитологічних ознак для даної категорії ТАПБ дуже важко визначити ризики малігнізації, а отже, і подальшу тактику лікування пацієнтів.
У даних рекомендаціях обговорюються питання диференціальної діагностики фолікулярних утворень, цитологічні критерії, терміни, нещодавно запропоновані цитопатологічним товариством Папаніколау (Papanicolaou Society of cytopathology — PSC), Системою цитологічних висновків Бетезда (Bethesda System for Reporting Thyroid Cytopathology, 2010), і клінічне застосування різних діагностичних категорій.
Діагностична термінологія та морфологічні критерії цитологічної діагностики захворювань щитоподібної залози
ТАПБ виявилася ефективним інструментом у виборі тактики лікування пацієнтів із вузловим зобом [1–28]. Його основною метою є забезпечення раціонального підходу в лікуванні та визначення за необхідності обсягу хірургічного втручання. Зараз не існує стандартів цитологічних висновків ТАПБ ЩЗ [22, 29, 30]. Нещодавно на підставі накопиченого досвіду запропоновано кілька класифікаційних схем цитологічних висновків ТАПБ вузлів ЩЗ (PSC, Американська тиреоїдна асоціація — АТА, Американська асоціація клінічних ендокринологів — ААКЕ, табл. 1) [22, 31, 32]. Аналіз опитування щодо сприйняття діагностичної термінології цитологічних висновків ТАПБ ЩЗ показав розбіжності серед патологоанатомів і клініцистів [1].
Більшість досліджень підтримують багаторівневі системи класифікації ТАПБ ЩЗ, що містять 3–6 (або більше) діагностичних категорій. Найбільш часто використовується шестикатегорійна діагностична схема, що включає доброякісні утворення, утворення (атипії) непевного значення, фолікулярні новоутворення, підозрілі, злоякісні й неінформативні [1, 5–7]. Зазвичай вважається необов’язковим висновок про ризик злоякісності для кожної діагностичної категорії. Отже, існує загальна підтримка використання багаторівневої системи класифікації, а вказівки щодо ризику злоякісності можуть бути передані клініцисту в усній формі.
Потенційна багаторівнева схема класифікації (табл. 2):
І. Доброякісні:
А. Низький ризик злоякісності.
Б. Ця категорія включає такі захворювання (але не лише їх):
— вузловий зоб;
— хронічний лімфоцитарний тиреоїдит;
— гіперпластичні/аденоматозі вузли на тлі багатовузлового зоба.
В. Пацієнти з доброякісними вузлами підлягають клінічному спостереженню з періодичним ультразвуковим дослідженням і повторною ТАПБ у разі збільшення розміру вузла.
ІІ. Фолікулярне утворення/атипії непевного значення:
А. Гетерогенна категорія, що включає випадки, які не можуть бути класифіковані як доброякісні новоутворення або фолікулярна неоплазія.
Б. Цитологічні критерії не є переконливо доброякісними, але ступінь клітинної або архітектурної атипії недостатній для висновку «фолікулярна неоплазія» або «підозра на злоякісний процес».
В. Деякі з цих випадків хибно відносять до цієї категорії з причини інтерпретації неадекватних цитологічних препаратів (наприклад, невелика кількість клітин, неякісна фіксація, кров’янистий препарат).
Г. Ризик злоякісності 5–10 %.
Д. Підлягає повторній ТАПБ і кореляції з клінічними й ультразвуковими дослідженнями.
Е. Додаткова категорія. Автори заохочують мінімізацію її використання.
/172/172.jpg)
ІІІ. Фолікулярна неоплазія/підозра на фолікулярну неоплазію:
А. Ризик злоякісності 20–30 %.
Б. До цієї категорії відносять непапілярні фолікулярні утворення/неоплазії та Гюртле-клітинні утворення/неоплазії.
В. За результатами більшості досліджень, близько 20 % випадків таких уражень ЩЗ визначаються як злоякісні після хірургічного видалення. Цей відсоток може бути вищим у випадках Гюртле-клітинних вузлів, якщо розмір вузла дорівнює або перевищує 3,5 см у найбільшому вимірі.
Г. Інші діагностичні терміни, що належать до цієї категорії:
— мікрофолікулярна проліферація/ураження;
— підозра на неоплазію:
— фолікулярна неоплазія.
Д. Більшості пацієнтів із цим діагнозом виконують лобектомію/гемітиреоїдектомію з експрес-гістологічним дослідженням під час операції та подальшою диференціальною діагностикою (аденоматозний вузол vs аденома vs карцинома).
Е. Альтернативний термін «підозра на фолікулярну неоплазію» є прийнятним.
Деякі лабораторії надають перевагу даному терміну завдяки можливості моніторингу: у близько 25 % таких випадків діагноз неоплазії не підтверджується.
IV. Підозра на злоякісний процес:
А. Термін може бути використаний у випадках підозри:
— на папілярний рак — у більшості випадків (50–75 %) виявляється фолікулярний варіант ПР (ФВПР);
— медулярний рак (МР) (стосується випадків з обмеженою кількістю препаратів для імуноцитохімічного дослідження з антитілами проти кальцитоніну. Для підтвердження підозри цитологічний висновок має включати рекомендацію щодо визначення рівня сироваткового кальцитоніну);
— інший злоякісний процес:
а) підозра на лімфому (може включати рекомендації щодо повторної ТАПБ із проточною цитометрією);
б) метастатичну/вторинну пухлину ЩЗ;
в) неоплазію через тотальний некроз клітин (наприклад, анапластичний рак (АР)).
V. Злоякісні.
VI. Неінформативні:
— за рахунок обмеженої кількості клітин;
— відсутності клітин фолікулярного епітелію;
— неправильної фіксації препаратів.
Може бути рекомендоване проведення повторної ТАПБ.
Діагностична термінологія доброякісних/непухлинних захворювань ЩЗ
Діагностична термінологія для доброякісних уражень ЩЗ, що застосовується в літературі, включає поняття «вузловий зоб», «хронічний лімфоцитарний тиреоїдит», «гіперпластичний/аденоматозний вузол» і «колоїдний вузол» (термін «колоїдний вузол» можна використовувати у випадках, коли на аспіратах виявляється рясний колоїд, але з адекватною для інтерпретації кількістю клітин. Якщо повторній аспірат із вузла містить в основному колоїд і кілька фолікулярних клітин, можна використовувати термін «імовірний колоїдний вузол») [8–12].
1. Термін «доброякісний» може також застосовуватися для неопластичних уражень (аденом). Інші терміни, що використовують замість «доброякісний»:
— негативний щодо злоякісності;
— не неопластичний.
2. На підставі офіційних обговорень більшість респондентів у групі патологів і лікарів згодні з терміном «доброякісний».
Діагностична термінологія для потенційно злоякісних/підозрілих утворень
Ця категорія позначається окремим діагностичним терміном «підозра на злоякісність» [13–29], а також «підозра на папілярний рак». У цих випадках рекомендують проведення експрес-гістологічного дослідження, адже встановлення діагнозу РЩЗ під час проведення операції дозволить виконати радикальну за обсягом операцію в один етап [30–35]. Термін «сумнівний» використовується лише для потенційно злоякісних утворень ЩЗ.
Діагностична термінологія для неопластичних/злоякісних захворювань ЩЗ
До термінів, запропонованих для діагностики пухлинних захворювань у випадках, коли неможливо знайти відмінність між доброякісним і злоякісним процесом (наприклад, клітинний аденоматозний вузол, фолікулярна аденома та фолікулярний рак), відносять: «фолікулярне утворення», «фолікулярна проліферація», «фолікулярна неоплазія (фолікулярна або Гюртле-клітинна)», а також «не можна виключити фолікулярне утворення/неоплазію» [7, 13–29, 36–53].
На сьогодні такий цитологічний висновок найчастіше використовується у випадках вузлів ЩЗ мікрофолікулярної будови, до яких входять клітинні аденоматозні вузли, фолікулярна аденома, фолікулярний рак, а також фолікулярний варіант папілярного раку. Диференціальну діагностику між доброякісним і злоякісним фолікулярним утворенням проводять під час дослідження серійних зрізів капсули пухлини на підставі виявлення капсулярної та/або судинної інвазії [54–74]. Крім того, не існує чітких цитологічних критеріїв для встановлення характеру процесу у випадках фолікулярної та Гюртле-клітинної неоплазії [12, 27, 55]. Більше того, існує велика кількість доброякісних станів, таких як тиреоїдит, післялікувальний ефект, аденоматозні вузли, при яких можуть визначаться цитологічні ознаки атипії [56–59]. Будь-який діагностичний термін, що вказує на «фолікулярну неоплазію», слід використовувати лише у випадках, коли хірургічне видалення необхідно для диференціальної діагностики між аденомою та карциномою (на підставі інвазійних характеристик). Деякі клініцисти вважають, що в таких випадках для уточнення діагнозу необхідно проводити повторну ТАПБ [60–66], а інші вважають, що повторна пункція може бути корисною лише для неінформативних та атипових випадків через обмежений клітинний матеріал [61]. Повторна ТАПБ супроводжується ризиком виявлення цитологічних ознак репаративної атипії фолікулярних клітин, що помилково приймають за неопластичні/злоякісні захворювання. З метою уникнення репаративних змін повторну ТАПБ слід проводити в основному у випадках діагнозу «фолікулярне утворення непевного значення» не раніше ніж через 3 місяці після первинної пункції [67].
До злоякісних утворень ЩЗ, що можуть бути діагностовані під час цитологічного аналізу аспіратів ТАПБ, належать: папілярний рак і його різновиди, медулярний рак, анапластичний рак, лімфома, низькодиференційований рак і метастази [11, 68].
1. Пухлини ЩЗ фолікулярної будови можна розділити на дві категорії:
— фолікулярне утворення, або атипові клітини непевного значення: потенційні кандидати для повторної ТАПБ;
— фолікулярна неоплазія або підозра на фолікулярну неоплазію: потенційний кандидат на хірургічне лікування.
2. Можлива термінологія для неоплазій фолікулярної будови:
— найчастіше використовуються терміни «фолікулярна неоплазія» або «фолікулярне утворення»;
— «клітинне фолікулярне утворення».
3. Діагностичні критерії злоякісних утворень ЩЗ добре описано та ілюстровано. Цитологічний висновок «папілярний рак ЩЗ» ґрунтується на характерних ядерних ознаках і структуральних характеристиках (для визначення варіантів). Діагноз медулярного раку встановлюється на підставі характерних цитоморфологічних ознак, а також за результатами імуноцитохімічного дослідження з кальцитоніном і тиреоглобуліном.
Морфологічні критерії доброякісних і непухлинних захворювань ЩЗ
У випадках доброякісних цитологічних висновків стандартного цитологічного аналізу аспіратів вузлів ЩЗ за результатами остаточного гістологічного дослідження виявляються колоїдні кістоподібно-дегенеруючі аденоми, колоїдні вузли нормо- та макрофолікулярної будови.
Цитологічні ознаки вузлового макрофолікулярного, змішаного макро-мікрофолікулярного зоба
Перераховані вище терміни охоплюють такі клінічні поняття, як вузловий зоб і дифузне збільшення ЩЗ, і можуть застосовуватися у визначенні доброякісних і гіперпластичних процесів або процесу невідомої етіології. Залежно від гормонального статусу виділяють токсичний і нетоксичний гіпотиреоз, еутиреоз або гіпертиреоз [12, 69].
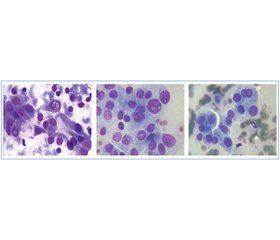
Цитологічні ознаки аспіратів вузлів макрофолікулярної будови (рис. 1) залежно від методу забарвлення препарату:
— значна кількість колоїду (зазвичай блакитного кольору, «дротяна сітка» — артефакт унаслідок повітряної фіксації препаратів;
— фолікулярні клітини, невеликі за розмірами, округлої або овальної форми, з гіперхромними ядрами, розташовані у вигляді моношарових пластів, груп з утворенням фолікулів або розрізнено [11, 70]. Цитоплазма фолікулярних клітин, як правило, без чітких контурів, мізерна, з численними дрібними синьо-чорними гранулами [70];
— у випадках кістозно-дегенеруючих вузлів цитологічні препарати мають ознаки кістозних змін: епітеліальні клітини нашаровуються одна на одну, розташовані невеликими групами, контури їх нечіткі, цитоплазма вакуолізована. Тло препарату представлене елементами крові, макрофагами та гістіоцитами;
— макрофаги, як правило, заповнені гранулами гемосидерину [70, 71].
Особливості цитологічного дослідження аспіратів гіперпластичних/аденоматозних вузлів
На відміну від аспіратів вузлів із кістозними змінами, цитологічні препарати гіперпластичних/аденоматозних вузлів ЩЗ містять велику кількість фолікулярного епітелію, що може бути причиною хибної інтерпретації на користь фолікулярної неоплазії (рис. 2).
Виявляються цитологічні ознаки гіперплазії та помірного плеоморфізму епітелію. Цитоплазма фолікулярних клітин рясна, вакуолізована, з нечіткими контурами. Епітеліальні ядра кулясті, добре забарвлені, різні за розмірами. У цитоплазматичних вакуолях виявляється колоїд блідого або рожевого кольору. У середині клітинних пластів визначаються скупчення зрілих лімфоцитів.
Дифузний токсичний зоб (хвороба Грейвса)
Хвороба Грейвса (ХГ) — системне автоімунне захворювання, що розвивається внаслідок вироблення антитіл до рецептора тиреоторопного гормона, клінічно проявляється дифузним збільшенням ЩЗ із розвитком синдрому тиреотоксикозу в поєднанні з екстратиреоїдною патологією: ендокринною офтальмопатією, претибіальною мікседемою, акропатією [12, 69, 73].
Зазвичай дифузне збільшення ЩЗ у пацієнтів із ХГ не розглядається як показання для проведення ТАПБ за винятком випадків виявлення вузлів у залозі.
Цитологічні ознаки аспіратів вузлів ЩЗ на тлі дифузного токсичного зоба:
— аспірати характеризуються високою клітинністю та аналогічними цитологічними ознаками з аспіратами гіперпластичних/аденоматозних вузлів; поміж клітин фолікулярного епітелію виявляються зрілі лімфоцити та онкоцитарні клітини;
— клітини фолікулярного епітелію розташовано у вигляді нещільних угрупувань із чіткими ядерцями та рясною еозинофільною цитоплазмою;
— інколи в ядрах фолікулярного епітелію виявляються зони просвітлення та, рідше, ядерні включення, проте інші ядерні ознаки, характерні для ПР ЩЗ, відсутні [74–77].
Автоімунний тиреоїдит
Уперше автоімунний тиреоїдит описано Хашимото в 1912 році. Захворювання характеризується атрофією фолікулярного епітелію, появою Гюртле-клітинної метаплазії та дифузної лімфоцитарної інфільтрації. Найчастіше тиреоїдит Хашимото трапляється у жінок, співвідношення жінок і чоловіків становить близько 10 : 1.
Унаслідок автоімунного ураження ЩЗ виробляються антитіла до різних компонентів залози (тиреоглобуліну, мікросомальної фракції) з утворенням комплексу антиген-антитіло, розвитком деструктивних змін і лімфоцитарною інфільтрацією залози. Переважання цитостимулючих антитіл обумовлює гіпертрофічну форму автоімунного тиреоїдиту, переважне вироблення цитотоксичних антитіл призводить до атрофічної форми, при осередковій формі співвідношення антитіл може бути різним [69]. ТАПБ проводиться пацієнтам із хронічним лімфоцитарним тиреоїдитом, у яких під час УЗД ЩЗ виявляються вузли [78–80].
Цитологічні ознаки аспіратів вузлів ЩЗ на тлі хронічного лімфоцитарного тиреоїдиту (рис. 3):
— колоїд у препаратах у незначній кількості, також виявляються гігантські багатоядерні клітини та епітеліальні клітини з ознаками плоскоклітинної метаплазії;
— поміж клітин фолікулярного епітелію виявляються лімфоцити різного ступеня зрілості, а в деяких випадках — лімфоїдні фолікули;
— фолікулярні клітини з нерівними контурами, іноді зруйновані або з ознаками атипії, трапляються скупчення Б-клітин;
— у клітинах Гюртле, подібно до фолікулярного епітелію, виявляються ознаки ядерної атипії, іноді зони просвітлення хроматину та борозни, проте ядра таких клітин округлої форми з чіткими ядерцями. Отже, слід утримуватися від хибної інтерпретації цих змін як злоякісних [39, 78, 80];
— папілярний рак, що виникає на тлі тиреоїдиту, розглядається як окрема популяція, позбавлена лімфоцитарного інфільтрату і з відповідними ядерними ознаками [12, 81]. У деяких аспіратах лімфоцитарного тиреоїдиту переважають клітини Гюртле, що призводить до хибної діагностики Гюртле-клітинної неоплазії. Такий діагноз встановлюється у випадках, коли аспірат містить лише клітини Гюртле та позбавлений лімфоцитарного інфільтрату;
— у деяких випадках одноманітні клітини лімфоцитарного інфільтрату нагадують ознаки злоякісної лімфоми [57–59, 82].
Морфологічні критерії фолікулярних пухлин ЩЗ
Мікрофолікулярні пухлини ЩЗ
Група пухлин ЩЗ мікрофолікулярної будови (фолікулярні неоплазії) включає пухлини, для яких характерний високий рівень проліферації клітин, а злоякісність процесу встановлюється лише під час гістологічного дослідження серійних зрізів капсули пухлини, за наявності інвазії капсули або судин. До даної групи пухлин входять: мікрофолікулярна аденома, трабекулярна аденома, аденома із клітин Гюртле, атипова аденома, фолікулярний рак, фолікулярний варіант папілярного раку [13, 14, 16–19, 26, 27, 38]. Зараз дана група гетерогенних пухлин ЩЗ є діагностично «сірою зоною» у морфологічній діагностиці захворювань ЩЗ, тому що навіть після повторного цитологічного дослідження препаратів, які були сумнівними за результатами стандартного цитологічного дослідження, відрізнити доброякісний процес від злоякісного неможливо [84, 85]. За результатами деяких досліджень, діагноз ФР ЩЗ підтверджується гістологічно лише у 20–30 % випадків із цитологічним висновком «фолікулярна неоплазія», тоді як більшість відповідає фолікулярній аденомі (ФА) або атиповій аденомі (АА) [7, 28, 51].
Зазвичай у цитологічних аспіратах фолікулярних неоплазій виявляється значна кількість клітин фолікулярного епітелію, що формують трабекулярні або фолікулярні структури, у центрі яких виявляється щільний колоїд. Іноді такі структури зливаються, утворюючи синцитій, де ядра епітеліальних клітин втрачають полярність. Ядра тиреоцитів великі за розмірами, овальної або кулястої форми, часто нашаровуються. Під час цитологічного дослідження аспіратів таких пухлин виявляються різні ознаки атипії ядер.
Цитологічні ознаки фолікулярної неоплазії (рис. 4, 5):
— значна кількість клітин фолікулярного епітелію з мінімальною кількістю колоїду;
— клітини, як правило, розташовано в тривимірних структурах або у вигляді мікрофолікулів із нашаруванням ядер;
— у деяких випадках виявляються ознаки ядерної атипії, що не є діагностичним критерієм злоякісності, так як у випадках доброякісних вузлів також визначаються ознаки атипії ядер [14, 16, 18];
— виявлення мікрофолікулярних структур під час цитологічного аналізу аспіратів вузлів ЩЗ є діагностичним критерієм фолікулярної неоплазії (аденоми або карциноми) [43, 86–89], причому мікрофолікулярні структури, що складаються з осередків фолікулярних клітин (щонайменше 15 клітин), мають становити дві третини клітинного матеріалу препарату [90];
— деякі автори для діагностики фолікулярної неоплазії пропонують застосовувати термін «мікрофолікулярне утворення». Проте за результатами більшості досліджень мікрофолікулярні аспірати можуть відповідати доброякісним, гіперпластичним та аденоматозним пухлинам залози [90]. Інші автори пропонують застосовувати висновок «фолікулярна неоплазія» при виявленні в цитологічних препаратах монотонної популяції клітин, розташованих у вигляді мікрофолікулярних структур із густим колоїдом всередині та нашаруванням ядер [14, 28].
Пухлини із клітин Гюртле
Термін «Гюртле-клітинна пухлина» ЩЗ позначає безліч пухлин, утворених виключно або переважно з фолікулярних клітин з еозинофільною цитоплазмою та збільшеними, округлими ядрами із чіткими ядерцями [91–93]. Відповідно до нового керівництва класифікації пухлин ЩЗ ВООЗ (2004) термін «онкоцитарний» замінено на «Гюртле-клітинний» [94]. Клітини Гюртле походять із фолікулярного епітелію та мають численні великі мітохондрії. Спочатку такі клітини, описані Hürthle 1894 року, вважали парафолікулярними або С-клітинами, а 1898 року Askanazy описав їх як оксифільні клітини. Пізніше за результатами імуногістохімічного дослідження визначено, що ці клітини виробляють тиреоглобулін, а кальцитонін у них відсутній [91, 95].
Клітини Гюртле не є специфічними для жодної патології ЩЗ, вони виявляються на тлі вузлового зоба, хронічного лімфоцитарного тиреоїдиту, гіпертиреозу, а також у ЩЗ осіб похилого віку й пацієнтів, які зазнали іонізованого опромінення ділянки голови та шиї [91, 93, 96, 97]. За таких умов клітини Гюртле трапляються у вигляді декількох фолікулів як прояв метапластичних змін або погано обмежених неінкапсульованих псевдовузлів. Найчастіше такі зміни відповідають дегенеративним/атрофічним змінам фолікулярного епітелію та виявляються на тлі хронічного лімфоцитарного тиреоїдиту [98]. Деякі автори класифікують пухлини з клітин Гюртле в окрему категорію пухлин ЩЗ через їх агресивнішу поведінку [99, 100]. Карциноми з клітин Гюртле характеризуються більшою схильністю до метастазування в регіонарні лімфатичні вузли та розвитку віддалених метастазів порівняно з ФР ЩЗ. Більше того, на відміну від інших карцином фолікулярного походження рак із клітин Гюртле рідко здатний до накопичення радіоактивного йоду, що обумовлює гірший прогноз [91–93, 98, 100]. Крім того, нещодавно молекулярні дослідження показали значні генетичні відмінності між Гюртле-клітинними та іншими пухлинами фолікулярного походження [101–105].
Клінічні особливості Гюртле-клітинних пухлин
Середній вік пацієнтів, у яких виявляються аденома або карцинома з клітин Гюртле, коливається від 46 до 50 років. З однаковою частотою ці пухлини трапляються в чоловіків і жінок. Проте, за результатами деяких досліджень, злоякісні пухлини з клітин Гюртле частіше виявляються серед чоловіків [91, 98, 106]. Як і у випадку непапілярних пухлин ЩЗ фолікулярного походження, діагноз злоякісного процесу для пухлин із клітин Гюртле встановлюється під час гістологічного дослідження за наявності ознак інвазії капсули або судин. Отже, неможливо відрізнити Гюртле-клітинну аденому від карциноми на підставі цитологічного аналізу аспіратів ТАПБ [107, 108].
Цитологічні ознаки аспіратів пухлин (доброякісних і злоякісних) із клітин Гюртле (рис. 6):
— виявляються лише популяції клітин Гюртле на тлі мінімальної кількості колоїду;
— епітеліальні клітини розташовано у вигляді одношарових пластів, фолікулярних груп або розрізнено [109]. Деякі автори припускають, що дисперсно розташовані клітини Гюртле більш характерні для злоякісного процесу, ніж для аденоми. Проте таке припущення вимагає подальшого дослідження [98, 109]. Більше того, дисперсія клітин частіше буває наслідком техніки приготування аспіратів, ніж ознакою злоякісності;
— часто виявляються ознаки ядерної атипії клітин Гюртле: збільшення розмірів ядер, багатоядерність, плеоморфізм, промінентні ядерця. Деякі автори вважають такі ознаки ядерної атипії цитологічними критеріями карциноми з клітин Гюртле, проте подібні ознаки характерні й для вузлів, що виникають на тлі лімфоцитарного тиреоїдиту, хвороби Грейвса, а також як наслідок проведення ТАПБ [110, 111].
Морфологічні критерії злоякісних пухлин ЩЗ
Високодиференційований РЩЗ — найпоширеніша форма злоякісних пухлин залози. Найбільш часто він виявляється в пацієнтів молодого віку, а низькодиференційований та анапластичний РЩЗ більше поширені серед літніх пацієнтів. Для більшості високодиференційованих пухлин характерна неагресивна поведінка та сприятливий прогноз. 5-річне виживання становить понад 90–95 %. Проте смертність у 6–10 % залишається незмінною протягом останніх 40 років [69].
Папілярний рак щитоподібної залози
Папілярний рак є найбільш поширеною формою злоякісних пухлин ЩЗ і становить близько 80 %. Зазвичай виявляється у віці до 40 років, частіше в жінок. Це найбільш поширена форма дитячого раку ЩЗ. ПР ЩЗ характеризується сприятливим прогнозом і високою ймовірністю одужання. Проте деякі його гістологічні варіанти мають агресивну поведінку, розвивають віддалені метастази та можуть стати причиною смерті. ПР найчастіше метастазує лімфатичними судинами, рідше — кровоносними [69].
Цитологічні ознаки папілярного раку та його варіантів
ПР — єдина форма злоякісного процесу ЩЗ, що діагностується на підставі характерних ядерних ознак незалежно від цитоплазматичних особливостей, характеру росту, методу забарвлення препаратів та імуногістохімічних маркерів. Це твердження справедливе для більшості випадків ПР. Однак декілька гістологічних варіантів ПР можуть становити діагностичні труднощі [11, 114, 115].
Цитологічні препарати аспіратів ПР, як правило, містять велику кількість клітин, які розташовані у вигляді папілярних структур, тривимірних кластерів, окремих клітин або є комбінацією усіх трьох моделей (рис. 7).
Тло препарату може бути представлене колоїдом, ядерним детритом, макрофагами, фрагментами строми [11].
Колоїд у препаратах ПР, як правило, щільний, у вигляді депозитів округлої або овальної форми. У препаратах, забарвлених за методом Май-Грювальда — Гімзи, колоїд може змінювати колір від темно-рожевого до пурпурного.
У препаратах виявляється різна кількість макрофагів, пропорційна до кістозного компонента пухлини.
Фрагменти строми ПР виявляються у вигляді обривків тонкої сполучної тканини, оточених епітеліальними клітинами або позбавлених них [11]. Візитною карткою у цитологічній діагностиці ПР є характерні ядерні ознаки.
Виявляються окремі клітини збільшеного розміру, в основному овальної форми, проте також є округлі клітини. Цитоплазма клітин ПР еозинофільна, як правило, з нечіткими контурами [11].
Ядра клітин ПР великі за розмірами, кулястої або овальної форми, блідо-блакитного кольору, з тонким сітчастим хроматином. У ядрах виявляються численні, різні за розмірами ядерця, часто спостерігається анізокаріоз і нашарування, часто містяться окремі включення внаслідок інвагінації каріолеми. Ядерні включення можуть мати різні розміри, бути поодинокими та численними, розташовуватися центрально або ексцентрично. Істинні внутрішньоядерні включення мають той же колір, що й цитоплазма [11, 72, 114].
Внутрішньоядерні включення можуть також виявлятися в деяких доброякісних і злоякісних пухлинах ЩЗ. До них належать тиреоїдит Хашімото, вузловий зоб, гіалінізована трабекулярна аденома, аденома з клітин Гюртле й медулярний рак. Деякі автори вважають гіалізовану трабекулярну пухлину варіантом ПР, випадки Гюртле-клітинних пухлин із характерними для ПР ядерними ознаками — Гюртле-клітинним варіантом ПР [116, 117]. Очевидно, що цитологічний діагноз ПР має ґрунтуватися на наявності всіх перерахованих ознак, а не лише однієї з них [118, 119].
Фолікулярний варіант папілярного раку ЩЗ
Як і гістологічний діагноз, цитологічна інтерпретація ФВПР також може бути ускладненою. У деяких випадках пухлини ФВПР через брак ядерних ознак папілярного раку можуть бути прийняті за гіперпластичні вузли (рис. 8).
У цитологічних препаратах аспіратів ФВПР клітини фолікулярного епітелію розташовуються у вигляді одношарових пластів і мікрофолікулярних структур на тлі водянистого колоїду. Щільний колоїд виявляється значно рідше, ніж при класичному ПР, і розташований у середині мікрофолікулярних структур.
Окремі клітини фолікулярного епітелію витягнутої форми, з просвітленим хроматином, ядерні борозни та внутрішньоядерні включення виявляються зрідка. Характерними ознаками ФВПР вважають просвітлення хроматину, витончення ядерної мембрани та еозинофілію цитоплазми фолікулярного епітелію [22, 24, 36, 37, 44–47, 49, 50, 52, 87, 127].
Цитологічні препарати аспіратів ТАПБ із фокально виявленими клітинами, ядра яких видовжені, з просвітленим хроматином, мають ядерні борозни, але внутрішньоядерні включення відсутні, можуть бути діагностовані як «пухлина фолікулярного походження з ознаками, підозрілими на ПР». Згідно з даними літератури, у 70 % випадків із такими цитологічними висновками встановлено діагноз ФВПР.
Висококлітинний варіант папілярного раку ЩЗ (ВВПР)
ВВПР — агресивна форма ПР, пов’язана з підвищеним ризиком розвитку множинних локальних рецидивів, віддалених метастазів і навіть летальним кінцем. У зв’язку з агресивною поведінкою даного варіанта ПР доцільно встановлювати діагноз у передопераційний період з метою розширення обсягу первинної дисекції лімфатичних вузлів шиї (рис. 9).
Цитологічні ознаки висококлітинного варіанта ПР:
— видовжені клітини фолікулярного епітелію з гострим цитоплазматичним краєм, гранульованою еозинофільною цитоплазмою та різними за розмірами ядрами із характерними ознаками ПР;
— на відміну від класичного варіанта ПР, характерні ядерні ознаки (борозни, внутрішньоядерні включення) легко ідентифікуються;
— за результатами деяких досліджень, в аспіратах пухлин ВВПР можуть виявлятися нейтрофіли, розташовані інтраепітеліально. Аспірати ТАПБ таких пухлин можна сплутати з Гюртле-клітинними пухлинами внаслідок цитоплазматичної еозинофілії. Проте в таких випадках ядерні ознаки служать диференційним критерієм між цими двома пухлинами [128–132].
Медулярний рак щитоподібної залози
Медулярний рак ЩЗ походить із C-клітин ЩЗ і становить близько 10 % від усіх злоякісних пухлин органа. Ця пухлина має різноманітні клінічні прояви, родинне походження та часто поєднується з іншими нейроендокринними пухлинами [69].
Під час цитологічного дослідження аспіратів МР виявляються різноманітні морфологічні ознаки, характерні для даного типу пухлин (рис. 10):
— цитологічні препарати аспірату МР містять велику кількість епітеліальних клітин округлої або овальної форми, розташованих головним чином поодиноко або у вигляді нечітких угрупувань;
— окремі клітини пухлини мають рясну еозинофільну гранульовану цитоплазму, у близько 20 % клітин препаратів, забарвлених за методом Май-Грюнвальда — Гімзи, виявляються дрібні цитоплазматичні гранули;
— ядра, як правило, розташовані ексцентрично, що нагадує плазматичну клітину;
— ядерний хроматин має вигляд чорно-білих зерен («сіль і перець») із непомітними ядерцями;
— внутрішньоядерні включення, на відміну від таких при ПР, із чітким затемненим контуром, також виявляються дво- та багатоядерні епітеліальні клітини;
— у деяких випадках виявляються веретеноподібні клітини;
— амілоїд може спостерігатися як позаклітинно, у вигляді фрагментів округлої або овальної форми, так і в оточенні пухлинних клітин, його можна відрізнити від щільного колоїду ПР, використовуючи цитохімічне забарвлення за методом Конго;
— імуноцитохімічно виявляється тиреокальцитонін і відсутній тиреоглобулін [11, 15];
— у випадках з обмеженим клітинним матеріалом для підтвердження діагнозу МР визначають рівень сироваткового кальцитоніну [11, 135].
Диференціальний цитологічний діагноз МР включає: Гюртле-клітинні пухлини, ПР, метастатичні пухлини нейроендокринного походження та плазмоцитому. На відміну від аспіратів МР, у ядрах Гюртле-клітинних пухлин зазвичай виявляються чіткі ядерця, відсутній характерний для МР нейроендокринний хроматин («сіль і перць») і цитоплазматичні гранули. Аспірати ПР характеризуються класичними для даного типу ядерними ознаками, негативною імуноцитохімічною реакцію до кальцитоніну та позитивною реакцією до тиреоглобуліну [89, 136]. Також у клітинах МР виявляється позитивна імуноцитохімічна реакція з карциноембріональним антигеном (КЕА), хромограніном і синаптофізином [89].
Анапластичний рак ЩЗ
АР ЩЗ є однією з найагресивніших і смертельних пухлин людини. Частіше виявляється в осіб похилого віку в регіонах, ендемічних за зобом. Аспірати АР ЩЗ зазвичай не становлять діагностичних труднощів і легко можуть бути класифіковані як злоякісні через надзвичайно виражені ознаки клітинного плеоморфізму та атипії:
— в аспіратах АР ЩЗ виявляються епітеліоїдні, веретеноподібні клітини, а також клітини типу гігантських остеобластів із вираженими ознаками клітинного плеоморфізму та анаплазії на тлі цитологічних ознак запалення й некрозу;
— пухлинні клітини, як правило, інфільтровані нейтрофільними лейкоцитами [11, 137–139]. Деякі випадки АР пов’язано з великим некрозом і склерозом, що може бути причиною неінформативних висновків ТАПБ, тому під час цитологічного аналізу аспіратів вузлів ЩЗ пацієнтів літнього віку з ознаками некрозу, запалення та поодинокими плеоморфними клітинами слід включати АР ЩЗ до диференціальної діагностики [12];
— за результатами імуноцитохімічного дослідження клітини АР негативні до тиреоглобуліну, позитивні до віментину, а також можуть бути позитивними до панцитокератину.
Застосування додаткових методів у цитологічній діагностиці вузлів ЩЗ
Показання для застосування додаткових методів дослідження аспіратів вузлів ЩЗ
1. Підозра на медулярний рак ЩЗ:
— імуноцитохімічне дослідження кальцитоніну, тиреоглобуліну, КЕА, хромограніну;
— визначення рівня сироваткового кальцитоніну.
2. Підозра на анапластичний рак ЩЗ:
— імуноцитохімічне дослідження панцитокератину.
3. Підозра на метастатичний рак ЩЗ:
— імуноцитохімічне дослідження TTF-1 (якщо TTF-1 негативний, розширити імунологічну панель відповідно до цитологічних ознак і клінічних даних).
4. Підозра на лімфому:
— імунофенотипування шляхом проточної цитометрії.
5. Підозра на пухлину прищитоподібної залози:
— імуноцитохімічне дослідження TTF-1, паратгормону, хромограніну;
— визначення рівня сироваткового паратгормону.
6. Підозра на метастази РЩЗ у лімфатичних вузлах:
— імуноцитохімічне дослідження TTF-1, кальцитоніну, тиреоглобуліну;
— визначення рівня сироваткового кальцитоніну, тиреоглобуліну.
7. Невизначені/сумнівні ТАПБ.
Комплексне використання маркерів малігнізації (МоАт 47 і ДАП IV)
Основну проблему в цитологічній діагностиці вузлів ЩЗ становить група так званих сумнівних цитологічних висновків. До неї відносять випадки із цитологічними ознаками атипії, що нагадують фолікулярні неоплазії. Цей діагноз встановлюється на підставі цитологічних досліджень, коли в епітеліальних клітинах, розташованих у вигляді мікрофолікулярних структур, присутні або відсутні атипія ядер та їх мітотична активність, а цитологічні ознаки аденоми та карциноми є ідентичними.
У подібних випадках діагноз ФРЩЗ може бути встановлений лише за наявності капсулярної або судинної інвазії, але не на підставі цитологічних ознак. Звідси й висновок, що препарати тканини з центральних відділів фолікулярної пухлини можуть бути сумнівними, хоча цього ще не досить для підтвердження діагнозу ФРЩЗ. Згідно з даними літератури, сумнівні висновки ТАПБ становлять від 13 до 30 % усіх діагнозів, а в 10–60 % усіх випадків діагноз РЩЗ може встановлюватися під час остаточного гістологічного дослідження, тому сумнівний висновок розглядають як показання до хірургічного лікування.
Отже, в окремих випадках цитологічні ознаки добро- та злоякісних пухлин ЩЗ є схожими, що ускладнює цитологічний аналіз і призводить до діагностичних помилок: хибнопозитивних і хибнонегативних результатів. Хибнонегативними є цитологічні висновки, що свідчать про доброякісну природу новоутворення, але після гістологічного дослідження в цих випадках виявляється рак. Згідно з результатами власних досліджень, від 20 до 30 % випадків папілярного раку не мають типових цитологічних ядерних ознак.
Використання традиційних методів цитологічного дослідження сьогодні певною мірою обмежене, тому що має досить значну частку хибнопозитивних результатів (17,3 %). Разом із тим ТАПБ є досить простим, швидким, не викликає ускладнень і в цілому досить інформативний для виявлення злоякісних новоутворень ЩЗ. Використання його дозволяє ефективно проводити селекцію вузлів для хірургічного лікування добро- та злоякісних пухлин ЩЗ. Паралельне використання ультразвукового контролю під час проведення пункції, у свою чергу, сприяє зменшенню відсотка неінформативних препаратів.
З метою підвищення ефективності діагностики раку взагалі і РЩЗ зокрема останніми роками розроблено значну кількість нових методів, заснованих на визначенні біохімічних особливостей доброякісних і злоякісних пухлин. Як маркери злоякісності використовували речовини, що давали можливість виявити характер структурно-функціональних змін у тканині в процесі її пухлинної трансформації.
Імуногістохімічні методи дозволяють виявляти у тканині білки, що характеризують рівень метаболізму або ступінь диференціювання клітин. Застосування цих методів паралельно з класичними морфологічними дозволяє повніше охарактеризувати стан залози як у нормі, так і в патології.
Зокрема, імуноцитохімічне дослідження ТПО з МоАт 47 полегшує диференціальну діагностику добро- та злоякісних пухлин ЩЗ, а цитохімічне визначення активності ДАП IV є маркером злоякісного процесу [127]. Іншими словами, за умов правильного виконання обидва методи можуть застосовуватись як скринінговий тест для всіх пацієнтів із вузлами ЩЗ з метою підвищення ефективності цитологічної діагностики доброякісних захворювань ЩЗ, коли хірургічного втручання можна уникнути без ризику пропустити рак. Визначення нормального рівня експресії ТПО, що є об’єктивним критерієм доброякісного характеру пухлинного процесу, необхідно розглядати як метод вибору. Відсутність імуноцитохімічної реакції з МоАт 47 в аспіратах вузлів ЩЗ і висока активність ДАП IV є характерними морфологічними ознаками злоякісної природи пухлини. Комплексне використання маркерів малігнізації (МоАт 47 і ДАП IV) у діагностиці захворювань ЩЗ на передопераційному етапі дозволяє зменшити відсоток неадекватних хірургічних втручань із приводу доброякісних пухлин залози. Використання імуноцитохімічного аналізу ТПО із МоАт 47 і цитохімічне визначення активності ДАП IV виключає можливість хибнопозитивних результатів і дозволяє підвищити діагностичну ефективність цитологічної діагностики захворювань ЩЗ у цілому. Отже, імуноцитохімічне дослідження ТПО із МоАт 47 і цитохімічне визначення активності ДАП IV можна вважати взаємодоповнюючими методами дослідження.
Результати наших досліджень свідчать, що використання даних методів дозволяє зменшити кількість хибнопозитивних результатів із 17 % у стандартному цитологічному дослідженні до 3,3 % — в імуноцитохімічному дослідженні із МоАт 47 і до 13,3 % — у цитохімічному визначенні активності ДАП IV, а застосування даних маркерів дає можливість підвищити діагностичні специфічність і ефективність методів цитологічної діагностики пухлин ЩЗ у цілому.
Висновок
На підставі аналізу результатів багатоцентрових досліджень і власних спостережень визначено оптимальну термінологію та методи цитологічної діагностики аспіратів ТАПБ вузлів щитоподібної залози. Рекомендується для широкого впровадження в клінічну практику.
1. Redman R., Yoder B.J., Massoll N.A. Perceptions of diagnostic terminology and cytopathologic reporting of fine-needle aspiration biopsies of thyroid nodules: a survey of clinicians and pathologists // Thyroid. — 2006. — Vol. 16. — P. 1003–8.
2. Guidelines of the Papanicolaou Society of Cytopathology for the examination of fine-needle aspiration specimens from thyroid nodules. The Papanicolaou Society of Cytopathology Task Force on Standards of Practice // Diagn. Cytopathol. — 1996. — Vol. 15. — P. 84–9.
3. Cooper D.S., Doherty G.M., Haugen B.R. et al. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer // Thyroid. — 2006. — Vol. 16. — P. 109–42.
4. American Association of Clinical Endocrinologists and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules // Endocr. Pract. — 2006. — Vol. 12. — P. 63–102.
5. Wang H.H. Reporting thyroid fine-needle aspiration: literature review and a proposal // Diagn. Cytopathol. — 2006. — Vol. 34. — P. 67–76.
6. Yassa L., Cibas E.S., Benson C.B. et al. Long-term assessment of a multidisciplinary approach to thyroid nodule diagnostic evaluation // Cancer. — 2007. — Vol. 111. — P. 508–16.
7. Yang J., Schnadig V., Logrono R., Wasserman P.G. Fine-needle aspiration of thyroid nodules: a study of 4703 patients with histologic and clinical correlations // Cancer. — 2007. — Vol. 111. — P. 306–15.
8. Poller D., Yiangou C., Cummings M., Boote D. Thyroid FNA and benign thyroid disease // Lancet. — 2000. — Vol. 356. — P. 679.
9. Mazzawi S.J., Rosen G., Luboshitzky R., Dharan M. Management of benign thyroid nodules based on the findings of fine-needle aspiration // J. Otolaryngol. — 2000. — Vol. 29. — P. 95–7.
10. Andreoli M., Summaria V., Sciacchitano S. An introduction to benign thyroid disease: pathophysiologic, epidemiologic aspects and diagnostic methodology // Rays. — 1999. — Vol. 24. — P. 169–81.
11. Kini S.R. Guides to Clinical Aspiration Biopsy Thyroid. — 2nd ed. — New York, NY: Igaku-Shoin, 1996.
12. Baloch Z., LiVolsi V.A. Pathology of the Thyroid Gland. — Philadelphia, PA: Churchill Livingston, 2002. — P. 61–88.
13. Pu R.T., Yang J., Wasserman P.G., Bhuiya T., Griffith K.A., Michael C.W. Does Hurthle cell lesion/neoplasm predict malignancy more than follicular lesion/neoplasm on thyroid fine-needle aspiration? // Diagn. Cytopathol. — 2006. — Vol. 34. — P. 330–4.
14. Deveci M.S., Deveci G., LiVolsi V.A., Baloch Z.W. Fine-needle aspiration of follicular lesions of the thyroid. Diagnosis and follow–Up // Cytojournal. — 2006. — Vol. 3. — P. 9.
15. Das D.K. Marginal vacuoles (fire-flare appearance) in fine needle aspiration smears of thyroid lesions: does it represent diffusing out of thyroid hormones at the base of follicular cells? // Diagn. Cytopathol. — 2006. — Vol. 34. — P. 277–83.
16. Stelow E.B., Bardales R.H., Crary G.S. et al. Interobserver variability in thyroid fine-needle aspiration interpretation of lesions showing predominantly colloid and follicular groups // Am. J. Clin. Pathol. — 2005. — Vol. 124. — P. 239–44.
17. Smith J., Cheifetz R.E., Schneidereit N., Berean K., Thomson T. Can cytology accurately predict benign follicular nodules? // Am. J. Surg. — 2005. — Vol. 189. — P. 592– 595.
18. Clary K.M., Condel J.L., Liu Y., Johnson D.R., Grzybicki D.M., Raab S.S. Interobserver variability in the fine needle aspiration biopsy diagnosis of follicular lesions of the thyroid gland // Acta Cytol. — 2005. — Vol. 49. — P. 378–82.
19. Carling T., Udelsman R. Follicular neoplasms of the thyroid: what to Recommend // Thyroid. — 2005. — Vol. 15. — P. 583–7.
20. Tulecke M.A., Wang H.H. ThinPrep for cytologic evaluation of follicular thyroid lesions: correlation with histologic findings // Diagn. Cytopathol. — 2004. — Vol. 30. — P. 7–13.
21. Giorgadze T., Rossi E.D., Fadda G., Gupta P.K., Livolsi V.A., Baloch Z. Does the fine-needle aspiration diagnosis of «Hurthle-cell neoplasm/follicular neoplasm with oncocytic features» denote increased risk of malignancy? // Diagn. Cytopathol. — 2004. — Vol. 31. — P. 307–12.
22. El Hag I.A., Kollur S.M. Benign follicular thyroid lesions versus follicular variant of papillary carcinoma: differentiation by architectural pattern // Cytopathology. — 2004. — Vol. 15. — P. 200–5.
23. Yang G.C., Liebeskind D., Messina A.V. Should cytopathologists stop reporting follicular neoplasms on fine-needle aspiration of the thyroid? // Cancer. — 2003. — Vol. 99. — P. 69–74.
24. Kesmodel S.B., Terhune K.P., Canter R.J. et al. The diagnostic dilemma of follicular variant of papillary thyroid carcinoma // Surgery. — 2003. — Vol. 134. — P. 1005–12.
25. Foppiani L., Tancredi M., Ansaldo G.L. et al. Absence of histological malignancy in a patient cohort with follicular lesions on fine-needle aspiration // J. Endocrinol. Invest. — 2003. — Vol. 26. — P. 29–34.
26. Bahar G., Braslavsky D., Shpitzer T. et al. The cytological and clinical value of the thyroid «follicular lesion» // Am. J. Otolaryngol. — 2003. — Vol. 24. — P. 217–20.
27. Goldstein R.E., Netterville J.L., Burkey B., Johnson J.E. Implications of follicular neoplasms, atypia, and lesions suspicious for malignancy diagnosed by fine-needle aspiration of thyroid nodules // Ann. Surg. — 2002. — Vol. 235. — P. 656–62; discussion 662–4.
28. Baloch Z.W., Fleisher S., LiVolsi V.A., Gupta P.K. Diagnosis of «follicular neoplasm»: a gray zone in thyroid fine-needle aspiration cytology // Diagn. Cytopathol. — 2002. — Vol. 26. — P. 41–4.
29. Raber W., Kaserer K., Niederle B., Vierhapper H. Risk factors for malignancy of thyroid nodules initially identified as follicular neoplasia by fine–needle aspiration: results of a prospective study of one hundred twenty patients // Thyroid. — 2000. — Vol. 10. — P. 709–12.
30. Logani S., Gupta P.K., LiVolsi V.A., Mandel S., Baloch Z.W. Thyroid nodules with FNA cytology suspicious for follicular variant of papillary thyroid carcinoma: follow–up and management // Diagn. Cytopathol. — 2000. — Vol. 23. — P. 380–5.
31. DeMay R.M. Frozen section of thyroid? Just say no // Am. J. Clin. Pathol. — 1998. — Vol. 110. — P. 423–4.
32. Lin H.S., Komisar A., Opher E., Blaugrund S.M. Follicular variant of papillary carcinoma: the diagnostic limitations of preoperative fine-needle aspiration and intraoperative frozen section evaluation // Laryngoscope. — 2000. — Vol. 110. — P. 1431–6.
33. Roach J.C., Heller K.S., Dubner S., Sznyter L.A. The value of frozen section examinations in determining the extent of thyroid surgery in patients with indeterminate fine-needle aspiration cytology // Archives of Otolaryngology — Head & Neck Surgery. — 2002. — Vol. 128. — P. 263–7.
34. Richards M.L., Chisholm R., Bruder J.M., Strodel W.E. Is thyroid frozen section too much for too little? // American Journal of Surgery. — 2002. — Vol. 184. — P. 510–4; discussion 514.
35. Kardon D.E., Edelman M. Evaluating thyroid nodules: The role of fine needle aspiration cytology and intraoperative consultation // Pathol. Case Rev. — 2001. — Vol. 6. — P. 200–205.
36. Yang G.C., Liebeskind D., Messina A.V. Diagnostic accuracy of follicular variant of papillary thyroid carcinoma in fine-needle aspirates processed by ultrafast Papanicolaou stain: histologic follow–up of 125 cases // Cancer. — 2006. — Vol. 108. — P. 174–9.
37. Wu H.H., Jones J.N., Grzybicki D.M., Elsheikh T.M. Sensitive cytologic criteria for the identification of follicular variant of papillary thyroid carcinoma in fine-needle aspiration biopsy // Diagn. Cytopathol. — 2003. — Vol. 29. — P. 262–6.
38. Kim E.S., Nam-Goong I.S., Gong G., Hong S.J., Kim W.B., Shong Y.K. Postoperative findings and risk for malignancy in thyroid nodules with cytological diagnosis of the so-called «follicular neoplasm» // Korean J. Intern. Med. — 2003. — Vol. 18. — P. 94–7.
39. Kollur S.M., El Sayed S., El Hag I.A. Follicular thyroid lesions coexisting with Hashimoto’s thyroiditis: incidence and possible sources of diagnostic errors // Diagn. Cytopathol. — 2003. — Vol. 28. — P. 35–8.
40. Matesa N., Tabain I., Dabelic N., Petric V., Kusic Z. Diagnostic relevance of fine needle aspiration cytology for follicular lesions of the thyroid: retrospective study // Croat. Med. J. — 2002. — Vol. 43. — P. 606–9.
41. Carpi A., Nicolini A., Sagripanti A. et al. Large-needle aspiration biopsy for the preoperative selection of follicular adenoma diagnosed by fine-needle aspiration as a microfollicular nodule or suspected cancer // Am. J. Clin. Oncol. — 2002. — Vol. 25. — P. 209–12.
42. Bastagli A., de Pasquale L., Schubert L. Follicular neoplasm of the thyroid: usefulness of extemporaneous histologic study of frozen sections // Ann. Ital. Chir. — 2001. — Vol. 72. — P. 283–6.
43. Barbaro D., Simi U., Lopane P. et al. Thyroid nodules with microfollicular findings reported on fine-needle aspiration: invariably surgical treatment? // Endocr. Pract. — 2001. — Vol. 7. — P. 352–7.
44. Jain M., Khan A., Patwardhan N., Reale F., Safran M. Follicular variant of papillary thyroid carcinoma: a comparative study of histopathologic features and cytology results in 141 patients // Endocr. Pract. — 2001. — Vol. 7. — P. 79–84.
45. Greaves T.S., Olvera M., Florentine B.D. et al. Follicular lesions of thyroid: a 5-year fine-needle aspiration experience // Cancer. — 2000. — Vol. 90. — P. 335–41.
46. Logani S., Gupta P.K., LiVolsi V.A., Mandel S., Baloch Z.W. Thyroid nodules with FNA cytology suspicious for follicular variant of papillary thyroid carcinoma: follow-up and management // Diagn. Cytopathol. — 2000. — Vol. 23. — P. 380–5.
47. Lin H.S., Komisar A., Opher E., Blaugrund S.M. Follicular variant of papillary carcinoma: the diagnostic limitations of preoperative fine–needle aspiration and intraoperative frozen section evaluation // Laryngoscope. — 2000. — Vol. 110. — P. 1431–6.
48. Tseleni–Balafouta S., Kavantzas N., Paraskevakou H., Davaris P. Computerized morphometric study on fine needle aspirates of cellular follicular lesions of the thyroid // Anal. Quant. Cytol. Histol. — 2000. — Vol. 22. — P. 323–6.
49. Baloch Z.W., Gupta P.K., Yu G.H., Sack M.J., LiVolsi V.A. Follicular variant of papillary carcinoma. Cytologic and histologic correlation // Am. J. Clin. Pathol. — 1999. — Vol. 111. — P. 216–22.
50. Goodell W.M., Saboorian M.H., Ashfaq R. Fine-needle aspiration diagnosis of the follicular variant of papillary carcinoma // Cancer. — 1998. — Vol. 84. — P. 349–54.
51. Tuttle R.M., Lemar H., Burch H.B. Clinical features associated with an increased risk of thyroid malignancy in patients with follicular neoplasia by fine-needle aspiration // Thyroid. — 1998. — Vol. 8. — P. 377–83.
52. Zacks J.F., de las Morenas A., Beazley R.M., O’Brien M.J. Fine-needle aspiration cytology diagnosis of colloid nodule versus follicular variant of papillary carcinoma of the thyroid // Diagn. Cytopathol. — 1998. — Vol. 18. — P. 87–90.
53. Schlinkert R.T., van Heerden J.A., Goellner J.R. et al. Factors that predict malignant thyroid lesions when fine-needle aspiration is «suspicious for follicular neoplasm» // Mayo Clin. Proc. — 1997. — Vol. 72. — P. 913–6.
54. Baloch Z.W., Livolsi V.A. Follicular-patterned lesions of the thyroid: the bane of the pathologist // Am. J. Clin. Pathol. — 2002. — Vol. 117. — P. 143–50.
55. Kelman A.S., Rathan A., Leibowitz J., Burstein D.E., Haber R.S. Thyroid cytology and the risk of malignancy in thyroid nodules: importance of nuclear atypia in indeterminate specimens // Thyroid. — 2001. — Vol. 11. — P. 271–7.
56. Lu C.P., Chang T.C., Wang C.Y., Hsiao Y.L. Serial changes in ultrasound-guided fine needle aspiration cytology in subacute thyroiditis // Acta Cytologica. — 1997. — Vol. 41. — P. 238–43.
57. MacDonald L., Yazdi H.M. Fine needle aspiration biopsy of Hashimoto’s thyroiditis. Sources of diagnostic error // Acta Cytol. — 1999. — Vol. 43. — P. 400–6.
58. Kumar N., Ray C., Jain S. Aspiration cytology of Hashimoto’s thyroiditis in an endemic area // Cytopathology. — 2002. — Vol. 13. — P. 31–9.
59. Kumarasinghe M.P., De Silva S. Pitfalls in cytological diagnosis of autoimmune thyroiditis // Pathology. — 1999. — Vol. 31. — P. 1–8.
60. Merchant S.H., Izquierdo R., Khurana K.K. Is repeated fine-needle aspiration cytology useful in the management of patients with benign nodular thyroid disease? // Thyroid. — 2000. — Vol. 10. — P. 489–92.
61. Baloch Z., LiVolsi V.A., Jain P. et al. Role of repeat fine-needle aspiration biopsy (FNAB) in the management of thyroid nodules // Diagn. Cytopathol. — 2003. — Vol. 29. — P. 203–6.
62. Shin J.H., Han B.K., Ko K., Choe Y.H., Oh Y.L. Value of repeat ultrasound-guided fine-needle aspiration in nodules with benign cytological diagnosis // Acta Radiol. — 2006. — Vol. 47. — P. 469–73.
63. Flanagan M.B., Ohori N.P., Carty S.E., Hunt J.L. Repeat thyroid nodule fine–needle aspiration in patients with initial benign cytologic results // Am. J. Clin. Pathol. — 2006. — Vol. 125. — P. 698–702.
64. Orlandi A., Puscar A., Capriata E., Fideleff H. Repeated fine–needle aspiration of the thyroid in benign nodular thyroid disease: critical evaluation of long-term follow-up // Thyroid. — 2005. — Vol. 15. — P. 274–8.
65. Chehade J.M., Silverberg A.B., Kim J., Case C., Mooradian A.D. Role of repeated fine-needle aspiration of thyroid nodules with benign cytologic features // Endocr. Pract. — 2001. — Vol. 7. — P. 237–43.
66. Merchant S.H., Izquierdo R., Khurana K.K. Is repeated fine-needle aspiration cytology useful in the management of patients with benign nodular thyroid disease? // Thyroid. — 2000. — Vol. 10. — P. 489–92.
67. Baloch Z.W., LiVolsi V.A. Post fine-needle aspiration histologic alterations of thyroid revisited // Am. J. Clin. Pathol. — 1999. — Vol. 112. — P. 311–6.
68. Danese D., Centanni M., Farsetti A., Andreoli M. Diagnosis of thyroid Carcinoma // J. Exp. Clin. Cancer Res. — 1997. — Vol. 16. — P. 337–47.
69. Murray D. The Thyroid Gland. — Malden, MA: Blackwell Science, 1998. — P. 295–380.
70. Layfield L.J., Wax T., Jones C. Cytologic distinction of goiterous nodules from morphologically normal thyroid: analyses of cytomorphologic features // Cancer. — 2003. — Vol. 99. — P. 217–22.
71. Baloch Z.W., Sack M.J., Yu G.H., Livolsi V.A., Gupta P.K. Fine-needle aspiration of thyroid: an institutional experience // Thyroid. — 1998. — Vol. 8. — P. 565–9.
72. Oertel Y.C., Oertel J.E. Thyroid cytology and histology // Baillieres Best Pract. Res Clin Endocrinol Metab. — 2000. — Vol. 14. — P. 541–57.
73. McKenna T.J. Graves’ disease // Lancet. — 2001. — Vol. 357. — P. 1793–6.
74. Centeno B.A., Szyfelbein W.M, Daniels G.H., Vickery A.L. Jr. Fine needle aspiration biopsy of the thyroid gland in patients with prior Graves’ disease treated with radioactive iodine. Morphologic findings and potential pitfalls // Acta Cytol. — 1996. — Vol. 40. — P. 1189–97.
75. Anderson S.R., Mandel S, LiVolsi V.A., Gupta P.K., Baloch Z.W. Can cytomorphology differentiate between benign nodules and tumors arising in Graves’ disease? // Diagn. Cytopathol. — 2004. — Vol. 31. — P. 64–7.
76. Kim W.B., Han S.M., Kim T.Y. et al. Ultrasonographic screening for detection of thyroid cancer in patients with Graves’ disease // Clin. Endocrinol (Oxf). — 2004. — Vol. 60. — P. 719–25.
77. Cantalamessa L., Baldini M., Orsatti A., Meroni L., Amodei V., Castagnone D. Thyroid nodules in Graves disease and the risk of thyroid carcinoma // Arch. Intern. Med. — 1999. — Vol. 159. — P. 1705–8.
78. Carson H.J., Castelli M.J., Gattuso P. Incidence of neoplasia in Hashimoto’s thyroiditis: a fine-needle aspiration study // Diagn. Cytopathol. — 1996. — Vol. 14. — P. 38–42.
79. Liu L.H., Bakhos R., Wojcik E.M. Concomitant papillary thyroid carcinoma and Hashimoto’s thyroiditis // Semin. Diagn Pathol. — 2001. — Vol. 18. — P. 99–103.
80. Kumar N., Ray C., Jain S. Aspiration cytology of Hashimoto’s thyroiditis in an endemic area // Cytopathology. — 2002. — Vol. 13. — P. 31–9.
81. Baloch Z.W., LiVolsi V.A. Warthin-like papillary carcinoma of the thyroid // Arch. Pathol. Lab. Med. — 2000. — Vol. 124. — P. 1192–5.
82. Mechler C., Bounacer A., Suarez H. et al. Papillary thyroid carcinoma: 6 cases from 2 families with associated lymphocytic thyroiditis harbouring RET/PTC rearrangements // Br. J. Cancer. — 2001. — Vol. 85. — P. 1831–7.
83. Baloch Z.W., Fleisher S., LiVolsi V.A., Gupta P.K. Diagnosis of «follicular neoplasm»: A gray zone in thyroid fine-needle aspiration cytology // Diagn. Cytopathol. — 2002. — Vol. 26. — P. 41–4.
84. Renshaw AA. Follicular lesions of the thyroid // Am. J. Clin. Pathol. — 2001. — Vol. 115. — P. 782–5.
85. Sidawy M.K., Del Vecchio D.M., Knoll S.M. Fine-needle aspiration of thyroid nodules: correlation between cytology and histology and evaluation of discrepant cases // Cancer. — 1997. — Vol. 81. — P. 253–9.
86. Carpi A., Nicolini A., Sagripanti A., Righi C., Fabris F.M., Di Coscio G. Large-needle aspiration biopsy for the preoperative selection of palpable thyroid nodules diagnosed by fine-needle aspiration as a microfollicular nodule or suspected cancer // Am. J. Clin. Pathol. — 2000. — Vol. 113. — P. 872–7.
87. Mesonero C.E., Jugle J.E., Wilbur D.C., Nayar R. Fine-needle aspiration of the macrofollicular and microfollicular subtypes of the follicular variant of papillary carcinoma of the thyroid // Cancer. — 1998. — Vol. 84. — P. 235–44.
88. Carpi A., Ferrari E., Sagripanti A. et al. Aspiration needle biopsy refines preoperative diagnosis of thyroid nodules defined at fine needle aspiration as microfollicular nodule // Biomed. Pharmacother. — 1996. — Vol. 50. — P. 325–8.
89. Collins B.T., Cramer H.M., Tabatowski K., Hearn S., Raminhos A., Lampe H. Fine needle aspiration of medullary carcinoma of the thyroid. Cytomorphology, immunocytochemistry and electron microscopy // Acta Cytol. — 1995. — Vol. 39. — P. 920–30.
90. Renshaw A.A., Wang E., Wilbur D., Hughes J.H., Haja J., Henry M.R. Interobserver agreement on microfollicles in thyroid fine-needle aspirates // Arch. Pathol. Lab. Med. — 2006. — Vol. 130. — P. 148–52.
91. Bronner M.P., LiVolsi V.A. Oxyphilic (Askanazy/Hurthle cell) tumors of the thyroid: Microscopic features predict biologic behavior // Surg. Pathol. — 1988. — Vol. 1. — P. 137–149.
92. Gonzalez-Campora R., Herrero-Zapatero A., Lerma E., Sanchez F., Galera H. Hurthle cell and mitochondrion-rich cell tumors. A clinicopathologic study // Cancer. — 1986. — Vol. 57. — P. 1154–63.
93. Carcangiu M.L., Bianchi S., Savino D., Voynick I.M., Rosai J. Follicular Hurthle cell tumors of the thyroid gland // Cancer. — 1991. — Vol. 68. — P. 1944–53.
94. DeLellis R.A., Lloyd R.D., Heitz P.U., Eng C., eds. WHO: Pathology and Genetics. Tumours of Endocrine Organs. — Lyon, France: IARC Press, 2004.
95. Davila R.M., Bedrossian C.W., Silverberg A.B. Immunocytochemistry of the thyroid in surgical and cytologic specimens // Arch. Pathol. Lab. Med. — 1988. — Vol. 112. — P. 51–6.
96. Janser J.C., Pusel J., Rodier J.F., Navarrete E., Rodier D. Hurthle cell tumor of the thyroid land. Analysis of a series of 33 cases // J. Chir. (Paris). — 1989. — Vol. 126. — P. 619–24.
97. Jayaram G., Singh B., Marwaha R.K. Grave’s disease. Appearance in cytologic smears from fine needle aspirates of the thyroid gland // Acta Cytologica. — 1989. — Vol. 33. — P. 36–40.
98. Baloch Z.W., LiVolsi V.A. Oncocytic lesions of the neuroendocrine system // Semin. Diagn. Pathol. — 1999. — Vol. 16. — P. 190–9.
99. Thompson N.W., Dunn E.L., Batsakis J.G., Nishiyama R.H. Hurthle cell lesions of the thyroid gland // Surgery, Gynecology & Obstetrics. — 1974. — Vol. 139. — P. 555–60.
100. Gundry S.R., Burney R.E., Thompson N.W., Lloyd R. Total thyroidectomy for Hurthle cell neoplasm of the thyroid // Archives of Surgery. — 1983. — Vol. 118. — P. 529–32.
101. Hunt J.L. Unusual thyroid tumors: a review of pathologic and molecular Diagnosis // Expert Rev. Mol. Diagn. — 2005. — Vol. 5. — P. 725–34.
102. Haigh P.I., Urbach D.R. The treatment and prognosis of Hurthle cell follicular thyroid carcinoma compared with its non-Hurthle cell counterpart // Surgery. — 2005. — Vol. 138. — P. 1152–7; discussion 1157–8.
103. Dettori T., Frau D.V., Lai M.L. et al. Aneuploidy in oncocytic lesions of the thyroid gland: diffuse accumulation of mitochondria within the cell is associated with trisomy 7 and progressive numerical chromosomal alterations // Genes Chromosomes Cancer. — 2003. — Vol. 38. — P. 22–31.
104. Wada N., Duh Q.Y., Miura D., Brunaud L., Wong M.G., Clark O.H. Chromosomal aberrations by comparative genomic hybridization in hurthle cell thyroid carcinomas are associated with tumor recurrence // J. Clin. Endocrinol. Metab. — 2002. — Vol. 87. — P. 4595–601.
105. Maximo V., Soares P., Lima J., Cameselle-Teijeiro J., Sobrinho-Simoes M. Mitochondrial DNA somatic mutations (point mutations and large deletions) and mitochondrial DNA variants in human thyroid pathology: a study with emphasis on Hurthle cell tumors // Am. J. Pathol. — 2002. — Vol. 160. — P. 1857–65.
106. McHenry C.R., Thomas S.R., Slusarczyk S.J., Khiyami A. Follicular or Hurthle cell neoplasm of the thyroid: can clinical factors be used to predict carcinoma and determine extent of thyroidectomy? // Surgery. — 1999. — Vol. 126. — P. 798–802.
107. Rosai J., Carcangui M.L., DeLellis R.A. Tumors of The Thyroid Gland. — 3rd Series, Fascicle 5 vol. — Washington, DC: Armed Forces Institute of Pathology, 1992.
108. Asa S.L. My approach to oncocytic tumours of the thyroid // J. Clin. Pathol. — 2004. — Vol. 57. — P. 225–32.
109. Kini S.R., Miller J.M., Hamburger J.I. Cytopathology of Hurthle cell lesions of the thyroid gland by fine needle aspiration // Acta Cytol. — 1981. — Vol. 25. — P. 647–52.
110. Renshaw A.A. Hurthle cell carcinoma is a better gold standard than Hurthle cell neoplasm for fine-needle aspiration of the thyroid: defining more consistent and specific cytologic criteria // Cancer. — 2002. — Vol. 96. — P. 261–6.
111. Nasuti J.F., Benedict C., Hurford M., Bibbo M. Differential diagnosis of oncocytic lesions of the breast and thyroid utilizing a semiquantitative approach // Acta Cytol. — 1999. — Vol. 43. — P. 544–51.
112. Yang Y.J., Khurana K.K. Diagnostic utility of intracytoplasmic lumen and transgressing vessels in evaluation of Hurthle cell lesions by fine-needle aspiration // Arch. Pathol. Lab. Med. — 2001. — Vol. 125. — P. 1031–5.
113. Elliott D.D., Pitman M.B., Bloom L., Faquin W.C. Fine-needle aspiration biopsy of Hurthle cell lesions of the thyroid gland: A cytomorphologic study of 139 cases with statistical analysis // Cancer. — 2006. — Vol. 108. — P. 102–9.
114. Oertel Y.C. Fine-Needle Aspiration in the Evaluation of Thyroid Neoplasms // Endocr. Pathol. — 1997. — Vol. 8. — P. 215–224.
115. Das D.K., Mallik M.K., Sharma P. et al. Papillary thyroid carcinoma and its variants in fine needle aspiration smears. A cytomorphologic study with special reference to tall cell variant // Acta Cytol. — 2004. — Vol. 48. — P. 325–36.
116. Papotti M., Volante M., Giuliano A. et al. RET/PTC activation in hyalinizing trabecular tumors of the thyroid // Am. J. Surg. Pathol. — 2000. — Vol. 24. — P. 1615–21.
117. Cheung C.C., Boerner S.L., MacMillan C.M., Ramyar L., Asa S.L. Hyalinizing trabecular tumor of the thyroid: a variant of papillary carcinoma proved by molecular genetics // Am. J. Surg. Pathol. — 2000. — Vol. 24. — P. 1622–6.
118. Baloch Z.W., LiVolsi V.A. Cytologic and architectural mimics of papillary thyroid carcinoma. Diagnostic challenges in fine-needle aspiration and surgical pathology specimens // Am. J. Clin. Pathol. — 2006. — Vol. 125. — P. 135–44.
119. Albores-Saavedra J., Wu J. The many faces and mimics of papillary thyroid carcinoma // Endocr. Pathol. — 2006. — Vol. 17. — P. 1–18.
120. Oertel Y.C., Oertel J.E. Diagnosis of malignant epithelial thyroid lesions: fine needle aspiration and histopathologic correlation // Ann. Diagn. Pathol. — 1998. — Vol. 2. — P. 377–400.
121. Das D.K. Intranuclear cytoplasmic inclusions in fine-needle aspiration smears of papillary thyroid carcinoma: a study of its morphological forms, association with nuclear grooves, and mode of formation // Diagn. Cytopathol. — 2005. — Vol. 32. — P. 264–8.
122. Das D.K., Mallik M.K., Haji B.E. et al. Psammoma body and its precursors in papillary thyroid carcinoma: a study by fine-needle aspiration cytology // Diagn. Cytopathol. — 2004. — Vol. 31. — P. 380–6.
123. Das D.K., Sharma P.N. Intranuclear cytoplasmic inclusions and nuclear grooves in fine needle aspiration smears of papillary thyroid carcinoma and its variants: advantage of the count under an oil-immersion objective over a high-power objective // Anal. Quant. Cytol. Histol. — 2005. — Vol. 27. — P. 83–94.
124. Renshaw A.A. «Histiocytoid» cells in fine-needle aspirations of papillary carcinoma of the thyroid: frequency and significance of an under–recognized cytologic pattern // Cancer. — 2002. — Vol. 96. — P. 240–3.
125. Renshaw A.A. Focal features of papillary carcinoma of the thyroid in fine-needle aspiration material are strongly associated with papillary carcinoma at resection // Am. J. Clin. Pathol. — 2002. — Vol. 118. — P. 208–10.
126. Szporn A.H., Yuan S., Wu M., Burstein D.E. Cellular swirls in fine needle aspirates of papillary thyroid carcinoma: a new diagnostic criterion // Mod. Pathol. — 2006. — Vol. 19. — P. 1470–3.
127. De Micco C., Vassko V., Henry J.F. The value of thyroid peroxidase immunohistochemistry for preoperative fine-needle aspiration diagnosis of the follicular variant of papillary thyroid cancer // Surgery. — 1999. — Vol. 126. — P. 1200–4.
128. Sobrinho-Simoes M., Sambade C., Nesland J.M., Johannessen J.V. Tall cell papillary carcinoma // Am. J. Surg. Pathol. — 1989. — Vol. 13. — P. 79–80.
129. Bocklage T., DiTomasso J., Ramzy I., Ostrowski M. Tall cell variant of papillary thyroid carcinoma: cytologic features and differential diagnostic considerations // Diag. Cytopathol. — 1997. — Vol. 17. — P. 25–29.
130. Cameselle-Teijeiro J., Febles-Perez C., Cameselle-Teijeiro J.F., Alfonsin-Barreiro N., Moldes-Boullosa J., Barreiro F. Cytologic clues for distinguishing the tall cell variant of thyroid papillary carcinoma. A case report // Acta Cytologica. — 1997. — Vol. 41. — P. 1310–6.
131. Gamboa-Dominguez A., Candanedo-Gonzalez F., Uribe-Uribe N., Angeles-Angeles A. Tall cell variant of papillary thyroid carcinoma. A cytohistologic correlation // Acta Cytol. — 1997. — Vol. 41. — P. 672–676.
132. Solomon A., Gupta P.K., LiVolsi V.A., Baloch Z.W. Distinguishing tall cell variant of papillary thyroid carcinoma from usual variant of papillary thyroid carcinoma in cytologic specimens // Diagn. Cytopathol. — 2002. — Vol. 27. — P. 143–8.
133. Fadda G., Mule A., Zannoni G.F., Vincenzoni C., Ardito G., Capelli A. Fine needle aspiration of a warthin-like thyroid tumor. Report of a case with differential diagnostic criteria vs. other lymphocyte–rich thyroid lesions // Acta Cytol. — 1998. — Vol. 42. — P. 998–1002.
134. Vasei M., Kumar P.V., Malekhoseini S.A., Kadivar M. Papillary Hurthle cell carcinoma (Warthin-like tumor) of the thyroid. Report of a case with fine needle aspiration findings // Acta Cytol. — 1998. — Vol. 42. — P. 1437–40.
135. Forrest C.H., Frost F.A., de Boer W.B., Spagnolo D.V., Whitaker D., Sterrett B.F. Medullary carcinoma of the thyroid: accuracy of diagnosis of fine-needle aspiration Cytology // Cancer. — 1998. — Vol. 84. — P. 295–302.
136. Papaparaskeva K., Nagel H., Droese M. Cytologic diagnosis of medullary carcinoma of the thyroid gland // Diagn. Cytopathol. — 2000. — Vol. 22. — P. 351–8.
137. Fortson J.K., Durden F.L., Jr., Patel V., Darkeh A. The coexistence of anaplastic and papillary carcinomas of the thyroid: a case presentation and literature review // Am. Surg. — 2004. — Vol. 70. — P. 1116–9.
138. Kumar P.V., Torabinejad S., Omrani G.H. Osteoclastoma like anaplastic carcinoma of the thyroid gland diagnosed by fine needle aspiration cytology. Report of two cases // Acta Cytol. — 1997. — Vol. 41. — P. 1345–8.
139. Saunders C.A., Nayar R. Anaplastic spindle–cell squamous carcinoma arising in association with tall-cell papillary cancer of the thyroid: A potential pitfall // Diagn. Cytopathol. — 1999. — Vol. 21. — P. 413–8.

/165/165.jpg)
/169/169.jpg)
/170/170.jpg)
/173/173.jpg)