Международный эндокринологический журнал 4 (68) 2015
Вернуться к номеру
Особенности липидного обмена у больных с пролактиномами на этапах супрессивной терапии агонистами дофамина
Авторы: Гогитидзе Т.Г. — ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины», г. Харьков
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
В работе представлены данные о состоянии липидного обмена на этапах длительной (12 месяцев) супрессивной терапии агонистом дофамина каберголином у 61 больного с пролактиномой. Доказано, что нормализация уровня пролактина на фоне терапии способствует снижению риска развития и прогрессирования атерогенеза путем снижения содержания общего холестерина и повышения холестерина липопротеинов высокой плотности. Супрессивная фармакотерапия каберголином приводит к снижению уровня общего холестерина как у мужчин, так и у женщин. У мужчин было наиболее выражено улучшение соотношения про- и антиатерогенных фракций липидов.
У роботі наведено дані про стан ліпідного обміну на етапах довготривалої (12 місяців) супресивної терапії агоністом дофаміну каберголіном у 61 хворого на пролактиному. Доведено, що нормалізація рівня пролактину в крові на тлі лікування сприяє зниженню ризику розвитку і прогресування атерогенезу через зниження вмісту загального холестерину і підвищення ХС ЛПВЩ. Супресивна фармакотерапія каберголіном призводить до зниження загального холестерину як у чоловіків, так і в жінок. У чоловіків було найбільш виражене поліпшення співвідношення про- та антиатерогенних фракцій ліпідів.
The article presents the data of lipid metabolism at the stages of long-term (12 months) suppressive therapy with dopamine agonist cabergoline in 61 patients with prolactinoma. It is proved that the normalization of prolactin levels during therapy reduces the risk of development and progression of atherogenesis through reduction of total cholesterol content and increase in high-density lipoprotein cholesterol. Suppressive pharmacotherapy with cabergoline reduces the total cholesterol level in both men and women. Men had most pronounced improvement in the ratio of pro- and antiatherogenic lipid fractions.
пролактин, липидный обмен, гиперхолестеринемия, коэффициент атерогенности.
пролактин, ліпідний обмін, гіперхолестеринемія, коефіцієнт атерогенності.
prolactin, lipid metabolism, hypercholesterolemia, atherogenic index.
Статья опубликована на с. 19-23
В последние годы интерес врачей различных специальностей вызывают заболевания и синдромы, связанные с нарушением секреции пролактина (ПРЛ) [1, 2]. Пролактин является полипептидным гормоном, синтезируемым и секретируемым лактотрофами, располагающимися преимущественно в заднелатеральных отделах аденогипофиза [3–6].
Основная физиологическая роль ПРЛ заключается в стимуляции развития молочных желез и секреции молока, роста сальных желез и внутренних органов. У женщин ПРЛ также стимулирует секреторную активность желтого тела и регулирует жировой обмен [7]. У мужчин ПРЛ влияет на периферические эффекты половых стероидов и репродуктивную функцию в целом [8, 9]. Наиболее часто причинами гиперпролактинемии (ГП) являются аденомы гипофиза, секретирующее ПРЛ (около 50 % случаев), и идиопатическая ГП (около 30 % случаев) при отсутствии патологических образований в области турецкого седла [10]. Повышение уровня ПРЛ часто ассоциировано с увеличением массы тела, что подтверждено в ряде исследований [11–13]. В настоящее время известно, что ПРЛ влияет на обмен костной ткани, а также водно-электролитный, липидный и углеводный обмен [14–17]. Наряду с влиянием ПРЛ на массу тела представляет интерес его влияние на липидный состав крови. Еще в начале 80-х годов XX века R. PelKonen выявил повышение уровня общего холестерина у пациентов с гиперпролактинемией [18].
В литературе данные о влиянии повышенного уровня ПРЛ на показатели липидного обмена немногочисленны [19–22], а объяснения имеющихся нарушений липидного обмена при ГП противоречивы [23–25]. При освещении в литературе вопросов, связанных с оценкой безопасности применения длительной супрессивной терапии агонистами дофамина у больных с органической ГП, информация о состоянии липидного обмена у таких пациентов практически отсутствует [26].
В связи с этим представляется интересным изучить особенности липидного обмена у больных с органической ГП, обусловленной активностью ПРЛ-секретирующей аденомы гипофиза, на различных этапах фармакологически индуцированных состояний, а именно при нормализации уровня ПРЛ и гипопролактинемии, вызванных назначением высоких доз каберголина.
Цель исследования — изучить особенности липидного обмена у пациентов с пролактиномами на этапах супрессивной фармакотерапии каберголином, провести сравнение этих показателей на фоне состояний гипер- и гипопролактинемии, а также при нормализации уровня пролактина в крови.
Материал и методы исследования
В клинике ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины» были обследованы и прошли 12-месячный курс лечения агонистом дофаминовых рецепторов (каберголином) пациенты (n = 61) с пролактиномой (52 женщины и 9 мужчин) в возрасте 16–66 лет. Общая длительность заболевания составляла от одного до 60 месяцев, в среднем 12,3 ± 10,1 месяца. Мониторинг уровня ПРЛ и показателей углеводного обмена на фоне супрессивной терапии проводился на этапах 3, 6 и 12 месяцев от начала лечения. Одна группа пациентов получала супрессивную терапию — максимальную дозу каберголина, кратную повышению уровня ПРЛ в крови (количество таблеток каберголина 0,5 мг соответствовало тому, во сколько раз уровень гормона превышал верхнюю границу нормы, но не более 5 мг в неделю) [27, 28], вторая группа — терапию с постепенным увеличением дозы каберголина каждые 4 недели под контролем уровня ПРЛ в сыворотке крови. Эффективность супрессивной терапии оценивали по показателям ПРЛ в крови с помощью перцентильных таблиц с учетом пола и возраста здоровых испытуемых. Гормональный статус считался нормализованным у пациентов с уровнем ПРЛ в пределах 5–95-го перцентиля. Состояние гипопролактинемии фиксировалось при уровне ПРЛ ниже 5-го перцентиля.
Биохимические и иммунологические исследования проводились в аттестованных для проведения измерений клинико-диагностических лабораториях ГУ «ИПЭП». Забор венозной крови для гормональных исследований проводился натощак после 12-часового голодания. Определение уровня гормонов проводили иммуноферментным методом на автоматическом анализаторе Stat Fax 2100 (Awareness Technology, США). Для определения концентрации ПРЛ использовались наборы фирмы «АлкорБио» (Россия). Определение концентрации общего холестерина (ОХС), липопротеинов высокой плотности (ХС ЛПВП) и триглицеридов (ТГ) проводили ферментативным методом с помощью наборов «ДИАЛИПОН ДС» (Россия) на аппарате «Флюорат-02-АБЛФ-Т». Концентрация липопротеинов низкой (ХС ЛПНП) и очень низкой (ХС ЛПОНП) плотности и коэффициент атерогенности (КА) вычислялись по общепринятым формулам Фридвальда [29, 30]:
ХС ЛПНП = общий ХС – ХС ЛПВП – ТГ/2,2.
ХС ЛПОНП = ОХС – ХС ЛПВП – ХС ЛПНП.
КА = (ОХС – ХС ЛПВП)/ХС ЛПВП.
Критериями диагностики различных типов дислипидемий были условия превышения следующих критических уровней показателей липидного спектра: ОХС ≥ 5,0 ммоль/л, ХС ЛПНП ≥ 3,0 ммоль/л, ТГ ≥ 1,7 ммоль/л, ХС ЛПВП < 1,2 ммоль/л [31].
Статистический анализ полученных данных проводили с помощью пакета прикладных программ Statgraphics Plus for Windows 3.0 (Manugistic Inc., USA). Для сравнения двух и более групп с различной по объему выборкой использовался одно- и двухфакторный дисперсионный анализ (F-критерий Фишера, непараметрический критерий Крускала — Уоллиса). Сравнение частоты дислипидемий проводилось по таблицам сопряжения признаков с использованием критерия хи-квадрат. Полученные результаты представлены в таблицах (M ± m), в тексте (M ± s) и на графиках, где M — среднее арифметическое, m — стандартное отклонение, s — стандартная ошибка.
Результаты исследования и их обсуждение
На первом этапе исследования были изучены основные показатели липидного спектра, полученные в ходе обследования пациентов на установленных этапах фармакотерапии каберголином, а также был проведен сравнительный анализ частоты встречаемости дислипидемий у пациентов. Результаты дисперсионного анализа по общей выборке обследованных представлены в табл. 1.
Было установлено, что супрессивная терапия привела к статистически значимому (р < 0,01) снижению среднего уровня ОХС к 6 и 12 месяцам фармакотерапии (табл. 1). Повышенный уровень ОХС на фоне гиперпролактинемии имел место у 60 % пациентов. На этапах фармакотерапии 3, 6 и 12 месяцев произошло статистически значимое уменьшение частоты гиперхолестеринемии до 37,5 % (χ2 = 4,5; р = 0,03), 30,5 % (χ2 = 6,15; р = 0,01) и 32,4 % (χ2 = 5,41; р = 0,02) соответственно (табл. 1).
Несмотря на то, что не было выявлено статистически значимых изменений среднего уровня ХС ЛПВП (табл. 1), частота гипоальфахолестеринемий (ХС ЛПВП < 1,2 ммоль/л) в ходе супрессивной фармакотерапии снизилась. На фоне гиперпролактинемии у 27,4 % пациентов определялся пониженный уровень ХС ЛПВП. На этапах 3, 6 и 12 месяцев лечения гипоальфахолестеринемия наблюдалась у 5 % (χ2 = 6,27; р = 0,01), 5,5 % (χ2 = 5,32; р = 0,02) и 11,1 % (χ2 = 2,49; р = 0,11) пациентов соответственно.
Анализ содержания в крови атерогенных фракций ХС ЛПНП и ХС ЛПОНП выявил разнонаправленные изменения в ходе супрессивной терапии (табл. 1). Так, на 6-м месяце лечения имело место снижение среднего уровня ХС ЛПНП (p < 0,01) и повышение среднего уровня ХС ЛПОНП (p < 0,001). Если повышение ХС ЛПНП ≥ 3,0 ммоль/ л на фоне гиперпролактинемии имело место у 53,2 % пациентов, то на 3, 6 и 12-м месяцах фармакотерапии — у 37,5 % (χ2 = 1,56; р = 0,2), 30,5 % (χ2 = 4,38; р = 0,06) и 41,6 % (χ2 = 0,02; р = 0,9) пациентов соответственно.
Уровень ТГ на фоне гиперпролактинемии варьировал в пределах от 0,36 до 5,4 ммоль/л, а частота гипертриглицеридемии (ГТГ) (ТГ ≥ 1,7 ммоль/л) составляла 20,8 %. Несмотря на то, что максимальный уровень ТГ на этапах 3, 6 и 12 месяцев снизился и равнялся 2,8; 2,3 и 3,8 ммоль/л соответственно, а частота ГТГ составляла 12,5; 25 и 19,4 % соответственно, статистически значимых различий средних значений уровня ТГ (табл. 1), а также частоты ГТГ в ходе фармакотерапии выявлено не было.
КА варьировал в пределах 1,15–9,26. Однако на протяжении всего периода наблюдения КА оставался на среднем уровне 2,91–2,96 (табл. 1). Высокий атерогенный риск (КА ≥ 3,0), имевший место у 56,5 % пациентов на фоне гиперпролактинемии, оставался у 52,5 % — после трех месяцев, у 55,5 % — после шести месяцев и у 52,7 % — после 12 месяцев супрессивной терапии.
Таким образом, несмотря на снижение ОХС и перераспределение фракций липопротеинов в липидном спектре пациентов с пролактиномами, фармакотерапия гиперпролактинемии не привела к снижению атерогенного риска у этих больных.
Интересно было также сравнить показатели липидного спектра при гиперпролактинемии и на фоне достигнутых целевых значений ПРЛ после супрессивной фармакотерапии, приведшей либо к нормализации уровня ПРЛ, либо к состояниям гипопролактинемии. На основании исходных показателей ПРЛ в крови, а также показателей, достигнутых на фоне супрессивной терапии, больные были разделены на три группы: первая группа — исходное состояние гиперпролактинемии, вторая группа — нормализация ПРЛ и третья группа — гипопролактинемия. С помощью двухфакторного дисперсионного анализа было проведено сравнение показателей липидного спектра у пациентов всех групп с учетом возможных гендерных различий этих показателей.
В первой, второй и третьей группах средние значения ОХС у мужчин составляли 5,70 ± 0,31 ммоль/л, 5,30 ± 0,42 ммоль/л и 5,21 ± 0,24 ммоль/л соответственно; у женщин — 5,10 ± 0,14 ммоль/л, 4,80 ± 0,14 ммоль/л и 4,7 ± 0,13 ммоль/л соответственно. Были отмечены статистически значимые различия между показателями ОХС в первой и третьей группах у мужчин (p < 0,05) и женщин (p < 0,05) (рис. 1). Частота гиперхолестеринемий в первой группе (57,6 %) превышала частоту в третьей группе (28,1 %) (χ2 = 9,16; р = 0,002).
В первой, второй и третьей группах средний уровень ХС ЛПВП у мужчин составлял 1,00 ± 0,09 ммоль/л, 1,29 ± 0,12 ммоль/л и 1,25 ± 0,07 ммоль/л соответственно, у женщин — 1,52 ± 0,04 ммоль/л, 1,39 ± 0,07 ммоль/л и 1,41 ± 0,04 ммоль/л соответственно. Гендерные различия показателей ХС ЛПВП, имевшие место на фоне гиперпролактинемии (p < 0,01), нивелировались после супрессивной терапии (рис. 2). В результате фармакотерапии наступило снижение частоты изолированной гипоальфахолестеринемии с 27,4 % в первой группе до 2,0 % во второй группе (χ2 = 9,35; р = 0,002) и 11,1 % в третьей группе (χ2 = 4,47; р = 0,03).
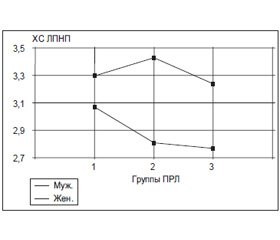
Средние значения ХС ЛПНП в первой, второй и третьей группах у мужчин составляли 3,29 ± 0,30 ммоль/л, 3,42 ± 0,41 ммоль/л и 3,23 ± 0,23 ммоль/л соответственно, у женщин — 3,07 ± 0,14 ммоль/л, 2,81 ± 0,14 ммоль/л и 2,76 ± 0,13 ммоль/л соответственно (рис. 3). Повышенный уровень ХС ЛПНП был выявлен у 51 % пациентов первой группы, 41,3 % — второй группы и у 33,3 % — третьей группы. Супрессивная терапия не оказывала статистически значимого влияния на уровень ХС ЛПНП.
Супрессивная фармакотерапия вызвала статистически значимое снижение среднего уровня ТГ у мужчин с 3,13 ± 0,17 ммоль/л в первой группе до 1,89 ± 0,24 ммоль/л во второй группе (p < 0,01) и до 1,82 ± 0,13 ммоль/л — в третьей группе (p < 0,01). У женщин с пролактиномами средний уровень ТГ не изменился и составлял: в первой группе — 1,01 ± 0,08 ммоль/л; во второй группе — 1,26 ± 0,10 ммоль/л и третьей группе — 1,1 ± 0,1 ммоль/л. Гендерные различия показателей имели место на фоне гиперпролактинемии (p < 0,001) и гипопролактинемии (p < 0,01) (рис. 4). Частота ГТГ в первой, второй и третьей группах составляла 20; 17,3 и 19 % соответственно и не изменилась в процессе лечения.
Сравнительная оценка соотношения фракций липидного спектра по показателям КА показала высокие риски развития атеросклероза у мужчин с пролактиномами. Так, КА у мужчин в первой группе составлял 4,90 ± 0,29, во второй группе — 3,92 ± 0,39 и в третьей группе — 3,5 ± 0,22. При переходе от гиперпролактинемии к нормализации пролактина и гипопролактинемии наблюдалось градуальное снижение КА (p < 0,01) (рис. 5).
У женщин с пролактиномами КА на протяжении всего периода обследования значимо не изменялся: в первой группе — 2,49 ± 0,14, во второй группе — 2,85 ± 0,13 и в третьей группе — 2,69 ± 0,12. Высокий атерогенный риск (КА ≥ 3) имел место у 43,7 % пациентов в первой группе, 50 % — во второй и 42,8 % — в третьей группе.
Выводы
1. Проведенный анализ показал, что около 50 % пациентов с пролактиномами находятся в группе риска развития или прогрессирования атеросклероза.
2. Состояние гиперпролактинемии в целом не влияет на известные гендерные различия в основных показателях липидного спектра, несмотря на снижение эстрогенной активности у женщин с пролактиномами.
3. Супрессивная фармакотерапия каберголином приводит к снижению общего холестерина как у мужчин, так и у женщин. Улучшение соотношения про- и антиатерогенных фракций липидов было наиболее выражено у мужчин.
4. Нормализация уровня пролактина способствует снижению риска развития и прогрессирования атерогенеза путем снижения содержания общего холестерина и повышения уровня ХС ЛПВП.
1. Mancini T. Hyperprolactinemia and prolactinomas [Text] / T. Mancini, F.F. Casanueva, А. Giustina // Endocrinol. Metabol. Clin. North. Am. — 2008. — Vol. 37, № 1. — Р. 67–99.
2. Дедов И.И. Акромегалия: патогенез, клиника, диагностика, дифференциальная диагностика, методы лечения [Текст]: Пособие для врачей / И.И. Дедов, Н.Н. Молитвословова, Е.И. Марова; под ред. И.И. Дедова. — Тверь: Триада, 2003. — 40 с.
3. Prolactin secretion in healthy adults is determined by gender, age and body mass index [Text] / F. Roelfsema, H. Pijl, D.M. Keenan [et al.] // PLoS One. — 2012. — Vol. 7 (2). — Р. e31305.
4. Gender, age, body mass index, and IGF-I individually and jointly determine distinct GH dynamics: analyses in one hundred healthy adults [Text] / J.D. Veldhuis, F. Roelfsema, D.M. Keenan [et al.] // J. Clin. Endocrinol. Metab. — 2011. — Vol. 96 (1). — Р. 115–121.
5. Klibanski A. Clinical practice. Prolactinomas [Text] / A. Klibanski // N. Engl. J. Med. — 2010. — Vol. 362. — P. 1219–2610.
6. Verhelst J. Hyperprolactinemia: pathophysiology and management [Text] / J. Verhelst, R. Abs // Treat. Endocrinol. — 2003. — Vol. 2, № 1. — Р. 23–32.
7. Crosignani P.G. Current treatment issues in female hyperprolactinaemia [Text]: review / P.G. Crosignani // Europ. J. Obstetr. Gynecol. Reproduct. Biol. — 2005. — № 4. — P. 13.
8. Марова Е.И. Нейроэндокринология [Teкст] / Е.И. Марова. — Ярославль, 1999. — 506 с.
9. PRL secreting adenomas in male patients [Text] / A. Ciccarelli, E. Guerra, M. De Rosa [et al.] // Pituitary. — 2005. — № 8. — Р. 39–42.
10. Guidelines of the piuitary Society for the diagnosis and management of prolactinomas [Text] / F. Casanueva, M. Molitch, J. Schlechte [et al.] // Clin. Endocrinol. — 2006. — № 65. — P. 265–273.
11. Endothelial function, insulin sensitivity and inflammatory markers in hyperprolactinemic premenopausal women [Text] / D. Yavuz, O. Deyneli, I. Akpinar [et al.] // Eur. J. Endocrinol. — 2003. — Vol. 149 (3). — Р. 187–193.
12. Roelfsema F. Phase difference between serum prolactin and cortisol rhythms is related to body mass index in humans [Text] / F. Roelfsema, H. Pijl // J. Clin. Endocrinol. Metabol. — 2012. — Vol. 97 (12). — Р. 2293–2296.
13. Increased prevalence of high Body Mass Index in patients presenting with pituitary tumours: severe obesity in patients with macroprolactinoma [Text] / C. Schmid, D.L. Goede, R.S. Hauser [et al.] // Swiss Med. Wkly. — 2006. — Vol. 136. — Р. 254–258.
14. Prolactin: a diabetogenic hormone [Text] / R. Landgraf, M.M. Landraf-Leurs, A. Weissmann [et al.] // Diabetologia. — 1977. — Vol. 13. — P. 99–104.
15. Bolanowski M. Pituitary disorders and osteoporosis [Text] / М. Bolanowski, J. Halupczok, А. Jawiarczyk-Przybyłowska // Int. J. Endocrinol. — 2015. — Vol. 2015. — P. 206853.
16. Focus on prolactin as a metabolic hormone [Text] / N. Ben-Jonathan, E.R. Hugo, T.D. Brandebourg [et al.] // Trends Endocrinol. Metabol. — 2006. — Vol. 17. — Р. 110–116.
17. Insulin sensitivity and hyperprolactinemia [Text] / A. Tuzcu, M. Bahceci, M. Dursun [et al.] // J. Endocrinol. Invest. — 2003. — Vol. 26. — Р. 341–346.
18. Serum lipids, postheparin plasma lipase activities and glucose tolerance in patients with prolactinoma [Text] / R. Pelkonen, E.A. Nikkil, B. Grahne [et al.] // Clin. Endocrinol. (Oxf). — 1982. — Vol. 16 (4). — P. 383–390.
19. Elevated serum lipids in hypogonadal men with and without hyperprolactinemia [Text] / D.S. Oppenheim, S.L. Greenspan, N.T. Zervas [et al.] // Ann. Intern. Med. — 1989. — Vol. 111 (4). — Р. 288–292.
20. Heshmati H.M. Chronic hyperprolactinemia and plasma lipids in women [Text] / Н.М. Heshmati, G.Turpin, J.L. de Gennes [et al.] // Klein. Wochenschr. — 1987. — Vol. 65 (11). — P. 516–519.
21. Fahy U. The lipoprotein profile of women with hyperprolactinemic amenorrhea [Text] / U. Fahy, M.I. Hopton // Hum. Reprod. — 1999. — Vol. 14, № 2. — P. 285–287.
22. The lipoprotein profile of women with hyperprolactinemic amenorrhoea [Text] / U. Fahy, M.I. Hopton, M. Hartog [et al.] // Hum. Reprod. — 1999. — Vol. 14. — Р. 285–287.
23. Webster, J. Cabergoline and quinagolide therapy for prolactinomas [Text] / J. Webster // Clin. Endocrinol. (Oxf). — 2000. — Vol. 53 (5). — Р. 549–550.
24. Влияние гиперпролактинемии опухолевого генеза на состояние жирового обмена [Текст] / Е.И. Марова, Н.Г. Мокрышева, Л.К. Дзеранова [и др.] // Ожирение и метаболизм. — 2005. — № 3. — С. 33–38.
25. The influences of hyperprolactinemia and obesity on cardiovascular risk markers: effects of cabergoline therapy [Text] / O. Serri, L. Li, J.C. Mamputu [et al.] // Clin. Endocrinol. (Oxf). — 2006. — Vol. 64. — Р. 366–370.
26. Insulin sensitivity and lipid profile in prolactinoma patients before and after normalization of prolactin by dopamine agonist therapy [Text] / K. Berinder, T. Nyström, C. Höybye [et al.] // Pituitary. — 2011. — Vol. 14 (3). — Р. 199–207.
27. Бондаренко Л.И. Достинекс: консервативное лечение пролактином гипофиза [Текст] / Л.И. Бондаренко, Е.В. Иващенко // Здоровье женщины. — 2005. — № 1. — С. 121–126.
28. Individualized High-Dose Cabergoline Therapy for Hyperprolactinemic Infertility in Women with Micro- and Macroprolactinomas [Text] / O. Masami, M. Nobuhiro, A. Kosaku [et al.] // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95, № 6. — Р. 2672–2679.
29. Климов А.Н. Обмен липидов и липопротеидов и их нарушения [Текст] / А.Н. Климов, Ю.Г. Никульчева. — СПб.: [Б. и.], 1999. — 505 с.
30. Friedewald W.T. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge [Text] / W.T. Friedewald, R.I. Levy, D.S. Fredrickson // Clin. Chem. — 1972. — Vol. 18. — Р. 499–502.
31. American Diabetes Association. Management of dyslipidemia in adult with diabetes [Text] // Diabetes Care. — 2000. — Vol. 23, Suppl. 1. — P. 57–60.

/20/20.jpg)
/21/21.jpg)
/22/22.jpg)