Международный эндокринологический журнал 4 (68) 2015
Вернуться к номеру
Вплив інсулінорезистентності на функцію нирок у хворих на первинний гіпотиреоз
Авторы: Дідушко О.М. - Івано-Франківський національний медичний університет
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
У статті наведено літературні дані та дані власних досліджень про роль лептину у формуванні асоційованої з ожирінням резистентності до інсуліну у хворих на первинний гіпотиреоз та їх вплив на функцію нирок. Обстежено 108 хворих на первинний гіпотиреоз, серед яких 60 жінок і 48 чоловіків. Між показниками індексу НОМА-IR та рівнем тиреотропного гормону встановлена пряма лінійна кореляційна залежність. Виявлено вірогідно високий рівень лептину у всіх обстежених хворих з явним гіпотиреозом порівняно з групою контролю. Установлено прямий кореляційний взаємозв’язок між показниками HOMA-IR і лептину у всіх обстежених хворих на гіпотиреоз, сильний прямий кореляційний взаємозв’язок між показниками HOMA-IR і лептину виявлено в групі хворих на явний гіпотиреоз у поєднанні з ожирінням. Крім того, рівень лептину негативно корелював із рівнем швидкості клубочкової фільтрації. Гіперлептинемія може розглядатися як ключовий фактор у розвитку інсулінорезистентності та порушенні функції нирок у хворих на гіпотиреоз із компонентами метаболічного синдрому.
В статье представлены литературные данные и данные собственных исследований о роли лептина в формировании ассоциированной с ожирением резистентности к инсулину у больных первичным гипотиреозом и их влиянии на функцию почек. Обследовано 108 больных первичным гипотиреозом, среди которых 60 женщин и 48 мужчин. Между показателями индекса НОМА-IR и уровнем тиреотропного гормона установлена прямая линейная корреляционная зависимость. Выявлен достоверно высокий уровень лептина у всех обследованных больных с явным гипотиреозом в сравнении с группой контроля. Установлена прямая корреляционная взаимосвязь между показателями HOMA-IR и лептина у всех обследованных больных гипотиреозом, сильная прямая корреляционная взаимосвязь между показателями HOMA-IR и лептина выявлена в группе больных явным гипотиреозом в сочетании с ожирением. Кроме того, уровень лептина отрицательно коррелировал с уровнем скорости клубочковой фильтрации. Гиперлептинемия может рассматриваться как ключевой фактор в развитии инсулинорезистентности и нарушения функции почек у больных гипотиреозом с компонентами метаболического синдрома.
The article presents literature data and data of our own researches on the role of leptin in the formation of insulin resistance associated with obesity in patients with primary hypothyroidism and their effect on the renal function. The study involved 108 patients with primary hypothyroidism, including 60 women and 48 men. Between HOMA-IR indices and the level of thyroid stimulating hormone, a direct linear correlation has been established. We have detected a significantly high level of leptin in all patients with overt hypothyroidism compared with the control group. A direct correlation between HOMA-IR and leptin indices has been established in all patients with hypothyroidism, a strong direct correlation between the values of HOMA-IR and leptin has been found in the group of patients with overt hypothyroidism in combination with obesity. In addition, the level of leptin negatively correlated with glomerular filtration rate. Hyperleptinemia can be regarded as a key factor in the development of insulin resistance and impaired renal function in patients with hypothyroidism with components of metabolic syndrome.
гіпотиреоз, інсулінорезистентність, ожиріння, лептин, функція нирок.
гипотиреоз, инсулинорезистентность, ожирение, лептин, функция почек.
hypothyroidism, insulin resistance, obesity, leptin, renal function.
Статья опубликована на с. 24-27
Вступ
В останні роки спостерігається тенденція до збільшення частоти захворювань щитоподібної залози (ЩЗ), що займають одну з провідних позицій у клінічній ендокринології. Найбільш поширеним варіантом порушення функції ЩЗ є первинний гіпотиреоз. Найбільша поширеність гіпотиреозу реєструється в старшій віковій групі (6–8 %). За даними епідеміологічних досліджень, поширеність клінічно вираженого гіпотиреозу становить 2 % серед жінок і 0,2 % серед чоловіків [5].
Гіпотиреоз традиційно відносять до стану, асоційованого із збільшенням маси тіла. При гіпотиреозі знижується гломерулярна фільтрація, страждає також тубулярна реабсорбція та секреція, спричиняючи затримку рідини, що проявляється набряками та збільшенням маси тіла. У когортному дослідженні Norwegian Nord–Trondelag (15 020 пацієнтів із патологією ЩЗ, які перебували під спостереженням протягом 10,5 року) був показаний взаємозв’язок між тиреоїдним статусом, масою тіла та ІМТ. Показано, що в жінок підвищення рівня тиреотропного гормону (ТТГ) на 1 мМО/л супроводжувалося збільшенням маси тіла на 0,9 кг, а ІМТ — на 0,3 кг/м2, у чоловіків — відповідно на 0,8 кг та 0,2 кг/м2 [22].
Дослідження показали, що адипоцити та преадипоцити як людини, так і тварин експресують рецептори ТТГ. Вплив тиреотропіну на рецептори ТТГ у жировій тканині призводить до диференціювання преадипоцитів у адипоцити, що, в свою чергу, стимулює адипогенез. Дослідження свідчать про те, що інсулінорезистентність (ІР) при ожирінні та гіпотиреозі пов’язана із хронічним запаленням і підвищеним рівнем адипоцитокінів [1, 4, 21]. Адипоцитокіни — різнорідна група сигнальних сполук із різними біологічними властивостями, що секретуються жировою тканиною. До адипоцитокінів відносять лептин, фактор некрозу пухлини альфа (TNF–a), інтерлейкін–6 (IL–6), трансформуючий фактор росту бета, інгібітор–1 активатора плазміногену, ангіотензиноген, адипсин — білок, що стимулює ацилювання, металтіонеїн, а також ендокринні чинники сімейства резистину й адипонектину [3, 6]. У даний час найбільш вивченою сполукою є лептин. За даними літератури, це мономерний білок, що виробляється майже виключно адипоцитами. Лептин опосередковано стимулює нейроендокринну адаптацію до голодування, зокрема змінюючи репродуктивну та тиреоїдну функції [4, 8]. Більшість дослідників вказують на безсумнівну роль лептину в атерогенезі і, отже, розглядають збільшення вмісту лептину в плазмі крові як незалежний фактор ризику розвитку коронарних захворювань. Доведено, що підвищення рівня лептину спричинює зменшення еластичності артеріальних стінок. У пацієнтів з ангіографічно підтвердженим атеросклерозом високий рівень лептину є прогностично несприятливим фактором ризику розвитку серцево–судинних ускладнень незалежно від вмісту в плазмі крові ліпідів і С–реактивного білка. Останнім часом інтенсивно вивчається патогенетичне значення лептину, адипонектину і резистину в патогенезі метаболічного синдрому та ожиріння, їх вплив на обмін глюкози і ліпідів, розвиток артеріальної гіпертензії (АГ), абдомінального ожиріння в пацієнтів на тлі зниженої функції ЩЗ [14, 17]. Установлено, що адипоцити при ожирінні експресують підвищений рівень TNF–a, що, у свою чергу стимулює вироблення IL–6. IL–6 займає особливе місце у формуванні різних проявів гіпотиреозу, бере активну участь в диференціюванні моноцитів в макрофаги, стимулює експресію генів гепатоцитів і макрофагів, відповідальних за синтез білків гострої фази, сприяє посиленню синтезу TNF–a макрофагами за участю ліпополісахаридів, індукує проліферацію гладком’язових волокон судин. Крім вищезгаданого, IL–6 разом із TNF–a і IL–1 є медіаторами відповіді гіпоталамо–гіпофізарно–надниркової (ГГН) системи на стрес і запалення. Стимуляція прозапальних цитокінів, насамперед ІЛ–6, активності ГГН–осі в осіб з ожирінням призводить до гіперхолестеринемії, збільшення ступеня ІР, зростання рівня глікемії і потреб організму в інсуліні [4, 12, 16].
Водночас з’явилися дані про те, що лептин має пошкоджуючу дію на структуру та функцію нирок [13]. Окремі автори продемонстрували, що екзогенне введення лептину протягом декількох тижнів значно збільшує продукцію колагену I і IV типу, призводячи до формування гломерулосклерозу та розвитку протеїнурії, навіть при нормальному рівні артеріального тиску [19, 23].
Мета дослідження: вивчити рівні лептину і показників інсулінорезистентності у хворих на первинний гіпотиреоз та їх вплив на функцію нирок.
Матеріали та методи
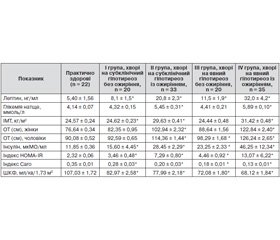
Обстежено 108 хворих на первинний гіпотиреоз (середній вік 56 ± 8 років), серед яких 60 жінок і 48 чоловіків. Методи дослідження включали загальноприйняте клінічне обстеження, визначення окружності талії (ОТ), індексу маси тіла (ІМТ). ОТ вважали нормальною, якщо вона не перевищувала 88 см у жінок і 102 см у чоловіків. Проводилося визначення глюкози натще і постпрандіальної глікемії (через 2 год після прийому їжі). Глюкоза в капілярній крові визначалася за допомогою аналізатора АГКМ–01 (фірма «Кверті–Мед», Україна). Ступінь ІР установлювали за індексами ІР, зокрема за індексом HOMA–IR (Homeostasis Model Assessment Insulin Resistance) та індексом Caro. Показник HOMA–IR обчислювався за формулою: HOMA–IR = глюкоза крові натще (ммоль/л) x інсулін крові натще (мкОД/л)/22,5. Індекс Caro обчислювався за формулою: глюкоза (ммоль/л)/інсулін (мкОД/л). Показник HOMA–IR у нормі не перевищує 2,77. Індекс Caro в нормі перевищує 0,33. Визначення концентрації ендогенного інсуліну, ТТГ, лептину проводилося методом імуноферментного аналізу в імунологічній лабораторії Івано–Франківської обласної клінічної лікарні з використанням автоматичного аналізаторa Stat Fax–303.
Усі хворі на первинний гіпотиреоз були розділені на 4 групи. У I групу включені 20 хворих на субклінічний гіпотиреоз (СГ) без ожиріння, в II групу — 33 хворих із СГ та ожирінням, в III групу — 20 хворих з явним гіпотиреозом без ожиріння, в IV групу — 35 хворих з явним гіпотиреозом і ожирінням. Контрольну групу обстеження становили 12 здорових осіб відповідного віку.
При проведенні статистичної обробки використовували параметричні і непараметричні методи аналізу: обчислювали середню арифметичну величину (М), середнє квадратичне відхилення (σ), середню похибку (τ), вірогідність відмінностей результатів дослідження (р). Вірогідність відмінностей оцінювали за t–критерієм Стьюдента для залежних і незалежних вибірок. Різницю вважали вірогідною при р < 0,05. Кореляційні зв’язки між вивченими показниками обчислювали за допомогою коефіцієнта кореляції Пірсона (r).
Результати дослідження та їх обговорення
Серед обстежених 108 хворих з гіпотиреозом у 68 спостерігався андроїдний тип ожиріння. ІМТ становив 32,63 ± 0,41 і 35,42 ± 0,48 кг/м2, тоді як у практично здорових осіб ІМТ був 24,57 ± 0,24 кг/м2. Як патогенетична ланка розвитку метаболічного синдрому розглядається ІР, що формується на тлі абдомінального ожиріння. Відомо, що ожиріння за абдомінальним типом більшою мірою корелює з показником HOMA–IR, ніж збільшення ІМТ. Ожиріння вісцерального типу виявилося характерним для всіх хворих II і IV груп, як чоловіків, так і жінок. Причому найбільші показники ОТ відзначено у хворих IV групи з явним гіпотиреозом. Нами виявлено, що в II групі ОТ у жінок із СГ становила 102,94 ± 2,32 см, у чоловіків — 114,36 ± 1,44 см, у IV групі у жінок з явним гіпотиреозом — 122,84 ± 2,40 см, у чоловіків з явним гіпотиреозом — 126,24 ± 2,65 см. Нами також установлено, що у хворих усіх досліджуваних груп вміст інсуліну був вірогідно вищим, ніж у групі контролю (р > 0,05). Однак цей показник у групі хворих з явним гіпотиреозом і ожирінням (IV група) перевищував рівень у конт–ролі майже в 2,5–3,9 раза (р < 0,05). Таким чином, вміст ендогенного інсуліну збільшується при формуванні ІР (табл. 1). Дослідження вмісту ендогенного інсуліну ви–явило вірогідну гіперінсулінемію: 46,25 ± 12,34 мкМО/мл у групі хворих з явним гіпотиреозом і ожирінням; 28,45 ± 2,29 мкМО/мл у групі хворих із СГ та ожирінням порівняно з групою контролю — 11,85 ± 0,36 (р < 0,05). Показник HOMA–IR виявився підвищеним неоднозначно в різних групах. Нами констатовано також вірогідне підвищення рівня індексу HOMA–IR у хворих з явним гіпотиреозом і ожирінням — 13,07 ± 6,22; у групі хворих із СГ та ожирінням — 7,29 ± 0,80 порівняно з групою контролю (р < 0,05). У хворих I групи даний показник перебував у межах 3,46 ± 0,48, III групи — 4,46 ± 0,92 відповідно. У хворих II групи показник HOMA–IR перевищував рівень у здорових осіб втричі, IV групи — у 5,6 раза (табл. 1). Отже, показник HOMA–IR підвищується у хворих на явний гіпотиреоз з ожирінням. Аналізуючи показники індексу Caro, установили, що у хворих I групи він суттєво не відрізнявся від показника здорових осіб. У хворих II, III, IV груп індекс Caro був відповідно в 1,7–2,7 раза меншим порівняно зі здоровими особами (р < 0,05).
Кореляційний аналіз показав наявність прямого кореляційного взаємозв’язку між показниками HOMA–IR і рівнем ТТГ (r = 0,572, р = 0,001) у хворих на гіпотиреоз. Також виявлено чіткий зворотний зв’язок між рівнем ендогенного інсуліну та швидкістю клубочкової фільтрації (ШКФ) (R = –0,52, р = 0,01), а також HOMA–IR та ШКФ (r = –0,49, р < 0,05) і прямий — з екскрецією альбуміну.
Виходячи з отриманих даних, на наш погляд, існує зв’язок між рівнем адипоцитокінів і функцією ЩЗ. При оцінці рівня лептину відзначено, що збільшення маси тіла у хворих на гіпотиреоз супроводжується наростанням концентрації лептину в сироватці крові. Так, у хворих із гіпотиреозом рівень лептину був удвічі вищим у групі з ІМТ > 24,9 кг/м2, ніж у групі з ІМТ < 24,9 кг/м2 (р < 0,01) і порівняно з контрольною групою (р < 0,001). У хворих усіх обстежених груп установлено істотне вірогідне збільшення рівня лептину порівняно з групою контролю (р < 0,05) (табл. 1), хоча він був вірогідно вищим у хворих на явний гіпотиреоз з ожирінням і становив 32,0 ± 4,2 мкг/мл. Отримані нами дані відповідають результатам досліджень інших авторів і показують, що у хворих із синдромом гіпотиреозу значно підвищується вміст лептину.
Нами проведено кореляційний аналіз, що показав прямий кореляційний взаємозв’язок між показниками HOMA–IR і лептину у всіх обстежених нами хворих на гіпотиреоз (r = 0,3682, р = 0,002). Сильний прямий кореляційний взаємозв’язок між показниками HOMA–IR і лептину нами виявлено в групі хворих на явний гіпотиреоз у поєднанні з ожирінням (r = 0,8763, р = 0,042). Крім того, рівень лептину в сироватці крові обстежених нами хворих негативно корелював із рівнем ШКФ (r = –0,456, р = 0,022). На наш погляд, гіперлептинемія є ключовим фактором у розвитку інсулінорезистентності та порушенні функції нирок у хворих на гіпотиреоз.
Висновки
1. Гіперлептинемія може розглядатись як маркер гіпотиреозу із компонентами метаболічного синдрому і може бути незалежним фактором розвитку інсулінорезистентності при гіпотиреозі.
2. Гіперлептинемія та інсулінорезистентність належать до факторів ризику порушення функції нирок у хворих на гіпотиреоз.
1. Марусин О.В., Боцюрко В.І. Ожиріння і лептинорезистентність // Галицький лікарський вісник. — 2012. — Т. 19, № 1. — С. 155–157.
2. Паньків В.І., Гаврилюк В.М., Непорадна Л.Д. та ін. Взаємозв’язки між структурно–функціональними порушеннями щитоподібної залози і компонентами метаболічного синдрому // Міжнародний ендокринологічний журнал. — 2011. — № 6(38). — С. 39–43.
3. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тиреоидология: Руководство. – М.: Медицина, 2007. – 816 с.
4. Скрипник Н.В. Роль гіпотиреозу у формуванні інсулінорезистентності / Н.В. Скрипник // Клінічна ендокринологія та ендокринна хірургія. — 2009. — № 4(29). — С. 47–53.
5. Паньків В.І. Практична тиреоїдологія. — Донецьк: Видавець Заславський О.Ю., 2011. — 224 с.
6. Гормоны жировой ткани и функциональная активность щитовидной железы / Н.А. Петунина, Н.Э. Альтшулер, Н.Г. Ракова, Л.В. Трухина // Ожирение и метаболизм. — 2010. — № 4. — С. 8–11.
7. Ожирение и гипотиреоз / С.М. Захарова // Ожирение и метаболизм. — 2013. — № 2. — С. 54–58.
8. Смирнов А.Н. Элементы эндокринной регуляции. — М.: ГЭОТАР–Медиа, 2008. — С. 94–100.
9. Сравнительный анализ концентрации гормонов жировой ткани, показателей липидного обмена и инсулинорезистентности при субклиническом гипотиреозе в зависимости от наличия/отсутствия заместительной терапии левотироксином / Н.Э. Альтшулер, Н.А. Петунина, А.П. Николаев, Т.В. Чернышова // Клиническая и экспериментальная тиреоидология. — 2011. — Т. 7, № 3. — С. 53–58.
10. Adiponectin is associated with vascular function independent of insulin sensitivity / J.M. Fernandez–Real, A. Castro, G. Vazquez, R. Casamitjana et al. // Diabetes Care. — 2004. — Vol. 27. — Р. 739–745.
11. Adiponectin levels and cardiovascular risk factors in hypothyroidism and hyperthyroidism / А.Е. Altinova, F.B. Toruner, M. Aktiirk et al. // J. Clinical Endocrinology. — 2006. — Vol. 65(4). — P. 530–535.
12. Adiponectin stimulates glucose utilization and fatty acid oxidation by activating AMP–activated protein kinase / T. Yamacuchi, J. Kamon, Y. Minokoshi et al. // Nat. Med. — 2002. — Vol. 8. — Р. 1288–1295.
13. Adipose tissue adiponectin production and adiponectin serum concentration in human obesity and insulin resistance / J. Hoffstedt, E. Arvidsson, E. Sjolin et al. // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89. — Р. 1391–1396.
14. Analysis of paradoxical observations on the association between leptin and insulin resistance / R.B. Ceddia, H.A. Koistinen, J.R. Zierath, G. Sweeney // FASEBJ. — 2002. — Vol. 16. — Р. 1163–1176.
15. Association of hypoadiponectinemia with impaired vasoreactivity / N. Ouchi, O. Mitsuru, S. Kihara et al. // Hypertension. — 2003. — Vol. 42. — Р. 231–234.
16. Brenta G. Why can insulin resistance be a natural consequence of thyroid dysfunction? / G. Brenta // J. Thyroid. Res. — 2011. — № 3. — P. 129–143.
17. Effect of experimental hypo– and hyperthyroidism on serum adiponectin / C.N. Aragao, L.L. Souza, A. Cabanelas, К.J. Oliveira // Metabolism. — 2007. — Vol. 56(1). — P. 6–11.
18. Effects of thyroid hormones on serum levels of adipokines as studied in patients with differentiated thyroid carcinoma during thyroxine withdrawal / J.I. Botella–Carretero, F. Alvarez–Blasco, J. Sancho, H.F. Escobar–Morreale // Thyroid. — 2006. — Vol. 16. — Р. 397–402.
19. Farvid M.S. Association of adiponectin and resistin with adipose tissue compartments, insulin resistance and dyslipidaemia / M.S. Farvid, D.C. Chan // Diabetes Obes. Metab. — 2005. — Vol. 7(4). — P. 406–413.
20. Hypoadiponectinemia is closely linked to endothelial dysfunction in man / M. Shimabukuro, N. Higa, T. Asahio et al. // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88. — Р. 3236–3240.
21. Klieverik L.P. Thyroid hormone modulates glucose production via a sympathetic pathway from the hypothalamic paraventricular nucleus to the liver. Proceeding of the National Academy of Sciences of the United States of America / L.P. Klieverik, S.F. Janssen, A. Van Riel // PMC. — 2009. — Vol. 14, № 106. — P. 5966–5971.
22. Maratou E. Studies of insulin resistance in patients with clinical and subclinical hypothyroidism / E. Maratou, D.J. Hadjidakis, A. Kollias // European Journal of Endocrinology. — 2009. — Vol. 5, № 160. — P. 785–790.
23. Kim M.K. Effects of thyroid hormone in A1C and glycated albumin levels in nondiabetic subjects with overt hypothyroidism / M.K. Kim, K.H. Sang, B. Ki–Hyum // Diabetes Care. — 2010. — Vol. 12, № 33. — P. 2546–2548.
24. Serum concentrations of adipocytokines in patients with hyperthyroidism and hypothyroidism before and after control of thyroid function / P. Iglesias, P. Alvarez Fidalgo, R. Codoceo, J.J. Diez // Clin. Endocrinol. — 2003. — Vol. 59. — Р. 621–629.

/26/26.jpg)