Международный эндокринологический журнал 4 (68) 2015
Вернуться к номеру
Cтан серцево-судинної системи та ліпідний спектр при соматотропній недостатності у молодих дорослих із маніфестацією в дитячому віці (огляд літератури та власні спостереження)
Авторы: Большова О.В., Вишневська О.А., Музь В.А., Ткачова Т.О., Малиновська Т.М., Самсон О.Я. -
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Проведено аналіз наукової літератури стосовно особливостей клінічного перебігу дефіциту гормона росту (ДГР), що маніфестував у дитячому віці, у молодих дорослих. Акцент зроблено на стані ліпідного обміну, а також серцево-судинної системи хворих із ДГР, які не отримували лікування рекомбінантним гормоном росту (рГР). Наведені власні дані, отримані при обстеженні молодих дорослих із ДГР до лікування рГР та на його тлі. Встановлено наявність суттєвих порушень з боку показників ліпідного, вуглеводного обмінів і кардіальних параметрів у хворих, які довготривало не отримували патогенетичного лікування, а також позитивні зміни на тлі призначення препаратів рГР.
Проведен анализ научной литературы относительно особенностей клинического течения дефицита гормона роста (ДГР), который манифестировал в детском возрасте, у молодых взрослых. Акцент сделан на состоянии липидного обмена, а также сердечно-сосудистой системы больных с ДГР, не получавших лечения рекомбинантным гормоном роста (рГР). Приведены собственные данные, полученные при обследовании молодых взрослых с ДГР до лечения рГР и на его фоне. Установлено наличие существенных нарушений со стороны показателей липидного, углеводного обменов и кардиальных параметров у больных, длительно не получавших патогенетического лечения, а также позитивные изменения на фоне назначения препаратов рГР.
The analysis of scientific literature on the features of clinical course of childhood-onset growth hormone deficiency (GHD) in young adults has been carried out. The focus was on the state of lipid metabolism, as well as on the state of cardiovascular system in patients with GHD who did not receive treatment with recombinant growth hormone (rGH). Own data obtained when examining young adults with GHD before rGH treatment and on its background are provided. The presence of significant disorders of the lipid, carbohydrate metabolism and cardiac parameters in patients who did not receive a long-term pathogenetic treatment, as well as improvements following rGH administration are established.
дефіцит гормона росту, що виник в дитинстві, молоді дорослі, метаболічні та кардіальні параметри, замісна терапія рекомбінантним гормоном росту.
дефицит гормона роста, возникший в детстве, молодые взрослые, метаболические и кардиальные параметры, заместительная терапия рекомбинантным гормоном роста.
childhood-onset growth hormone deficiency, young adults, metabolic and cardiac parameters, growth hormone replacement therapy.
Статья опубликована на с. 93-101
Дефіцит гормона росту (ДГР) — соматотропна недостатність — може виникати у пацієнтів будь–якого віку внаслідок дії різноманітних чинників, може бути ізольованим або поєднуватися (70–88 %) із дефіцитом інших гормонів гіпофіза (множинний дефіцит гормонів гіпофіза — МДГГ).
Рівень циркулюючого гормона росту (ГР) після народження дитини невпинно підвищується, має плато в періоді пубертації, потім знижується приблизно на 14 % кожну декаду життя [1]. В осіб похилого віку без наявності патології з боку гіпоталамо–гіпофізарної ділянки відбувається природне зниження рівня ГР, що супроводжується підвищенням ризику серцево–судинних захворювань (ССЗ), надлишком маси тіла/ожирінням, зниженням мінеральної щільності кісток, зниженням фізичної витривалості, порушенням інсулінорезистентності (ІР) та ліпідного спектра, зниженням якості життя [2].
Але з точки зору клінічної ендокринології на особливу увагу заслуговує ДГР, пов’язаний із різними патологічними станами, в першу чергу з ураженням гіпоталамо–гіпофізарної ділянки, генетичними порушеннями тощо.
За часом виникнення можна виділити дефіцит гормона росту, що виник в дитячому віці (дит–ДГР), і дефіцит гормона росту, що виник уже в дорослому віці (дор–ДГР). Приблизно 20 % дорослих із ДГР мають захворювання, що виникло в дитячому віці та в більшості випадків є наслідком ураження гіпоталамо–гіпофізарної ділянки або пов’язане з генетичними чинниками.
Підозра на ДГР у молодих дорослих посилюється за наявності дефіциту ГР у дитячому віці, дефіциту інших гормонів гіпофіза, а також у хворих на черепно–мозкову травму, з опроміненням ділянки голови та шиї в анамнезі, органічним ураженням гіпоталамо–гіпофізарної ділянки.
Пацієнти з маніфестацією ДГР у дитячому віці — доволі гетерогенна група, до якої входять хворі на ідіопатичний ізольований дефіцит ГР, генетичні дефекти, з органічними вродженими або набутими ураженнями головного мозку.
У хворих на ДГР при проведенні магнітно–резонансної томографії (МРТ) виявляють різноманітні структурні аномалії (зменшення/відсутність передньої частки гіпофіза, стоншення або розрив ніжки гіпофіза, ектопія заднього гіпофіза), причому такі аномалії присутні у 53 % хворих на ізольований дефіцит ГР та у 79 % хворих на множинний дефіцит гормонів гіпофіза. За наявності тріади структурних аномалій більшість пацієнтів (65–80 %) мають пік викиду ГР менше 3 нг/мл [3].
Причиною ізольованого дефіциту та МДГГ може бути дисгенезія ніжки гіпофіза, причому у більшості хворих (до 96 %) з віком ступінь дефіциту ГР може прогресувати, або до ізольованого ДГР приєднується дефіцит інших гіпофізарних гормонів, аж до пангіпопітуїтаризму (46 %) [4]. Дисгенезію ніжки гіпофіза діагностують у віці до 14 років у 46,2 % пацієнтів, у віці 14–18 років — у 23 %, у дорослих — у 30,8 % випадків. Дефіцит ГР може бути наслідком пологової травми (30 %), мутації генів, відповідальних за розвиток і функцію гіпофіза (до 10 %). У хворих на МДГГ в анамнезі часто спостерігаються тривала жовтяниця, пологова травма, накладання щипців, гіпоглікемії, асфіксія в пологах.
Синдром розриву ніжки гіпофіза може визначатися у дітей із попереднім діагнозом ідіопатичної соматотропної недостатності або МДГГ. Клінічно синдром проявляється в дитинстві або в другій декаді життя. Гормональний дефіцит може бути різного ступеня тяжкості.
Аналіз результатів обстеження 353 хворих з реєстру Pfizer International Metabolic Database KIMS, в яких ДГР виник у дитячому віці, встановив наявність неорганічної природи захворювання у 147 хворих, органічної — у 159 хворих, у 47 були підтверджені пухлини головного мозку [5]. Пухлини головного мозку — найчастіша причина ДГР у дорослому віці (до 70–72 %); аденома гіпофіза найчастіше трапляється при дор–ДГР (60–65 %), а герміноклітинні пухлини (до 50 %) та краніофарингіоми (до 45 %) — при виникненні ДГР у дитячому віці [6]. Згідно з даними Голландського національного реєстру дорослих, які отримували лікування рекомбінантним гормоном росту (рГР), найчастішою причиною ДГР були пухлини гіпофіза та їх лікування, краніофарингіома та ідіопатична соматотропна недостатність [7]. При органічній природі ДГР хворі досягають вищого фінального зросту, але мають найгірші показники якості життя; показники зросту та рівні інсуліноподібного фактора росту–1 (ІФР–1) і білка, що його зв’язує (ІФР–ЗБ–3), у молодих дорослих з дит–ДГР значно нижчі, ніж при дор–ДГР.
Дорослі пацієнти, в яких ДГР маніфестував у дитячому віці, за відсутності лікування рГР мають зниження показників росту та затримку термінів осифікації (рентген–вік значно відстає від паспортного віку). Залежно від наявності дефіциту інших гормонів гіпофіза у хворих на ДГР спостерігаються безплідність, порушення функції щитоподібної залози, надниркових залоз. Дефіцит пролактину зазвичай клінічно не проявляється. Хворі відзначають зниження працездатності, слабкість, швидку втомлюваність, міальгію, пригнічений настрій. Проведені нейрофізіологічні дослідження та біопсія м’язів виявляють нейром’язову дисфункцію як при дит–ДГР, так і дор–ДГР. Симптомокомплекс ДГР у дорослих, що виник унаслідок патологічних процесів у гіпоталамо–гіпофізарній ділянці, характеризується наявністю порушень з боку ліпідного спектра та серцево–судинної системи, зниженням мінеральної щільності кісток, порушенням будови тіла (збільшення абдомінального жиру), психологічного стану та зниженням якості життя [8].
Згідно з даними Transition GHD Group (2013), при обстеженні 112 дорослих, які мали ДГР з дитячого віку, у більшої половини хворих (64 %) спостерігали недостатність аденогіпофіза (56 % — набута, 33 % — вроджена) та в 11 % — ідіопатичний ДГР [9]. Більшість пацієнтів (88 %) припинили лікування рГР до початку перехідного періоду (середній вік — 16,3 року), незважаючи на збереження ДГР. У перехідному періоді (середній вік — 19,4 року) у 101 хворого був підтверджений дефіцит ГР, а у чотирьох пацієнтів був знятий діагноз ідіопатичної соматотропної недостатності. При поновленні терапії у 70 % пацієнтів рівень ІФР–1 становив ≤ 2 SDS, через три роки після поновлення лікування — у 34 %. На тлі лікування відбулися також позитивні зміни з боку ліпідного профілю та мінеральної щільності кісток.
На сьогодні застосування рГР — єдиний патогенетичний метод лікування хворих на ДГР. Реакція на лікування рГР не залежить від віку маніфестації захворювання та головним чином залежить від тяжкості дефіциту ГР: чим тяжчий дефіцит ГР, тим вища відповідь на лікування [10]. В Україні хворі з підтвердженою соматотропною недостатністю безкоштовно забезпечуються препаратами рГР до досягнення 18–річного віку. Після цього віку практично всі хворі припиняють лікування, що призводить до різкого погіршення як соматичного, так і психологічного стану пацієнтів. Крім того, існує значна кількість хворих, які з різних причин взагалі ніколи не отримували лікування рГР у дитячому або підлітковому віці.
При маніфестації захворювання в дитячому віці головною метою лікування є досягнення задовільних показників росту протягом дитинства та юнацтва [11]. За умов проведення регулярного лікування рГР середній фінальний зріст у хворих з дит–ДГР становить у чоловіків — 168,5 і 170,3 см; у жінок — 160,0 і 157,3 см (при ізольованому ГР–дефіциті та МДГГ відповідно) [12]. При призначенні рГР у дозі приблизно 0,3 мг/кг/тиждень діти з ДГР досягають дорослого зросту, який практично не відрізняється від нормального фінального зросту (SDS –0,7 ± 1,3 для чоловіків і –0,7 ± 1,1 для жінок) та становить 171,6 ± 8,2 см у чоловіків і 158,5 ± 7,1 см — у жінок [13]. При тяжкому дефіциті ГР фінальний зріст становить 163,9 см у чоловіків і 151,1 см у жінок. При частковому дефіциті ГР середній фінальний зріст становить 166,2 см (чоловіки) та 157,7 см (жінки), при інтракраніальних пухлинах — 175,9 см (чоловіки) та 160,2 см (жінки). Пізня діагностика, відсутність можливостей лікуватися, мала кількість ін’єкцій на тиждень, недостатня доза препарату — головні чинники того, що фінальний зріст пацієнта не досягає цільових значень.
На жаль, найбільш загальною практикою є припинення лікування при досягненні фінального (або соціально прийнятного) зросту. Однак не можна ігнорувати участь ГР не тільки в процесі росту, а й інших метаболічних процесах: підвищення рівня ліпопротеїдів високої щільності (ЛПВЩ), зниження рівня ліпопротеїдів низької щільності (ЛПНЩ), збільшення м’язової сили та худої маси тіла, зниження вмісту жиру, підвищення мінеральної щільності кісток, розвиток статевих залоз тощо [14–16]. У зв’язку з цим відсутність лікування рГР у підлітків з дит–ДГР у період переходу до дорослого віку після досягнення фінального зросту може призвести до серйозних порушень стану здоров’я. Навіть при досягненні задовільного фінального зросту в короткі терміни після припинення лікування рГР у хворих відбувається підвищення кількості жирової тканини, зниження худої маси тіла та мінеральної щільності кісток.
Відновлення/початок терапії рГР у молодих дорослих з дит–ДГР сприяє подальшому соматичному дозріванню внутрішніх органів. Показано, що застосування препарату рГР в дозі 0,02 ОД/кг/добу (7 мкг/кг/добу) протягом одного року у молодих дорослих з дит–ДГР сприяє нормалізації рівня ІФР–1 в крові, а також покращенню систолічної функції лівого шлуночка (ЛШ) [17].
Серце та судини розглядають як органи–мішені для ГР та ІФР–1 [18–20]. Експериментальні і клінічні дослідження свідчать про суттєвий вплив ГР та –ІФР–1 на розвиток серця. Зокрема, ГР регулює зростання кардіального м’яза та прямо і опосередковано відіграє ключову роль у фізіології серця [21].
Одним із головних діагностичних критеріїв ДГР є рівень ІФР–1 [22]. Як патологічно високий, так і патологічно низький рівень ІФР–1 в крові негативно впливає на стан серцево–судинної системи. Патологічно високі рівні ГР та ІФР–1 зумовлюють розвиток специфічної кардіоміопатії, для якої характерною є концентрична кардіальна гіпертрофія з систолічною дисфункцією, що призводить до серцевої недостатності; можливий розвиток порушення серцевого ритму, артеріальної гіпертензії (АГ), цукрового діабету (ЦД), ІР, дисліпідемій [23]. В осіб із патологічно низькими рівнями ГР та ІФР–1 спостерігаються порушення будови тіла, зміни ліпідного профілю, ІР, ендотеліальна дисфункція, ранній атеросклероз, ішемічна хвороба серця, зниження маси серцевого м’яза з порушенням систолічної функції (особливо після фізичного навантаження), зниженням фібринолітичної активності [24]. Дефіцит ГР призводить до зменшення маси обох шлуночків та зниження серцевої діяльності (гіпокінетичний синдром). Розвиток гіпокінетичного синдрому найбільш характерний для дітей із соматотропною недостатністю, що виникла в молодшому дитячому віці [21].
Встановлено наявність низки структурних і функціональних аномалій з боку серця при ДГР, таких як стоншення кардіальної стінки, зниження діастолічного наповнення та порушення відповіді лівого шлуночка на фізичні вправи. Крім того, пацієнти з ДГР (особливо з дит–ДГР) можуть мати збільшення товщини carotid intima–media та високий ризик появи атероматичних бляшок (ранній атеросклероз), що в подальшому може призводити до гемодинамічних порушень і підвищувати ризик серцево–судинної захворюваності та смертності вже в молодому віці [25].
У патогенезі серцево–судинної патології у хворих на ДГР, які не отримували лікування рГР, можуть бути задіяні судинний ендотеліальний ростовий фактор і матричні металопротеїнази [26]. Встановлено, що пацієнти з ДГР мають дисфункцію ЛШ в період спокою та при фізичних навантаженнях. Це свідчить про фізіологічну роль ГР у підтримці нормальної роботи серця. Не знайдено різниці між дитячим та дорослим ДГР, обидві групи мають ураження серця [27], а замісна терапія рГР знижує ризик кардіоваскулярної патології у дорослих з дит–ДГР [28] та у дорослих з дор–ДГР [29]. У пацієнтів з дор–ДГР, які не отримували лікування рГР, встановлено вірогідне збільшення об’єму ЛШ та позитивний ефект терапії (більшою мірою у чоловіків, але не у жінок) [30]. Експериментальними дослідженнями ГР L. Groban та співавт. (2011) виявлено наявність діастолічної дисфункції у мишей з дефіцитом ГР та запобігання її порушенню при призначенні лікування рГР [31].
Отже, метою нашого дослідження стало вивчення стану серцево–судинної системи та ліпідного обміну у дорослих осіб із ДГР до лікування препаратами рГР та через 12 місяців після лікування.
Під нашим наглядом перебували 16 пацієнтів (10 чоловіків, 6 жінок) віком від 23 до 34 років із ДГР, що був діагностований у дитинстві. Лікування препаратами рГР у дитинстві ці хворі не отримували з різних причин. Контрольну групу становили 10 здорових осіб (6 чоловіків, 4 жінки) віком від 25 до 36 років.
Стан серцево–судинної системи вивчали за допомогою електрокардіографії (ЕКГ), ультразвукового дослідження (УЗД) серця, вимірюванням систолічного та діастолічного артеріального тиску (АТ). ЕКГ–дослідження виконували на електрокардіографі Fukuda Denshi фірми Cardimax FX–326. УЗД серця проводили на апараті SSD–1700 (Aloka, Японія), датчик 3,0 МГц, у двовимірному М–режимі для вимірювання розмірів лівого передсердя і шлуночка, товщину стінки ЛШ, що дозволяє розрахувати масу міокарда ЛШ, і об’єми — за формулою Шиллера і Сімпсона.
Статистичний аналіз отриманих даних проводився з використанням методів варіаційної статистики та методу різниць з обчисленням t–критерію Стьюдента. Різницю між середніми значеннями вважали вірогідною за р < 0,05, а за 0,05 < р < 0,1 відзначали тенденцію до вірогідності відмінностей.
До лікування у більшості пацієнтів (10 осіб) при огляді був зареєстрований низький АТ (від 80/50 до 90/55 мм рт.ст.), в однієї хворої спостерігалась гіпертонія (АТ = 140/70 мм рт.ст.), у 5 пацієнтів АТ був у межах норми. Брадикардія відзначалася у трьох осіб, тахікардія — в однієї, а у більшості пацієнтів частота серцевих скорочень (ЧСС) перебувала в межах норми.
Через 12 місяців лікування рГР у 5 з 10 хворих АТ залишався низьким (від 80/45 до 90/60 мм рт.ст.); підвищення АТ не спостерігалось. Брадикардію (ЧСС від 64 до 73 уд/хв) виявили у двох хворих, тахікардію (ЧСС від 98 до 122 уд/хв) — у трьох пацієнтів.
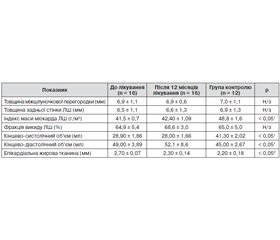
Серцеву функцію досліджували за допомогою ехокардіографії у всіх пацієнтів. Індекс маси міокарда ЛШ становив 41,5 ± 0,7 г/м2 у пацієнтів до лікування рГР та 42,40 ± 1,09 г/м2 — через 12 місяців після лікування (48,8 ± 1,6 г/м2 — в осіб із групи контролю). Маса міокарда ЛШ була значно нижчою до лікування та після порівняно з групою контролю (р < 0,05) (табл. 1). Однак товщина міжшлуночкової перегородки і задньої стінки суттєво не змінювались на тлі лікування (табл. 1).
Фракція викиду ЛШ у стані спокою була однаковою для всіх груп; у той час кінцево–систолічний і кінцево–діастолічний об’єми були значно нижчими у пацієнтів до лікування і після порівняно з контрольною групою (р < 0,05) (табл. 1).
За результатами ехографії встановлено, що товщина епікардіальної жирової тканини у молодих дорослих становила 2,70 ± 0,07 мм у хворих до лікування препаратами рГР та зменшувалась до 2,30 ± 0,14 мм на тлі терапії рГР (2,20 ± 0,18 мм — у здорових). Товщина епікардіальної жирової тканини була вірогідно більшою у пацієнтів до лікування порівняно з показниками через 12 місяців лікування рГР та показниками осіб із групи контролю (р < 0,05).
Встановлено позитивну кореляцію між індексом маси тіла (ІМТ) і товщиною епікардіальної жирової тканини у всіх групах пацієнтів (до лікування рГР та після, здорові): р < 0,03, < 0,002, < 0,01 і r = 0,84; 0,20; 0,51 відповідно. Не виявлено корелятивного зв’язку між ІМТ і індексом маси міокарда ЛШ.
Ехокардіографічне вимірювання товщини епікардіальної жирової тканини є простим і надійним індикатором вісцеральної жирової тканини, що дозволяє виявляти серцево–судинні ризики. Епікардіальна жирова тканина — це справжня вісцеральна тканина, що накопичується в ділянці серця — на стінці правого шлуночка, на верхівці ЛШ і навколо передсердь, і розподіл жиру (особливо черевної жирової тканини) значно корелює з товщиною епікардіальної жирової тканини. В дослідженні G. Iacobellis et al. (2013) встановлено корелятивний зв’язок між товщиною епікардіальної жирової тканини і талії, діастолічним АТ, ЛПНЩ і рівнем адипонектину у пацієнтів із метаболічним синдромом [32]. Ми виявили збільшення товщини епікардіальної жирової тканини у пацієнтів, які ніколи не отримували рГР, порівняно з тими, які лікувались рГР, та групою контролю.
Отже, дит–ДГР, що зберігається у молодих дорослих, асоціюється із порушенням функції серцево–судинної системи, а саме: зниженням маси міокарда ЛШ, стоншенням ендотеліальної стінки судин, збільшенням епікардіальної жирової тканини.
Підвищений ризик патології з боку серцево–судинної системи у хворих на ДГР може бути обумовлений як безпосередньо дефіцитом ГР та ІФР–1, так і наявністю метаболічного синдрому. Так, серед 2479 пацієнтів із тяжким ДГР, які не отримували лікування рГР, метаболічний синдром траплявся у 43,1 % осіб та у 49,1 % осіб з дор–ДГР (в 1,5–2 рази частіше, ніж в загальній популяції) [33, 34]. Частота метаболічного синдрому у хворих на ДГР залежала від віку, тривалості захворювання, ІМТ та не залежала від тяжкості, тривалості та етіології ДГР. Пацієнти з метаболічним синдромом мали більший ризик розвитку ЦД — 4,65 (95% CI 3,29–6,58), серцево–судинної патології — 1,91 (95% CI 1,33–2,75), цереброваскулярної патології — 1,77 (95% CI 1,09–2,87), ніж пацієнти без метаболічного синдрому [35]. На більшу частоту метаболічного синдрому в осіб із ДГР у США вказують A.F. Attanasio та співавт. (2010) порівняно із загальною популяцією [36].
Вплив ГР на зростання дитини обмежений з віком, у той же час вплив системи ГР/ІФР–1 на метаболічні процеси та серцево–судинну систему триває практично все життя [37]. У підлітків з дит–ДГР, що продовжує існувати в дорослому віці, без відновлення замісної терапії рГР вже через 2–3 роки відбувається зростання кількості загального жиру та жирової маси тіла, вмісту загального холестерину, ЛПНЩ, b–ліпопротеїну В, тригліцеридів; знижується рівень ЛПВЩ, тобто акумулюються важливі кардіоваскулярні фактори ризику [38, 39].
Крім того, що пацієнти з ДГР у дорослому віці в більшості випадків мають ознаки метаболічного синдрому, тяжкий дефіцит ГР асоціюється з розвитком неалкогольної жирової інфільтрації печінки [40]. А. Shimatsu та співавт. (2011) при обстеженні 349 дорослих хворих на ДГР встановили наявність дисліпідемії у 55,9 %, захворювання печінки — у 15,5 %, порушення полів зору — у 19,2 %, артеріальну гіпертензію — у 16,9 % хворих [8]. Якщо терапія рГР не відновлюється, у молодих дорослих з дит–ДГР можливе виникнення множинних метаболічних порушень, а саме: гіпертригліцеридемії, неалкогольної жирової дистрофії печінки, гіперхолестеринемії, ЦД, АГ, що діагностуються вже в перші роки після припинення терапії рГР. Більше двох супутніх захворювань виявляється у 30–32 % хворих [20, 41, 42].
Дефіцит ГР, що маніфестував у дитячому віці та зберігається в молодому дорослому віці, супроводжується збільшенням окружності талії (ОТ), стегон і порушенням їх співвідношення; надлишковою масою/ожирінням; підвищенням рівня загального холестерину та ЛПНЩ. Пацієнти з МДГГ мають більшу ОТ, зниження рівнів ЛПВЩ, високі рівні тригліцеридів. Однак ризик розвитку ЦД і серцево–судинних ускладнень однаковий при ізольованому дефіциті ГР та МДГГ [4]. На сьогодні встановлено, що жирова тканина — одне з головних місць дії ГР. Саме цей гормон стимулює ліполіз та зменшує жирову масу, пригнічує ріст адипоцитів; визначені 246 генів, які регулюють обмін ліпідів у жировій тканині з боку ГР [43].
Низький рівень тестостерону у чоловіків із МДГГ асоціюється з великим показником ОТ та центральним ожирінням. Дорослі з ДГР інсулінорезистентні та мають знижені запаси глікогену, зниження інсуліностимульованої утилізації глюкози, зниження синтезу глікогену в м’язах. Не знайдено збільшення частоти ЦД у пацієнтів із ДГР (8,2 %) порівняно із загальною популяцією (США — 11,3 %; Європа — 5,7 %), захворюваність становила 9,7/1000/рік (США — 14,1; Європа — 7,0), але виявлено значне збільшення частоти ожиріння [8].
Ми мали змогу дослідити стан ліпідного обміну у 12 пацієнтів (8 чоловіків/4 жінки) віком 23–34 роки з ДГР, що був діагностований у дитинстві (у 10 хворих встановлено наявність МДГГ). Основними скаргами хворих були низькорослість (100 %), зайва маса тіла (76 %), недостатній статевий розвиток (23 %), порушення статевої функції (48 %), швидка втомлюваність і загальна слабкість (96 %), частий головний біль (73 %), біль у ділянці серця (75 %). Жоден хворий/хвора не мали власних дітей.
Крім значного відставання в рості (ступінь нанізму, 12 осіб) та статевому розвитку (у 10 пацієнтів) встановлено різке зниження викиду ГР (0,05–0,06 нг/мл) при проведенні функціональних проб (з інсуліном або клонідином). Рівні ІФР–1 перебували в межах від 25,0 до 90, 4 мкг/л; SDS ІФР–1 становив від –8,46 до –4,13 (при референтних значеннях ±2 SDS). Рівні ІФР–ЗБ–3 у крові хворих також були значно зниженими і перебували в межах від 1,120 до 2,93 мг/л. SDS ІФР–ЗБ–3 становив від –7,56 до –2,85, що підтверджувало наявність значного дефіциту ГР.
Тільки у двох пацієнтів рівень тригліцеридів знаходився в межах норми (< 2,26 ммоль/л), у решти хворих цей показник був підвищеним. Загальний холестерин крові в 11 хворих був підвищеним (≥ 5,29 ммоль/л, при референтному значенні < 5,18 ммоль/л). У всіх хворих зафіксовано підвищення рівня ЛПНЩ (при референтних значеннях < 2,59 ммоль/л, цей показник був не нижчим за 3,67 ммоль/л), а рівень ЛПВЩ не перевищував 1,15 г/л (референтні значення > 1,45 г/л).
Також відбувалось незначне підвищення рівня АроВ при нормальних показниках АроА1 та підвищення рівня С–реактивного білка (≥ 8,76 мг/л, референтні значення < 5,0 мг/л). Високий рівень ЛПНЩ і знижений рівень ЛПВЩ, підвищений рівень загального холестерину, порушення співвідношення –ApoA–1/ApoB, високий рівень С–реактивного білка визнані як фактори ризику ССЗ.
Рівень імунореактивного інсуліну (ІРІ) в плазмі крові у 50 % хворих знаходився на нижній межі норми, а у 50 % — значно перевищував нормативні показники (від 189,6 до 218,2 пмоль/л, референтні значення — від 20,0 до 144,0 пмоль/л). Встановлено позитивну кореляцію між значенням HOMA–IR та рівнем ІФР–1 у плазмі крові. Показники глікованого гемоглобіну перебували у межах норми (від 4,8 до 5,9 %) у всіх хворих.
Встановлене нами вірогідне підвищення рівнів тригліцеридів, загального холестерину та ЛПНЩ сироватки крові у всіх молодих дорослих з дит–ДГР свідчить про наявність високого ризику розвитку атеросклерозу та серцево–судинної патології за наявності тривалого дефіциту ГР.
Таким чином, у результаті проведеного дослідження можна зробити висновок, що у більшості хворих постпубертатного віку з ДГР, які не отримували лікування препаратами рГР, на тлі різкого зниження стимульованого рівня ГР, рівнів ІФР–1 та ІФР–ЗБ–3 встановлені суттєві зміни з боку показників ліпідного та вуглеводного обмінів. Такі зміни можна розглядати як наслідок тривалого тяжкого дефіциту ГР. Наявність значних метаболічних порушень у хворих на дит–ДГР обумовлюють необхідність пролонгації терапії рГР в постпубертатному періоді та молодому дорослому віці та проведення систематичного моніторингу показників ліпідного обміну та стану серцево–судинної системи з метою запобігання прогресу атеросклерозу та ранньої кардіальної патології [18, 44].
Припинення лікування рГР у підлітків з дит–ДГР асоціюється зі значним збільшенням жирової маси та зниженням метаболічного рівня у молодих дорослих. Замісна терапія призводить до однакового зниження підшкірного та вісцерального жиру. У 50 % хворих із дит–ДГР підвищується рівень інсуліну в крові (на 10–15 %), велика кількість пацієнтів із ДГР мають порушення толерантності до глюкози. Замісна терапія рГР призводить до незначного зниження чутливості до інсуліну або не змінює її. Також слід пам’ятати, що, за даними деяких дослідників, замісна терапія рГР у пацієнтів із ДГР може негативно впливати на толерантність глюкози та призводити до підвищення рівня інсуліну в крові. У зв’язку з цим у молодих дорослих із дит–ДГР деякі дослідники рекомендують призначати низькі дози рГР (середня — 0,14 ОД/кг/тиж–день), що не викликають суттєвого порушення толерантності до глюкози [45]. Це є важливим моментом при довготривалому спостереженні за молодими хворими з дит–ДГР, які отримують лікування рГР. K.C. Yuen, D.B. Dunger (2007) встановили, що низькі дози рГР (0,1 мг/добу) підвищують чутливість до інсуліну без впливу на будову тіла у молодих дорослих та в осібі з метаболічним синдромом, що можна пояснити здатністю рГР підвищувати рівень вільного «біодоступного» ІФР–1 без посилення ліполізу [46]. Результати цих досліджень вказують на доцільність використання низьких доз рГР для запобігання зниженню функції b–клітин та подальшого розвитку ЦД 2–го типу у пацієнтів із групи високого ризику [47]. Встановлено, що навіть низькі дози рГР призводять до зниження рівня загального холестерину та ЛПНЩ у дорослих пацієнтів із ДГР [48].
Порушення з боку внутрішніх органів та обміну речовин, що спостерігаються у пацієнтів із дит–ДГР, в багатьох випадках можна корегувати призначенням (або відновленням) лікування рГР. Особливо важливим це питання є для пацієнтів з дит–ДГР у перехідний період до дорослого віку. Раннє відновлення терапії рГР у хворих на дит–ДГР повинно розглядатися навіть після досягнення фінального зросту. Якщо терапія не відновлюється у молодих дорослих із дит–ДГР, можливе виникнення множинних метаболічних порушень. На момент припинення терапії рГР діти із дит–ДГР не в змозі досягнути піку маси кісткової тканини, оскільки його досягнення завершується протягом перехідної фази до дорослого віку [37]. Тому лікування рГР необхідно продовжувати до досягнення піку маси кісткової тканини незалежно від досягнення фінального зросту. Доза рГР для замісної терапії у перехідній фазі залишається вищою, ніж в дорослому віці; після пубертації рекомендують поступове зменшення дози препарату (приблизно до 25–річного віку) з метою отримати оптимальний пік маси кісткової тканини. Сучасна клінічна практика пропонує індивідуальний вибір доз рГР від низьких (1–4 мг/тиждень) із подальшим титруванням відповідно до рівня ІФР–1 у крові до досягнення оптимальної дози [49].
Перед відновленням терапії рГР у молодих дорослих із дит–ДГР необхідно підтвердити або виключити наявність дефіциту ГР. Ретестування включає в себе визначення рівня ІФР–1 у крові та проведення стимуляційного тесту з інсуліном, аргініном, аргініном + ГР–РГ. Тест з інсуліновою гіпоглікемією є золотим стандартом для визначення піку ГР [50]. Рішення про проведення ГР–тестування базується на клінічній картині захворювання, даних анамнезу хвороби та результатах біохімічних аналізів. Також обов’язково враховуються результати попередніх стимуляційних тестів (проведених в дитинстві), дані МРТ та рівень ІФР–1. Підтвердження діагнозу ДГР шляхом тестів необхідне, якщо не було встановлено генетичних або структурних уражень гіпоталамо–гіпофізарної ділянки в дитинстві. У молодих дорослих із дит–ДГР точним діагностичним критерієм ДГР вважають значення піку ГР нижче від 5,62 мкг/л; обов’язково визначають рівень ІФР–1, що підтверджує тяжкість дефіциту ГР. Хворі з ізольованим ідіопатичним дефіцитом ГР повинні пройти два тести, з МДГГ — один стимуляційний тест. Пацієнти з вродженими аномаліями гіпофіза (гіпоплазією гіпофіза, агенезією ніжки гіпофіза або з ектопією задньої частки гіпофіза) не потребують подальшого вивчення секреції ГР [11, 49].
Найкращим підтвердженням (100 %) наявності дефіциту ГР у перехідному періоді є органічна природа захворювання та наявність додатково дефіциту двох або більше гіпофізарних гормонів — таким хворим лікування рГР продовжують без проведення ретестування [50].
Крім того, що ДГР, який виник у дитячому віці, призводить до підвищення захворюваності та смертності в дорослому віці, він має значний вплив на соціальний і психологічний статус хворого, пацієнти мають проблеми сексуального характеру та проблеми в створенні сім’ї. Так, згідно з даними Голландського реєстру, порівняно із загальною популяцією пацієнти з дит–ДГР у дорослому віці мали нижчий освітній рівень, нижчий матеріальний дохід, високий рівень звільнення з роботи; незалежно від соціального та освітнього статусу пацієнти мали підвищений ризик ранньої смерті [51, 52]. Існування ДГР протягом підліткового періоду негативно впливає на здатність до навчання, пам’ять та увагу, які погіршуються в середньому віці, якщо не проводилась замісна терапія рГР [53]. На тлі терапії рГР відбувається суттєве покращення пам’яті, сну, настрою, уваги, енергійності, емоційних реакцій, знижуються збудженість і напруженість, рівень соціальної ізоляції. Позитивні ефекти терапії зберігаються тривалий час. Терапія рГР повинна продовжуватись довготривало для покращення психологічного стану [54]. Вважають, що позитивні ефекти лікування пов’язані з прямою дією ГР на нервову систему та з підвищенням рівнів ГР та ІФР–1 [55]. Система ГР/ІФР–1 може відігравати важливу роль в розвитку когнітивних функцій, оскільки рецептори ГР та ІФР–1 локалізовані в ділянці гіпокампуса — ділянці мозку, що має важливе значення в становленні когнітивних функцій, особливо пам’яті та навчання [56]. Доведений суттєвий позитивний вплив замісної терапії рГР на якість життя пацієнтів із ДГР [57]. Підвищення рівня ІФР–1 у пацієнтів із ДГР на тлі лікування рГР чітко асоціюється з підвищенням їх настрою (підвищення енергійності, зниження агресивності та тривожності).
Таким чином, досягнення фінального зросту у хворих на дефіцит гормона росту не можна вважати завершенням лікування. У період переходу від юнацтва та ранньої дорослості дефіцит ГР має суттєвий вплив на серцево–судинну та кісткову системи, ліпідний, вуглеводний і білковий обмін, психологічний стан хворого. При підтвердженні наявності дефіциту гормона росту в перехідний період (визначення стимульованої секреції ГР, визначення рівня ІФР–1) терапія рГР повинна бути відновлена, у першу чергу з метою зниження ризиків розвитку серцево–судинної патології, корекції ліпідного обміну, стану жирової та кісткової тканини. Пацієнти, які припинили лікування в дитячому віці та не почали лікуватися як дорослі, повинні перебувати під ретельним довготривалим спостереженням ендокринолога для визначення вірогідних побічних явищ (наприклад, зниження мінеральної щільності кісток, дисліпідемії, порушення ІР), що типово асоціюються з припиненням терапії рГР. Відновлення/призначення адекватної терапії рГР молодим дорослим із підтвердженим ДГР призводить до суттєвого підвищення якості життя пацієнтів та зниження ранньої серцево–судинної захворюваності та смертності. Велике значення в удосконаленні спостереження за пацієнтами з дит–ДГР має тісна співпраця дитячого ендокринолога, дорослого ендокринолога, сімейного лікаря, кардіолога.
1. Giustina A.I., Veldhuis J.D. Pathophysiology of the neuroregulation of growth hormone secretion in experimental animals and the human // Endocr. Rev. — 1998. — Vol. 19, № 6. — P. 717–97.
2. Melmed S. Idiopathic adult growth hormone deficiency // J. Clin. Endocrinol. Metab. — 2013. — Vol. 98, № 6. — P. 2187–97.
3. Acharya S.V., Gopal R.A., Lila A. et al. Phenotype and radiological correlation in patients with growth hormone deficiency // Indian J. Pediatr. — 2011. — Vol. 78, № 1. — P. 49–54.
4. Fernandez–Rodriguez E.I., Quinteiro C., Barreiro J. et al. Pituitary stalk dysgenesis–induced hypopituitarism in adult patients: prevalence, evolution of hormone dysfunction and genetic analysis // Neuroendocrinology. — 2011. — Vol. 93, № 3. — P. 181–188.
5. Hоybye C., Hilding A., Jacobsson H. et al. Metabolic profile and body composition in adults with Prader–Willi syndrome and severe obesity // J. Clin. Endocrinol. Metab. — 2002. — Vol. 87, № 8. — P. 35–90.
6. Shimatsu A. Diagnosis and testing of hypothalamo–hypophysial (pituitary) tumor: general considerations // Nihon. Rinsho. — 2011. — Vol. 69, № 2. — P. 146–149.
7. Van Bunderen C., van Nieuwpoort I.C., Arwert L.I. et al. Adults with GH deficiency (GHD) have a decreased life expectancy. The effect of GH treatment on mortality remains to be established. Does growth hormone replacement therapy reduce mortality in adults with growth hormone deficiency? Data from the Dutch National Registry of Growth Hormone Treatment in adults // J. Clin. Endocrinol. Metab. — 2011. — Vol. 96, № 10. — P. 3151–3159.
8. Shimatsu A., Tai S., Tanaka T. et al. Clinical characteristics of Japanese adults with growth hormone deficiency: a HypoCCS database study // Endocr. J. — 2011. — Vol. 58, № 5. — P. 325–333.
9. Courtillot C., Baudoin R., Du Souich T. et al. Monocentric study of 112 consecutive patients with childhood onset GH deficiency around and after transition // Eur. J. Endocrinol. — 2013. — Vol. 169, № 5. — P. 587–596.
10. Smyczynska J., Hilczer M., Stawerska R. et al. A. Significant increase of IGF–I concentration and of IGF–I/IGFBP–3 molar ratio in generation test predicts the good response to growth hormone (GH) therapy in children with short stature and normal results of GH stimulating tests // Neuro Endocrinol. Lett. — 2013. — Vol. 34, № 3. — P. 222–228.
11. Geffner M.E. Growth hormone replacement therapy: transition from adolescence to adulthood // J. Clin. Res. Pediatr. Endocrinol. — 2009. — Vol. 1, № 5. — P. 205–208.
12. Maghnie M., Ambrosini L., Cappa M. et al. Adult height in patients with permanent growth hormone deficiency with and without multiple pituitary hormone deficiencies // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91, № 8. — P. 2900–2905.
13. Saenger P. A lifetime of growth hormone deficiency: a US pediatric perspective // J. Pediatr. Endocrinol. Metab. — 2000. — Vol. 13, № 6. — P. 1337–1342.
14. Leong G.M., Johannsson G. Growth hormone deficiency: strategies and indications to continue growth hormone therapy in transition from adolescence to adult life // Horm. Res. — 2003. — Vol. 60, № 1. — P. 78–85.
15. Verhelst J., Abs R. Cardiovascular risk factors in hypopituitary GH–deficient adults // Eur. J. Endocrinol. — 2009. — Vol. 161, № 1. — P. 41–49.
16. Chaves V.E., Junior F.M., Bertolini G.L. The metabolic effects of growth hormone in adipose tissue // Endocrine. — 2013. — Vol. 44, № 2. — P. 293–302.
17. Minczykowski A., Gryczynska M., Ziemnicka K. et al. The influence of growth hormone (GH) therapy on cardiac performance in patients with childhood onset GH deficiency // Growth Horm IGF Res. — 2005. — Vol. 15, № 2. — P. 156–164.
18. Oliveira C.R., Pereira R.M., Barreto–Filho J.A. et al. Long time consequences of the growth hormone deficiency // Arq. Bras. Endocrinol. Metabol. — 2008. — Vol. 52, № 5. — P. 745–749.
19. Lombardi G., Di Somma C., Grasso L.F. et al. The cardiovascular system in growth hormone excess and growth hormone deficiency // J. Endocrinol. Invest. — 2012. — Vol. 35, № 11. — P. 1021–1029.
20. Toumba M., Neocleous V., Shammas C. et al. Effects of growth hormone on heart structure and function in adolescence // Georgian Med. News. — 2012. — Vol. 2, № 10. — P. 34–39.
21. Saccа L., Cittadini A., Fazio S. Growth hormone and the heart // Endocr. Rev. — 1994. — Vol. 15, № 5. — P. 555–573.
22. Toogood A.A., Shalet S.M. Diagnosis of severe growth hormone (GH) deficiency in young adults who received GH replacement therapy during childhood // Acta Paediatr. Suppl. — 1997. — Vol. 423. — P. 117–120.
23. Andreassen M. The growth hormone system and cardiac function in patients with growth hormone disturbances and in the normal population // Dan. Med. Bull. — 2010. — Vol. 57, № 10. — P. 41–62.
24. Leong G.M., Johannsson G. Growth hormone deficiency: strategies and indications to continue growth hormone therapy in transition from adolescence to adult life // Horm. Res. — 2003. — Vol. 60, № 1. — P. 78–85.
25. Colao A. The GH–IGF–I axis and the cardiovascular system: clinical implications // Clin. Endocrinol. (Oxf.). — 2008. — Vol. 69, № 3. — P. 347–358.
26. Murray R.D., Randeva H.S., Lewandowski K.C. et al. Serum vascular endothelial growth factor (VEGF) is elevated in GH deficient adults // Growth Horm. IGF Res. — 2011. — Vol. 21, № 2. — P. 96–101.
27. Longobardi S., Cuocolo A., Merola B. et al. Left ventricular function in young adults with childhood and adulthood onset growth hormone deficiency // Clin. Endocrinol. (Oxf.). — 1998. — Vol. 48, № 2. — P. 137–143.
28. Jallad R.S., Liberman B., Vianna C.B. et al. Effects of growth hormone replacement therapy on metabolic and cardiac parameters, in adult patients with childhood–onset growth hormone deficiency // Growth Horm. IGF Res. — 2003. — Vol. 13, № 2–3. — P. 81–88.
29. Araujo V.P., Aguiar–Oliveira M.H., Oliveira J.L. et al. Arrest of atherosclerosis progression after interruption of GH replacement in adults with congenital isolated GH deficiency // Eur. J. Endocrinol. — 2012. — Vol. 166, № 6. — P. 977–982.
30. Dlesk A., Kamensky G., Lazurovа I. et al. The effect of growth hormone replacement therapy on the morphological and functional changes in the left ventricle in patients with adult–onset growth hormone deficiency // Wien Klin. Wochenschr. — 2014. — Vol. 126, № 15–16. — P. 480–484.
31. Groban L., Lin M., Kassik K.A. et al. Early–onset growth hormone deficiency results in diastolic dysfunction in adult–life and is prevented by growth hormone supplementation // Growth Horm. IGF Res. — 2011. — Vol. 21, № 2. — P. 81–88.
32. Iacobellis G. Epicardial adipose tissue in endocrine and metabolic diseases // Endocrine. — 2014. — Vol. 46, № 1. — P. 8–15.
33. Sirdah M.M., Abu Ghali A.S., Al Laham N.A. The reliability of the National Cholesterol Education Program's Adult Treatment Panel III (NCEP/ATP III) and the International Diabetes Federation (IDF) definitions in diagnosing metabolic syndrome (MetS) among Gaza Strip Palestinians.Diabetes // Metab. Syndr. — 2012. — Vol. 6, № 1. — P. 4–8.
34. Vishram J.K. Prognostic interactions between cardiovascular risk factors. Prognostic interactions between cardiovascular risk factors // Dan. Med. J. — 2014. — Vol. 61, № 7. — P. 4892.
35. Verhelst J., Mattsson A.F., Luger A. et al. Prevalence and characteristics of the metabolic syndrome in 2479 hypopituitary patients with adult–onset GH deficiency before GH replacement: a KIMS analysis // Eur. J. Endocrinol. — 2011. — Vol. 165, № 6. — P. 881–889.
36. Attanasio A.F., Mo D., Erfurth E.M. et al. International Hypopituitary Control Complications Study Advisory Board. Prevalence of metabolic syndrome in adult hypopituitary growth hormone (GH)–deficient patients before and after GH replacement // J. Clin. Endocrinol. Metab. — 2010. — Vol. 95, № 1. — P. 74–81.
37. Oliveira C.R., Meneguz–Moreno R.A., Aguiar–Oliveira M.H. et al. Emerging role of the GH/IGF–I on cardiometabolic control // Arq. Bras. Cardiol. — 2011. — Vol. 97, № 5. — P. 434–439.
38. Fukuda I., Hizuka N., Yasumoto K. et al. Metabolic co–morbidities revealed in patients with childhood–onset adult GH deficiency after cessation of GH replacement therapy for short stature // Endocr. J. — 2008. — Vol. 55, № 6. — P. 977–984.
39. Pelin A.M., Mătăsaru S. Metabolic syndrome in obese children and adolescents // Rev. Med. Chir. Soc. Med. Nat. Iasi. — 2012. — Vol. 116, № 4. — P. 957–961.
40. Hong J.W., Park J.K., Lim C.Y. et al. A weekly administered sustained–release growth hormone reduces visceral fat and waist circumference in abdominal obesity // Horm. Metab. Res. — 2011. — Vol. 43, № 13. — P. 956–961.
41. Rapaport R., Cook D.M. Transition of childhood–onset growth hormone–deficient patients to adult healthcare // Pediatr. Endocrinol. Rev. — 2006. — Vol. 4, № 1. — P. 82–90.
42. Yuen K.C., Koltowska–Hаggstrоm M., Cook D.M. et al. Clinical characteristics and effects of GH replacement therapy in adults with childhood–onset craniopharyngioma compared with those in adults with other causes of childhood–onset hypothalamic–pituitary dysfunction // Pfizer International Metabolic Database Eur. J. Endocrinol. — 2013. — Vol. 169, № 4. — P. 511–519.
43. Zhao J.T., Cowley M.J., Lee P. et al. Identification of Novel GH–Regulated Pathway of Lipid Metabolism in Adipose Tissue: A Gene Expression Study in Hypopituitary Men // J. Clin. Endocrinol. Metab. — 2011. — Vol. 96, № 7. — P. 1186–1196.
44. Evans M., Roberts A., Davies S. et al. Medical lipid–regulating therapy: current evidence, ongoing trials and future developments // Drugs. — 2004. — Vol. 64, № 11. — P. 1181–1196.
45. Bulow B., Erfurth E.M. A low individualized GH dose in young patients with childhood onset GH deficiency normalized serum IGF–I without significant deterioration in glucose tolerance // Clin. Endocrinol. (Oxf.). — 1999. — Vol. 50, № 1. — P. 45–55.
46. Yuen K.C., Dunger D.B. Therapeutic aspects of growth hormone and insulin–like growth factor–I treatment on visceral fat and insulin sensitivity in adults // Diabetes Obes. Metab. — 2007. — Vol. 9, № 1. — P. 11–22.
47. Cordoba–Chacon J., Gahete M.D., Pokala N.K. et al. Long– but not short–term adult–onset, isolated GH deficiency in male mice leads to deterioration of β–cell function, which cannot be accounted for by changes in β–cell mass // Endocrinology. — 2014. — Vol. 155, № 3. — P. 726–735.
48. Newman C.B., Carmichael J.D., Kleinberg D.L. Effects of low dose versus high dose human growth hormone on body composition and lipids in adults with GH deficiency: a meta–analysis of placebo–controlled randomized trials // Pituitary. — 2014. — Vol. 9.
49. Molitch M.E., Clemmons D.R., Malozowski S. et al. Endocrine Society’s Clinical Guidelines Subcommittee Evaluation and treatment of adult growth hormone deficiency: an Endocrine Society Clinical Practice Guideline // J. Clin. Endocrinol. Metab. — 2006. — Vol. 91. — P. 1621–1634.
50. Secco A., di Iorgi N., Napoli F. et al. Reassessment of the growth hormone status in young adults with childhood–onset growth hormone deficiency: reappraisal of insulin tolerance testing // J. Clin. Endocrinol. Metab. — 2009. — Vol. 94, № 11. — P. 4195–4204.
51. Erfurth E.M. Update in mortality in GH–treated patients // J. Clin. Endocrinol. Metab. — 2013. — Vol. 98, № 11. — P. 4219–4226.
52. Stochholm K., Juul S., Christiansen J.S. et al. Mortality and socioeconomic status in adults with childhood onset GH deficiency (GHD) is highly dependent on the primary cause of GHD // Eur. J. Endocrinol. — 2012. — Vol. 167, № 5. — P. 663–670.
53. Nieves–Martinez E., Sonntag W.E., Wilson A. et al. Early–onset GH deficiency results in spatial memory impairment in mid–life and is prevented by GH supplementation // J. Endocrinol. — 2010. — Vol. 204, № 1. — P. 31–36.
54. Cabo D., Lecube A., Barrios M. et al. Long term treatment with growth hormone deficiency in adults // Med. Clin. (Barc.). — 2011. — Vol. 136, № 15. — P. 659–664.
55. Wass J.A., Reddy R. Growth hormone and memory // J. Endocrinol. — 2010. — Vol. 207, № 2. — P. 125–126.
56. Van Nieuwpoort I.C., Drent M.L. Cognition in the adult with childhood–onset GH deficiency // Eur. J. Endocrinol. — 2008. — Vol. 159, № 1. — P. 53–57.
57. Spielhagen C., Schwahn C., Muller K. et al. The benefit of long–term growth hormone (GH) replacement therapy in hypopituitary adults with GH deficiency: results of the German KIMS database // Growth Horm. IGF Res. — 2011. — Vol. 21, № 1. — P. 1–10.

/96/96.jpg)