Статья опубликована на с. 24-30
Вступ
Скелетна м’язова тканина є ключовим компонентом будови тіла людини, що високо корелює з фізичною активністю та загальним станом здоров’я.
Вперше зміни м’язової тканини з віком були описані Гіппократом, проте тільки в 1989 р. Irwin Rozenberg для описання втрати маси скелетних м’язів з віком запропонував використовувати термін «саркопенія» (гр. термін sarx — «тіло, плоть» + penia — «зниження»).
Під егідою Європейського товариства геріатричної медицини (European Union Geriatric Medicine Society (EUGMS)) у 2009 р. створена робоча група з вивчення саркопенії у людей похилого віку (European Working Group on Sarcopenia in Older People, EWGSOP) та опубліковано консенсус з діагностики саркопенії. Згідно з опублікованим консенсусом, саркопенія — це синдром, що характеризується прогресивним і генералізованим зниженням скелетної м’язової маси та її сили з ризиком розвитку таких ускладнень, як порушення рухливості, зниження якості життя, і смерті [5].
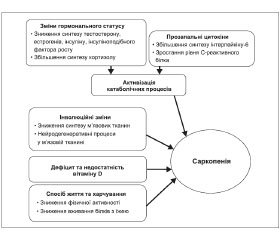
Існує багато причин, що призводять до втрати м’язової маси. Найчастіше саркопенія спостерігається у людей похилого віку. Виділяють первинну і вторинну форму саркопенії. Первинна форма розвивається з віком за відсутності впливу різних вторинних факторів на скелетну м’язову тканину. Вторинна форма саркопенії є наслідком одного або декількох станів/факторів, що впливають на стан м’язової тканини (саркопенія, асоційована зі зниженою фізичною активністю, харчуванням, супутньою патологією та ін.). У більшості осіб похилого віку природа саркопенії мультифакторіальна (рис. 1).
Протягом останніх років надзвичайна увага науковців світу приділяється вивченню саме патогенетичних механізмів розвитку саркопенії, серед яких вагому частку становлять вік-асоційовані зміни гормонального статусу, а саме рівня андрогенів, естрогенів та соматотропного гормона (СТГ).
Андрогени та стан скелетної м’язової мускулатури
У чоловіків рівень тестостерону знижується на 1 % щороку, біодоступний тестостерон — на 2 % після 30 років [6]. У жінок рівень тестостерону швидко знижується з 20 до 45 років [10]. За даними літератури, рівень тестостерону у жінок знижується у четвертій декаді життя та перед настанням менопаузи досягає 50 % від рівня, який спостерігався у третій декаді життя. Після настання менопаузи середній рівень тестостерону досягає 15 % від рівня в пременопаузальних жінок. Хоча жінки мають рівень циркулюючого андрогену у 20–25 разів менший порівняно з чоловіками, андрогени є прекурсором продукції та синтезу естрогенів і відіграють ключову роль у процесах дозрівання фолікулів яєчників. Дефіцит андрогенів у жінок асоційований з порушенням сексуальних функцій, знежиреної маси та її функції, когнітивних функцій, емоціональної сфери, мінеральної щільності кісткової тканини та старезності [6]. Біологічна роль тестостерону у жінок не є достеменно вивченою. Доведено, що відхилення вмісту андрогенів із віком у жінок відіграє ключову роль у підтриманні функціональних можливостей при старінні та зростанні летальності. Згідно з роботами Smith G.I. та співавт., саме тестостерон та прогестерон, а не естрадіол стимулюють синтез білка у постменопаузальному періоді [11], що модулюється декількома факторами: спадковістю, харчуванням та фізичною активністю [10]. Тестостерон знижує рівень прозапальних цитокінів (туморнекротизуючий фактор α, інтерлейкін-6, інтерлейкін-1β) та стимулює протизапальний цитокін-10. Однак у жінок у пременопаузі та в похилому віці високий рівень тестостерону та естрадіолу і низький рівень секс-зв’язаного глобуліну асоційований з резистентністю до інсуліну та діабетом, станами, що характеризуються низьким рівнем запалення. Тому вікові зміни статевих гормонів по-своєму впливають на розвиток прозапального стану, а також розвиток таких станів, як атеросклероз, серцево-судинні захворювання, метаболічний синдром і цукровий діабет 2-го типу. Хоча роль статевих гормонів при старінні та «вікових» захворюваннях досі не з’ясована, чіткими є їх асоціації з віком, що, ймовірно, знижують здорове старіння та негативно впливають на тривалість життя [6].
Дослідник A. Yuki та співавт. встановили, що рівень вільного тестостерону є предиктором ризику втрати скелетної м’язової тканини у жінок Японії. Зв’язку між низьким рівнем загального тестостерону та саркопенією не було встановлено [14]. У подальших роботах автори встановили вірогідний зв’язок між рівнем вільного тестостерону та показником апендикулярної знежиреної маси [13].
У лонгітудинальному дослідженні I-Lan автори довели, що індекс вільного тестостерону має вірогідний позитивний зв’язок з масою та силою скелетних м’язів у чоловіків та жінок Тайваню. Рівні вільного та біодоступного тестостерону мали подібну кореляцію з масою скелетної м’язової тканини у жінок (в обох випадках — р < 0,001) та силою м’язів у чоловіків (р = 0,007 і р = 0,002 відповідно). Рівень дегідроепіандростерону позитивно корелював із масою скелетної м’язової тканини у чоловіків (р = 0,013) і жінок віком 65 років і старше (р = 0,004), силою стискання в обох статей (у чоловіків — р < 0,001, у жінок — р = –0,009). Не було виявлено зв’язку між рівнем вільного й біодоступного тестостерону та швидкістю ходьби. Рівень дегідроепіандростерону позитивно корелював зі швидкістю ходьби в пацієнтів обох статей (в обох випадках — р = 0,001) [7].
Протягом останніх років проведено декілька досліджень ефективності терапії тестостероном у людей похилого віку. В 1999 р. P.J. Snyder та співавт. показали, що введення тестостерону чоловікам молодого та похилого віку призводить до збільшення маси скелетних м’язів. Проте при введенні тестостерону чоловікам похилого віку не спостерігалось зростання сили скелетних м’язів на відміну від ефективності у молодих чоловіків. Доведено, що введення тестостерону пригнічує розвиток саркопенічного синдрому, в тому числі втрату маси та сили скелетних м’язів. У недавньому рандомізованому плацебо-контрольованому дослідженні при введенні тестостерону в супрафізіологічних дозах протягом 6 місяців спостерігалось збільшення маси скелетних м’язів на рівні нижніх кінцівок, сили скелетних м’язів на рівні верхніх та нижніх кінцівок. Проте, хоча при призначенні високих доз тестостерону чоловікам похилого віку спостерігалось зростання сили скелетних м’язів, необхідно пам’ятати, що потенційні ризики зазначеної терапії переважають сьогодні користь їх використання. Встановлені такі ризики при введенні тестостерону чоловікам похилого віку: апное під час сну, тромботичні ускладнення та зростання ризику розвитку раку простати. Маючи на увазі зазначені ризики, сьогодні вчені вивчають ефективність селективних модуляторів андрогенних рецепторів, що мають високу селективність та кращі фармакокінетичні властивості, однак необхідні подальші дослідження щодо вивчення їх ефективності.
Препарати, що містять дегідроепіандростерон, у Сполучених Штатах Америки зареєстровано як харчові добавки та широко доступні в країні. На відміну від тестостерону та естрадіолу дегідроепіандростерон є попередником гормонів, що конвертується у статеві гормони в специфічних цільових тканинах: 95 % секретується корою наднирникових залоз під впливом адренокортикотропного гормона та пролактину. При введенні дегідроепіандростерону чоловікам та жінкам похилого віку спостерігалось зростання мінеральної щільності кісткової тканини, рівнів тестостерону та естрадіолу, проте змін з боку маси, сили та функціональних можливостей скелетних м’язів не виявлено [10]. A. Abbasi та співавт. не виявили зв’язку між рівнем дегідроепіандростерону та будовою тіла [8]. У невеликому подвійному сліпому рандомізованому плацебо-контрольованому та перехресному дослідженні J.J. Christiansen та співавт. вивчали ефективність дегідроепіандростерону (50 мг протягом 6 місяців) у жінок (n = 10, середній вік — 38,5 року) з недостатністю андрогенів. У результаті не було виявлено вірогідного впливу терапії на показники м’язової, жирової та кісткової тканин, окрім показників знежиреної маси всього тіла, які вірогідно збільшились в результаті терапії (р = 0,02) [4]. В іншому дослідженні при введенні дегідроепіандростерону в дозі 50–100 мг на день протягом 3–9 місяців також не спостерігалось вірогідного збільшення маси скелетних м’язів [8].
Естрогени та стан скелетної м’язової мускулатури
Рівень естрогенів протягом першого року постменопаузи знижується в середньому на 80 %.
Доведено, що високий рівень ендогенного естрогену асоційований з високою силою скелетних м’язів та низькою частотою переломів нижніх кінцівок після стандартизації за мінеральною щільністю кісткової тканини у 75-річних жінок [6].
Естрогени стимулюють відновлення м’язів та регенеративні процеси, хоча дані механізми досконало не вивчені. Припускають, що у цьому випадку естрогени є антиоксидантами, лімітуючи оксидативне пошкодження, а також завдяки їх мембраностабілізуючій дії [6]. Крім того, естрогени відіграють ключову роль у підтриманні маси та міцності кісткової тканини, стимулюючи формування її остеобластами та пригнічуючи резорбцію остеокластами [6].
T. van Geel та співавт. виявили позитивний зв’язок між знежиреною масою всього тіла та рівнем естрогенів. M. Ianuzzi-Sucich та співавт. встановили зв’язок між масою скелетних м’язів та рівнем естрону та естрадіолу у жінок. Проте у подальших роботах R. Baumgartner та співавт. не підтвердили зв’язку між рівнем естрогенів та масою скелетних м’язів у жінок віком понад 65 років [10]. Сьогодні механізм впливу естрогенів на м’язову тканину достеменно не вивчено, проте більшість авторів пояснюють його зростанням рівня прозапальних цитокінів (інтерлейкіну-6 та туморнекротизуючого фактора α). Беручи до уваги те, що на мембранах клітин скелетних м’язів знаходяться естроген-β-рецептори, естрогени можуть прямо впливати на масу скелетних м’язів. Тобто може відбуватися прямий потенційний механістичний зв’язок між низьким рівнем естрогенів та зниженням синтезу білка. Необхідні подальші дослідження для підтвердження цієї гіпотези [10].
У наш час існують суперечливі дані щодо використання замісної гормональної терапії з метою профілактики втрати маси скелетних м’язів із віком. У дослідженні Women Health Initiative в жінок, які приймали захисну замісну терапію, спостерігалась вірогідно менша втрата знежиреної маси порівняно з плацебо-групою при спостереженні протягом 3–6 років [2]. Дані недавно опублікованого метааналізу показали, що замісна терапія естрогенами справляє вірогідний позитивний вплив на силу скелетних м’язів у жінок постменопаузального періоду. Жінки, які приймали замісну гормональну терапію, мали на 5 % вищі показники сили скелетних м’язів порівняно з контрольною групою. Маючи на увазі те, що жінки втрачають близько 1 % сили скелетних м’язів щороку після настання менопаузи, автори метааналізу вважають, що замісна гормональна терапія справляє відносно малий клінічно значимий ефект [3].
Соматотропний гормон та стан скелетної м’язової мускулатури
Після 30 років рівень соматотропного гормона прогресивно знижується зі швидкістю ~ 1 % на рік. У чоловіків похилого віку секреція СТГ у 5–20 разів менша порівняно з молодими особами. Вікозалежне зниження секреції СТГ є вторинним у відповідь на зниження соматотропін-рилізинг-гормона та збільшення соматостатину [9, 12]. Встановлено, що вікозалежне зниження рівня СТГ у комбінації з низьким рівнем ІРФ-1 впливає на розвиток саркопенії. З віком спостерігається зниження кількості ІРФ-1-рецепторів та афінності рецепторів до ІРФ-1 [10].
T. Briosche та співавт. довели, що введення СТГ старим мишам призводило до зростання знежиреної маси, при цьому спостерігалось зростання швидкості синтезу білка у скелетних м’язах та шляхів біогенезу мітохондрій. Більше того, виявлено вікасоційоване зниження рівня оксидативного стресу, підвищення рівня ІРФ-1 та індукцію антиоксидантних ензимів у скелетній м’язовій тканині тварин, які отримували СТГ. Необхідні подальші дослідження для підтвердження зазначених попередніх результатів [2].
Проте питання впливу СТГ-терапії на масу, силу та функціональні можливості скелетної м’язової тканини досі є дискутабельними. На моделі тварин СТГ-терапія показала високу ефективність щодо пригнічення розвитку саркопенічних симптомів: атрофії м’язів та зниження синтезу білка, особливо в комбінації з фізичним навантаженням. Вплив СТГ-терапії у людей похилого віку доволі суперечливий. В деяких дослідженнях було продемонстровано покращення сили скелетних м’язів при довготривалому введенні СТГ (3–11 місяців). У недавно опублікованому дослідженні виявлено позитивний вплив комбінованої терапії СТГ та тестостероном у профілактиці розвитку саркопенії. Сьогодні описані декілька причин, що пояснюють неефективність терапії СТГ у покращенні маси та сили скелетних м’язів: нездатність екзогенного СТГ імітувати пульсуючий характер секреції гормона в організмі або індукувати СТГ-відносну резистентність до інсуліну. Крім того, у людей похилого віку знижується рівень mРНК СТГ-рецепторів у скелетній м’язовій тканині порівняно з особами молодого віку, демонструючи вірогідний негативний зв’язок з рівнем міостатину. Необхідно звернути увагу на те, що у багатьох дослідженнях виявлено побічні ефекти СТГ-терапії: набряк м’яких тканин, карпальний тунельний синдром, артралгії, гінекомастію [10].
Отже, існує багато протиріч у визначенні ролі гормонального статусу у розвитку втрати скелетної м’язової мускулатури, через що необхідні подальші дослідження.
Метою дослідження, проведеного на базі ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», було вивчення зв’язку стану скелетної м’язової тканини з рівнем андрогенів та соматотропного гормона у жінок похилого та старечого віку.
Матеріали та методи
Обстежені 42 практично здорові жінки віком від 60 до 86 років (середній вік — 70,62 ± 6,97 року, середній зріст — 1,59 ± 0,07 м, середня маса тіла — 62,43 ± 9,43 кг, середній індекс маси тіла — 24,67 ± 3,22 кг/м2). За геронтологічною класифікацією обстежені жінки були розподілені на дві групи: похилого віку — 60–74 роки (n = 25, середній вік — 65,96 ± 4,18 року), старечого віку — 75–89 років (n = 17, середній вік — 77,47 ± 3,79 року).
При проведенні квартильного аналізу обстежені жінки були розподілені на групи залежно:
1. Від рівня СТГ:
— Q1 (n = 11): СТГ — 0,61–1,12 нг/мл;
— Q2 (n = 10): СТГ — 1,13–1,98 нг/мл;
— Q3 (n = 11): СТГ — 1,99–2,60 нг/мл;
— Q4 (n = 10): СТГ — 2,61–3,19 нг/мл.
2. Рівня загального тестостерону (ЗТ):
— Q1 (n = 11): ЗТ — 0,68–0,90 нмоль/л,
— Q2 (n = 11): ЗТ — 1,01–1,14 нмоль/л;
— Q3 (n = 10): ЗТ — 1,15–1,51 нмоль/л;
— Q4 (n = 10): ЗТ — 1,52–2,53 нмоль/л.
3. Рівня вільного тестостерону (ВТ):
— Q1 (n = 11): ВТ — 0,82–1,20 пг/мл;
— Q2 (n = 11): ВТ — 1,21–2,12 пг/мл;
— Q3 (n = 10): ВТ — 2,13–2,80 пг/мл;
— Q4 (n = 10): ВТ — 2,81–3,78 пг/мл.
Стан знежиреної маси всього тіла, верхніх та нижніх кінцівок оцінювали за допомогою двофотонної рентгенівської абсорбціометрії (Prodigy, GEHC Lunar, Madison, WI, США).
Силу скелетної мускулатури оцінювали за допомогою кистьового пружинного динамометра, який пацієнт стискає кистю витягнутої верхньої кінцівки. Сила стискання (кг) вказується стрілкою на спеціальній шкалі динамометра.
Для визначення функціональних можливостей скелетних м’язів оцінювали швидкість ходьби обстежених жінок за допомогою чотириметрового тесту.
Визначення рівнів загального, вільного тестостерону та соматотропного гормону в сироватці крові обстежених жінок проведено за допомогою імунохемілюмінесцентного методу з використанням обладнання Immulite 2000 виробництва компанії Siemens DPC (США). Устаткування закритого типу. Реагенти виробництва Siemens (Німеччина).
Статистичну обробку даних здійснювали за допомогою програми Statistica 10 (StatSoft, Inc., США). Характер розподілу у кожній вибірці визначали за критерієм Shapiro — Wilk. Статистичну значущість відмінностей між двома незалежними групами оцінювали за критерієм Mann — Whitney U-test, трьома та більше — за методом Крускала — Уолліса (Н), для вивчення кореляційного зв’язку визначали коефіцієнт кореляції Спірмена (R). Дані у тексті та таблицях подані у вигляді Ме (Q25; Q75), де Ме — медіана, Q25; Q75 — квартильний розмах, R — коефіцієнт кореляції, р — рівень статистичної значущості. За критичний рівень значущості при перевірці статистичних гіпотез брали р < 0,05.
Результати та їх обговорення
При квартильному розподілі обстежених жінок за рівнем соматотропного гормона були виявлені вірогідні відмінності показників знежиреної маси залежно від цього показника. У жінок із найнижчим рівнем соматотропного гормона спостерігались найнижчі показники знежиреної маси верхніх, нижніх кінцівок, апендикулярної знежиреної маси (табл. 1).
Вірогідних відмінностей показників знежиреної маси в обстежених жінок залежно від рівня загального та вільного тестостерону не встановлено (табл. 2–3).
Встановлено слабкий вірогідний позитивний кореляційний зв’язок між рівнем соматотропного гормона та показником знежиреної маси верхніх кінцівок (R = 0,37), апендикулярної знежиреної маси (R = 0,30) в осіб похилого, старечого віку (R = 0,35 і R = 0,34 відповідно) та в усій групі обстежуваних жінок (R = 0,36 і R = 0,31) (рис. 2). Також встановлено слабкий кореляційний зв’язок між рівнем вільного тестостерону та показником знежиреної маси нижніх кінцівок (R = 0,30) у жінок старечого віку. Між рівнем тестостерону (загального та вільного) та іншими показниками знежиреної маси вірогідного зв’язку не виявлено (р > 0,05).
/29_2.jpg)
При вивченні зв’язку між рівнем досліджуваних гормонів та силою скелетної м’язової тканини, визначеної за допомогою кистьової динамометрії, встановлено вірогідний помірний позитивний кореляційний зв’язок між рівнем загального тестостерону та показником динамометрії правої (R = 0,55) і лівої кисті (R = 0,68) в жінок старечого віку та помірний зв’язок — у всій обстежуваній групі (R = 0,32) (рис. 3). Виявлено також слабкий кореляційний зв’язок між рівнем вільного тестостерону та показником динамометрії правої (R = 0,31) і лівої (R = 0,47) кисті в жінок старечого віку, між рівнем соматотропного гормона та показником динамометрії правої кисті в жінок старечого віку (R = 0,35) та в усій обстежуваній групі (R = 0,32).
Між показником швидкості ходьби та показниками соматотропного гормона (R = 0,05), загального (R = –0,08) та вільного тестостерону (R = –0,18) вірогідного кореляційного зв’язку в усій групі обстежених жінок не виявлено. В осіб старечого віку виявлено вірогідний помірний кореляційний зв’язок між рівнем загального, вільного тестостерону та швидкістю ходьби (R = 0,46 і R = 0,48 відповідно).
Висновок
Встановлено зв’язок рівня соматотропного гормона та апендикулярної знежиреної маси; рівня загального, вільного тестостерону, соматотропного гормона та сили скелетної мускулатури; рівня загального, вільного тестостерону та функціональних можливостей скелетної м’язової тканини у жінок похилого та старечого віку.
Список литературы
1. Поворознюк В.В. Захворювання кістково-м’язової системи в людей різного віку (вибрані лекції, огляди, статті): в 3 т. — К., 2009. — С. 664.
2. Bea J.W., Zhao O., Cauley J.A. et al. Effect of hormone therapy on lean body mass, falls, and fractures: Six-year results from the Women’s Health Initiative Hormone Trials // Menopause. — 2011. — Vol. 18(1). — P. 44-52.
3. Budul S.L., Rossi A.P., Zamboni M. The pathogenic bases of sarcopenia. Mini-review // The clinical cases in mineral and bone metabolism. — 2015. — Vol. 12(1). — P. 22-26.
4. Christiansen J.J., Andersen N.H., Sоrensen K.E. et al. Dehydroepiandrosterone substitution in female adrenal failure: no impact on endothelial function and cardiovascular parameters despite normalization of androgen status // Clin. Endocrinol. (Oxf). — 2007. — Vol. 66(3). — P. 426-433.
5. Cruz-Jentoft A.J., Baeyens J.P., Bauer J.M et al. Sarcopenia: European consensus on definition and diagnosis // Age and ageing. — 2010. — Vol. 39. — P. 412-423.
6. Horstman A.M., Dillon E.L., Urban R.J., eld-Moore M.Sh. The role of androgens and estrogens on healthy aging and longe-vity // Journals of Gerontology: Biological Sciences Cite journal. — 2012. — Vol. 67(11). — Р. 1140-1152.
7. Hwang A.C., Liu L.K., Lee W.J. et al. Association of androgen with skeletal muscle mass and muscle function among men and women aged 50 years and older in Taiwan: results from the I-Lan longitudinal aging study // Rejuvenation Res. — 2013. — Vol. 16(6). — P. 453-459.
8. Messier V., Rabasa-Lhoret R., Barbat-Artigas S. et al. Menopause and sarcopenia: a potential role for sex hormones // Maturitas. — 2011. — Vol. 68. — P. 331-336.
9. Perrini S., Laviola L., Carreira M.C. The GH/IGF1 axis and signaling pathways in the muscle and bone: mechanisms underlying age-related skeletal muscle wasting and osteoporosis // Journal of Endocrinology. — 2010. — Vol. 205. — Р. 201-210.
10. Sakuma K., Yamaguchi A. Sarcopenia and age-related endocrine function. Review article. // International journal of endocrinology. — 2012. — Article ID 127362, 10 pages, doi: 10.1155/2012/127362.
11. Smith G.I., Yoshino J., Reeds D.N. et al. Testosterone and progesterone, but not estradiol, stimulate muscle protein synthesis in postmenopausal women // J. Clin. Endocrinol. Metab. — 2014. — Vol. 99(1). — P. 256-265.
12. Velloso C.P. Regulation of muscle mass by growth hormone and IGF-I // Br. J. Pharmacol. — 2008. — Vol. 154(3). — P. 557-568.
13. Yuki A., Ando F., Otsuka R., Shimokata H. Low free testosterone is associated with loss of appendicular muscle mass in Japanese community-dwelling women // Geriatr. Gerontol. Int. — 2015. — Vol. 15(3). — P. 326-333.
14. Yuki A., Otsuka R., Kozakai R. et al. Relationship between Low free testosterone levels and loss of muscle mass. — 2013. — Scientific Reports 3, Article number: 1818 doi:10.1038/srep01818.

/25.jpg)
/28.jpg)
/29.jpg)
/29_2.jpg)