Статья опубликована на с. 31-34
Вступ
За даними Всесвітньої організації охорони здоров’я, у світі нараховується понад 2 мільярди (майже 30 % населення) людей із захворюваннями печінки. Це набагато перевищує поширеність цукрового діабету (ЦД) чи інших хронічних захворювань [2]. Європейська асоціація з вивчення печінки (EASL, 2013) повідомила, що поширеність неалкогольної жирової хвороби печінки (НАЖХП) у загальній європейській популяції становить 2–44 %, у пацiєнтiв iз ЦД 2-го типу — 42,6–69,5 %, а у людей iз надмірною масою тіла — до 57–74 %. Поширеність НАЖХП у США сягає 46 %, за наявності неалкогольного стеатогепатиту (НАСГ) — 12,2 % [8, 9]. На думку провідних міжнародних організацій у галузі гепатології (AASLD, AGA, ACG), під НАЖХП слід розуміти наявність ознак стеатозу за відсутності причин для вторинного накопичення жиру. Таким чином, –НАЖХП — самостійна нозологічна одиниця хронічного ураження печінки невірусного генезу, представлена спектром морфологічних змін, що включають стеатоз печінки, НАСГ, фіброз і цироз печінки і розвиваються в пацієнтів, які не вживають алкоголь в гепатотоксичних дозах [12]. За Міжнародною класифікацією хвороб 10-го перегляду НАЖХП відповідає шифру К76.0 та разом з алкогольною входить до рубрики «Жирова хвороба печінки» [3].
Щорічне зростання захворюваності на НАЖХП спонукає науковців до дослідження нових ланок патогенезу та причин виникнення стеатозу печінки. Одним iз важливих і недостатньо вивчених механізмів розвитку та прогресування НАЖХП є підвищення рівня гомоцистеїну в плазмі крові. Завдяки наявності у складі гомоцистеїну SH-групи він має прооксидантнi властивостi: при підвищеному вмістi його в крові він окислюється і утворює вільні радикали, що індукує перекисне окислення ліпідів, порушує виділення оксиду азоту ферментом NO-синтазою, змінює гомеостаз і активує запальні процеси у печінці через активацію нуклеарного фактора NF-kB. Високі концентрації гомоцистеїну шляхом індукування пошкодження ендоплазматичного ретикулуму призводять до порушень регуляції стеролзв’язуючого регуляторного білка (SREBPs), підвищеного синтезу і засвоєння триацилгліцеридів та холестерину, зумовлюючи жирову інфільтрацію печінки.
Гіпергомоцистеїнемія (ГГЦ) у плазмі крові через зниження вмiсту плазмової протеїнліпази провокує збільшення рiвнiв ліпопротеїнів низької (ЛПНЩ) та дуже низької щільності (ЛПДНЩ) у мембранах гепатоцитів [5]. Гомоцистеїн — незалежний фактор розвитку мікро- та макроангіопатій при ЦД [10].
Комплексна терапія НАЖХП ґрунтується на таких головних принципах, як модифікація стилю життя (поступове зниження маси тіла), оптимізація фізичної активності, раціональне гіпокалорійне харчування, відміна всіх потенційно гепатотоксичних препаратів, корекція метаболічних порушень [6]. Останній пункт включає лікування інсулінорезистентності, гіперглікемії, дисліпідемії, оксидантного стресу. Широкий вибір медикаментозних засобів, що діють на різні ланки патогенезу НАЖХП, і відсутність єдиного підходу до лікування стеатозу печінки окреслюють подальші дослідження для оптимізації схем ефективного лікування. Розглядаючи ГГЦ як предиктор патологічних змін у печінці, слід згадати методи корекції цього стану. У рандомізованих клінічних дослідженнях висвітлений вплив комплексу вітамінів В6, В12 та фолієвої кислоти на зниження вмісту гомоцистеїну плазми крові та зменшення його патологічної дiї [4, 11].
Мета дослідження — оцінити терапевтичний вплив вітамінів В6, В12 та фолієвої кислоти на рівень гомоцистеїну плазми крові та перебіг НАЖХП.
Матеріали та методи
Обстежено 110 пацієнтів, які були розподілені на дві групи: І група (63 особи) — пацієнти з НАЖХП та ІІ група (47 осiб) — пацієнти з НАЖХП у поєднанні з ЦД 2-го типу. Діагноз НАЖХП встановлювався за результатами лабораторних (рівні трансаміназ печінки підвищені у 2–4 рази) та інструментальних (наявність стеатозу печінки підтверджували за допомогою УЗД) досліджень. Діагноз ЦД 2-го типу виставляли згідно з наказом Мiнiстерства охорони здоров’я України № 1118 від 21.12.2012 р. Пацієнти з наявністю маркерів вірусних гепатитів В, С та алкогольного анамнезу (вживання етанолу в гепатотоксичних дозах — 30–40 г етанолу на день) виключалися з дослідження. Пацієнти відповідали вимогам репрезентативної вибірки за статтю, віком, тривалістю захворювань.
Усім хворим проводили визначення рівня гомоцистеїну плазми крові імуноферментним методом з використанням аналізаторів Immulite One, DPA (США) і наборів реактивів Immulite 1000 Homocysteine згідно з інструкцією. Референтні значення вмiсту гомоцистеїну плазми крові здорових людей — 5–12 мкмоль/л. Досліджували рівні ферментів печінки та ліпідограму за загальноприйнятими методиками. Усім пацієнтам призначали фолієву кислоту (5 мг/добу у вигляді таблеток) та вітаміни В6 (піридоксину гідрохлорид) 100 мг/добу, В12 (ціанокобаламін) 1 мг/добу (у вигляді комплексного препарату нейробіон, що також містить тіаміну гідрохлорид (100 мг)), внутрішньом’язово 1 раз на добу (2 тижні), подальші 2 тижні — тричі на тиждень [7], протягом місяця. Також всім пацієнтам були дані рекомендації щодо харчування та модифікації стилю життя. Через один місяць після терапії пацієнтам знову проводився весь спектр вищевказаних лабораторних аналізів.
Статистичну обробку даних проводили з використанням програмних пакетів SPSS Statistics. Для розрахунку параметричних статистичних критеріїв визначали середню арифметичну варіаційного ряду (М) і середню похибку середньої арифметичної (m). Для визначення сили та напрямку зв’язку між показниками в досліджуваних групах застосовували кореляційний аналіз (кореляційний індекс Пірсона — r), однофакторний дисперсійний аналіз. Значення р < 0,05 вважали вірогідними.
Результати дослідження та їх обговорення
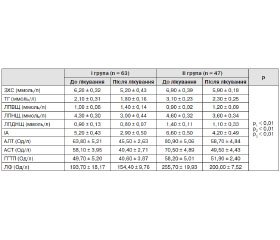
До лікування в обстежених хворих спостерігалися прогресуючі зміни функціонального стану печінки з підвищенням вмісту аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), лужної фосфатази (ЛФ) та гамма-глутамілтранспептидази (ГГТП). У пацієнтів обох груп відзначалися патологічні зміни ліпідограми у вигляді підвищених рівнів загального холестерину (ЗХС), тригліцеридів (ТГ), ЛПНЩ, ЛПДНЩ та зниження ЛПВЩ. У пацієнтів iз поєднанням НАЖХП та ЦД 2-го типу вказані зміни були більш виражені (табл. 1).
У результаті лікування встановлено вірогідне зниження таких показників ліпідного профілю, як ЗХС, ТГ, ЛПНЩ, ЛПДНЩ, ІА, та підвищення ЛПВЩ. Виявлено достовірне зниження екскреторних ферментів печінки та трансаміназ у пацієнтів обох груп.
Результати визначення гомоцистеїну у досліджуваних групах наведені в табл. 2.
Ураховуючи зміни вмісту гомоцистеїну плазми крові залежно від віку [11], ми розподілили пацієнтів на дві групи: 32–55 та 56–74 роки. Як бачимо з наведених даних, уміст гомоцистеїну вищий у пацієнтів iз коморбідною патологією. Унаслідок лікування рівень гомоцистеїну вірогідно знизився у хворих обох груп (табл. 2), при цьому у пацієнтів з ізольованою НАЖХП він досягнув показника здорових людей.
При виявленні зв’язків між досліджуваними показниками визначили вірогідну пряму кореляцію (р < 0,01) між гомоцистеїном та ЗХС (r = 0,86), ТГ (r = 0,78), АЛТ (r = 0,81), АСТ (r = 0,77) та обернену — між гомоцистеїном та ЛПВЩ (r = –0,37) до лікування у всіх пацієнтів iз НАЖХП. Після лікування прослідковувалися прямі кореляційні зв’язки між гомоцистеїном та ЗХС (r = 0,48), ТГ (r = 0,67), АЛТ (r = 0,64), АСТ (r = 0,58), обернений — з ЛПВЩ (r = 0,37). У результаті проведеного нами лікування виявили зниження рівнів показників ліпідного профілю, ферментів печінки та гомоцистеїну в пацієнтів обох груп.
Отримані результати ми пояснюємо зниженням концентрації гомоцистеїну, зменшенням його патологічного впливу на клітини печінки та їх обмінні процеси, що проявляються в стабілізації жирового обміну та нормалізації ферментної функції гепатоцитів. Крім того, вітаміни В6 та В12 регулюють окислювально-відновні процеси в печінці, сприяють нормалізації ліпідного та білкового обміну, детоксикації гепатоцитів.
При інсулінорезистентності, що притаманна як НАЖХП, так і ЦД 2-го типу, збільшується мобілізація вільних жирних кислот з депо та підвищується синтез ТГ та ЛПДНЩ у печінці. За цих умов постійна дизрегуляція ліпопротеїнліпази призводить до пригнічення катаболізму багатих на триацилгліцериди ЛПДНЩ, що знижує концентрацію ЛПВЩ [1]. Унаслідок збільшення концентрації гомоцистеїну знижується рівень метіоніну, який є головним донатором метильних груп у чисельних метаболічних реакціях. Недостатність метильної групи (СН3) обумовлює зниження синтезу білкових компонентів ліпопротеїнів і може бути причиною переважання в мембранах і міжклітинному просторі ЛПНЩ і ЛПДНЩ. Це призводить до судинних порушень як у всьому організмі, так і в судинах печінки зокрема. Гомоцистеїн викликає активацію оксидантного стресу та прозапальних цитокінів, порушує мікроциркуляцію, зменшує продукцію релаксуючого фактора і сульфітованих глікозаміногліканів, знижує еластичність інтими судин і синтез в ендотеліоцитах простацикліну, а також посилює ріст артеріальних клітин. Зазначені зміни негативно впливають на функціонування гепатоцитів, призводячи до порушення цілісності мембран та цитолітичного синдрому. Крім того, у дослідженні H. Li та співавт. (2002), що проводилися на ендотелії клітин людини, отримано докази, що гомоцистеїн стимулює експресію гідроксиметилглутарил-КоА-редуктази, ключового ферменту в синтезі холестерину. У пацієнтів обох груп після лікування спостерігали вірогідне зниження рiвня ЗХС.
Основною причиною ГГЦ є зниження активності ферментів, що забезпечують метаболізм гомоцистеїну, унаслідок генетичних мутацій і/або зниження рівнів вітамінів-кофакторів. Реметилювання гомоцистеїну в метіонін у печінці відбувається двома шляхами. Головний iз них каталізується плазматичним ферментом метіонінсинтазою (MTR), для роботи якого необхідний метилкобаламін, похідний вітаміну В12. MTR забезпечує перетворення гомоцистеїну в метіонін через реакції, у яких кобаламін є проміжним транспортером метильної групи. Але ключову роль у синтезі метіоніну з гомоцистеїну відіграє 5,10-метилентетрагідрофолатредуктаза, що відновлює 5,10-метилентетрагідрофолат до 5-метилентетрагідрофолату, що є донатором метильної групи для реметилювання гомоцистеїну. Також існує шлях перетворення гомоцистеїну в цистеїн через проміжний продукт цистатіон і за участю ферменту цистатіон-β-синтази і кофактора піридоксину, похідного вітаміну В6 [5]. Отримані нами результати можна пояснити стабілізацією метаболізму гомоцистеїну шляхом залучення його до реакцій реметилювання та транссульфування завдяки наявності вітамінів-кофакторів, з утворенням метіоніну та цистеїну.
Висновки
1. Уміст трансаміназ печінки та ЗХС, ЛПНЩ, ЛПДНЩ, ІА підвищений у пацієнтів iз неалкогольною жировою хворобою печінки порівняно зі здоровими людьми. У пацієнтів iз коморбідною патологією ці показники вищі, ніж у пацієнтів з ізольованою неалкогольною жировою хворобою печінки.
2. Рiвень гомоцистеїну плазми крові вищий у хворих обох груп порівняно зі здоровими людьми та вищий у пацієнтів iз поєднанням неалкогольної жирової хвороби печінки та цукрового діабету 2-го типу.
3. У результаті лікування вітамінами В6, В12 та фолієвою кислотою протягом одного місяця вміст гомоцистеїну знизився в пацієнтів обох груп, з ізольованою НАЖХП та у поєднанні з ЦД 2-го типу. Зниження вмісту гомоцистеїну в плазмі крові позитивно вплинуло на концентрації ферментів печінки, сприяло нормалізації ліпідного профілю в пацієнтів обох груп.
Перспективи подальших досліджень. Отримані нами дані узгоджуються з проспективними дослідженнями у цьому напрямку, підтверджуючи вплив гомоцистеїну на патологічні зміни в печінці. Подальші дослідження дозволять поглибити розуміння патогенезу неалкогольної жирової хвороби печінки.
Список литературы
1. Бабак О.Я. Неалкогольный стеатоз печени — «аккорд» метаболических нарушений / О.Я. Бабак, Е.В. Колесникова, К.Ю. Дубров // Украинский терапевтический журнал. — 2011. — № 1. — С. 5-11.
2. Балко А.Н. Место силимарина в лечении пациентов с заболеваниями гепатобилиарной системы / А.Н. Балко // Therapia. Укр. мед. вісник. — 2011. — № 10. — С. 80-82.
3. Богомолов П.О. Неалкогольная жировая болезнь печени: стеатоз и неалкогольный стеатогепатит / П.О. Богомолов, Ю.О. Шульпекова // Клинические перспективы в гастроэнтерологии, гепатологии. — 2004. — № 3. — С. 20-27.
4. Верткин А.Л. Проблема гипергомоцистеинемии у кардиологических больных / А.Л. Верткин, А.В. Тополянский // Фарматека. — 2007. — № 15. — С. 10-14.
5. Звягинцева Т.Д. Роль адеметионина в развитии и прогрессировании хронических заболеваний печени / Т.Д. Звягинцева, А.И. Чорнобай, С.В. Глущенко // Український медичний часопис. — 2014. — № 3(101). — С. 56-59.
6. Черняєва А.О. Показники центральної гемодинаміки у хворих на цукровий діабет 2-го типу з неалкогольною жировою хворобою печінки / А.О. Черняєва, Н.О. Кравчун // Міжнародний ендокринологічний журнал. — 2015. — № 1(65). — С. 53-56.
7. Інструкція до препарату Нейробіон (р-р д/ін. амп. 3 мл, № 3), Компендіум, http://compendium.com.ua/info/172249/takeda/nejrobion-rastvor-dlja-in_ektsij
8. Epidemiology of non-alcoholic fatty liver disease / S. Bellentani, F. Scaglioni, M. Marino [et al.] // Dig. Dis. — 2010. — Vol. 28(1). — P. 155-161.
9. From NAFLD in clinical practice to answers from guidelines / F. Nascimbeni, R. Pais, S. Bellentani [et al.] // J. Hepatol. — 2013. — Vol. 59(4). — P. 859-871.
10. Homocysteine induces caspase activation by endoplasmic reticulum stress in platelets from type 2 diabetics and healthy donors / H. Zbidi, P.C. Redondo, J. Lopez [et al.] // Thrombosis and Haemostasis. — 2010. — № 103(5). — P. 1022-1032.
11. Homocysteine Lowering by Folate-Rich Diet or Pharmacological Supplementations in Subjects with Moderate Hyperhomocysteinemi / B. Zappacosta, P. Mastroiacovo, S. Persichilli [et al.] // Nutrients. — 2013. — № 5. — P. 1531-1543.
12. The Diagnosis and Management of Non-alcoholic Fatty Liver Disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association / N. Chalasani, Z. Younossi, J.E. Lavine [et al.] // Am. J. Gastroenterol. — 2012. — Vol. 107. — P. 811-826.

/33.jpg)