Статья опубликована на с. 59-64
Целью создания клинического руководства по гипопаратиреозу (ГипоПТ) явилась необходимость помощи практическим врачам в оптимизации лечения и правильном выборе целевых показателей контроля для мониторинга хронического ГипоПT у взрослых при отсутствии терминальной стадии почечной патологии.
Состав рабочей группы. Клиническое руководство было создано и спонсировано Европейским обществом эндокринологов, при помощи Нидерландского института усовершенствования медицинской помощи, под руководством Jens Bollerslev (клиницист), Olaf Dekkers (методист), включая Claudio Marcocci, Lars Rejnmark и Dolores Shoback (эндокринологи), Wim van Biesen (нефролог) и Antonio Sitges Sierra (хирург-эндокринолог). Системный литературный обзор включил 1100 статей, в библиографический список вошло 312 источников (статьи, тезисы), за основу были взяты 32 статьи. Проект клинического руководства был разослан членам Европейского общества эндокринологов и прокомментирован ими, затем представлен и обсужден на Европейском конгрессе эндокринологов 18 мая 2015 года в Дублине.
Гипопаратиреоз — редкое эндокринное заболевание, сопровождающееся низким уровнем кальция и значительным снижением (недостаточностью) паратгормона (ПТГ) крови. В январе 2014 г. Европейской комиссией ГипоПT был отнесен к группе орфанных заболеваний (редко диагностируемых).
Наиболее частой причиной хронического ГипоПTявляются оперативные вмешательства на шее, в том числе на щитовидной и паращитовидных железах, но заболевание может иметь и аутоиммунное происхождение с генетической этиологией или без нее [1]. Особенность ГипоПT состоит в том, что это единственное из основных эндокринных состояний, в лечении которого сегодня практически не используется заместительная терапия недостающим гормоном (ПТГ). ГипоПТ может иметь аутоиммунный генез, и у большинства таких больных причиной является мутация аутоиммунного регулятора эндокринной функции (гена AIRE) [2]. Кроме того, существует много других редких генетических нарушений, которые могут привести к развитию ГипоПT, либо он выступает частью синдрома (например, синдрома DiGeorge). ГипоПТ может быть и изолированной эндокринопатией (табл. 1) [3].
Распространенность ГипоПТ
В недавнем систематическом исследовании в Дании, в котором в общей сложности участвовало более 2000 пациентов, продемонстрирована распространенность ГипоПТ ~ 24/100 000 жителей, и лишь у очень немногих из них (2/100 000) был ГипоПТ нехирургической этиологии [4, 5]. Эти показатели согласуются с последними данными из США, в соответствии с которыми у американцев наблюдается аналогичная распространенность хронического ГипоПТ [6].
По усредненным данным мировой статистики, у 2–10 % пациентов после проведенной тиреоидэктомии развивается хронический ГипоПT. Начальное проявление послеоперационной паратиреоидной недостаточности — гипокальциемия, которая определяется в пределах 24 часов после тиреоидэктомии и встречается у 30–60 % пациентов, перенесших тотальную тиреоидэктомию.
Предрасполагающие факторы: молодой возраст, женский пол, болезнь Грейвса, лимфаденэктомия, случайная паратиреоидэктомия, паратиреоидная аутотрансплантация и малое количество ткани оставшихся функционирующих паращитовидных желез.
Около 60–70 % случаев послеоперационной гипокальциемии нивелируются в течение 4–6 недель после проведенной операции (транзиторный ГипоПT); в остальных случаях она прогрессирует и ведет к затяжному ГипоПT, характеризующемуся низким уровнем ПТГ сыворотки и необходимостью продолжать лечение. У 15–25 % пациентов с затяжным ГипоПT развивается хронический ГипоПT.
Риск развития хронического ГипоПT напрямую зависит от количества оставшихся при операции функционирующих паращитовидных желез и составляет: 16 % при 1–2 сохранившихся железах, 6 % — при трех и 2,5 % — при четырех.
Рабочая группа рекомендует диагностировать хронический гипопаратиреоз:
1. При наличии гипокальциемии и снижении уровня паратгормона сыворотки (строгая рекомендация).
2. При проведении генетического обследования и/или семейного скрининга у пациентов с ГипоПТ неизвестного происхождения (менее строгая рекомендация) [7].
Как правило, выявляют сопутствующую гиперфосфатемию и гиперкальциурию. Уровень магния и 25-гидроксивитамина D является обязательным для измерения перед постановкой диагноза ГипоПT.
Осложнения хронического гипопаратиреоза у взрослых
Пациенты с хроническим ГипоПT имеют:
— более низкое качество жизни;
— общую и мышечную слабость;
— испытывают беспокойство и склонность к депрессиям;
— у них повышен риск госпитализаций вследствие депрессий и аффективных расстройств;
— частую почечную патологию, инфекции.
ГипоПT традиционно ассоциируется с кальцийсодержащим уролитиазом и заболеваниями почек. Потеря ренальных эффектов ПТГ ведет к снижению тубулярной реабсорбции кальция и экскреции фосфатов, обусловливая гиперкальциурию и гиперфосфатемию — образование камней в почках, почечную недостаточность (табл. 2).
Беременность и грудное вскармливание
В этот период возникают краткосрочные проблемы с материнским кальциевым гомеостазом: необходима минерализация скелета плода, поступление этого важного минерала в грудное молоко для поддержания послеродового формирования скелета и благополучного развития новорожденного.
Проблемы в материнском организме решаются путем интенсивной плацентарной продукции 1,25(OH)2D, который стимулирует всасывание кальция и фосфатов в кишечнике во время беременности, что приводит к повышению экскреции кальция с мочой и низкой, вплоть до подавленной, эндогенной секреции ПТГ.
В этот период увеличивается синтез паратгормонсвязанного белка (PTHrP) во многих тканях. PTHrP увеличивает резорбцию костной ткани и реабсорбцию кальция в почках, что совместно обеспечивает стабильное снабжение кальцием производимого молока, оказывает влияние на почки, и уровень кальция в моче падает в период лактации.
В связи с изменениями уровней PTHrP и 1,25(OH)2D во время беременности и лактации уровень эндогенного ПТГ супрессирован.
Хотя ПТГ играет незначительную роль в регуляции гомеостаза кальция во время беременности и в период лактации у здоровых женщин, у пациенток с хроническим ГипоПT, в чьих сыворотках уровень кальция поддерживается дополнительным приемом препаратов кальция и витамина D3, появляется значительный риск возникновения как гиперкальциемии, так и гипокальциемии в период беременности и кормления грудью.
Плохой контроль ГипоПT у матери и в результате гипокальциемия во время беременности может вы-звать выкидыш, мертворождение, преждевременные роды и смерть новорожденных.
Гипокальциемия у матери может влиять на развитие скелета новорожденного с возникновением у него компенсаторного гиперпаратиреоза. Деформации скелета, переломы, гиперплазия паращитовидных желез и такие клинические осложнения, как респираторный дистресс, плохое вскармливание, гипотония могут стать его следствием. Результатом лечения матери без соответствующего мониторинга может быть гиперкальциемия, вследствие которой подавляется развитие паращитовидных желез у плода, что вызывает в дальнейшем гипокальциемию новорожденных.
Рекомендации по мониторингу хронического ГипоПТ
Авторы клинического руководства рекомендуют:
— Режим рутинного биохимического мониторинга сывороточного уровня ионизированного или общего кальция с перерасчетом на альбумин и фосфатов.
Риск экстраскелетной кальцификации, включая нефрокальциноз и катаракту, возрастает при ГипоПT в связи с высоким уровнем сывороточных фосфатов и ростом кальций-фосфорного продукта. Кальций-фосфорный продукт — это перемноженные значения уровней кальция (ионизированного или общего с перерасчетом на альбумин) и фосфора сыворотки. Единицы измерения кальций-фосфорного продукта — ммоль2/л2 (или мг2/дл2).
— Уровень магния является обязательным для измерения перед постановкой диагноза ГипоПT (для исключения функционального ГипоПT).
— Уровень 25-гидроксивитамина D учитывается перед постановкой диагноза ГипоПТ, так как его недостаточность влияет на уровень не только паратгормона, не позволяя его объективно оценить, но и кальциемии.
— Креатинин (ожидаемая скорость клубочковой фильтрации (СКФ)).
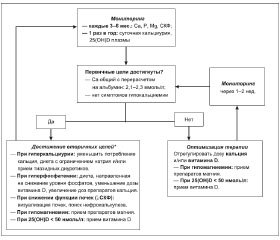
Важна оценка симптомов гипо- и гиперкальциемии регулярно в установленные временные промежутки, например каждые 3–6 месяцев (табл. 3). При коррекции терапии авторы рекомендуют биохимический мониторинг еженедельно или раз в 2 недели.
Рекомендован 24-часовой мониторинг экскреции кальция с мочой регулярно в следующие интервалы времени (например, раз в год или раз в два года) с учетом специфических для пола референтных значений (экскреция кальция у мужчин выше, чем у женщин).
Рабочая группа дополнительно рекомендует:
— проведение компьютерной или магнитно-резонансной томографии почек при наличии у пациента симптомов мочекаменной болезни или в случае роста уровня креатинина;
— контроль за возможным развитием симптомов сопутствующей патологии регулярно, например раз в год.
Не рекомендуется регулярное проведение определения минеральной плотности костной ткани с использованием двухэнергетической рентгеновской абсорбциометрии.
Мониторирование гипопаратиреоза при беременности и грудном вскармливании
Авторы рекомендуют:
1. Регулярное определение содержания сывороточного ионизированного кальция (1 раз в 2 или 3 недели), поддержание уровня кальция на нижних пределах нормы (возможно использование уровня кальция с перерасчетом на альбумин).
2. Лечение витамином D3 и препаратами кальция проводят так же, как и у небеременных пациенток.
Лечение хронического ГипоПТ
— Проводят всем пациентам с хроническим ГипоПT с симптомами гипокальциемии и уровнем общего кальция сыворотки крови (с перерасчетом на альбумин) < 2,0 ммоль/л или уровнем ионизированного кальция сыворотки (Ca++) < 1,0 ммоль/л.
— Авторы предлагают лечение пациентов с бессимптомным хроническим ГипоПT и уровнем общего кальция сыворотки крови между 2,0 ммоль/л и нижним пределом нормального диапазона с целью определить, насколько это может улучшить их самочувствие.
— Использование аналогов витамина D (преимущественно холекальциферола) с добавлением кальция в несколько приемов. Суточная доза витамина D — 1000–2000 МЕ, общая суточная доза кальция — 800–2000 мг с титрованием.
— Целевые уровни терапии: у пациентов с бессимптомным течением гипокальциемии уровень 25(OH)D должен составлять 75–125 нмоль/л (30–50 нг/мл). Целевые уровни сывороточного кальция поддерживаются в пределах диапазона: общего кальция с перерасчетом на альбумин — 2,1–2,3 ммоль/л или ионизированного кальция (Са++) — 1,10–1,25 ммоль/л.
— У пациентов с гиперкальциурией авторы предлагают снижение потребления кальция, диету с ограничением натрия и лечение тиазидными диуретиками.
— Больным с камнями в почках рекомендовано оценить все риски, связанные с их наличием, и действовать согласно соответствующим международным стандартам.
— У пациентов с гиперфосфатемией и/или повышением кальций-фосфорного продукта, целевые уровни которого должны быть < 4,4 ммоль2/л2, авторы предлагают диетические меры и/или коррекцию лечения с использованием кальция и аналогов витамина D.
— Больным с гипомагниемией авторы рекомендуют рассмотреть меры по увеличению уровня магния сыворотки (использование солей магния или амилорида — калийсберегающего диуретика).
— Лечение должно быть направлено на поддержание сывороточного уровня кальция на нижней границе нормы, фосфатов сыворотки — в пределах нормального диапазона, кальций-фосфорного продукта — ниже 4,4 ммоль2/л2; важно избегать гиперкальциурии.
— Стандартное лечение включает пероральное использование солей кальция и аналогов витамина D.
— Гиперфосфатемия устраняется путем уменьшения потребления фосфатов в пище и с помощью использования фосфатных буферов.
— Авторы против рутинного применения заместительной терапии ПТГ или его аналогами. Заместительная терапия синтетическим ПТГ (1-34) и интактным ПTГ (1-84) рекомендована тем пациентам, которые не могут достичь стабильности в поддержании уровня кальция мочи и сыворотки в целевом диапазоне.
Консолидированные рекомендации по ведению пациентов с хроническим ГипоПТ приведены в алгоритме «Мониторинг и лечение хронического ГипоПТ» (рис. 1).
В заключение авторы хотели бы упомянуть, что –ГипоПТ может встречаться в клинической практике как элемент аутоиммунного полигландулярного синдрома типа 1 (вместе с недостаточностью надпочечников и хроническим кандидозом). Доказана связь между аутоиммунной эндокринной патологией и развитием преждевременной яичниковой недостаточности, возникновением проблем бесплодия. При этом нередко причиной является мутация гена ингибина В [13]. При лабораторном обследовании молодых людей фертильного возраста в таких случаях обнаруживают: снижение уровней паратгормона, кальция; ингибина В и антимюллерова гормона (АМГ) — маркеров овариального резерва. Усугубляться ситуация может наличием сопутствующего D-дефицита.
Таким образом, для полноты решения рассмотренной в статье клинической задачи диагностики и ведения гипопаратиреоза рекомендован следующий объем лабораторного обследования:
1) паратгормон, кальций, фосфор, магний;
2) креатинин, скорость клубочковой фильтрации;
3) 25-гидроксивитамин D;
4) ингибин В, АМГ, фолликулостимулирующий гормон (для оценки репродуктивного возраста, при планировании беременности).a
Список литературы
1. Puzziello A., Rosato L., Innaro N. et al. Hypocalcemia following thyroid surgery: incidence and risk factors. A longitudinal multicenter study comprising 2,631 patients // Endocrine. — 2014. — 47. — 537-542.
2. Betterl C., Garelli S., Presotto F. Diagnosis and classification of autoimmune parathyroid disease // Autoimmunity Reviews. — 2014. — 13. — 417-422.
3. Lima K., Abrahamsen T.G., Wolff A.B. et al. Hypoparathyroidism and autoimmunity in the 22q11.2 deletion syndrome // European Journal of Endocrinology. — 2011. — 165. — 345-352.
4. Underbjerg L., Sikjaer T., Mosekilde L., Rejnmark L. Cardiovascular and renal complications to postsurgical hypoparathyroidism: a Danish nationwide controlled historic follow-up study // Journal of Bone and Mineral Research. — 2013. — 28. — 2277-2285.
5. Underbjerg L., Sikjaer T., Mosekilde L., Rejnmark L. The epidemiology of non-surgical hypoparathyroidism in Denmark: a nationwide case finding study // Journal of Bone and Mineral Research. — 2015. In press: doi:10.1002/jbmr.2501.
6. Powers J., Joy K., Ruscio A., Lagast H. Prevalence and incidence of hypoparathyroidism in the United States using a large claims database // Journal of Bone and Mineral Research. — 2013. — 28. — 2570-2576.
7. Bollerslev J., Rejnmark L., Marcocci C., Shoback D.M. et al. European Society of Endocrinology Clinical Guideline: Treatment of chronic hypoparathyroidism in adults // European Journal of Endocrinology. — 2015. — 173. — G1-G20.
8. Arlt W., Fremerey C., Callies F. et al. Well-being, mood and calcium homeostasis in patients with hypoparathyroidism receiving standard treatment with calcium and vitamin D // European Journal of Endocrinology. — 2002. — 146. — 215-222.
9. Cusano N.E., Rubin M.R., McMahon D.J. et al. The effect of PTH(1-84) on quality of life in hypoparathyroidism // Journal of Clinical Endocrinology and Metabolism. — 2013. — 98. — 2356-2361.
10. Underbjerg L., Sikjaer T., Mosekilde L. & Rejnmark L. Postsurgical hypoparathyroidism — risk of fractures, psychiatric diseases, cancer, cataract, and infections // Journal of Bone and Mineral Research. — 2014. — 29. — 2504-2510.
11. Mitchell D.M., Regan S., Cooley M.R. et al. Long-term follow-up of patients with hypoparathyroidism // Journal of Clinical Endocrinology and Metabolism. — 2012. — 97. — 4507-4514.
12. Shoback D. Clinical practice. Hypoparathyroidism // New England Journal of Medicine. — 2008. — 359. — 391-403.
13. The abnormal menstrual cycle / Ed. by M. Rees, S. Hope. — Tailor&Francis 2010 UK/USA. — 248 p.
/60.jpg)
/60_2.jpg)

/62.jpg)
/63.jpg)