Статья опубликована на с. 69-80
Сахарный диабет (СД) 2-го типа — одно из наиболее распространенных заболеваний, выявляется у 80–90 % от общего числа диагностированных диабетических пациентов, с эпидемиологическим ростом (382 млн человек в 2013 году и прогнозируемое прогрессирующее увеличение до 592 млн человек в 2035 году) [28]. Патофизиология этого заболевания характеризуется дефектной секрецией инсулина и тканевой инсулинорезистентностью (ИР) [5]. Важность гликемического контроля была верифицирована в UKPDS, показавшем благоприятный эффект раннего интенсивного конт-роля глюкозы крови для впервые диагностированных больных СД 2-го типа, а именно: снижение микро- и макрососудистых осложнений, как и общей смертности [26, 56, 57], и доказавшем существование клинического феномена метаболического наследия («гликемическая память») как патогенетического основания для формирования алгоритма современной антидиабетической терапии (литература в обзоре [3]).
Разработаны пероральные сахароснижающие препараты (ПСП) с различными механизмами действия, такими как увеличение функции панкреатических β-клеток относительно секреции инсулина, уменьшение резистентности тканей организма, ингибирование почечной реабсорбции глюкозы или повышение глюкагонподобного пептида-1 (ГПП-1), которые активно используются в терапии больных СД 2-го типа. Производные сульфонилмочевины (ПСМ) и метформин являются наиболее часто назначаемыми ПСП с доказанной клинической эффективностью и безопасностью, вместе с тем они имеют различные механизмы действия, а именно: ПСМ уменьшают гипергликемию, повышая секрецию инсулина, а метформин — путем улучшения чувствительности к инсулину и подавления продукции глюкозы печенью. Поскольку больные СД 2-го типа преимущественно тучные и инсулинорезистентные с высоким риском развития преждевременного атеросклероза (атеросклеропатии), то метформин рассматривается сейчас как препарат первой линии терапии [29]. Метформин является широко используемым антидиабетическим препаратом, который уменьшает риск связанных с СД конечных точек, при этом у пациентов отмечены меньшая прибавка в весе и незначительное число гипогликемий по сравнению с инсулином. В целом монотерапия метформином в сочетании с модификацией образа жизни рекомендуется первоначально при манифестации СД. Вместе с тем, если уровень глюкозы контролируется недостаточно, то для достижения гликемического контроля дополнительно применяют другие классы антидиабетических препаратов [29, 45].
ПСМ широко назначаются больным СД 2-го типа, обеспечивая более чем у 80 % пациентов достижение нормогликемии, однако сульфонилмочевина способна вызывать гипогликемии и при хроническом введении — прибавку в весе, что может усиливать ИР. Глимепирид относится к ПСМ третьей генерации, и помимо более выраженной специфической сахароснижающей активности по сравнению с первой генерацией (он не уступает препарату второй генерации глибенкламиду) и большой длительности действия, позволяющей вводить его однократно в сутки [18], ему присущ целый спектр благоприятных экстрапанкреатических (за пределами гликемического контроля) эффектов, оптимизирующих его терапевтическое действие [1, 2, 4, 32, 43].
Вместе с тем монотерапия может замедлять, но не предупреждать прогрессирование болезни. Как показано, монотерапия глюкозопонижающими препаратами с течением времени характеризуется увеличивающейся неэффективностью относительно контроля глюкозы крови, что требует комбинации с рядом антидиабетических препаратов или инсулином [29, 55]. Успешный менедж-мент базируется на комбинированной терапии, направленной на оба патогенетических механизма развития СД 2-го типа, а именно ИР и дисфункцию β-клеток [12].
Метформин и глимепирид часто назначаются совместно для улучшения гликемического контроля и снижения риска неблагоприятных событий (гипогликемия, прибавка в весе), синергизм достигается сочетанием различных механизмов действия этих лекарственных препаратов: метформин тормозит печеночный глюконеогенез за счет аденозин-монофосфат-активируемой протеинкиназы (АМФПК), а глимепирид «щадяще» стимулирует секрецию инсулина, связываясь с АМФ-зависимыми калиевыми каналами на поверхности панкреатических β-клеток, в сочетании с экстрапанкреатическими эффектами, дополняющими/усиливающими инсулин-сенситайзерное действие метформина [1, 2, 4, 18, 36].
На сегодняшний день получены убедительные доказательства целесообразности комбинированной терапии сульфонилмочевиной и метформином в случае недостаточной эффективности монотерапии (табл. 1).
Комбинация «сульфонилмочевина + метформин» среди ПСП хорошо обоснована. UKPDS выявило, что пропорция больных, у которых концентрация HbA1c была < 7 %, увеличилась с 21 до 33 % с добавлением метформина к режиму монотерапии ПСМ (р < 0,05) [57]. Добавочный благоприятный эффект (повышение эффективности) может быть объяснен комплементарными механизмами антигипергликемического действия двух препаратов, а именно стимулированной секрецией панкреатических β-клеток ПСМ и повышенной чувствительностью печени и периферических тканей к инсулину с использованием метформина [15].
Препарат третьей генерации глимепирид обладает рядом преимуществ как компонент комбинированной терапии с метформином, связанных с уникальной экстрапанкреатической активностью и более благоприятным профилем безопасности по сравнению с верифицированными у других ПСМ [37, 50, 60, литература в обзоре [2]]. Так, в рандомизированном контролированном исследовании (46 больных СД 2-го типа) лечение глимепиридом в течение 28 недель было связано со значимым улучшением чувствительности к инсулину периферических тканей и антиатеросклеротическим эффектом по сравнению с глибенкламидом, определенным по снижению HOMA-IR, скорости плечелодыжечной пульсовой волны и индекса увеличения (показатель начальной стадии атеросклероза) [37]. В плацебо-контролированном клиническом исследовании 15 больных СД 2-го типа показано, что 4-недельная терапия глимепиридом была ассоциирована со значимым уменьшением активации моноцитарного редокс-чувствительного транскрипционного фактора каппа В, тогда как изменения в группе «плацебо + глибенкламид» были незначимыми [50]. Неконтролируемое постмаркетинговое исследование выживаемости у 1770 больных СД 2-го типа показало, что терапия глимепиридом на протяжении 1,5 года не была ассоциирована с прибавкой веса [60].
В UKPDS 49 [55], которое включало 4075 больных с впервые диагностированным СД 2-го типа и периодом наблюдения в среднем 9 лет, показано, что у пациентов с нормальным или избыточным весом, получавших терапию ПСМ, или с избыточным весом, получавших метформин, целевые уровни HbA1c не поддерживались соответственно у 56 и 76 % пациентов через 3 года и у 56 и 87 % спустя 9 лет лечения. Это свидетельствует о потребности в политерапии с более чем одним ПСП или инсулином.
Комбинированная терапия, использующая ПСМ и метформин, которая стимулирует секрецию инсулина и снижает ИР, соответственно, является эффективным комплементарным методом, улучшающим (реабилитирующим) оба ключевых механизма, нарушение которых определяет развитие СД 2-го типа. Клинический опыт свидетельствует о большей эффективности такой фармакологической комбинации, чем при монотерапии ее составляющими [13, 25, 57].
Так, добавление глимепирида к метформину у больных СД 2-го типа, неадекватно контролированных одним метформином, приводило к лучшему гликемическому контролю по сравнению с монотерапией глимепиридом или метформином (рис. 1) [13].
Таким образом, в этом исследовании четко показано, что добавление глимепирида к предсуществующей терапии метформином является наиболее соответствующей терапевтической стратегией у пациентов с СД 2-го типа, неадекватно контролированных одним метформином, по сравнению с переходом на один глимепирид.
В рандомизированном исследовании с усиленной титрацией препарата, включавшем 203 пациента с СД 2-го типа с неадекватным гликемическим конт-ролем (HbA1c 7,5–10 %) монотерапией метформином (≥ 8 недель), добавление глимепирида (первоначальная доза 2 мг/сутки, титрованная до 8 мг/сутки в течение 6 недель) к метформину на протяжении 28 недель приводило к значимому сокращению времени, необходимого для достижения целевых концентраций HbA1c (≤ 7 %), более низкому уровню общего холестерина и холестерина липопротеинов низкой плотности по сравнению с пиоглитазоном, добавленным к монотерапии метформином (первоначальная доза 30 мг/сутки, титрованная до 45 мг/сутки в течение 12 недель) [59].
Из-за комплементарных механизмов действия такая комбинированная терапия (метформин + сульфонилмочевина) является рациональной и может вести не только к улучшенному гликемическому контролю, но и к повышению переносимости в связи с более низкими дозами отдельных препаратов [9, 17, 47]. Это положение четко иллюстрируется результатами метаанализа сравнительной эффективности и безопасности лекарственной терапии больных СД 2-го типа, включая новые препараты и двухкомпонентные комбинации (табл. 2).
Следует отметить, что анализ включал результаты 140 рандомизированных контролированных исследований и 26 обсервационных исследований head-to-head монотерапии или комбинированной терапии, для которых были сообщены клинические исходы или повреждающие эффекты при средне- или долгосрочной терапии.
Ниже приводится краткий анализ имеющихся на сегодня данных, обосновывающий преимущественное использование именно глимепирида (ПСМ третьей генерации) в комплексной терапии «метформин + сульфонилмочевина» больных СД 2-го типа. Подробное изложение представлено в обзоре [4]. Необходимость и преимущества комбинированной терапии «метформин + глимепирид» базируются на максимальной фармакологической коррекции молекулярных механизмов, нарушение которых определяет патофизиологию СД 2-го типа, и конкретизированы в следующем. Для больных СД 2-го типа в связи со спонтанной эволюцией заболевания (персистентная ИР в сочетании с неизбежным прогрессированием инсулиновой недостаточности от относительной к абсолютной) характерно хронозависимое снижение эффективности гликемического менеджмента препаратом первого выбора метформином. Это усиливается также тем, что АМФПК, основной реализатор снижающего ИР действия бигуанидов, тормозит секрецию инсулина. Поэтому со временем для достижения целевого гликемического контроля требуется «щадящая» стимуляция панкреатических β-клеток, которая обеспечивается препаратом сульфонилмочевины третьей генерации глимепиридом. В добавление, «щадящая» стимуляция β-клеток замедляет развитие феномена десенситизации (нечувствительности) β-клеток к физиологическим (гипергликемия, аргинин) и фармакологическим (в первую очередь ПСМ первой и второй генерации) стимулам в результате длительной сверхстимуляции β-клеток. В связи с этим существенное преимущество фармкомбинации «метформин + глимепирид» обеспечивается также наличием у метформина нормализующего влияния на функциональный паттерн секреторной активности β-клеток, а именно — снижением проатерогенной гиперпроинсулинемии и отношения проинсулин/инсулин в циркуляции.
Сочетание метформина с глимепиридом оптимально в плане терапевтического воздействия на обе молекулы, недостаточная активность которых определяет метаболическое состояние ИР, соответственно, АМФПК и пролифератором пероксисом активируемого рецептора γ (РРАR-γ).
NB! Наиболее мощными активаторами РРАR-γ являются тиазолидиндионы (ТЗД), обеспечивающие сопоставимый хороший гликемический контроль как при раздельном применении, так и в сочетании с метформином относительно глимепирида, но обладающие рядом повреждающих эффектов, частично обусловленных очень выраженной стимуляцией РРАR-γ (например, повышенная частота остеопороза, рака). Следует отметить, что умеренная редукция гипоадипонектинемии, индуцируемая при терапии глимепиридом (20 % от эффекта ТЗД), не сопровождается этими осложнениями при проявлении подобных ТЗД благоприятных терапевтических эффектов. Последние обеспечиваются глимепиридом за счет наличия двойного реабилитирующего действия на оба патогенетических звена СД 2-го типа («щадящая» стимуляция β-клеток и прямые инсулин-сенситайзерные эффекты).
Терапевтическая оптимальность пероральной фармакологической комбинации «метформин + глимепирид» базируется также на уникальной способности метформина устранять феномен «гипергликемической памяти» (метаболическое наследие) за счет повышения экспрессии и активности ключевого «игрока» — сиртуина-1, с одной стороны, и патогенетически обоснованного соответствия реабилитирующих эффектов такого сочетания спонтанной эволюции СД 2-го типа — с другой [3, 4].
Преимущества глимепирида по сравнению с другими ПСМ для оптимизации комбинированной терапии с метформином включают следующее:
— глимепирид щадяще стимулирует секрецию инсулина с воспроизведением ее физиологического биоритма (повышает прежде всего первую фазу секреции гормона);
— глимепирид сохраняет физиологический ответ на физическую нагрузку, включая снижение секреции инсулина;
— глимепирид повышает синтез и секрецию адипонектина — единственного гормона жировой ткани с доказанным антиатерогенным действием;
— глимепирид обладает прямым (за пределами гликемического контроля) снижающим инсулинорезистентность действием за счет: 1) инсулин-миметического эффекта (через DIGs-детергентами нерастворимые, богатые гликолипидами «мостики» путем активации фосфолипазы С); 2) инсулин-сенситайзерных эффектов (через повышение адипонектина, снижение ФНО-α, оксидативного стресса и др.);
— глимепирид — единственное производное сульфонилмочевины с клинически доказанной способностью сохранять защитный феномен «ишемического прекондиционирования» [2, 39].
Глимепирид расширяет спектр реабилитирующего влияния на патофизиологические составляющие ИР, а также потенцирует благоприятные эффекты метформина (в частности, через адипонектин, который является активатором АМФПК — ключевого фермента в реализации снижающего ИР действия метформина). С этим связано достижение оптимизированной терапевтической эффективности пероральной фармкомбинации при снижении побочного действия (уменьшение дозы глимепирида, метформина) (литература в обзоре [4]).
Таким образом, комбинированная терапия «метформин + глимепирид» обеспечивает максимальное соответствие специфических эффектов пероральной фармкомбинации детерминирующим патогенетическим факторам СД 2-го типа и ассоциированных ангиопатий.
Так как СД 2-го типа является хроническим и прогрессирующим заболеванием, менеджмент которого обеспечивается длительным использованием пероральных сахароснижающих (антигипергликемических) препаратов, то низкая приверженность (комплайенс) к ПСП составляет главную помеху для гликемического контроля. Приверженность уменьшается с увеличением частоты приемов препарата или в связи с политерапией [14].
Приверженность к ПСП является очень важной для поддержания гликемического контроля. Так, в ретроспективном обсервационном исследовании пациентов с СД 2-го типа (n = 2741), которые получали ПСП, показано, что 10% увеличение приверженности к ПСП было ассоциировано с 0,1% абсолютным уменьшением концентрации HbA1c [48]. Однако в ретроспективных и проспективных исследованиях также сообщено, что пациенты с СД 2-го типа могли использовать меньше ПСП, чем им назначалось, с колебанием приверженности от 36 до 93 % в течение периода терапии (от 6 до 24 месяцев) [14]. Известно, что приверженность уменьшалась с увеличением частоты приемов (79 % при однократном приеме в сутки, 38 % при трехкратном приеме в сутки на протяжении шести месяцев) [52] и/или в связи с политерапией (63 и 61 % при монотерапии с метформином или ПСМ соответственно; 36 % при политерапии «метформин + ПСМ» в течение двух лет) [16].
P.T. Donnan и соавт. (2002), проанализировав медицинские базы данных округа Тэйсайд (Шотландия), провели ретроспективное исследование соблюдения врачебных назначений среди всех пациентов с СД 2-го типа в регионе, принимавших ПСП. Адекватная приверженность к лечению (более 90 %) составила 31 % при терапии ПСМ и 34 % при терапии метформином [20]. Отмечено статистически значимое линейное ухудшение этого показателя в зависимости от количества принимаемых таблеток и увеличения перечня сопутствующих препаратов для ПСМ. В повседневных условиях только 1 пациент из 3 имел адекватную приверженность к лечению при терапии ПСП. Демонстративны результаты исследования, акцентировавшие положительную роль осведомленности больных о терапии для повышения их приверженности к рекомендованному лечению (табл. 3) [7].
Уместно также акцентировать следующее утверждение: «Низкая приверженность к терапии — одна из основных причин плохого метаболического конт-роля» (чем меньше количество таблеток, тем выше приверженность к терапии) [31].
Эта проблема может преодолеваться назначением дозофиксированных пероральных комбинаций, которые снижают количество приемов таблеток [23, 33, 46]. Дозофиксированная комбинация ПСП способна увеличивать приверженность за счет уменьшения числа ежедневных приемов. Ранняя агрессивная терапия может не только улучшать исходы у пациента, но и уменьшать общие финансовые траты системы здравоохранения. Потенциальные преимущества раннего начала комбинированной терапии с фиксированными комбинациями включают:
— более раннее достижение терапевтических целей;
— снижение риска развития побочных эффектов при комбинации препаратов в низких дозах по сравнению с повышением дозы одного препарата;
— возможность комбинировать сахароснижающие препараты с взаимодополняющими способами действия;
— увеличение приверженности пациентов на 30 % в сравнении с использованием свободной комбинации препаратов;
— потенциальная возможность замедлить прогрессирование заболевания [19].
Рассматривая комплайенс пациентов и соотношение «цена — эффективность», следует отметить, что использование таблеток с дозофиксированной комбинацией сульфонилмочевины и метформина в последнее время увеличивается. Дозофиксированные комбинации могут улучшить комплайенс больных по сравнению с множественным приемом таблеток с ожидаемой минимизацией побочных эффектов, вы-званных высокими дозами монотерапии, при эффективно контролируемом уровне глюкозы крови [42]. В частности, показано, что комбинированная терапия фиксированными дозами глимепирида/метформина (первоначальная доза 1/250 мг дважды в сутки) была более эффективна относительно гликемического контроля, чем повышающаяся титрация метформина (первоначальная доза 500 мг дважды в сутки), комбинация хорошо переносилась больными СД 2-го типа, неадекватно контролированными низкими дозами метформина при монотерапии [34].
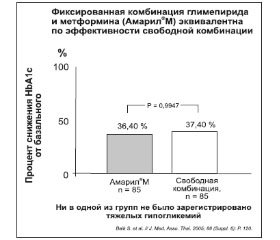
Таблетка Амарил®М (глимепирид/метформин) является дозофиксированной комбинацией активных ингредиентов глимепирида и метформина гидрохлорида (соответственно 1/250 мг), которая широко используется в клинической практике и обладает безопасностью, эффективностью и клинической эквивалентностью по сравнению со свободной комбинированной терапией [30, 38] (рис. 2).
Интересны результаты обсервационного, мультицентрового с участием многих стран проспективного исследования регистрации продукта PERSIST (фиксированная комбинация Amaryl®M) после шести месяцев у азиатских больных СД 2-го типа (n = 1309) в повседневной практике [30].
В этом исследовании показано, что менеджмент больных СД 2-го типа Амарилом®М ассоциирован с высокой степенью приверженности к терапии, эффективным улучшением гликемического контроля и благоприятным профилем безопасности (табл. 4).
Уместно подчеркнуть, что дозофиксированная комбинация «глимепирид + метформин» (соответственно 1/500 мг в 1 таблетке 2 раза в день, Glimetal 1/500, Laboratorios Silanes, Mexico) была более эффективной в достижении гликемического контроля по сравнению с дозофиксированной комбинацией «глибенкламид + метформин» (соответственно 5/500 мг в 1 таблетке 2 раза в день, Bi-Euglucon M5, Laboratorios Roche, Mexico) [22]. Так, к концу 2-недельного исследования у больных СД 2-го типа глимепиридной группы был отмечен более высокий процент достигших целевых значений НbA1c < 7 %, а именно 44,6 % против 26,8 %, и при меньшей частоте гипогликемических событий (17,1 % против 28,9 %, р < 0,047).
Недавно разработана новая форма выпуска Амарил®М СР (GМ-SR). Предпосылки для создания фиксированных комбинаций с компонентом замедленного действия определяются следующим:
— хорошая компенсация на свободной/фиксированной комбинации достижима при высокой приверженности к лечению (!);
— побочные эффекты бигуанидов отмечаются чаще, чем у ПСМ (20 % против 4 %), прежде всего это побочные реакции со стороны желудочно-кишечного тракта;
— в отличие от ПСМ гипогликемия при применении бигуанидов (например, метформина) возникает очень редко.
В связи с этим следует подчеркнуть особенности фармакокинетики метформина, а именно:
— абсолютная биодоступность метформина, введенного per os, cоставляет 50–60 %;
— почти весь метформин, попадающий в кровоток, всасывается на ограниченном участке верхних отделов желудочно-кишечного тракта, и лишь незначительная часть метформина всасывается в дистальных отделах пищеварительного тракта;
— всасывание метформина в тонком кишечнике является «насыщающимся»:
- при увеличении концентрации метформина в просвете кишечника выше определенного порогового уровня происходит «насыщение всасывания», тем самым значительная часть препарата проходит мимо «окна абсорбции» и не всасывается вовсе;
- уровень всасывания метформина из желудочно-кишечного тракта зависит от скорости эвакуации метформина из желудка.
Эти особенности определяют сложность разработки таблеток метформина с замедленным высвобождением, пригодных для приема один раз в сутки [54].
Более того, в связи с различной фармакокинетикой могут возникать некоторые проблемы при создании комбинации «метформин + глимепирид». Дело в том, что глимепирид назначается однократно или дважды в сутки, а метформин обычно вводится более двух раз в сутки и часто связан с гастроинтестинальными побочными эффектами. За последние годы эти проблемы относительно метформина были преодолены разработкой системы доставки для контролированного высвобождения препарата и однократного введения в сутки [40, 54, 61]. Это технология Gelshield Diffusion System, использованная при разработке новой формы метформина замедленного высвобождения (Glucophage® XR, Bristol-Myers Squibb Company, США), и запатентованный мультиполимерный гидрофильный матрикс (Handok, Корея [61]), примененный при разработке дозофиксированной комбинации метформина замедленного высвобождения (sustained release — SR) и глимепирида (Amaryl®M SR или Aмарил®M СР). Последняя новая форма была одобрена Korea Food and Drug Administration (KEDA) и находится на рынке Кореи с 2009 года. Таблетки Amaryl®M SR (Aмарил®M СР) состоят из следующих слоев: матриксного слоя, в котором метформина гидрохлорид смешан с гидрофильными макромолекулами, контролирующими высвобождение активного фармацевтического ингредиента, промежуточного покрывающего слоя, состоящего из гидрофильных макромолекул для независимого высвобождения метформина гидрохлорида из внутреннего слоя, наружного глимепиридного слоя и гидрофильных макромолекул, покрывающих слой, содержащий глимепирид. Как только таблетка вводится перорально, глимепиридный слой быстро выделяется с последующей пенетрацией гастроинтестинальной жидкости в таблетки замедленного высвобождения. Затем гидратация и экспансия гидрофильных молекул вызывают диффузию лекарственных субстанций, обеспечивая медленное высвобождение метформина гидрохлорида из матрикса независимо от pH [35]. После введения таблетки полимеры с наружного слоя гидратируются и вызывают превращение таблетки в гелеподобную массу. Первоначальный размер таблетки и ее трансформация в нераспадающийся гель могут временно предупредить транзит таблетки через привратник желудка (когда вводится с пищей) и таким путем эффективно удлинить ее нахождение в желудке [54]. Следует отметить, что гидрофильные полимерные системы для замедленной доставки пероральных препаратов известны давно [11], как и влияние их величины на задержку в желудке таких не разрушающих активную субстанцию форм [24, 44], но и Gel-Shield Diffusion System, и Handok (Корея) представляют собой новые технологии в этой области [53, 61].
Показано, что препараты с фиксированной дозой глимепирида и метформина медленного высвобождения Aмарил®M СР (2/500 мг) обладают фармакокинетическим профилем, подобным относительно высвобождения глимепирида и с несколько задержанным временем достижения максимальной концентрации и слегка уменьшенной биодоступностью метформина (анализ площади под кривой зависимости концентрация/время, АUС24) по сравнению с дозофиксированной комбинацией немедленного –высвобождения (immediate realease — IR) (Amaryl®M
2/500 мг однократно в сутки или Amaryl®M 1/250 мг дважды в сутки) у здоровых добровольцев [35, 51]. В связи с этим следует подчеркнуть, что данные были получены только от 12 человек и общее заключение относительно фармакокинетических характеристик глимепирида/SR метформина затруднено, особенно принимая во внимание тот факт, что установленное 13–25% уменьшение АUС24 не является существенным при наличии в норме 40% межындивидуумной вариабельности клиренса фармпрепаратов [49]. Более того, в одном из исследований третьей фазы клинических испытаний (Clinical Trial. gov Identifier: NCT00437554) показана терапевтическая эффективность, а именно изменение HbA1c после 16-недельной терапии глимепиридом/SR метформином
2/500 мг однократно в сутки, эквивалентная терапии глимепиридом/IR метформином 1/250 мг дважды в сутки [38]. Это значит, что новую форму глимепирид/SR метформин можно назначать однократно в сутки, основываясь на терапевтической эквивалентности и несмотря на несколько уменьшенную биодоступность SR-формы [35].
В основе пролонгированного эффекта Амарила®М СР лежит гипромеллоза с вязкостью 100 000 сантипуаз (сПз), которая обеспечивает замедленное высвобождение метформина гидрохлорида [61]. Профиль растворения препарата с добавлением 43 % гипромеллозы 100 000 сПз (ядро метформина пролонгированного высвобождения в препарате Амарил®М СР) подобен профилю, полученному для доступного на рынке препарата метформина замедленного высвобождения Глюкофажа XR [35, 54]. Время достижения максимальной концентрации метформина в плазме (Сmax) после приема метформина пролонгированного высвобождения было больше, чем после приема метформина обычного высвобождения, соответственно, для Глюкофажа XR 7 ч против 3–4 ч [54] и для Амарила®М СР от 4 до 8 ч против 1–4 ч для Амарила®М [35].
Со временем дезинтеграция гидратированной полимерной массы, как и эластичность последней, обеспечивает ее прохождение через привратник желудка, и эта масса может разрушаться нормальной перистальтикой гастроинтестинального тракта. Биологически инертные компоненты этих дозофиксированных форм с замедленным высвобождением метформина подчас могут оставаться интактными во время гастроинтестинального прохождения и удаляются с фекалиями в виде легкой гидратированной массы [54, 61].
Преимущества системы для замедленного высвобождения метформина гидрохлорида включают:
— оптимальную абсорбцию;
— меньшее вовлечение/раздражение нижних отделов желудочно-кишечного тракт;
— сопоставимую биоэквивалентность [10, 35, 54].
Состав Амарила®М СР (таблетки пролонгированного действия). 1 таблетка содержит: активное вещество: глимепирид микронизированный 2 мг, метформина гидрохлорид 500 мг; вспомогательные вещества: ядро: гипромеллоза, повидон К-30, лактозы моногидрат, магния стеарат; промежуточная инертная оболочка: гипромеллоза, поли-этиленгликоль 6000 (макрогол); внешняя оболочка быстрого высвобождения: гипромеллоза, полиэтиленгликоль 6000, титана диоксид (Е 171), натрия лаурилсульфат.
Амарил®М СР (glimepiride metformin sustained release) содержит те же активные ингредиенты (глимепирид/метформин соответственно 2/500 мг), что и Амарил®М (соответственно 1/250 мг) — лекарственная форма с замедленным высвобождением метформина. Амарил®М СР — новая лекарственная форма, обеспечивающая быстрое высвобождение глимепирида, а затем медленное высвобождение метформина из матрикса независимо от рН. Следовательно, таблетки Амарил®М СР могут быть введены больным СД 2-го типа менее часто, с меньшими желудочно-кишечными побочными эффектами и с ожидаемым повышением комплайентности, а также отношения «стоимость/выгода (положительные свойства) препарата» (drug cost-to-benefit) при длительном использовании этой новой лекарственной формы по сравнению с таблетками Амарил®М. Следует отметить, что «сульфонилмочевина в комбинированной терапии с метформином является самым рентабельным лекарственным средством, демонстрируя при этом выраженное улучшение гликемического контроля и низкий абсолютный риск тяжелой гипогликемии, требующей медицинского вмешательства» [6].
— Новый препарат является достижением с точки зрения уникального устройства для доставки с оптимальной фармакокинетикой метформина и глимепирида.
— В основе — запатентованный мультиполимерный гидрофильный матрикс (Handok, Koрея) [61].
— Задекларированный однократный прием действительно обоснован!
— Доказана лучшая желудочно-кишечная переносимость, нет возрастания частоты гипогликемий.
— Потенциально высокая приверженность к лечению и, как следствие, компенсация СД.
Показано, что однократный в сутки прием препарата ассоциирован с лучшими показателями НbА1c и лучшей приверженностью к лечению [13, 14, 52].
Результаты мультицентрового, рандомизированного, дважды слепого, с двойным плацебо исследования показали, что у больных СД 2-го типа (длительность диабета менее 10 лет, ИМТ < 40 кг/м2, исходный НbА1c между 7 и 10 %) GM-SR (2/500 мг) однократно в сутки на протяжении 16 недель был так же эффективен, как и GM 1/250 мг двукратно в сутки для понижения НbА1c (табл. 5, 6) [27].
Кроме того, отсутствовали различия в частоте гипогликемических событий между исследованными группами (табл. 7).
Следует подчеркнуть, что гастроинтестинальные побочные эффекты метформина (тошнота, диарея, абдоминальный дискомфорт), как полагают, связаны с абсорбционным процессом препарата, поэтому снижение частоты его приема может уменьшать их проявления [41, 46]. Разработанные лекарственные формы метформина с замедленным высвобождением, вводимые однократно в сутки, могут уменьшать гастроинтестинальные побочные эффекты путем подавления высвобождения метформина после перорального введения и задержки (приостановки) растворения, а также абсорбции лекарства в кишечнике [10, 54]. Повышение комплайентности к терапии Amaryl®М СР (однократный прием в сутки), ассоциированное с аналогичной Amaryl®М фармакодинамикой (двукратный прием в сутки), создает новые возможности для больных СД 2-го типа относительно оптимизации гликемического контроля и качества жизни.
Список литературы
1. Полторак В.В., Горшунская М.Ю. Сахарный диабет 2-го типа: два патогенетических дефекта, две мишени для терапевтического воздействия // Ліки України. — 2010. — T. 6, № 142. — С. 82-85.
2. Полторак В.В., Кравчун Н.С., Горшунская М.Ю., Красова Н.С. Глимепирид (Амарил) в терапии больных сахарным диабетом 2 типа (патофизиологическое обоснование и клиническая реализация) // Мiжнародний ендокринологiчний журнал. — 2014. — № 1. — С. 77-89.
3. Полторак В.В., Красова Н.С., Горшунская М.Ю. Гликемическая память как патогенетическое основание для формирования алгоритма современной антидиабетической терапии // Міжнародний ендокринологічний журнал. — 2014. — № 3. — С. 15-21.
4. Полторак В.В., Красова Н.С., Горшунская М.Ю. Комбинированная терапия «метформин + глимепирид» у больных сахарным диабетом 2-го типа (молекулярные механизмы оптимизации реабилитирующего действия) // Мiжнародний ендокринологiчний журнал. — 2015. — № 1. — С. 87-97.
5. Abdul-Ghani M.A., Tripathy D., DeFronzo R.A. Contribution of beta-cell dysfunction and insulin resistance to the pathogenesis of impaired fasting glucose // Diabetes Care. — 2006. — Vol. 29, № 5. — P. 1130-1139.
6. Abrahamson M.J. Should sulfonylureas remain an acceptable first-line add-on to metformin therapy in patients with type 2 diabetes? Yes, they continue to serve us well! // Diabetes Care. — 2015. — Vol. 38. — P. 160-169.
7. Ahmad N.S., Ramli A., Islahudin F., Paraidathathu T. Medication adherence in patients with type 2 diabetes mellitus treated at primary health clinics in Malaysia // Patient Preference and Adherence. — 2013. — Vol. 7. — P. 525-530.
8. American Diabetes Association. Executive summary: Standards of medical care in diabetes-2014 // Diabetes Care. — 2014. — Vol. 37, № 1. — P. 5-13.
9. Bennett W.L., Maruthur N.M., Singh S. et al. Comparative effectiveness and safety of medications for type 2 diabetes: an update including new drugs and 2-drug combinations // Ann. Intern. Med. — 2011. — Vol. 154. — P. 602-613.
10. Blonde L., Dailey G.E., Jabbour S.A. et al. Gastrointestinal tolerability of extended release metformin tablets compared to immediate-release metformin tablets: results of a retrospective cohort study // Curr. Med. Res. Opin. — 2004. — Vol. 20, № 4. — P. 565-572.
11. Caldwell L.J., Gardener C.R., Cargll R.C., inventors. Merck and Co, Inc., assignee. Drug delivery device which can be retained in the stomach for a controlled period of time. US patent 4,767,627. — Aug 30, 1988.
12. Cefalu W.T. Pharmacotherapy for the treatment of patients with type 2 diabetic mellitus: rationale and specific agents // Clinical Pharmacology and therapeutics. — 2007. — Vol. 81, № 5. — P. 636-649.
13. Charpentier G., Fleury F., Kabir M. et al. Improved glycaemic control by addition of glimepiride to metformin monotherapy in type 2 diabetes patients // Diabet. Med. — 2001. — Vol. 18, № 10. — P. 828-834.
14. Cramer J.A. A systematic review of adherence with medications for diabetes // Diabetes Care. — 2004. — Vol. 27, № 5. — P. 1218-1224.
15. Cusi K., Consoli A., DeFronzo R.A. Metabolic effects of metformin on glucose and lactate metabolism in noninsulin-dependent diabetes mellitus // J. Clin. Endocrinol. Metab. — 1996. — Vol. 81, № 11. — P. 4059-4067.
16. Daily G., Kim M.S., Lian J.F. Patient compliance and persistence with anty-hyperglycemic therapy: evaluation of a population of type 2 diabetic patients // J. Int. Med. Res. — 2002. — Vol. 30, № 1. — P. 71-79.
17. Daily G.E. Glyburide/metformin tablets: A new therapeutic option for the management of type 2 diabetes // Exp. Opin. Pharmacother. — 2003. — Vol. 4, № 8. — P. 1417-1430.
18. Davis S.N. The role of glimepiride in the effective management of type 2 diabetes // J. Diabet. Complications. — 2004. — Vol. 18, № 6. — P. 367-376.
19. Del Prato S., Felton A.M., Munro N. et al., Global Partnership for Effective Diabetes Management. Improving glucose management: ten steps to get more patients with type 2 diabetes to glycaemic goal // Int. J. Clin. Pract. — 2005. — Vol. 59, № 11. — P. 1345-1355.
20. Donnan P.T., MacDonald T.M., Morris A.D. Adherence to prescribed oral hypoglycaemic medication in a population of patients with type 2 diabetes: a retrospective cohort study // Diabet. Med. — 2002. — Vol. 19, № 4. — P. 279-284.
21. Dunn C.J., Peters D.H. Metformin. A review of its pharmacological properties and therapeutic use in non-insulin-dependent diabetes mellitus // Drugs. — 1995. — Vol. 49, № 5. — P. 721-749.
22. González-Ortiz M., Guerrero-Romero J.F., Violante-Ortiz R. et al. Efficacy of glimepiride/metformin combination versus glibenclamide/metformin in patients with uncontrolled type 2 diabetes mellitus // J. Diabet. Complications. — 2009. — Vol. 23, 6. — P. 376-379.
23. Gu N., Kim B.H., Rhim H. et al. Comparison of the bioavailability and tolerability of fixed dose combination glimepiride/metformin 2/500-mg tablets versus separate tablets: A single-dose, randomized-sequence, open-label, two-period, crossover study in healthy, Korean volunteers // Clin. Ther. — 2010. — Vol. 32, № 7. — P. 1408-1418.
24. Gusler G., Gorsline J., Levy G. et al. Pharmacokinetics of a metformin gastro-retentive tablets in healthy volunteers // J. Clin. Pharmacol. — 2001. — Vol. 41, № 6. — P. 655-661.
25. Hermann L.S., Scherstén B., Bitzén P.O. et al. Therapeutic comparison of metformin and sulfonylurea, alone and in various combinations. A double blind controlled study // Diabetes Care. — 1994. — Vol. 17, № 10. — P. 1100-1109.
26. Holman R.R., Paul S.K., Bethel M.A. et al. 10-year follow-up of intensive glucose control in type 2 diabetes // N. Engl. J. Med. — 2008. — Vol. 359, № 15. — P. 1577-1589.
27. Hwang Y.C., Kang M., Ahn C.W. et al. Efficacy and safety of glimepiride/metformin sustained release once daily vs. glimеpiride/metformin twice daily in patients with type 2 diabetes // Int. J. Clin. Pract. — 2013. — Vol. 67, № 3. — P. 236-243.
28. International Diabetes Federation. Diabetes Atlas. — 6th edition. — Brussels Belgium: International Diabetes Federation, 2013.
29. Inzucci S.E., Bergenstal R.M., Buse I.B. et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. — 2015. — Vol. 38. — P. 140-149.
30. Javaz S.A.A., Soewondo P., Wang E., Admane K. PERSISTence on Glimepiride-Metformin (Amaryl M®) fixed combination in everyday practice in asian type 2 diabetes patients // 72nd Scientific sessions of American Diabetes Assoaciation, 8–12 June 2012, Philadelphia, USA. — Abstract 1124-P.
31. Johnson S.B. Methodological issues in diabetes research. Measuring adherence // Diabetes Care. — 1992. — Vol. 15, № 11. — P. 1658-1667.
32. Jojima T., Suzuki K., Hirama N. et al. Glimеpiride upregulates eNOS activity and inhibits cytokine-induced NF-kappaB activation through a phoshoinoside 3-kinase-Akt-dependent pathway // Diabetes Obes. Metab. — 2009. — Vol. 11, № 2. — P. 143-149.
33. Kim B.H., Shin K.H., Kim J. et al. Pharmacokinetic comparison of a new glimepiride 1-mg + metformin 500-mg combination tablet formulation and a glimepiride 2-mg + metformin 500-mg combination tablet formulation: a single-dose, randomized, open-label, two-period, two-way, crossover study in healthy, fasting Korean male volunteers // Clin. Ther. — 2009. — Vol. 31, 11. — P. 2755-2764.
34. Kim H.S., Kim D.M., Cha B.S. et al. Efficacy of glimepiride/metformin fixed dose combination vs metformin uptitration in type 2 diabetic patients inadequately controlled on low dose metformin monotherapy: A randomized open-label, parallel group, multicenter study in Korea // J. Diabetes Invest. — 2014. — Vol. 5, № 6. — P. 701-708.
35. Kim K.P., Lim K.S., Kim B.H. et al. Pharmacokinetics of a fixed-dose glimepiride/sustained-release metformin combination // Int. J. Clin. Pharmacol. Ther. — 2012. — Vol. 50, № 2. — P. 142-149.
36. Kim Y.D., Park K.G., Lee Y.S. et al. Metformin inhibits hepatic gluconeogenesis through AMP-activated protein kinase-dependent regulation of the orphan nuclear receptor SHP // Diabetes. — 2008. — Vol. 57, № 2. — P. 306-314.
37. Koshiba K., Nomura M., Nakaya Y., Ito S. Efficacy of glimepiride on insulin resistance, adipocytokines, and atherosclerosis // J. Med. Invest. — 2006. — Vol. 53, № 1–2. — P. 87-94.
38. Lee S.H., Lee I.K., Baik S.H. et al. Comparison of the efficacy and safety of glimepiride/metformin fixed combination versus free combination in patients with type 2 diabetes: multicenter, randomized, controlled trial // J. Korean Diabetes Assoc. — 2006. — Vol. 30, № 6. — P. 466-475.
39. Lee T.M., Chou T.F. Impairment of myocardial protection in type 2 diabetic patients // J. Clin. Endocrinol. Metab. — 2003. — Vol. 88, № 2. — P. 531-537.
40. Lewin A., Lipetz R., Wu J., Schwartz S. Comparison of extended-release metformin in combination with a sulfonylurea (glyburide) to sulfonylurea monotherapy in adult patients with type 2 diabetes: multicenter, double-blind, randomized, controlled, phase III study // Clin. Ther. — 2007. — Vol. 29, № 5. — P. 844-855.
41. Marathe P.H., Arnold M.E., Meeker J. et al. Pharmacokinetics and bioavailability of a metformin/gliburide tablet administered alone and with food // J. Clin. Pharmacol. — 2000. — Vol. 40. — P. 1494-1502.
42. Melikian C., White T.J., Vanderplas A. et al. Adherence to oral antidiabetic therapy in a managed care organization: a comparison of monotherapy, combination therapy, and fixed-dose combination therapy // Clin. Ther. — 2002. — Vol. 24, № 3. — P. 460-467.
43. Nakamura I., Oyama J., Komoda H. et al. Possible effects of glimepiride beyond glycemic control in patients with type 2 diabetes: a preliminary report // Cardiovasc. Diabetol. — 2014. — Vol. 13. — P. 15.
44. Noel D.S. Kinetic study of normal and sustained release dosage forms of metformin in normal subjects // J. Int. Biomed. Inform. Data. — 1980. — Vol. 1. — P. 9-20.
45. Nyenwe E.A., Jerkins T.W., Umpierrez G.E., Kitabchi A.E. Management of type 2 diabetes: evolving strategies for the treatment of patients with type 2 diabetes // Metabolism. — 2011. — Vol. 60, № 1. — P. 1-23.
46. Pan F., Chernew M.E., Fendrick A.M. Impact of fixed-dose combination drugs on adherence to prescription medications // J. Gen. Intern. Med. — 2008. — Vol. 23, № 5. — P. 611-614.
47. Rendell M. The role of sulfonureas in the management of type 2 diabetes mellitus // Drugs. — 2004. — Vol. 64, № 12. — P. 1339-1358.
48. Rozenfeld Y., Hunt J.S., Plauschinat C., Wong K.S. Oral antidiabetic medication adherence and glycemic control in managed care // Am. J. Manag. Care. — 2008. — Vol. 14, № 2. — P. 71-75.
49. Sambol N.C., Chiang J., Lin E.T. et al. Kidney function and age are both predictors of pharmacokinetics of metformin // J. Clin. Pharmacol. — 1995. — Vol. 35. — P. 1094-1102.
50. Schiekofer S., Rudofsky G. Jr, Andrassy M. et al. Glimepiride reduces mononuclear activation of the redox-sensitive transcription factor nuclear factor-kappa B // Diabetes Obes. Metab. — 2003. — Vol. 5, № 4. — P. 251-261.
51. Shin K.H., Kim S.E., Yoon S.H. et al. Pharmacokinetic comparison of a new sustained-release formulation of glimepiride/metformin 1/500 mg combination tablet and a sustained-release formulation of glimepiride/metformin 2/500 mg combination tablet in healthy korean male volunteers: a randomized, 2-sequence, 2-period, 2-treatment crossover study // Clin. Therap. — 2011. — Vol. 33. — P. 1809-1818.
52. Srivastava K., Arora A., Kataria A. et al. Impact of reducing dosing frequency on adherence to oral therapies: a literature review and meta-analysis // Patient Prefer. Adherence. — 2013. — Vol. 7. — P. 419-434.
53. Timmins P., Dennis A.B., Vyas K.A., inventors. Bristol-Myers Squibb Company, assignee. Biphasic controlled realese delivery system for high solubility pharmaceuticals and method. US patent 6,475,521. — Nov 5, 2002.
54. Timmins P., Donahue S., Meeker J., Marathe P. Steady-state pharmacokines of a novel extended-release metformin formulation // Clin. Pharmacokinet. — 2005. — Vol. 44, № 7. — P. 721-729.
55. Turner R.C., Cull C.A., Frighi V., Holman R.R., UK Prospective Diabetes Study (UKPDS) Group. Glycemic control with diet, sulfonylurea metformin or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49) // JAMA. — 1999. — Vol. 281, № 21. — P. 2005-2012.
56. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulfonylurea or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33) // Lancet. — 1998. — Vol. 352, № 9131. — P. 837-853.
57. UK Prospective Diabetes Study (UKPDS) Group. UKPDS 28: a randomized trial of efficacy of early addition of metformin in sulfonylurea-treated type 2 diabetes // Diabetes Care. — 1998. — Vol. 21, № 1. — P. 87-92.
58. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) // Lancet. — 1998. — Vol. 352, № 9131. — P. 854-865.
59. Umpierrez G., Issa M., Vlajnic A. Glimepiride versus Pioglitazone combination therapy in subjects with type 2 diabetes inadequately controlled on metformin monotherapy: Results of a randomized clinical trial // Curr. Med. Res. Opin. — 2006. — Vol. 22, № 4. — P. 751-759.
60. Weitgasser R., Lechleitner M., Luger A., Klingler A. Effects of glimepiride on HbA(1c) and body weight in type 2 diabetes: Results of a 1.5-year follow-up study // Diabetes Res. Clin. Pract. — 2003. — Vol. 61, № 1. — P. 13-19.
61. Yu K.-S., Handok Pharmaceuticals company Ltd. Seoul, Korea // Bull. Korean Chem. Soc. — 2011. — № 41. — P. 22-28.
1. Poltorak VV, Gorshunska MY. Sakharniy dyabet 2-ho typa: dva patohenetycheskykh defekta, dve mysheny dlya terapevtycheskoho vozdeystvyya. Liky Ukrayiny 2010;6(142):82-85.
2. Poltorak VV, Kravchun NS, Gorshunska MY, Krasova NS. Hlymepyryd (Amaryl) v terapyy bol'nykh sakharnym dyabetom 2 typa (patofyzyolohycheskoe obosnovanye y klynycheskaya realyzatsyya. Mizhnarodnyy endokrynolohichnyy zhurnal 2014;(1):77-89.
3. Poltorak VV, Krasova NS, Gorshunska MY. Hlykemycheskaya pamyat' kak patohenetycheskoe osnovanye dlya formyrovanyya alhorytma sovremennoy antydyabetycheskoy terapyy. Mizhnarodnyy endokrynolohichnyy zhurnal 2014;(3):15-21.
4. Poltorak VV, Krasova NS, Gorshunska MY. Kombynyrovannaya terapyya «metformyn+hlymepyryd» u bol'nykh sakharnym dyabetom 2-ho typa (molekulyarnye mekhanyzmy optymyzatsyy reabylytyruyushcheho deystvyya). Mizhnarodnyy endokrynolohichnyy zhurnal 2015;(1):87-97.
5. Abdul-Ghani MA, Tripathy D, DeFronzo RA. Contribution of beta-cell dysfunction and insulin resistance to the pathogenesis of impaired fasting glucose. Diabetes Care 2006; 29(5):1130-1139. doi:10.2337/dc05-2179.
6. Abrahamson MJ. Should sulfonylureas remain an acceptable first-line add-on to metformin therapy in patients with type 2 diabetes? Yes, they continue to serve us well! Diabetes Care 2015;38:160-169. doi: 10.2337/dc14-1945.
7. Ahmad NS, Ramli A, Islahudin F, Paraidathathu T. Medication adherence in patients with type 2 diabetes mellitus treated at primary health clinics in Malaysia. Patient Preference and Adherence 2013;7:525-530. doi: 10.2147/PPA.S44698.
8. American Diabetes Association. Executive summary: Standards of medical care in diabetes-2014. Diabetes Care 2014;37(1):S5-S13. doi: 10.2337/dc14-S005.
9. Bennett WL, Maruthur NM, Singh S, Segal JB, Wilson LM, Chatterjee R, Marinopoulos SS, Puhan MA, Ranasinghe P, Block L, Nicholson WK, Hutfless S, Bass EB, Bolen S. Comparative effectiveness and safety of medications for type 2 diabetes: an update including new drugs and 2-drug combinations. Ann Intern Med 2011;154:602-613. doi:10.7326/0003-4819-154-9-201105030-00336.
10. Blonde L, Dailey GE, Jabbour SA, Reasner CA, Mills DJ. Gastrointestinal tolerability of extended release metformin tablets compared to immediate–release metformin tablets: results of a retrospective cohort study. Curr Med Res Opin 2004;20(4):565-572. doi: 10.1185/030079904125003278.
11. Caldwell LJ, Gardener CR, Cargll RC, inventors. Merck and Co, Inc, assignee. Drug delivery device which can be retained in the stomach for a controlled period of time. US patent 4, 767, 627. 30 Aug 1988.
12. Cefalu WT. Pharmacotherapy for the treatment of patients with type 2 diabetic mellitus: rationale and specific agents. Clin Pharmacol Ther 2007;81(5):636-649. doi:10.1038/sj.clpt.6100156.
13. Charpentier G, Fleury F, Kabir M, Vaur L, Halimi S. Improved glycaemic control by addition of glimepiride to metformin monotherapy in type 2 diabetes patients. Diabet. Med. 2001;18(10):828-834. doi: 10.1046/j.1464-5491.2001.00582.x.
14. Cramer JA. A systematic review of adherence with medications for diabetes. Diabetes Care 2004;27(5):1218-1224. doi: 10.2337/diacare.27.5.1218.
15. Cusi K, Consoli A, DeFronzo RA. Metabolic effects of metformin on glucose and lactate metabolism in noninsulin-dependent diabetes mellitus. J Clin Endocrinol Metab 1996;81(11):4059-4067. doi: 10.1210/jcem.81.11.8923861.
16. Daily G, Kim MS, Lian JF. Patient compliance and persistence with anty-hyperglycemic therapy: evaluation of a population of type 2 diabetic patients. J Int Med Res 2002;30(1): 71-79. doi: 10.1177/147323000203000111.
17. Daily GE. Glyburide/metformin tablets: A new therapeutic option for the management of type 2 diabetes. Expert Opin Pharmacoter 2003;4(8): 1417-1430. doi: 10.1517/14656566.4.8.1417.
18. Davis SN. The role of glimepiride in the effective management of type 2 diabetes. J Diabetes Complicat 2004;18(6): 367-376. doi: 10.1016/j.jdia-comp.2004.07.001.
19. Del Prato S, Felton AM, Munro N, Nesto R, Zimmet P, Zinman B, Global Partnership for Effective Diabetes Management. Improving glucose management: ten steps to get more patients with type 2 diabetes to glycaemic goal. Int J Clin Pract 2005;59(11):1345-1355. doi: 10.1111/j.1742-1241.2005.00674.x.
20. Donnan PT, MacDonald TM, Morris AD. Adherence to prescribed oral hypoglycaemic medication in a population of patients with type 2 diabetes: a retrospective cohort study. Diabet Med 2002;19(4):279-284. doi: 10.1046/j.1464-5491.2002.00689.x.
21. Dunn CJ, Peters DH. Metformin. A review of its pharmalogical properties and therapeutic use in non-insulin – dependent diabetes mellitus. Drugs 1995;49(5):721-749. PMID: 7601013.
22. González-Ortiz M, Guerrero-Romero JF, Violante-Ortiz R, Wacher-Rodarte N, Martínez-Abundis E, Aguilar-Salinas C, Islas-Andrade S, Arechavaleta-Granell R, González-Canudas J, Rodríguez-Morán M, Zavala-Suárez E, Ramos-Zavala MG, Metha R, Revilla-Monsalve C, Beltrán-Jaramillo TJ. Efficacy of glimepiride/metformin combination versus glibenclamide/metformin in patients with uncontrolled type 2 diabetes mellitus. J Diabet Complicat 2009;23(6):376-379. doi: 10.1016/j.jdiacomp.2008.09.002.
23. Gu N, Kim BH, Rhim H, Chung JY, Kim JR, Shin HS, Yoon SH, Cho JY, Shin SG, Jang IJ, Yu KS. Comparison of the bioavailability and tolerability of fixed dose combination glimepiride/metformin 2/500-mg tablets versus separate tablets: A single-dose, randomized-sequence, open-label, two-period, crossover study in healthy, Korean volunteers. Clin Ther 2010;32(7): 1408-1418. doi: 10.1016/j.clinthera.2010.07.012.
24. Gusler G, Gorsline J, Levy G, Zhang SZ, Weston IE, Naret D, Berner B. Pharmacokinetics of a metformin gastric-retentive tablets in healthy volunteers. J Clin Pharmacol. 2001;41(6):655-661. doi: 10.1177/00912700122010546.
25. Hermann LS, Scherstén B, Bitzén PO, Kjellström T, Lindgärde F, Melander A. Therapeutic comparison of metformin and sulfonylurea, alone and in various combinations. A double blind controlled study. Diabetes Care 1994;17(10):1100-1109. PMID: 7821128.
26. Holman RR, Paul SK, Bethel MA, Neil HA, Matthews DR. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008;359:1577-1589. doi:10.1056/NEJMoa0806470.
27. Hwang YC, Kang M, Ahn CW, Park JS, Baik SH, Chung DJ, Jang HC, Kim KA, Lee IK, Min KW, Nam M, Park TS, Son SM, Sung YA, Woo JT, Park KS, Lee MK. Efficacy and safety of glimepiride/metformin sustained release once daily vs. glimipiride/metformin twice daily in patients with type 2 diabetes. Int J Clin Pract 2013;67(3): 236-243. doi: 10.1111/ijcp.12071.
28. International Diabetes Federation. Diabetes Atlas. 6th edition Brussels Belgium: International Diabetes Federation; 2013.
29. Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, Peters AL, Tsapas A, Wender R, Matthews DR. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015;38:140-149. doi: 10.2337/dc14-2441.
30. Javaz SAA, Soewondo P, Wang E, Admane K. PERSISTence on Glimepiride-Metformin (Amaryl M®) fixed combination in everyday practice in asian type 2 diabetes patients // 72nd Scientific sessions of American Diabetes Assoaciation, 8-12 June 2012, Philadelphia, USA. – Abstract 1124-P.
31. Johnson SB. Methodological issues in diabetes research. Measuring adherence. Diabetes Care 1992;15(11):1658-1667. PMID: 1468298.
32. Jojima T, Suzuki K, Hirama N, Uchida K, Hattori Y. Glimepiride upregulates eNOS activity and inhibits cytokine-induced NF-kappaB activation through a phosphoinoside 3-kinase-Akt-dependent pathway. Diabetes Obes Metab 2009; 11:143-149. doi:10.1111/j.1463-1326.2008.00923.x.
33. Kim BH, Shin KH, Kim J, Lim KS, Kim KP, Kim JR, Cho JY, Shin SG, Jang IJ, Yu KS. Pharmacokinetic comparison of a new glimepiride 1-mg + metformin 500-mg combination tablet formulation and a glimepiride 2-mg + metformin 500-mg combination tablet formulation: a single-dose, randomized, open-label, two-period, two-way, crossover study in healthy, fasting Korean male volunteers. Clin Ther 2009;31(11): 2755-2764. doi: 10.1016/j.clinthera.2009.11.001.
34. Kim HS, Kim DM, Cha BS, Park TS, Kim KA, Kim DL, Chung CH, Park JH, Jang HC, Choi DS. Efficacy of glimepiride/metformin fixed dose combination vs metformin uptitration in type 2 diabetic patients inadequately controlled on low dose metformin monotherapy: A randomized open-label, parallel group, multicenter study in Korea. J Diabetes Invest 2014;5(6):701-708. doi: 10.1111/jdi.12201.
35. Kim KP, Lim KS, Kim BH, Shin HS, Cho JY, Shin SG, Jang IJ, Yu KS. Pharmacokinetics of a fixed-dose glimepiride/sustained-release metformin combination. Int J Clin Pharmacol Ther 2012;50(2):142-149. doi: 10.5414/CP201598.
36. Kim YD, Park KG, Lee YS, Park YY, Kim DK, Nedumaran B, Jang WG, Cho WJ, Ha J, Lee IK, Lee CH, Choi HS. Metformin inhibits hepatic gluconeogenesis through AMP-activated protein kinase-dependent regulation of the orphan nuclear receptor SHP. Diabetes 2008;57(2): 306-314. doi: 10.2337/db07-0381
37. Koshiba K, Nomura M, Nakaya Y, Ito S. Efficacy of glimepiride on insulin resistance, adipocytokines, and atherosclerosis. J Med Invest 2006;53:87-94. doi:10.2152/jmi.53.87
38. Lee SH, Lee IK, Baik SH, Choi DS, Park KS, Song KH, Lee KW, Cha CW, Lee HW, Chung CH, Nam MS, Baek HS, Kim HY, Rhim HY, Son HY. Comparison of the efficacy and safety of glimepiride/metformin fixed combination versus free combination in patients with type 2 diabetes. multicenter, randomized, controlled trial. J Korean Diabetes Assoc 2006;30(6): 466-475. doi: 10.4093/jkda.2006.30.6.466.
39. Lee TM, Chou TF. Impairment of myocardial protection in type 2 diabetic patients. J Clin Endocrinol Metab 2003;88:531-537. doi: 10.1210/jc.2002-020904.
40. Lewin A, Lipetz R, Wu J, Schwartz S. Comparison of extended-release metformin in combination with a sulfonylurea (glyburide) to sulfonylurea monotherapy in adult patients with type 2 diabetes: multicenter, double-blind, randomized, controlled, phase III study. Clin Ther 2007;29(5): 844-855. doi: 10.1016/j.clinthera.2007.05.013.
41. Marathe PH, Arnold ME, Meeker J, Greene DS, Barbhaiya RH. Pharmacokinetics and bioavailability of a metformin/gliburide tablet administered alone and with food. J Clin Pharmacol 2000;40:1494-1502. doi: 10.1177/009127000004001222.
42. Melikian C, White TJ, Vanderplas A, Dezii CM, Chang E. Adherence to oral antidiabetic therapy in a managed care organization: a comparison of monotherapy, combination therapy, and fixed-dose combination therapy. Clin Ther 2002;24(3):460-467. PMID: 11952029.
43. Nakamura I, Oyama J, Komoda H, Shiraki A, Sakamoto Y, Taguchi I, Hiwatashi A, Komatsu A, Takeuchi M, Yamagishi S, Inoue T, Node K. Possible effects of glimepiride beyond glycemic control in patients with type 2 diabetes: a preliminary report. Cardiovasc Diabetol 2014;13:2014. doi:10.1186/1475-2840-13-15
44. Noel DS. Kinetic study of normal and sustained release dosage forms of metformin in normal subjects. J Int Biomed Inform Data 1980;1:9-20.
45. Nyenwe EA, Jerkins TW, Umpierrez GE, Kitabchi AE. Management of type 2 diabetes: evolving strategies for the treatment of patiens with type 2 diabetes. Metabolism 2011;60(1):1-23. doi: 10.1016/j.metabol.2010.09.010.
46. Pan F, Chernew ME, Fendrick AM. Impact of fixed-dose combination drugs on adherence to prescipton medications. J Gen Intern Med. 2008;23(5): 611-614. doi: 10.1007/s11606-008-0544-x
47. Rendell M. The role of sulfonylureas in the management of type 2 diabetes mellitus. Drugs 2004;64(12):1339-1358. PMID: 15200348.
48. Rozenfeld Y, Hunt JS, Plauschinat C, Wong KS. Oral antidiabetic medication adherence and glycemic control in managed care. Am J Manag Care 2008;14(2):71-75. PMID: 18269302.
49. Sambol NC, Chiang J, Lin ET, Goodman AM, Liu CY, Benet LZ, Cogan MG. Kidney function and age are both predictors of pharmacokinetics of metformin. J Clin Pharmacol 1995;35: 1094-1102. doi: 10.1002/j.1552-4604.1995.tb04033.x.
50. Schiekofer S, Rudofsky G Jr, Andrassy M, Schneider J, Chen J, Isermann B, Kanitz M, Elsenhans S, Heinle H, Balletshofer B, Häring HU, Schleicher E, Nawroth PP, Bierhaus A. Glimepiride reduces mononuclear activation of the redox-sensitive transcription factor nuclear factor-kappa B. Diabetes Obes Metab 2003;5(4):251-261. doi: 10.1046/j.1463-1326.2003.00270.x.
51. Shin KH, Kim SE, Yoon SH, Cho JY, Jang IJ, Shin SG, Yu KS. Pharmacokinetic comparison of a new sustained-release formulation of glimepiride/metformin 1/500 mg combination tablet and a sustained-release formulation of glimepiride/metformin 2/500 mg combination tablet in healthy korean male volunteers: a randomized, 2-sequence, 2-period, 2-treatment crossover study. Clin Therap 2011;33:1809-1818. doi: 10.1016/j.clinthera.2011.10.003.
52. Srivastava K, Arora A, Kataria A, Cappelleri JC, Sadosky A, Peterson AM. Impact of reducing dosing frequency on adherence to oral therapies: a literature review and meta-analysis. Patient Prefer Adherence 2013;7:419-434. doi: 10.2147/PPA.S44646.
53. Timmins P, Dennis AB, Vyas KA, inventors. Bristol-Myers Squibb Company, assignee. Biphasic controlled release delivery system for high solubility pharmaceuticals and method. US patent 6, 475, 521. 5 Nov 2002.
54. Timmins P, Donahue S, Meeker J, Marathe P. Steady-state pharmacokinetics of a novel extended-release metformin formulation. Clin Pharmacokinet 2005;44(7):721-729. doi: 10.2165/2F00003088-200544070-00004.
55. Turner RC, Cull CA, Frighi V, Holman RR, UK Prospective Diabetes Study (UKPDS) Group. Glycemic control with diet, sulfonylurea, metformin or insulin in patients with type 2 diabetes mellitus: progressive requirement for multiple therapies (UKPDS 49). JAMA 1999;281(21):2005-2012. doi: 10.1001/jama.281.21.2005.
56. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulfonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998;352(9131):837-853. doi: 10.1016/S0140-6736(98)07019-6.
57. UK Prospective Diabetes Study (UKPDS) Group. UKPDS 28: a randomized trial of efficacy of early addition of metformin in sulfonylurea-treated type 2 diabetes. Diabetes Care 1998;21(1):87-92. PMID: 9538975.
58. UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998;352(9131):854-865. doi: 10.1016/S0140-6736(98)07037-8.
59. Umpierrez G, Issa M, Vlajnic A. Glimepiride versus Pioglitazone combination therapy in subjects with type 2 diabetes inadequately controlled on metformin monotherapy: Results of a randomized clinical trial. Curr Med Res Opin 2006;22(4):751-759. doi: 10.1185/030079906X104786.
60. Weitgasser R, Lechleitner M, Luger A, Klingler A. Effects of glimepiride on HbA(1c) and body weight in type 2 diabetes: Results of a 1.5-year follow-up study. Diabetes Res Clin Pract 2003;61(1):13-19. doi: 10.1016/S0168-8227(02)00254-1.
61. Yu K-S, Handok Pharmaceuticals company Ltd. Seoul, Korea. - Bull Korean Chem Soc. 2011;(41):22-28.
/70.jpg)
/74.jpg)
/74_2.jpg)

/71.jpg)
/72.jpg)
/73.jpg)
/76.jpg)
/77.jpg)