Статья опубликована на с. 110-115
Цукровий діабет (ЦД) становить серйозну медико-соціальну проблему, обумовлену високою поширеністю, тенденцією до збільшення числа хворих, хронічним перебігом, високою інвалідизацією і значними економічними витратами [1]. Відзначається значне зростання захворюваності практично в усіх країнах світу. В Україні поширеність ЦД на початку 2015 р. становила 2,8 % [2]. За прогнозами фахівців, число хворих на ЦД подвоюється в усьому світі кожні 12–15 років, тобто можна стверджувати про пандемію ЦД серед дорослого населення. Особливу проблему становлять ускладнення ЦД, зокрема діабетична полінейропатія, ретинопатія, нефропатія та ін.
Синдром діабетичної стопи (СДС) належить до найтяжчих хронічних ускладнень ЦД і є провідною причиною госпіталізації хворих [3].
Порівняльний аналіз показує, що ампутації нижніх кінцівок у пацієнтів із СДС здійснюєються у 30 разів частіше, ніж в осіб без ЦД. Важливо підкреслити, що розвиток гнійно-деструктивних змін на фоні СДС більше ніж у 50–70 % випадків призводить до нетравматичних ампутацій [4]. Пацієнти із СДС і виразками в анамнезі мають значний ризик летального кінця впродовж 10 років. Фінансові витрати на пацієнтів із СДС становлять мільярди доларів [5].
У багатьох дослідженнях було виділено низку факторів ризику ймовірного розвитку і рецидивування виразок на стопі. Так, за даними досліджень, сенсомоторна нейропатія, деформація стоп, наявність виразок і/або ампутацій в анамнезі, ангіопатія нижніх кінцівок відіграють головну роль серед факторів ризику [6]. Вплив інших факторів, таких як рівень глікованого гемоглобіну (HbA1c), показників ліпідного спектра крові, згортальної системи крові, артеріального тиску (АТ) тощо залишається дискутабельним і потребує подальших додаткових досліджень.
У зв’язку з цим актуальною є оцінка ролі показників метаболізму як можливих факторів, що впливають на процес загоєння виразкових дефектів і віддалені результати лікування.
Мета дослідження — визначити можливі модифіковані фактори ризику, що впливають на розвиток і перебіг виразкових дефектів стоп у хворих із синдромом діабетичної стопи.
Матеріали та методи
Дослідження проведене на базі Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України і Броварської центральної районної лікарні.
У дослідження було включено 155 пацієнтів із виразковими дефектами стоп віком від 39 до 79 років (61,2 ± 8,2 року). Серед них — 59 жінок (38,1 %) і 96 чоловіків (61,9 %). Із ЦД 1-го типу було 37 хворих (23,9 %), ЦД 2-го типу — 118 хворих (76,1 %). До групи хворих із СДС увійшли пацієнти, які перебували на стаціонарному лікуванні в хірургічному відділенні Броварської ЦРЛ у період з 2009 по 2014 р.
Критерієм включення в дослідження була наявність СДС. Використовували карту спостереження з детальною оцінкою анамнезу захворювання, способу життя, наявності шкідливих звичок, супутньої патології та ін.
Загальноклінічні методи дослідження включали загальний аналіз крові, загальний аналіз сечі, розгорнутий біохімічний аналіз крові з використанням стандартних методів лабораторної діагностики. Компенсацію вуглеводного обміну оцінювали за допомогою визначення HbA1c і систематичного контролю за рівнем глікемії.
Стан параметрів ліпідного спектра досліджували за допомогою стандартних методик. У процесі роботи здійснювали оцінку загального холестерину (ЗХС), холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), тригліцеридів (ТГ).
Для оцінки згортальної системи крові визначали показники активного часткового тромбопластинового часу (АЧТЧ), протромбіновий індекс (ПТІ). Для об’єктивізації невропатичних скарг пацієнтів із СДС використовували шкали: TSS (Total Symptom Score, загальний симптоматичний рахунок) і візуальну аналогову шкалу (ВАШ). TSS включає оцінку в балах чотирьох симптомів: стріляючого болю, печії, парестезій та оніміння в ділянці стоп або гомілок (позитивні ней-ропатичні чутливі симптоми). Оцінка за TSS бувала в межах від 0 (симптомів немає) до 14,78 бала (всі симптоми, що зберігаються практично постійно). За ВАШ оцінювали больові відчуття пацієнта, проводили вимірювання віддалі сантиметровою лінійкою з лівого краю на правий і виставляли бали больової симптоматики.
Для оцінки ступеня сенсорного дефіциту використовували клінічні неврологічні тести (КНТ), відображені в шкалі NDS (Neuropathy Disability Score) (Young M., 1993). Тактильна чутливість визначалася з допомогою 10 г монофіламенту Земмеса — Вейнштейна. Тестування проводили в трьох загальноприйнятих зонах стопи.
Вібраційну чутливість оцінювали за допомогою градуйованого камертона, що вібрує з частотою 128 Гц. Результат вказували в октавах (8/8) та здійснювали інтерпретацію під шкалу NDS. Показники 6/8 і більше розцінювали як норму, менше 6/8 — свідчили про зниження вібраційної чутливості. Отримані дані заносили в шкалу NDS.
Температурну чутливість оцінювали за здатністю пацієнта розрізняти дотик холодної і теплої частин спеціального приладу. Больову чутливість враховували за допомогою уколу неврологічною голкою в проекціях першого і п’ятого плюснефалангових суглобів і на підо-
шовній поверхні великого пальця. Згідно зі шкалою NDS проводили оцінку ахіллового рефлексу за стандартною методикою.
Інтерпретацію даних за шкалою NDS здійснювали відповідно до рекомендацій дослідницької групи Neurodiab при Європейській асоціації з вивчення цукрового діабету. Діагноз «полінейропатія» не встановлювали, якщо сума балів становила до 2, сума балів від 3 до 5 відповідає легкому ступеню сенсорних розладів, від 6 до 8 — середньому, 9 або 10 — тяжкому ступеню.
Оцінку стану магістрального кровотоку в нижніх кінцівках проводили за допомогою ультразвукової допплерографії Hitachi EUB-5500 (лінійним датчиком EUP-L54 MA-13-6 МГц), у частини хворих проведено рентгеноконтрастну артеріографію. Частота ультразвукового сигналу датчика становила 7,5 МГц. Кісточково-плечовий індекс (КПІ) обчислювали як відношення величини систолічного АТ в артеріях нижньої кінцівки до величини систолічного АТ плечовій артерії. Показник КПІ 0,98 і вище розглядався як норма; 0,7–0,97 — легкий ступінь ішемії; 0,4–0,69 — помірна ішемія; менше ніж 0,4 — тяжка ішемія (Donnelly R. et al., 2000; Bowker J., Pfeifer M., 2001; TASC II, 2007). Оцінку виразкових дефектів проводили за методом, запропонованим W. His та ін. у 1993 році. Виразкові дефекти у пацієнтів також вимірювалися за даними площі ураження. Глибину виразкового дефекту визначали візуально і шляхом його зондування. Оцінювали наявність і характер перебігу інфекційного процесу (гострий, хронічний перебіг; легкий, середньої тяжкості та тяжкий перебіг).
Для об’єднання досліджуваних параметрів (наявність виразки, її глибина; наявність інфекції, ішемії кінцівки) була вибрана Техаська класифікація виразкових дефектів, запропонована L.A. Lavaery та ін. у 1996 році (табл. 1).
Усім пацієнтам, включеним у дослідження, проводилася терапія, що відповідає основним стандартам лікування СДС. Залежно від форми, характеру перебігу СДС здійснювалося консервативне та/або хірургічне лікування. Призначалася терапія, спрямована на компенсацію вуглеводного, ліпідного обміну. Місцева терапія включала повне розвантаження кінцівки, адекватну хірургічну обробку виразок, використання сучасних перев’язувальних засобів. Антибактеріальна терапія призначалася з урахуванням посіву з рани на мікрофлору та її чутливості до антибіотиків. Ефективність лікування оцінювали за термінами загоєння виразкових дефектів.
Статистичну обробку отриманих даних проводили за допомогою пакета прикладних програм SPSS Statistics 8.0 (США). Використовували методи непараметричної статистики: z-критерій Вілкоксона, U-критерій Манна — Уїтні, двовибірковий критерій Колмогорова — Смирнова для оцінки вірогідності відмінностей, одновибірковий критерій Стьюдента (t), t-критерій Стьюдента для незалежних вибірок. При порівнянні дискретних величин використовували χ2-критерій. При розгляді понад двох змінних, що належали до однієї і тієї ж вибірки, використовували дисперсійний аналіз із повторними вимірюваннями, а також багатовимірний дисперсійний аналіз. У разі оцінки залежності між змінними використовували метод множинного регресійного аналізу.
Результати та їх обговорення
Клінічне обстеження пацієнтів на етапі включення в дослідження дозволило встановити певні закономірності. У переважного числа хворих при надходженні до стаціонару з приводу СДС відзначалися декомпенсація ЦД (середній рівень HbA1c — 9,49 ± 1,87 %), порушення ліпідного обміну (підвищення рівня ЗХС, ТГ, ХС ЛПНЩ).
Серед 155 хворих, включених у дослідження, лише 23 (14,8 %) отримували гіполіпідемічні препарати. Звертає на себе увагу частота супутньої патології, насамперед серцево-судинних захворювань. Артеріальна гіпертензія (АГ) спостерігалася у 96,1 % обстежених, при цьому лише 44,5 % з них отримували гіпотензивну терапію. У 29 пацієнтів (18,8 %) в анамнезі були дані про гострі порушення мозкового кровообігу. Майже у половини пацієнтів (43,9 %) відзначалася ішемічна хвороба серця (ІХС), у 42 хворих в анамнезі був перенесений інфаркт міокарда. Заслуговує на увагу факт наявності у значної частини обстежених шкідливих звичок, що могли би вплинути на виникнення хронічних ускладнень ЦД, у тому числі СДС. Аналіз шкідливих звичок у хворих показав, що алкоголем зловживали 29 пацієнтів (18,7 %), з них 26 чоловіків і 3 жінки. В обстеженій групі пацієнтів було 98 хворих, які палили (63,2 %), серед них 87 чоловіків і 11 жінок. Середня тривалість паління у цих пацієнтів становила 23,9 ± 2,7 року.
Серед обстежених пацієнтів виявлено 197 виразкових дефектів стоп. При розподілі залежно від патогенезу розвитку встановлено 139 нейропатичних виразкових дефектів і 58 нейроішемічних (ішемічних) виразкових дефектів. Найчастіше виразкові дефекти локалізувалися в передньому відділі стопи (включаючи пальці) — 165 виразок (83,8 %), у середньому відділі — 19 виразок (9,6 %), у задньому відділі — 13 виразок (6,6 %). Ліва стопа була ураженою в 44,5 % випадків, права стопа — у 55,5 %. Середнє значення площі виразкових дефектів становило 46 мм2 (із діапазоном від 4 до 827 мм2).
Аналіз виразок, згідно з Техаською класифікацією СДС, виявив, що I стадія відзначалася у 25,2 % обстежених пацієнтів, II стадія — у 20,6 %, III стадія — у 54,2 %. Ознаки інфекційного процесу спостерігалися у 85,8 % виразок, при I стадії інфікованих виразок було 28 (14,2 %), при II стадії — 34 (17 %3), при III стадії — 135 виразкових дефектів (68,5 %). Зі збільшенням стадії частота інфікованих виразок в обстежених пацієнтів зростала. Велика частина виразкових дефектів характеризувалася ураженням м’яких тканин стопи із залученням до процесу кісткових структур і суглобів та наявністю значного інфекційного й ішемічного компонентів (при III стадії — 60 %). При цьому слід підкреслити, що глибокі та великі за розмірами виразки в усіх випадках супроводжувалися інфекцією. Поєднання клінічно значущої інфекції у виразковому дефекті та ішемії спостерігалося у 19,8 % випадках. Поєднання клінічно значущої ішемії та інфекції на тлі глибокого виразкового дефекту несприятливо впливало як на результат лікування, так і на прогноз для кінцівки.
Нами був проведений порівняльний аналіз включених у дослідження пацієнтів залежно від форми СДС. Маючи на увазі те, що на сьогодні в клінічній практиці прийнято об’єднувати ішемічну та нейро-ішемічну форми СДС, ми порівнювали дві групи пацієнтів. Перша група була представлена пацієнтами з нейропатичною формою — 102 (65,8 %), друга група — 53 (34,2 %) хворі з нейроішемічною формою СДС. У процесі порівняння виявилось, що пацієнти з нейроішемічною формою СДС були більш старшого віку та мали ЦД 2-го типу. У цієї групи пацієнтів спостерігалася відсутність компенсації ЦД, більш виражені порушення ліпідного спектра, що супроводжувалося більшою поширеністю і тяжкістю перебігу макроангіопатії, тяжчим перебігом діабетичної нефропатії на фоні сенсорного дефіциту середнього ступеня тяжкості.
При аналізі поширеності провідних факторів ризику розвитку виразкових дефектів нами встановлено, що сенсомоторний дефіцит спостерігався у більшості обстежених пацієнтів і становив 86,5 %. При цьому більше ніж у половини пацієнтів (51,6 %) була відсутня чутливість до 10 г монофіламенту. Вираженість неврологічного дефіциту за шкалою NDS в обстежених пацієнтів відповідала середньому ступеню (середній бал — 6,43 ± 1,04). Ці факти свідчать про те, що вже за одним фактором ризику (сенсомоторна нейропатія) більшість обстежених пацієнтів мали високу вірогідність рецидиву СДС і появи нових виразкових дефектів. Однак на момент виявлення виразки у пацієнтів було поєднання сенсомоторної нейропатії з іншими факторами ризику — деформацією стоп (43,9 %), наявністю виразок і/або ампутацій в анамнезі (41,9 %/55,5 %), макроангіопатією (38,1 %).
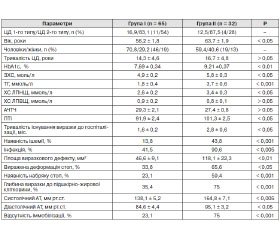
Нами проаналізовані причини, що впливають на швидкість загоєння виразкових дефектів на фоні проведеної терапії. З цією метою 97 пацієнтів були розподілені на групи залежно від терміну загоєння виразки. У першу групу були включені пацієнти з терміном загоєння виразкового дефекту до 8 тижнів, у другу групу — з терміном загоєння понад 8 тижнів (табл. 2).
Результати порівняльного аналізу свідчать про те, що серед пацієнтів із тривалим терміном загоєння переважали особи більш старшого віку (р < 0,05); зі значною тривалістю існування виразок до моменту госпіталізації (p < 0,05), зі значущою ішемією (p < 0,01), із більшою площею і глибиною виразкового дефекту (p < 0,01), наявністю інфекції (p < 0,005), з більш вираженою деформацією стопи (p < 0,05).
Нами вивчено вплив корекції модифікованих факторів на ефективність лікування. У зв’язку з цим був проведений порівняльний аналіз між двома групами на підставі показників вуглеводного і ліпідного обміну, реологічних властивостей крові, ступеня корекції АГ. Встановлено, що пацієнти з виразковими дефектами, які тривало не загоюються, характеризувалися незадовільним контролем ЦД. У них рівень HbA1c був вірогідно вищий, ніж у групі з коротшим терміном загоєння виразки (9,21 ± 0,37 % проти 7,69 ± 0,34 %; p < 0,01).
У цій групі відзначалися більш виражені порушення ліпідного обміну, зокрема вірогідно вищі показники ХС ЛПНЩ (p < 0,05), ЗХС (р < 0,05), ТГ (p = 0,001). Досліджувані показники реологічних властивостей крові не зазнали істотних змін на фоні лікування. Показники АЧТЧ в обох групах статистично вірогідно не відрізнялися, однак ПТІ був вищий у пацієнтів із більш тривалим терміном загоєння виразкових дефектів. Рівень АТ також вірогідно був вищий у пацієнтів другої групи.
Крім того, нами проведений аналіз місцевих факторів, що впливають на процес загоєння виразок, із використанням методу множинної регресії. У модель входили такі фактори — інфекція в рані, площа і глибина ураження, наявність макроангіопатії нижніх кінцівок (оцінка за КПІ), деформація стоп, вплив навантаження, набряк стопи. З усіх факторів найбільше значення мала інфекція в рані (43,3 %), на частку глибини ураження припадало 37,1 %, надмірного навантаження на стопу через неадекватне використання ортопедичних засобів — 16,5 %, макроангіопатії (за значенням КПІ) — 8,2 %, на набряк і деформацію стоп припадало 4,1 %.
Отже, найбільш значущо впливали на швидкість загоєння виразки наявність інфекції, глибина і площа виразкового дефекту. Слід зазначити, що хоча деформація стопи і макроангіопатія належать до факторів ризику виникнення виразки, вплив їх на процес загоєння менш значний.
На завершальному етапі дослідження нами проведено порівняльний аналіз пацієнтів із СДС залежно від дотримання і виконання рекомендацій лікуючого лікаря стосовно консервативної терапії. Після закінчення спостереження до групи з високою прихильністю до терапії (перша група) було віднесено 22 хворих, до групи з низькою прихильністю (друга група) до лікування — 19 хворих. В аналіз не включали осіб зі значущою ішемією (з нейроішемічною формою СДС), гнійно-деструктивним перебігом СДС, вираженою деформацією стоп, оскільки ці показники могли істотно вплинути на результат. Показники вивчалися при первинному надходженні до стаціонару і кожні три місяці впродовж двох років після загоєння ранового дефекту.
На момент включення пацієнтів у дослідження обидві групи вірогідно не розрізнялися за ступенем компенсації ЦД. При цьому рівень HbA1c перевищував 8 % (8,4 ± 0,5 % у першій групі та 8,6 ± 0,6 % у другій групі). Впродовж терміну спостереження показники HbA1c істотно відрізнялися в обох групах. Так, у першій групі рівень HbA1c перебував у межах цільових значень на відміну від пацієнтів другої групи (7,2 проти 7,9 %; p < 0,05).
Вірогідні відмінності між групами спостерігалися і при порівнянні показників ліпідограми. До включення в дослідження в обох групах відзначалася відсутність цільових значень показників ліпідного спектра. В процесі спостереження встановлено, що у пацієнтів першої групи досягнуто цільових значень ЗХС, ХС ЛПНЩ, ТГ, ХС ЛПВЩ, що вірогідно відрізнялися від показників пацієнтів другої групи. Стосовно показників згортальної системи крові встановлено вірогідну різницю в досліджуваних групах лише за рівнем ПТІ (p < 0,05). Середній рівень АТ був вірогідно вищим у пацієнтів, які входили до другої групи (p < 0,05).
Слід зазначити, що хворі першої групи дотримувалися й інших рекомендацій з лікування. Так, усі хворі першої групи регулярно використовували ортопедичні пристосування (взуття, устілки), а серед пацієнтів другої групи — лише 27 %.
У пацієнтів першої групи на фоні стабільної компенсації ЦД і досягнення цільових значень ліпідного спектра крові й АТ із регулярним використанням ортопедичних пристосувань було зафіксовано появу тільки одного нового виразкового дефекту і відсутність будь-яких ампутацій нижніх кінцівок впродовж терміну спостереження.
У пацієнтів другої групи без стабільної компенсації ЦД, цільових значень ліпідного спектра крові й АТ, без регулярного використання ортопедичних пристосувань впродовж терміну спостереження було встановлено 11 нових виразкових дефектів, 3 рецидиви виразки, проведено 5 ампутацій у межах стопи.
При відмінності груп за такими метаболічними показниками, як HbA1c, ліпідний спектр крові (ЗХС, ХС ЛПНЩ, ХС ЛПВЩ, ТГ), ПТІ, рівень АТ, використання індивідуальних розвантажувальних засобів, групи не відрізнялися практично за усіма основними факторами ризику СДС — наявності ампутацій в анамнезі, тривалості існування виразкового дефекту до лікування, ступеня інфікування виразок, а також частоти глибоких виразкових дефектів.
Отже, проведене нами дослідження показало, що стабільна компенсація ЦД, досягнення цільових значень ліпідного спектра крові, АТ значно покращують віддалений прогноз захворювання (зменшення рецидивування виразкових дефектів стоп). Тому доцільно виділити групу ризику стосовно несприятливого перебігу СДС із ризиком ампутації, до якої належать хворі з глибокими виразковими дефектами та макроангіопатією нижніх кінцівок.
Висновки
1. У більшості хворих на цукровий діабет при надходженні до стаціонару з приводу синдрому діабетичної стопи відзначаються тривала декомпенсація ЦД (HbA1c — 9,21 ± 0,37 %), порушення ліпідного обміну (підвищення рівня ЗХС, ТГ, ХС ЛПНЩ) і супутня серцево-судинна патологія (ІХС, АГ).
2. Формування сенсомоторної нейропатії у пацієнтів із ЦД — основний фактор ризику утворення виразкових дефектів стоп. На момент виявлення виразки у більшості пацієнтів спостерігається поєднання сенсомоторної нейропатії з іншими факторами ризику — деформацією стоп, наявністю виразок і/або ампутацій в анамнезі, макроангіопатією.
3. Наявність інфекції у виразковому дефекті належить до значущого фактора ризику несприятливого перебігу СДС.
4. Досягнення стабільної компенсації ЦД, цільових значень ліпідного спектра крові й АТ дозволяють в коротші терміни забезпечити загоєння виразкових дефектів. Постійний моніторинг цих показників зменшує ризик розвитку нових і рецидиву старих виразкових дефектів.

/112.jpg)
/113.jpg)