Статья опубликована на с. 125-129
Патологія кістково-м’язової системи є однією з найбільш значущих медичних проблем із вираженим впливом на економіку, здоров’я та якість життя людей. Висока поширеність остеопоротичних переломів кісток скелета в популяції підкреслює її важливість. Якщо в 1990 р. у світі було зареєстровано 1,7 млн таких випадків, то в 1999 р. — 2,5 млн, а до 2050 р. прогнозується 6 млн випадків остеопоротичних переломів щорічно [1]. При цьому переломи проксимального відділу стегнової кістки, як найтяжче ускладнення системного остеопорозу, характеризуються дуже високою смертністю — впродовж перших шести місяців після перелому вона досягає 30 % [2].
Попри те, що останнім часом інтенсивно вивчаються різні аспекти остеопорозу як за кордоном, так і в нашій країні, багато питань залишаються нез’ясованими. Виникають і цілком нові теорії, пов’язані з патогенезом остеопорозу. Щоразу більше накопичується даних про взаємозв’язок між остеопорозом, порушенням обміну кальцію, вітаміну D і такими захворюваннями, як атеросклероз, цукровий діабет, гіпо- та гіпертиреоз [3, 4].
У пацієнтів із гіпотиреозом уповільнюється кісткове ремоделювання, у 2–3 рази знижена швидкість обох складових ремоделюючого циклу — кісткової резорбції і кісткового формування [5]. Окремі автори вказували, що у жінок репродуктивного віку при нелікованому первинному гіпотиреозі виявляються ознаки уповільнення кісткоутворення і кісткової резорбції за відсутності змін мінеральної щільності кісткової тканини (МЩКТ) [6]. Однак інші дослідники повідомляють, що у таких хворих відбуваються потовщення поверхневого шару клубової кістки, ущільнення склепіння основи черепа зі зникненням губчастої речовини [7].
Встановлені значущі фактори ризику розвитку вторинного остеопорозу у жінок із гіпотиреозом: маса тіла до 60 кг, індекс маси тіла (ІМТ) до 27,5 кг/м2, прийом замісної гормональної терапії левотироксином у добовій дозі понад 75 мкг/добу, тривалість прийому цих препаратів понад 5 років, стан компенсації гіпотиреозу [8]. Дані літератури показують, що питання про вплив гіпотиреозу на стан кісткової тканини вивчене недостатньо.
На сьогодні значна увага приділяється метаболічним факторам, здатним спричинити дисфункцію або ушкодження ендотелію. Число таких факторів збільшується при накопиченні знань і можливостей лабораторної діагностики (С-реактивний білок (СРБ), фактор Віллебранда (фВ), інтерлейкін-6, фібриноген, фактор некрозу пухлини, тканинний інгібітор активатора плазміногену та ін.). Деякі дослідники зараховують ці метаболічно активні речовини до так званих неліпідних факторів ризику серцево-судинних захворювань [9]. При цьому особливе значення має фВ плазми крові [10], що не вивчений як пре-диктор ризику розвитку остеопоротичного процесу.
Мета дослідження — оцінити значення фВ як маркера ендотеліальної дисфункції у формуванні та прогнозуванні ризику розвитку остепоротичного процесу в жінок із гіпотиреозом.
Матеріали та методи
В одномоментне дослідження за типом «випадок — контроль» було включено 67 жінок віком від 52 до 74 років із первинним гіпотиреозом у постменопаузальному періоді. Середній вік обстежених становив 61,7 ± 6,2 року.
Критерії включення у дослідження: жінки з первинним гіпотиреозом віком від 52 до 74 років, наявність менопаузи не менше двох років.
Критерії виключення: наявність в анамнезі та/або при обстеженні ознак захворювань, що призводять до розвитку вторинного остеопорозу (онкологічна патологія, тиреотоксикоз, ендогенний гіперкортицизм, гіперпаратиреоз, цукровий діабет 1-го типу, ревматоїдний артрит, системний червоний вовчак, дерматоміозит, синдром мальабсорбції, хронічна ниркова і/або печінкова недостатність, захворювання крові, хронічні обструктивні захворювання легень, алкоголізм, прийом глюкокортикоїдів, хронічна недостатність кровообігу III–IV ступеня).
Загальноклінічне та клініко-інструментальне обстеження для визначення стану пацієнток включало збір скарг та анамнезу, вимірювання росту, маси тіла, окружності талії і стегон, визначення ІМТ. На базі Українського науково-медичного центру проблем остеопорозу проведено дослідження маркерів кісткового ремоделювання — бета-термінальних С-телепептидів колагену 1-го типу (β-СТх), маркерів гормональної регуляції — паратгормону (ПТГ) і вітаміну D загального, а також показників мінерального обміну (кальцій, фосфор). Активність фВ визначали імуноферментним методом із використанням комерційного набору фірми Shield diagnostics (Великобританія). Крім цього, проводили дослідження концентрації СРБ, загального холестерину (ЗХС), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), а також тригліцеридів (ТГ).
МЩКТ встановлювали з використанням двофотонної рентгенівської абсорбціометрії (ДРА) на апараті Lunar Prodigy Primo фірми General Electric (США). Вимірювання проводилося за двома ділянками: поперековий відділ хребта і проксимальний відділ стегнової кістки. За класифікацією ВООЗ значення МЩКТ розцінювалися як нормальні за Т-критерієм понад –1,0 SD, остеопенія відповідала значенням від –1,0 до –2,4 SD, остеопороз — значенням ≤ –2,5 SD.
Статистичний аналіз проводився за допомогою пакета прикладних програм Statistica 6.0 з використанням методів простої описової статистики. Результати подані у вигляді середніх значень (M) і середніх квадратичних відхилень (SD) для кількісних ознак, що мають нормальний розподіл, медіани (Me) та інтерквартильного інтервалу [25%; 75%] для неправильно розподілених аналізованих ознак. Аналіз взаємозв’язку двох ознак проводили з використанням непараметричного кореляційного аналізу за методом Спірмена. Результати цього аналізу представлені коефіцієнтом кореляції r і значенням р. Для порівняння двох незалежних груп використаний непараметричний критерій Манна — Уїтні. Відмінності вважали вірогідними при значенні р < 0,05.
Результати та їх обговорення
Основна група дослідження сформована з 67 пацієнток (середній вік 61,7 ± 6,2 року) з первинним гіпотиреозом. Розподіл пацієнток за віком в основній групі:
— від 52 до 60 років — 26 (38,8 %);
— від 61 до 70 років — 31 (46,3 %);
— понад 70 років — 10 (14,9 %).
Всі пацієнтки перебували в постменопаузальному періоді. Тривалість постменопаузи на момент обстеження становила 11,2 [6,0; 17,0] року.
До групи контролю увійшло 20 жінок постменопаузального періоду віком від 53 до 64 років, без клінічних та інструментальних ознак патології щитоподібної залози (ЩЗ) і остеопоротического процесу. Середній вік у групі — 59,7 ± 4,1 року. Тривалість –постменопаузи на момент обстеження становила 10,5 [5,0; 14,0] року.
Жінки основної групи залежно від значень МЩКТ, згідно з даними ДРА, були розподілені за трьома підгрупами. Першу підгрупу становили жінки з нормальними показниками МЩКТ (n = 22), другу підгрупу — 27 жінок з остеопенією, третю підгрупу — 18 жінок з остеопорозом.
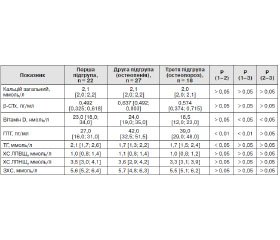
При аналізі основних клінічних характеристик у жінок основної групи залежно від показників МЩКТ встановлено, що середній вік пацієнток з остеопенією та остеопорозом був вірогідно вищим (p < 0,05), ніж у жінок із нормальними значеннями МЩКТ. Подібна закономірність прослідковується і для тривалості постменопаузального періоду (p < 0,05), що пов’язано з більш старшим віком пацієнток у групах з остеопорозом та остеопенією (табл. 1). Крім того, пацієнтки з остеопорозом проксимального відділу стегнової кістки та з остеопенічним синдромом у цій же зоні мали вірогідно нижчий ІМТ порівняно з жінками з нормальною МЩКТ (p < 0,05).
Відомо, що до незалежних факторів ризику розвитку остеопорозу належить ІМТ нижче 20 кг/м2. Серед обстежених пацієнток не виявилося жінок із низьким ІМТ, при цьому понад 75 % осіб мали надмірну масу тіла або ожиріння. Середній ІМТ у групі з остеопорозом та остеопенією мав тенденцію (p > 0,05) до зниження порівняно з показниками пацієнток із нормальною МЩКТ (табл. 1), однак без досягнення статистичної значущості.
Нами проведений аналіз динаміки змін лабораторних показників залежно від значень МЩКТ у жінок основної групи (табл. 2).
Встановлено, що за наявності остеопорозу проксимального відділу стегна вміст вітаміну D вірогідно нижчий порівняно з групою з остеопенією і нормальною МЩКТ у цій же ділянці (p < 0,05). Концентрація ПТГ у групі з нормальними значеннями МЩКТ була вірогідно нижчою (p < 0,01) порівняно з групами з остеопорозом та остеопенією проксимального відділу стегна. Крім того, спостерігається вірогідне зниження вмісту ТГ у групі з остеопенією проксимального відділу стегна порівняно з показником в осіб із нормальною МЩКТ, а також при остеопорозі поперекового відділу хребта порівняно з нормальною МЩКТ (p < 0,05).
У табл. 3 наведені показники вмісту СРБ і фВ у 67 жінок основної групи і 20 жінок із групи конт-ролю.
При дослідженні маркерів запалення й активації судинного ендотелію виявлено, що в групі жінок із гіпотиреозом і зниженням МЩКТ концентрація СРБ була вірогідно вищою, ніж у групі контролю. Значення фВ не розрізнялися в групах порівняння.
При дослідженні взаємозв’язку цих показників залежно від ступеня зниження МЩКТ у жінок основної групи (табл. 4) встановлено, що концентрація СРБ не відрізнялася між групами порівняння.
Нами встановлені вірогідно більш високі значення фВ у жінок з остеопенією порівняно з групою пацієнток з остеопорозом і нормальною МЩКТ (p < 0,05).
В осіб з остеопорозом у проксимальному відділі стегнової кістки концентрація СРБ вірогідно вища порівняно з групою жінок із нормальною МЩКТ (p < 0,05), але нижча, ніж у групі жінок з остеопенією (p < 0,05) (табл. 5).
Відзначається також тенденція до збільшення активності фВ при остеопорозі в проксимальному відділі стегнової кістки. Однак показник не досягає вірогідних відмінностей (p > 0,05). Нами встановлено, що в групі пацієнток із гіпотиреозом рівень СРБ вірогідно вищий, однак не залежить від показника МЩКТ.
Отже, нами встановлено вірогідне підвищення концентрації маркера активації ендотелію судин — фВ при остеопенії хребта, тобто на початкових стадіях зниження МЩКТ у хворих на первинний гіпотиреоз. Кісткова тканина хребта належить до трабекулярних і страждає на початку патологічного процесу. Тому можна припустити, що за наявності гіпотиреозу формування кісткових втрат запускається за участю механізму гіпоксії кістки і вироблення при цьому молекул, що призводять до активації механізмів зниження МЩКТ.
У той же час більш стійка кортикальна кістка, що міститься в проксимальному відділі стегна, уражається на подальших етапах розвитку остеопорозу. У проведеному дослідженні виявлено підвищення рівня СРБ при остеопенічному синдромі в кортикальній кістці. Це підкреслює значення фВ як раннього маркера започаткування втрати кісткової маси у хворих на гіпотиреоз, а СРБ — більш пізнього маркера, асоційованого з втратою маси кортикальної кістки.
Висновки
1. У жінок постменопаузального періоду з гіпотиреозом встановлено вірогідне збільшення концентрації фВ при остеопенії в поперековому відділі хребта.
2. Рівень СРБ вірогідно підвищений у жінок пост-менопаузального періоду з гіпотиреозом у поєднанні з остеопорозом проксимального відділу стегнової кістки.
3. Високі концентрації фВ у жінок із гіпотиреозом слід розглядати як предиктор ризику розвитку остеопоротичного процесу.
4. Підвищений рівень СРБ належить до несприятливих прогностичних ознак щодо зниження МЩКТ.
Список литературы
1. Dhanwal D.K., Dennison E.M., Harvey N.C., Cooper C. Epidemiology of hip fracture: Worldwide geographic variation // Indian J. Orthop. — 2011. — Vol. 45(1). — P. 15-22. doi: 10.4103/0019-5413.73656.
2. Sattui S.E., Saag K.G. Fracture mortality: associations with epidemiology and osteoporosis treatment // Nat. Rev. Endocrinol. — 2014. — Vol. 10(10). — P. 592-602. doi: 10.1038/nrendo.2014.125.
3. Cangoz S., Chang Y.Y., Chempakaseril S.J. et al. Vitamin D and type 2 diabetes mellitus // J. Clin. Pharm. Ther. — 2013. — Vol. 38. — P. 81-84.
4. Souberbielle J.-C., Body J.-J., Lappe J.M. et al. Vitamin D and musculoskeletal health, cardiovascular disease, autoimmunity and cancer: recommendations for clinical practice // Autoimmunity Reviews. — 2010. — Vol. 9(11). — P. 709-715.
5. Garin M.C., Arnold A.M., Lee J.S. et al. Subclinical thyroid dysfunction and hip fracture and bone mineral density in older adults: the cardiovascular health study // J. Clin. Endocrinol. Metab. — 2014. — Vol. 99(8). — P. 2657-2664. doi: 10.1210/jc.2014-1051.
6. Марова Е.И., Ахкунбекова Н.К., Рожинская Л.Я. и др. Кальций-фосфорный обмен и костный метаболизм у больных с первичным гипотиреозом // Остеопороз и остеопатии. — 2000. — № 3. — С. 13-16.
7. Ночевная Л.Б., Павленко О.А., Килина О.Ю., Столярова В.А. Состояние костной ткани у больных с впервые выявленным гипотиреозом // Сибирский медицинский журнал. — 2011. — Т. 26, № 4. — С. 189-192.
8. Amashukeli M., Giorgadze E., Tsagareli M. et al. The impact of thyroid diseases on bone metabolism and fracture risk // Georgian Med. News. — 2010. — № 184–185. — P. 34-39.
9. Sadler J.E. Low von Willebrand factor: sometimes a risk factor and sometimes a disease / J.E. Sadler // Hematology Am. Soc. Hematol. Educ. Program. — 2009. — Vol. 106–12. doi: 10.1182/asheducation-2009.1.106.
10. Fan W., Bouwense S.A., Crawford R., Xiao Y.J. Structural and cellular features in metaphyseal and diaphyseal periosteum of osteoporotic rats // Mol. Histol. — 2010. — Vol. 41(1). — P. 51-60. doi: 10.1007/s10735-010-9261-y.

/127.jpg)
/128.jpg)