Статья опубликована на с. 135-139
Висока поширеність захворювань щитоподібної залози (ЩЗ) зумовлює важливість їх своєчасної діагностики та лікування. Одним з основних методів лікування більшості захворювань ЩЗ дотепер залишається хірургічний [1]. У зв’язку зі зростанням у світі захворюваності на тиреоїдну патологію щорічно збільшується й кількість оперативних втручань. В Україні за останні 10 років захворюваність на вогнищеву патологію ЩЗ зросла майже у 2,5 раза [2]. Попри широке використання хірургічного методу лікування і детальні розробки методики операцій на ЩЗ, серйозною проблемою залишаються післяопераційні ускладнення. Одним із найчастіших специфічних ускладнень після операцій на ЩЗ є післяопераційний гіпопаратиреоз, що посідає особливе місце, зважаючи на тяжкість проявів і складність профілактики [3]. Зазвичай він обумовлений травмою або видаленням прищитоподібних залоз (ПЩЗ), порушенням їх кровопостачання, а також розвитком фіброзу в місці операції у віддалених термінах [4]. Порушення функції однієї або декількох ПЩЗ призводить до зниження секреції паратгормона (ПТГ) і розвитку гіпокальціємії [5]. Розрізняють транзиторний і стійкий (6 місяців і більше після операції) післяопераційний гіпопаратиреоз. Транзиторний гіпопаратиреоз трапляється істотно частіше (за різними даними, від 0,9 до 68 % випадків), ніж стійкий (5–10 %) [6]. Очевидно, що частота стійкого гіпопаратиреозу буде вищою після тиреоїдектомії, ніж при субтотальних резекціях або гемітиреоїдектоміях [7]. Однак вірогідна залежність між характером патології ЩЗ і частотою післяопераційної гіпокальціємії досі не встановлена.
Більшість авторів вважають, що у хворих на дифузний токсичний зоб, рецидивуючий багатовузловий зоб (БВЗ) і рак ЩЗ ризик гіпопаратиреозу вищий у зв’язку з травматичністю й обширністю хірургічного втручання [8, 9]. Виникають проблеми і в діагностиці після-операційного гіпопаратиреозу. Хоча на перший погляд вона нескладна і включає оцінку, крім клінічних проявів, визначення рівня кальцію крові (загального або іонізованого) і ПТГ. Однак, за даними багатьох авторів, клінічна картина не завжди відповідає тяжкості гіпопаратиреозу, що потребує диференційованого підходу до цієї групи хворих [10]. Відсутня єдина думка про те, через який час після тиреоїдектомії необхідно визначати рівні кальцію і ПТГ у сироватці крові. Викликає дискусії і доцільність проведення профілактики гіпокальціємії і гіпопаратиреозу у пацієнтів, які зазнали оперативного втручання на ЩЗ [11].
Отже, незважаючи на значні успіхи в розвитку хірургічного лікування захворювань ЩЗ, залишаються актуальними питання профілактики і корекції після-операційного гіпопаратиреозу.
Мета дослідження — встановити особливості мінерального обміну у хворих на БВЗ після тиреоїдектомії.
Матеріали та методи
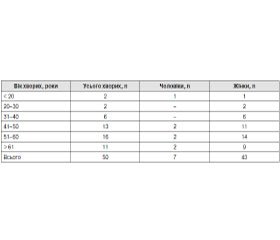
У дослідження було включено 50 хворих на БВЗ, які перебували на стаціонарному лікуванні в хірургічному відділенні Українського науково-практичого центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України за період 2012–2013 рр. (табл. 1).
Усім хворим проведено оперативне втручання на ЩЗ — тиреоїдектомія. Подальше клінічне обстеження пацієнтів було проведено за відсутності ознак гострих і загострення хронічних соматичних захворювань. Результати дослідження заносилися в спеціально розроблені реєстраційні карти.
При аналізі анамнезу цих пацієнтів не спостерігалося симптомів, які б указували на метаболічні захворювання кісток. Досліджувані особи не вживали ліків, що впливають на метаболізм кальцію, наприклад пероральні добавки кальцію і вітаміну D, антирезорбтивні засоби, не отримували замісну гормональну терапію для жінок у постклімактеричному віці, анаболічні середники, тіазидові діуретики та протиепілептичні засоби.
Більшості хворим на БВЗ (84 %) операція здійснювалася у зв’язку з наявністю синдрому компресії органів шиї. Перед проведенням операції у хворих визначали показники загального та іонізованого кальцію, фосфору, лужної фосфатази, ПТГ, 25(OH)D у сироватці крові. Рівні ПТГ та іонізованого кальцію в сироватці крові також визначали до і після операції. Референсні значення біохімічних параметрів у сироватці крові були такими: загальний кальцій — 2,15–2,55 ммоль/л; іонізований кальцій — 1,05–1,25 ммоль/л; фосфор — 0,74–1,52 ммоль/л; лужна фосфатаза — 90–240 од/л; 25(OH)D — 30–100 нг/мл; ПТГ — 15–65 пг/мл. Дефіцитом вважали показник 25(OH)D нижче від 20 нг/мл, недостатність вітаміну D — від 20 до 30 нг/мл, понад 30 нг/мл вважали за достатню концентрацію [12]. Рівень ПТГ у крові нижче від 10 пг/мл, а також показник загального кальцію нижче від 2,0 ммоль/л розглядали як маркер післяопераційного гіпопаратиреозу. Про гіпокальціємію свідчили значення сироваткової концентрації загального кальцію 2,0 ммоль/л або менше (іонізованого кальцію нижче від 1,0 ммоль/л). Безсимптомну гіпокальціємію визначали за лабораторними показниками, тоді як симптоматична гіпокальціємія, крім лабораторних даних, супроводжувалася клінічними симптомами (парестезії, симптоми Хвостека або Труссо, м’язові спазми).
Загальноклінічне обстеження включало аналіз медичної документації пацієнтів, збір скарг, вивчення даних анамнезу, загальноклінічний огляд. За показаннями проводилася консультація фахівців — кардіолога, офтальмолога та ін. Рівні кальцію, фосфору, лужної фосфатази в сироватці крові визначали за допомогою автоматичного аналізатора, стандартними наборами; рівні ПТГ та 25(ОН)D — на електрохемолюмінесцентному аналізаторі. Всім пацієнтам було проведено ультразвукове дослідження (УЗД) ЩЗ з оцінкою розмірів і ехографічних характеристик.
Статистична обробка результатів дослідження виконана за допомогою пакета прикладних програм Statistica v 6.0 for Windows. Описова статистика кількісних ознак представлена середніми і середньоквадратичними відхиленнями (у форматі M ± m; у разі нормальних розподілів) або медіанами і квартилями. Для порівняння двох незалежних вибірок за кількісними ознаками використовувався критерій Манна — Уїтні і критерій Вілкоксона для залежних вибірок. Результати вважалися статистично значущими при р < 0,05.
Результати та їх обговорення
Середній вік 50 прооперованих хворих на БВЗ становив 52,1 ± 11,8 року (у діапазоні від 18 до 75 років). Співвідношення жінки/чоловіки становило 6 : 1 (n = 43/7). При аналізі скарг пацієнтів із БВЗ встановлено, що більшість серед них були пов’язані зі збільшенням розмірів ЩЗ і, відповідно, компресією сусідніх органів. Найчастіше пацієнти вказували на деформацію шиї внаслідок збільшення ЩЗ. Дещо рідше пацієнти пред’являли скарги на відчуття стискання в ділянці шиї, але вірогідних відмінностей із частотою попередньої скарги виявлено не було. У той же час значуще менше відзначалася така скарга як задишка (р < 0,05), а частка пацієнтів, яких турбувала дисфагія, була мінімальною. При аналізі скарг ми звернули увагу, що в жодному випадку не були виявлені скарги, характерні для гіпопаратиреозу.
Оцінка об’єму ЩЗ, за даними УЗД, дозволила встановити, що в середньому цей показник становив 49,63 ± 11,37 см3 при коливаннях індивідуальних значень від 24,5 см3 до 118 см3. За тиреоїдним об’ємом хворі на БВЗ розподілені так: до 50 см3 — 6 (12 %), 51–75 см3 — 32 (64 %), 76–100 см3 — 11 (22 %), понад 100 см3 — 1 (2 %).
При вивченні структури тканини ЩЗ за даними УЗД виявлено, що у більшості пацієнтів вона була неоднорідною — у 76 % (n = 38) пацієнтів, тоді як однорідна структура діагностувалася у вірогідно меншого числа хворих — 34 % (n = 12; р < 0,05). Ступінь ехогенності тканини ЩЗ також був неоднаковий в обстежених пацієнтів. Майже у половині випадків (46 % — 23 особи) виявлена гіпоехогенна структура ЩЗ, тоді як інші варіанти ехогенності відзначалися вірогідно менше (р < 0,05). У 7 (14 %) пацієнтів спостерігалася гіперехогенна структура. При оцінці васкуляризації ЩЗ встановлено, що у 47 (94 %) хворих на БВЗ вона підвищена, а незмінний кровоток виявлявся вірогідно менше — у 6 % (n = 3; р < 0,05).
За допомогою УЗД проведена оцінка розмірів і кількості вузлових утворень ЩЗ. У більшості пацієнтів розмір вузлових утворень перевищував 3 см, а їх кількість становила 4 і більше. При цьому найчастіше вузлові утворення локалізувалися в обох частках залози (68 %). Локалізація лише в правій частці відзначалася вірогідно рідше — у 18 % (n = 9) випадків (р < 0,05). В усіх обстежених осіб при проведенні тонкоголкової аспіраційної пункційної біопсії (ТАПБ) виявлений колоїдний зоб, підтверджений при подальшому гістологічному дослідженні післяопераційного матеріалу.
Лабораторна оцінка стану мінерального обміну у хворих на БВЗ до операції дозволила встановити, що середній рівень кальцію (як загального, так і іонізованого) перебував у межах норми. Середній рівень фосфору в крові у пацієнтів із БВЗ також відповідав нормальним показникам і становив 1,06 ± 0,03 ммоль/л. Звертає на себе увагу, що у деяких пацієнтів жіночої статі (n = 9) відзначався підвищений вміст лужної фосфатази (271,2 ± 39,5 Од/л), в інших випадках її показники відповідали нормативним значенням (127,1 ± 19,4 Од/л (n = 41).
Середній рівень базального ПТГ у хворих на БВЗ становив 39,2 ± 7,4 пмоль/л, що цілком відповідає його референсним значенням. При визначенні концентрації 25(ОН)D у сироватці крові у 29 випадках (жінки — 27, чоловіки — 2; 58 %) становив 20 нг/мл або менше, а у 21 випадку (жінки — 16, чоловіки — 5; 42 %) — понад 20 нг/мл.
Оцінка змін клінічного стану пацієнтів після проведення тиреоїдектомії дозволила встановити, що вже протягом першої доби у частини пацієнтів виникли скарги, характерні для гіпопаратиреозу. Такий післяопераційний стан був діагностований у 14 (28 %) пацієнтів, причому найбільша частота його проявів була зафіксована відразу після операції. Вже в першу добу післяопераційного періоду частота реєстрації клінічних симптомів гіпопаратиреозу була практично втричі вищою, ніж у подальші дні, коли відзначалася тенденція до зниження цих проявів.
Хворі на гіпокальціємію пред’являли скарги на відчуття оніміння, парестезії в кінчиках пальців і в ділянці обличчя, похолодання кінцівок, а також запаморочення та озноб. В одному спостереженні (2 %) відзначалися диспептичні розлади у вигляді блювоти і нестійкого випорожнення. Серед пацієнтів із післяопераційним гіпопаратиреозом виявлявся позитивний симптом Хвостека. Залежно від післяопераційної концентрації кальцію пацієнтів розподілили на дві групи.
У першій групі (n = 14) післяопераційний рівень кальцію в сироватці крові становив 2,0 ммоль/л або менше, у другій групі (n = 36) перевищував 2,0 ммоль/л. При порівнянні показників обох груп із нормокальціємією і гіпокальціємією після операції відзначалося, що в групі з гіпокальціємією переважав більш старший вік, також спостерігалося виражене зменшення рівня ПТГ у крові нижче за референсні значенні після операції. Крім того, у більшої кількості людей у групі з гіпокальціємією виявлений дефіцит вітаміну D порівняно з групою з нормокальціємією. Різниця показників була статистично вірогідною.
При вивченні динаміки рівня загального та іонізованого кальцію у хворих на БВЗ із подальшим розвитком гіпопаратиреозу в післяопераційному періоді було виявлено, що вже після першої доби обидва показники були вірогідно нижчими від початкового рівня. Так, після операції рівень загального кальцію знизився на 11,4 %, а іонізованого кальцію — на 18,1 %. Загалом після операції частота гіпокальціємії становила 28 % (n = 14).
Звертає на себе увагу, що частота виявлення гіпокальціємії вірогідно вища від частоти реєстрації клінічних проявів гіпопаратиреозу (28 і 18 % випадків відповідно, р < 0,05). Отже, у 10 % (n = 5) хворих на БВЗ відзначалася безсимптомна гіпокальціємія.
Аналіз динаміки рівня фосфору в крові у після-операційному періоді дозволив встановити, що він вірогідно підвищувався щодо початкового рівня.
Протягом післяопераційного періоду відбувалося підвищення рівня фосфору в крові майже вдвічі, що перевищувало нормативні значення. При вивченні динаміки рівня ПТГ після тиреоїдектомії було встановлено, що впродовж післяопераційного періоду він вірогідно знизився, найбільш виражено — в групі пацієнтів із гіпокальціємією. При аналізі результатів було виявлено, що після операції відзначалося вірогідне зниження середнього рівня ПТГ у крові в обох групах. Протягом післяопераційного періоду він став вірогідно нижчий від первинного значення, а в групі з гіпокальціємією — нижчим від референсних значень. При нормокальціємії рівень ПТГ залишався в межах норми, а відмінності між групами були вірогідними.
При вивченні індивідуальних особливостей хворих на БВЗ встановлено, що після операції рівень ПТГ зменшився нижче від 10 пг/мл у 22 % (n = 11). Рівень ПТГ після операції: серед 39 пацієнтів із нормальним показником ПТГ у 36 була нормокальціємія, 3 мали лабораторну гіпокальціємію без клінічних проявів. З 11 пацієнтів із ПТГ у крові нижче від 10 пг/мл після операції 8 були з клінічними проявами гіпокальціємії, у 2 була безсимптомна гіпокальціємія і в 1 — нормокальціємія.
Нами встановлено, що ПТГ після операції в межах нормальних значень був у 39 пацієнтів (78 %), 11 (22 %) мали низькі показники ПТГ. У всіх 39 хворих із рівнем ПТГ понад 10 пг/мл не було клінічних симптомів гіпокальціємії. Тому нормальний післяопераційний показник ПТГ виключає подальший розвиток симптоматичної гіпокальціємії.
Становить інтерес можливість використання як прогностичного фактора розвитку гіпокальціємії після тиреоїдектомії такого показника як рівень 25(OH)D до операції. Встановлено, що в групі осіб, у яких початковий рівень 25(OH)D був нижчий за 20 нг/мл, значно частіше траплялася післяопераційна гіпокальціємія, ніж у групі пацієнтів із рівнем 25(OH)D понад 20 нг/мл (37,9 проти 14,2 %). Також виявлено, що в жодного хворого при рівні 25(ОН)D понад 20 нг/мл у подальшому не розвинувся стійкий гіпопаратиреоз.
Чим більший об’єм ЩЗ у хворих на БВЗ, тим більше виражені гіпокальціємія і гіпопаратиреоз у післяопераційному періоді (р < 0,05). При збільшенні тиреоїдного об’єму рівень ПТГ після операції знижується майже втричі (у групі хворих з об’ємом до 50 см3 рівень ПТГ становив у середньому 22,8 ± 4,2, а в групі 76–100 см3 — 9,2 ± 1,8; р < 0,05). Отже, при збільшенні ступеня збільшення ЩЗ зростає вірогідність ушкодження ПЩЗ і спостерігаються більш виражені порушення кальцієвого обміну.
При вивченні основних предикторів гіпопаратиреозу після тиреоїдектомії при БВЗ встановлено, що до операції рівень базального ПТГ у всіх хворих був у межах референсних значень, у той же час концентрація 25(ОН)D у 58 % (n = 29) хворих до операції була нижчою за 20 нг/мл.
У післяопераційному періоді гіпопаратиреоз розвинувся у 14 (28 %) пацієнтів, частіше він був транзиторним — у 12 хворих (24 %), у 2 (4 %) у подальшому розвинувся стійкий гіпопаратиреоз. Слід зазначити, що у 10 % (n = 5) випадків у пацієнтів у післяопераційному періоді відзначалася безсимптомна гіпокальціємія.
Як бачимо, основними характеристиками, що впливають на розвиток гіпокальціємії у хворих на БВЗ після тиреоїдектомії, були: більш старший вік, більший тиреоїдний об’єм, низький рівень 25(ОН)D до операції, зниження рівня ПТГ після операції. Як надійний, специфічний і чутливий доопераційний предиктор розвитку гіпокальціємії після тиреоїдектомії, у тому числі з клінічною симптоматикою, а також стійкого гіпопаратиреозу у пацієнтів цієї групи можна розглядати рівень 25(ОН)D нижче від 20 нг/мл.
Предикторами розвитку зазначених станів можна вважати рівень ПТГ після операції нижче від 10 пг/мл.
Висновки
1. Вік понад 60 років, більший об’єм ЩЗ, більш низький рівень 25(ОН)D до операції, зниження рівня ПТГ після операції належать до основних факторів, що впливають на розвиток гіпокальціємії у хворих на багатовузловий зоб після тиреоїдектомії.
2. Рівень 25(ОН)D нижче від 20 нг/мл слід розглядати як специфічний і чутливий доопераційний предиктор розвитку гіпокальціємії після тиреоїдектомії, у тому числі з клінічною симптоматикою, а також стійкого гіпопаратиреозу.
3. Предикторами розвитку зазначених станів можна вважати рівень ПТГ після операції нижче від 10 пг/мл.
Список литературы
1. Мамчич В.І., Погорєлов О.В., Воскобойнік О.Ю. Хірургічне лікування щитоподібної залози: історія та перспективи подальшого вивчення (науковий огляд) // Український журнал хірургії. — 2013. — № 2(21). — С. 11-14.
2. Митник З.М., Данова М.П., Крушинська З.Г та ін. Стан ендокринологічної служби України в 2007 р. // Міжнародний ендокринологічний журнал. — 2008. — № 3(15). — С. 8-15.
3. De Sanctis V., Soliman A., Fiscina B. Hypoparathyroidism: from diagnosis to treatment // Curr. Opin. Endocrinol. Diabetes. Obes. — 2012. — Vol. 19(6). — P. 435-442. doi: 10.1097/MED.0b013e3283591502.
4. Tripathi M., Karwasra R.K., Parshad S. Effect of preoperative vitamin D deficiency on postoperative hypocalcemia after thyroid surgery // Thyroid Res. — 2014. — 7. — 8. Published online 2014 Dec 15. doi: 10.1186/1756-6614-7-8.
5. Khafif A., Pivoarov A., Medina J.E. et al. Parathyroid hormone: a sensitive predictor of hypocalcemia following total thyroidectomy // Otolaryngol Head Neck Surg. — 2006. — 134(6). — 907-910. doi: 10.1016/j.otohns.2005.12.008.
6. Thomusch O., Machens A., Sekulla C. et al. Multivariate analysis of risk factors for postoperative complications in benign goiter surgery: prospective multicenter study in Germany // World J. Surg. — 2000. — 24(11). — 1335-1341. doi: 10.1007/s002680010221.
7. Toniato A., Boschin I.M., Piotto A. et al. Thyroidectomy and parathyroid hormone: tracing hypocalcemia-prone patients // Am. J. Surg. — 2008. — 196(2). — 285-288. doi: 10.1016/j.amjsurg.2007.06.036.
8. Lombardi C.P., Raffaelli M., Princi P. et al. Early prediction of postthyroidectomy hypocalcemia by one single iPTH measurement // Surgery. — 2004. — 136. — 1236-1241. doi: 10.1016/j.surg.2004.06.053.
9. Yamashita H., Noguchi S., Murakami T. et al. Predictive risk factors for postoperative tetany in female patients with Graves’disease // J. Am. Coll. Surg. — 2001. — 192(4). — 465-468. doi: 10.1016/S1072-7515(01)00803-1.
10. Bellantone R., Lombardi C.P., Raffaelli M. et al. Is routine supplementation therapy (calcium and vitamin D) useful after total thyroidectomy? // Surgery. — 2002. — 132(6). — 1109-1112. doi: 10.1067/msy.2002.128617.
11. Weaver S., Doherty D.B., Jimenez C., Perrier N.D. Peer-reviewed, evidence-based analysis of vitamin D and primary hyperparathyroidism // World. J. Surg. — 2009. — 33(11). — 2292-2302. doi: 10.1007/s00268-009-9966-9.
12. Holick M.F. Vitamin D deficiency // N. Engl. J. Med. — 2007. — 357(3). — 266-281. doi: 10.1056/NEJMra070553.

/136.jpg)