Статья опубликована на с. 156-166
Цукровий діабет (ЦД) — хронічне захворювання, що потребує безперервного медичного нагляду з урахуванням стратегії, спрямованої на постійний глікемічний контроль та зниження ризику виникнення інвалідизуючих ускладнень [1].
Висока захворюваність на ЦД, що постійно зростає в масштабах усього світу, призводить і до збільшення поширеності його хронічних ускладнень.
При ЦД 2-го типу відбувається ураження судин як макро-, так і мікроциркуляторного русла. Найтяжчі прояви діабетичної мікроангіопатії — ретино- і нефропатія, частота виявлення яких становить близько 50–70 % [2, 3]. Діабетична нефропатія (ДН) перебуває на другому місці після серцево-судинних захворювань (ССЗ) серед причин смертності хворих на ЦД 2-го типу [2], оскільки ускладнюється хронічною нирковою недостатністю (ХНН). ЦД 2-го типу — головна причина термінальної стадії ХНН [4], а ССЗ належать до найчастішої причини смерті у діабетичного загалу пацієнтів із хронічною хворобою нирок (ХХН) [5–7].
За даними МОЗ України, кількість хворих на ЦД в Україні за 10 років (2003–2013) збільшилася на 48,5 %, а кількість хворих на ХНН, обумовленою ДН, за цей же період зросла на 60,86 % [8, 9].
З іншого боку, спектр патології серцево-судинної системи у пацієнтів із ХНН включає гіпертрофію і дилатацію лівого шлуночка, кардіоміопатію, уремічний перикардит, застійну серцеву недостатність, ішемічну хворобу серця (ІХС), захворювання периферичних судин [5, 10].
Очевидним є обтяжений прогноз взаємного впливу ЦД 2-го типу, ССЗ та ХНН, що потребує ранньої діагностики та профілактики органів-мішеней і вивчення загальних патофізіологічних механізмів ураження судинного русла та нирок при ЦД 2-го типу (рис. 1).
ДН посідає перше місце за частотою розвитку термінальної ХНН, на другому місці — артеріальна гіпертензія (АГ) і хронічний гломерулонефрит. Ще у 1936 р. P. Kimmelstiel і C. Wilson уперше описали характерну патологоанатомічну картину тяжкої ДН, що клінічно проявляється нефротичним синдромом та АГ. Тепер цю форму захворювання називають діабетичним гломерулосклерозом.
Приблизно у 7 % пацієнтів із ЦД 2-го типу відзначається мікроальбумінурія (МАУ) вже на момент встановлення діагнозу «цукровий діабет». Діагностується МАУ при добовій екскреції від 30–300 мг/добу альбуміну з сечею або за відношенням «альбумін/креатинін» > 30 мг/г (> 3,4 мг/ммоль креатиніну) за критеріями Американської діабетичної асоціації або понад 2,5 мг/ммоль креатиніну у чоловіків і понад 3,5 мг/ммоль креатиніну у жінок відповідно до критеріїв Міжнародної діабетичної федерації [11, 12]. МАУ пов’язана зі збільшенням у 8,9 раза ризику ССЗ, з підвищенням ризику серцево-судинних ускладнень [13] і серцево-судинних подій, особливо у хворих на ЦД 2-го типу [14, 15]. МАУ також асоційована з прогресуванням термінальної стадії ниркової недостатності [13]. Доведений взаємозв’язок рівня МАУ з тривалістю ЦД 2-го типу [15] і ступенем його компенсації [16].
Так, у дослідженні European Diabetes Prospective Complications Study [17] захворюваність на МАУ в осіб із ЦД 1-го типу становила приблизно 12 % протягом семи років. У дослідженні UKPDS частота розвитку МАУ у хворих на ЦД 2-го типу становила 2 % на рік, а показник поширеності через 10 років після встановлення діагнозу — 25 %.
До факторів ризику розвитку ДН належать генетична схильність, чоловіча стать, похилий вік, а факторами ризику її прогресування є альбумінурія у пацієнтів з уперше діагностованим ЦД, гіперхолестеринемія, АГ і куріння. Наявність протеїнурії в анамнезі у батьків різко підвищує ризик розвитку ДН у дітей, які страждають від ЦД.
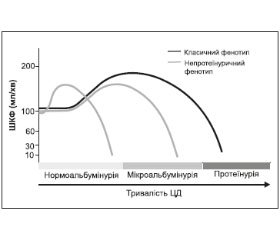
Основний клінічний прояв прогресуючої нефропатії — поява постійної протеїнурії, яка свідчить про те, що 50–75 % клубочків склерозовано, і процес у нирках має необоротний характер. Із цього моменту швидкість клубочкової фільтрації (ШКФ) неухильно знижується (10 мл/хв/рік) (рис. 2).
Існують дві теорії розвитку ДН — імунна і неімунна. Так, за неімунною теорією, гіперглікемія призводить до хронічної гіперфільтрації і підвищення ШКФ із подальшим розвитком внутрішньоклубочкової гіпертензії, пошкодженням і неферментативним глікозилюванням гломерулярної базальної мембрани із втратою нею негативного заряду. В базальній мембрані клубочків порушується синтез глікозаміногліканів, підвищується її проникність для молекул білка, внаслідок чого виникає протеїнурія.
Згідно з імунною теорією, в організмі виробляються антитіла до мікросомальних ниркових клітин, інсуліну крові, утворюються імунні комплекси, що ушкоджують базальну мембрану ниркових клубочків. Можлива й автоімунізація зміненими детермінантами гломерулярних структур.
Існує чимало класифікацій ДН, але в клінічній практиці найчастіше використовують класифікацію Могенсена (1983), згідно з якою виділяють п’ять стадій ДН [18], перші три стадії — доклінічні [19].
I стадія — стадія гіперфункції, коли з сечею виділяється нормальна кількість білка, але вже розвивається гіперфільтрація в ниркових клубочках. Виникає ця стадія з моменту розвитку початкових симптомів ЦД.
ІI стадія — стадія початкових структурних змін — розвивається через 2–5 років після перебігу захворювання на ЦД, клінічно характеризується МАУ, що періодично виникає, морфологічно визначаються потовщення гломерулярної базальної мембрани й експансія мезангію нирки.
ІІІ стадія — стадія початкової нефропатії — розвивається через 5–10 років із моменту виникнення перших симптомів ЦД. Характеризується постійною МАУ (кількість альбуміну в сечі до 300 мг/добу), нормальною або помірно зниженою ШКФ.
IV стадія — стадія клінічно вираженої нефропатії. Визначається протеїнурія (вміст білка в сечі — понад 300 мг/добу), може розвиватися АГ, знижується ШКФ, при біопсії тканини нирки визначається склероз понад 50–75 % клубочків.
V стадія — стадія ХНН. Підвищений уміст креатиніну в крові (понад 0,132 ммоль/л), різко знижується ШКФ. Ця стадія розвивається через 15–20 років із моменту виникнення ознак ЦД.
Гіперглікемія — основний ініціюючий метаболічний фактор розвитку ДН. Під впливом гіперглікемії відбувається неферментативне глікування білків, активуються процеси окисного стресу (активні форми кисню, NADPH-оксидази), збільшується активність низки ферментів (протеїнкіназа С, мітогенактивування протеїнкінази, транскрипційного фактора NF-κB, факторів росту (ТФР-β, судинного ендотеліального фактора росту (VEGF), сполучнотканинного фактора росту (CTGF)), цитокінів і молекул клітинної адгезії (фактор некрозу пухлини, MCP-1 (моноцитарний хемотаксичний протеїн), ICAM-1 (міжклітинна молекула адгезії), VCAM-1 (молекула адгезії судинних клітин), що призводять до пошкодження базальної мембрани і клітин клубочкового апарату нирок, внаслідок чого збільшується проникність клубочків нирок для альбуміну та інших компонентів плазми. Хронічна гіперглікемія призводить до зниження тонусу артеріоли, по якій надходить кров до нирки, а підвищення активності ангіотензину II сприяє збільшенню тонусу виносної артеріоли, що потенціює розвиток внутрішньоклубочкової гіпертензії при ЦД навіть за відсутності системної АГ.
Патоморфологічною ознакою мікроангіопатії та ранньої ДН є розширення мезангію, гіпертрофія клубочків і потовщення базальної мембрани з підвищенням її проникності [20].
Беручи до увази вищезазначене, важливо виявити розвиток ДН на початкових стадіях, коли ще можливо поліпшити функціональний стан нирок. У цьому може допомогти визначення креатиніну сироватки крові, розрахунок кліренсу креатиніну, концентрації цистатину С (Cystatin C), визначення вираженості альбумінурії, вимірювання резистивного індексу (РІ).
На сьогодні визначення ШКФ вважається найточнішим методом оцінки фільтраційної функції нирок. ШКФ менше 60 мл/хв/1,73 м2 є пороговою величиною, що відповідає втраті 50 % фільтраційної здатності нирок. За величиною ШКФ визначають стадію ХХН. Під терміном ХХН прийнято об’єднувати всі випадки ураження нирок незалежно від етіології та/або зниження ШКФ, що зберігаються протягом трьох і більше місяців. Усім пацієнтам із ЦД 2-го типу рекомендовано визначення ШКФ один раз на рік для виявлення ниркової дисфункції [21]. Дуже високі концентрації креатиніну в поєднанні з низьким значенням ШКФ незалежно пов’язані зі смертністю від усіх причин, тоді як ізольоване зниження ШКФ асоційоване зі смертю від ССЗ [22]. Для визначення ШКФ найчастіше використовуються формули Кокрофта — Голта і MDRD (Modification of Diet in Renal Disease), що прості в застосуванні та валідовані щодо еталонних методів оцінки ШКФ. Загальний недолік наведених формул — їх неточність при нормальних або незначно знижених показниках ШКФ. Розроблена нова формула CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration), розрахунок за допомогою якої дає точніші результати, в тому числі при збереженій функціональній здатності нирок [21, 23].
Робочою групою KDIGO CKD (Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Work Group) рекомендується вимірювання цистатину С як підтверджуючого тесту для діагностики ХХН у дорослих пацієнтів зі зниженою ШКФ, виміряною за рівнем креатиніну [24]. Цистатин С — це неглікований білок, що інгібує цистеїнові протеїнази [25]. Утворюється в організмі з постійною швидкістю, вільно фільтрується через клубочкову мембрану, а потім повністю реабсорбується проксимальними канальцями без подальшої секреції [25]. Цистатин меншою мірою залежить від віку, статі, раси, м’язової маси, впливу лікарської терапії, фізичної активності та дієти порівняно з креатиніном [26]. Зазначені властивості зробили його майже ідеальним кандидатом для оцінки функції нирок. Відзначено, що цистатин С — більш чутливий біомаркер, ніж креатинін [27], для моніторингу ренальної функції і виявлення як ранніх стадій ДН [28], так і більш пізніх стадій ХХН, що супроводжуються альбумінурією [25]. При ЦД 2-го типу при прогресуванні ДН відзначено збільшення концентрації цистатину С [28].
Підвищення концентрації сироваткового цистатину С розглядається яке предиктор розвитку не лише ХНН, але й ССЗ [29, 30] (захворювання периферичних артерій, інсульту, аневризми черевного відділу аорти, ІХС, інфаркту міокарда, серцевої недостатності) [22], у тому числі у хворих на ЦД 2-го типу [31]. У хворих на ЦД 2-го типу, які страждають від ІХС, реєструють більш високий рівень цистатину С, ніж без ІХС [31]. Збільшення рівня цистатину С — незалежний фактор ризику смертності від усіх причин і серцево-судинної смертності серед літніх людей [29], в осіб із захворюваннями периферичних артерій [32], пацієнтів з ІХС незалежно від рівня креатиніну, навіть після корегування ШКФ [33].
У пацієнтів із ЦД 2-го типу ШКФ, виміряна за рівнем цистатину, більш точна, ніж ШКФ, виміряна за рівнем креатиніну для оцінки функції нирок при нормоальбумінурії [34, 35]. Навіть мінімальне зниження ШКФ за рівнем цистатину при наявності МАУ було незалежним предиктором ризику смертності від ІХС та серцевої недостатності [36, 37].
Метод дуплексного сканування ниркових артерій дозволяє оцінити нирковий судинний опір — РІ і пульсацію ниркового кровотоку — пульсаційний індекс (ПІ). У літературі є дані про значне підвищення РІ і ПІ у пацієнтів із ЦД 2-го типу порівняно з пацієнтами без нього, навіть при схожих значеннях ШКФ [38, 39]. При цьому в літературі є дані про зв’язок тривалості ЦД 2-го типу з рівнем РІ і ПІ [40].
Збільшення індексу резистивності ниркових артерій при ЦД 2-го типу — найбільш рання ознака ураження судин нирок, що спостерігається ще до появи МАУ [38]. При значенні РІ > 0,7 виявляють хворих на ЦД 2-го типу з групи ризику прогресування ниркової недостатності [41]. Крім того, пацієнти з ХХН із РІ ≥ 0,7 мають значно гірший прогноз щодо тривалості життя, ніж із РІ < 0,7 [42]. Високий РІ, протеїнурія, низький рівень ШКФ і АГ — незалежні фактори ризику прогресування ХНН [43]. Так, за даними багатьох робіт, у хворих на АГ при розвитку МАУ відзначається підвищення РІ [43].
Отже, ниркова дисфункція, виявлена за зниженням ШКФ, наявністю МАУ або збільшенням концентрації цистатину С, прогнозує несприятливі серцево-судинні наслідки як у пацієнтів із ЦД 2-го типу, так і без нього, і незалежно від наявності або відсутності попередніх ССЗ, навіть при мінімальній дисфункції нирок [44].
Останнім часом накопичуються дані щодо зв’язку показників функції нирок і ниркового кровотоку з вираженістю атеросклеротичного процесу і з показниками жорсткості артерій. Відомо, що підвищена жорсткість артерій еластичного, м’язово-еластичного типів асоціюється з розвитком як макро-, так і мікросудинних ускладнень при ЦД 2-го типу (ретино-, нефропатії) [45]. З іншого боку, навіть при початкових стадіях нефропатії відзначається збільшення жорсткості судин [46]. Відомо також про зв’язок показників жорсткості аорти і загальної сонної артерії з МАУ і зниженням ШКФ у хворих на ЦД 2-го типу [47–49]. Крім того, є дані про зв’язок РІ ниркових артерій з показниками жорсткості аорти як у пацієнтів із ЦД 2-го типу, так і у хворих з АГ без ЦД 2-го типу [43, 50, 51]. Вищезазначені дані свідчать про незалежну асоціацію між нирковою гемодинамікою та артеріальною жорсткістю, що припускає наявність спільних патофізіологічних механізмів розвитку мікро- і макроангіопатії. Наголошується, що у пацієнтів поєднання підвищеного РІ ниркових артерій і зниженого кліренсу креатиніну асоціювалося з більшою кількістю факторів ризику ССЗ і з більш високим ризиком розвитку первинної кінцевої точки (перший прояв серцево-судинних і ниркових результатів), ніж у пацієнтів з ізольованою зміною одного із зазначених показників [52].
Зв’язок показників жорсткості судин еластичного і м’язово-еластичного типу з показниками функції нирок і ниркового кровотоку трапляється у пацієнтів з АГ [53]; в одній з таких робіт у третини пацієнтів був ЦД 2-го типу [52]. Наголошується, що у пацієнтів з АГ за наявності МАУ показники жорсткості артерій еластичного і м’язово-еластичного типів вищі, ніж у пацієнтів без МАУ [53, 54].
У наш час наближається до свого завершення робота (LOD-DIABETES Study), присвячена оцінці прогностичного значення показників центральної гемодинаміки і швидкості пульсової хвилі на каротидно-феморальному сегменті щодо змін маркерів субклінічного ураження органів-мішеней (гіпертрофії лівого шлуночка, товщини комплексу інтима-медіа, ретинопатії, нефропатії) у пацієнтів із ЦД 2-го типу [55].
При тяжких стадіях ХХН розвитку і прогресуванню ССЗ, збільшенню жорсткості артерій поряд із традиційними факторами ризику сприяють і уремічні фактори, пов’язані з ХХН: анемія, гіперпаратиреоз, електролітний дисбаланс з об’ємним перевантаженням із подальшим розвитком АГ; ускладнення, пов’язані з гемодіалізом, порушення фосфорно-кальцієвого обміну, що призводить у тому числі до кальцифікації судин [44, 56].
Одним з основних патогенетичних факторів розвитку та прогресування захворювань серцево-судинної системи, ЦД, ХХН є окислювальний стрес [57–59]. Активація процесів окисного стресу супроводжується збільшенням кількості активних форм кисню (АФК) (reactive oxygen species — ROS), таких як супероксидний аніон-радикал (О2•–), гідропероксидний радикал (НО2•) і гідроксил-радикал (OH•), а також пероксид водню (Н2О2) і гіпохлорна кислота (НОСL) [60, 61]. Найбільша кількість вільних радикалів в організмі належить до сполук реактивного кисню. Основним ушкоджуючим агентом у клітині є гідроксил-радикал (OH•) [62].
Дефіцит активності антиоксидантних ферментів (АОФ) традиційно розглядається як один з пускових механізмів виникнення та прогресування окисного стресу [60, 61, 63]. Антиоксидантна система включає: неферментні антиоксиданти, переважно фенольної природи (α-токоферол, убіхінон, бета-каротин) та АОФ, супер-оксиддисмутаза (СОД), що утилізують супероксидний аніон-радикал (О2•–), каталазу і глутатіонпероксидазу, що утилізують пероксид водню, а глутатіонпероксидаза, у свою чергу, перешкоджає накопиченню вторинних радикалів [60, 61]. У хворих на ЦД 2-го типу відзначається зниження активності АОФ, у першу чергу СОД, що спричинено інгібуючою дією природних низькомолекулярних дикарбонілів при тривалих і виражених порушеннях вуглеводного обміну [64, 65]. Відомо, що метилгліоксаль, що накопичується при діабетичній гіперглікемії, є більш вираженим інгібітором активності АОФ, ніж малоновий діальдегід (МДА). Це підтверджується літературними даними, в яких зазначено, що 5–6-кратне накопичення метилгліоксалю в плазмі крові пацієнтів із ЦД 2-го типу призводить до зниження активності СОД [66]. Крім того, окислені модифіковані білки і кінцеві продукти глікозилювання (КПГ) можуть бути джерелами АФК, виснажуючи запас антиоксидантів [67], що, у свою чергу, підтримує вільнорадикальні процеси, що сприяють прогресуванню атеросклерозу за наявності ЦД 2-го типу [68].
При ЦД 2-го типу утворення АФК збільшується. Внаслідок активації процесів автоокислення глюкози і проміжних продуктів метаболізму глюкози (глюкозо-6-фосфату, фруктозо-6-фосфату) підвищується продукція дикарбонільних сполук (метилгліоксалю, 3-дезоксиглюкозону), запускаються процеси глікування білків, що супроводжується збільшенням утворення АФК і накопиченням кінцевих продуктів глікування (гідроімідазолінів, Nδ-карбоксиметил-лізину, Nδ-карбоксиетил-лізину, а також пентозидину, глюкозепану) [62, 69]. Вільні радикали при ЦД 2-го типу утворюються також внаслідок поліолового і гексозамінового шляхів метаболізму глюкози, підвищення процесів окисного фосфорилювання, накопичення тріозофосфатів, що призводить і до активного утворення карбонільних сполук [61, 68].
У механізмах підвищення окислювального стресу при ЦД бере участь і гіперінсулінемія у вигляді активації симпатичної нервової системи. Під впливом катехоламінів збільшується утворення вільних радикалів як безпосередньо, так і через підвищене утворення вільних жирних кислот [62], що є предиктором розвитку неалкогольної жирової хвороби печінки (НАЖХП). АФК взаємодіють із нерадикальними сполуками і утворюють нові вільні радикали [62], через це відбувається окислювальна модифікація біополімерів: білків, ліпідів, нуклеїнових кислот, вуглеводів [62]. Найбільш схильні до вільнорадикального окислення ненасичені ліпіди, що входять до складу біомембран і ліпопротеїнів [62].
Внаслідок накопичення окислювально-модифікованих ліпопротеїнів низької щільності утворюються ліпоїдні передатерогенні ушкодження [57–59, 62, 70]. Гіперліпідемія сприяє інтенсифікації перекисного окислення ліпідів, причому виявлено накопичення ліпогідропероксидів у крові хворих на ЦД 2-го типу в поєднанні з НАЖХП [57, 62, 68, 70–72]. Найбільш виражене підвищення рівнів ліпогідропероксидів визначається у хворих на ЦД 2-го типу із судинними ускладненнями та ІХС [73]. Окисна деструкція ліпопероксидів при ІХС супроводжується утворенням низькомолекулярних карбонільних сполук, подібних до МДА [60–62, 65, 70–72, 74]. Дикарбоніли, що акумулюються в процесі окислювальних перетворень глюкози, є більш атерогенними, ніж МДА, що може пояснити посилене прогресування атеросклерозу за наявності ЦД [70, 71, 75].
Накопичення при ЦД 2-го типу дикарбонілів альдегідної природи (гліоксаль, метилгліоксаль) і МДА провокують розвиток карбонільного стресу [60, 61, 65, 70, 71]. Перекисне окислення ліпідів (ПОЛ) і окислювальна модифікація білків тісно пов’язані між собою, формуючи порочне коло, що сприяє подальшому посиленню окисного стресу [62].
При порушеннях вуглеводного обміну відбувається глюкозозалежна модифікація білків: глікування — пряме приєднання альдольної форми глюкози до молекули білка (наприклад, глікування гемоглобіну) і гліоксилювання — автоокислення глюкози з утворенням гліоксалю (цей процес посилюється при окисленні ліпідів), а також фрагментованість триозофосфатів, що накопичуються при інтенсифікації гліколізу, з утворенням метилгліоксалю і 3-дезоксиглюкозону [65, 70, 71].
Дикарбонільні сполуки різного походження взаємодіють з кінцевими аміногрупами білків із послідовним утворенням основ Шиффа, продуктів Амадорі та пентозидинів (КПГ) [65, 69, 74, 76–78], що можуть призводити до утворення внутрішньо- і міжмолекулярних зшивок (cross-links) у молекулах білків, які спричинюють зміни їх конформації і властивостей [60, 61, 65]. Так відбувається зміна структури і властивостей ЛПНЩ, АОФ. Відомо, що КПГ [69, 76, 78], насамперед reactive carbonyl specias (RCS), можуть брати участь в утворенні поперечних зшивок у молекулах структурних білків стінки судин — колагену й еластину [79] і тим самим сприяти збільшенню жорсткості судин за ЦД 2-го типу [69, 78] і розвитку гломерулосклерозу нирок [20].
Отже, прогресування ХНН при ДН розглядається як результат ураження всього нефрону, ключовим ініціюючим фактором якого є гіперглікемія та пов’язані з нею внутрішньоклубочкові гемодинамічні порушення, які мають здатність до прогресування за наявності НАЖХП. Не викликає сумніву той факт, що гіперглікемія — не тільки є пусковим фактором розвитку початкових діабетичних ускладнень у клубочках нефрону, але й сприяє прогресуванню НАЖХП. Окрім того, позитивний вплив компенсації вуглеводного обміну на прогресування ДН доведений численними клінічними дослідженнями, а стабільне функціонування нирок при ЦД 2-го типу є запорукою відсутності прогресування НАЖХП від стадії неалкогольного стеатогепатиту (НАСГ) до фіброзу печінки. Тому актуальність визначення особливостей діагностики ДН при ЦД 2-го типу в поєднанні з НАЖХП не викликає сумніву.
Метою роботи стало дослідження показників ниркових проб у хворих на ЦД 2-го типу з НАЖХП.
Матеріали та методи дослідження
На базі клініки ДУ «Інститут проблем ендокринної патології імені В.Я. Данилевського НАМН України» (м. Харків) було обстежено 78 хворих на ЦД 2-го типу, із них у 66 діагностовано НАЖХП. Серед 66 пацієнтів було 38 жінок (57,6 %) та 28 чоловіків (42,4 %) віком від 30 до 74 років (середній вік — 56,02 ± 1,15 року) із тривалістю захворювання від 3 до 18 років (у середньому — 8,91 ± 0,39 року); у 12 хворих на ЦД 2-го типу не було НАЖХП.
У всіх обстежених хворих досліджені показники вуглеводного, білкового та ліпідного обміну, функціонального стану печінки, ниркових проб, ПОЛ та системи згортання крові.
Аналіз клініко-біохімічних даних включав визначення показників глікемії протягом доби, глікемії крові натще (ГКН), постпрандіальної глікемії (ГКПП) глюкозооксидазним методом за допомогою експрес-аналізатора Biosen C line; проводився розрахунок показників середньодобової глікемії (ГКСР), амплітуди глікемії; визначення HbA1c — колориметричним методом.
Визначення ліпідного спектра крові включало дослідження загального холестерину (ЗХС), холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), тригліцеридів (ТГ) ферментативним методом за допомогою набору ТОВ НВП «Філісіт-Діагностика» (Україна); β-ЛП — турбодиметричним методом; загального білірубіну — методом Йєндрашика на апаратах «Флюо-рат-02-АВЛФ-Т» та «Фотометр РМ2111-У» виробництва «Солар». Розрахунок умісту в крові холестерину ліпопротеїнів низької і дуже низької щільності (ХС ЛПНЩ, ХС ЛПДНЩ) та коефіцієнту атерогенності (КА) проводився за загальноприйнятими формулами.
Дослідження тимолової проби та активності лужної фосфатази (ЛФ) у сироватці крові проводили за методом Мак-Лагана; активність аланінамінотрансферази (АлАТ) та аспартатамінотрансферази (АсАТ) у сироватці крові визначали методом Райтмана — Френкеля на апаратах «Флюорат-02-АВЛФ-Т» та «Фотометр РМ 2111-У» («Солар»).
Розраховували коефіцієнт де Рітіса як співвідношення активності сироваткових АсАТ і АлАТ. Значення коефіцієнта в нормі становить 1,33 ± 0,42. Коефіцієнт де Рітіса менше 1 свідчить про ураження печінки і є діагностично несприятливою ознакою.
Вміст фібрину та фібриногену визначали ваговим (гравіметричним) методом за Р.А. Рутберг.
Рівень загального білка у сироватці крові визначали біуретовим методом, фракційний склад білків сироватки крові — турбодиметричним методом.
ПОЛ визначали за даними дієнових (ДК), триєнових (ТК), оксидієнових (ОДК), тетраєнових (ТрК) кон’югант та МДА спектрофотометричним методом із використанням коефіцієнта молярного поглинання продуктів.
Рівні сечовини крові та сечі визначали уреазним методом; креатиніну сечі — за кольоровою реакцією Яффе (методом Поппера); креатиніну крові — за допомогою набору ТОВ НВП «Філісіт-Діагностика».
Значущість відмінностей для нормально розподілених даних оцінювали за критерієм Стьюдента (t). Отримані результати в таблицях і тексті подано як відносні величини (%), а також як (x ± Sx), де x — середнє арифметичне значення, Sx — статистична похибка арифметичного. Зв’язок між показниками оцінювали за допомогою коефіцієнта рангової кореляції Спірмена (rs). Відмінності вважали за статистично значущі при р < 0,05.
База даних сформована в ліцензійній програмі Exсel. Розрахунки проведено за допомогою програми Statistica 6.
Результати та їх обговорення
Аналіз показників вуглеводного обміну характеризувався однаковим ступенем компенсації вуглеводного обміну у хворих на ЦД 2-го типу в поєднанні з НАЖХП та без неї (табл. 1).
При визначенні показників ПОЛ встановлено, що їх значення були вірогідно вищими у хворих на ЦД 2-го типу з НАЖХП порівняно з хворими на ЦД 2-го типу без НАЖХП (табл. 2).
Генерація первинних продуктів ПОЛ послідовно збільшувалася. Все це дозволяє використовувати вивчені показники ПОЛ як критерії прогресування НАЖХП від стадії НАСГ до фіброзу печінки.
Серед досліджуваних показників ліпідного обміну у хворих на ЦД 2-го типу в поєднанні з НАЖХП виявлено вірогідно більший рівень ТГ порівняно з хворими на ЦД 2-го типу без НАЖХП, всі інші атерогенні фракції ліпідограми вірогідно не відрізнялися між собою (табл. 3).
Виявлені зміни свідчать про наявні атеросклеротичні зміни у хворих обох обстежених груп, а вірогідно вищий рівень ТГ є предиктором розвитку НАЖХП із накопиченням даних фракцій не тільки в коронарних судинах, але й у гепатоцитах хворих на ЦД 2-го типу.
Досліджувався також білковий обмін у хворих на ЦД 2-го типу в поєднанні з НАЖХП та без неї (табл. 4).
Отримані дані вказують на більш глибокі порушення білково-синтезуючої функції печінки у хворих на ЦД 2-го типу в поєднанні з НАЖХП порівняно з пацієнтами з ЦД 2-го типу без НАЖХП.
При дослідженні системи згортання крові за даними активованого часткового тромбопластинового часу, протромбінового індексу, концентрації фібриногену, фібрину та фібринолітичної активності вірогідних змін рівня визначених показників у хворих на ЦД 2-го типу залежно від наявності або відсутності НАЖХП виявлено не було.
Вивчаючи функціональну активність печінки у хворих на ЦД 2-го типу в поєднанні з НАЖХП (табл. 5), ми виявили більш виражені прояви мезенхімального запалення за даними трансаміназ і відсутність таких змін у хворих без патології печінки.
Дослідження ниркових проб у хворих на ЦД 2-го типу в поєднанні з НАЖХП (табл. 6) виявило вірогідно більші значення рівня креатиніну сечі порівняно з хворими без патології печінки. Цей показник можна вважати відносним маркером прогресування діабетичної нефропатії у хворих на ЦД 2-го типу, особливо за супутньої патології печінки, адже, як відомо, фільтраційна здатність нирок тривалий час може не змінюватися незалежно від наявності протеїнурії. Тому раніше відомі маркери ДН у наш час вважаються недостатньо інформативними щодо прогресування ДН аж до розвитку ХНН (WCN, 2015).
У роботі були визначені кореляційні взаємозв’язки між результатами ниркових проб та показниками ПОЛ, адже серед механізмів прогресування ДН з урахуванням того, що при гемодинамічних порушеннях у нирках особливу роль відіграють зміни метаболізму оксиду азоту.
Серед досліджених показників ниркових проб виявлені вірогідні кореляційні взаємозв’язки канальцевої реабсорбції з показниками ПОЛ (табл. 7).
/163.jpg)
При визначенні кореляційних взаємозв’язків показників ПОЛ із даними канальцевої реабсорбції виявлено різнонаправлений характер досліджуваних змін. Зниження канальцевої реабсорбції у хворих на ЦД 2-го типу без патології печінки можна пояснити залученням до патологічного процесу мозкової речовини нирки при збільшенні оксидативного напруження ще до розвитку доклінічної стадії ДН, яку можна розцінювати як адаптивний механізм до судинних змін, що вже відбуваються у нефроні, а саме — внутрішньоклубочкової гіпертензії. Виявлені зміни збігаються з даними B. Brenner, який встановив, що, попри значне зниження маси функціонуючих нефронів нирок, деякий час підтримується гомеостаз завдяки адаптаційним змінам, тобто збільшенню клубочкової фільтрації та зниженню канальцевої реабсорбції. Завдяки цьому підтримується ефективний нирковий плазмоток, а ішемія паренхіми нирок, що виникає при цьому, призводить до порушення окисно-антиоксидант-ного гомеостазу, метаболізму оксиду азоту і розвитку АГ.
Знижена фільтрація при погіршенні ниркового кровотоку поєднується зі збільшенням канальцевої реабсорбції. Підсилення канальцевої реабсорбції відбувається при порушенні системної гемодинаміки, що може спричинити ішемію міокарда та мозку. Даний стан реалізується через симпатоадреналову систему, яка завдяки компенсаторним механізмам впливає на централізацію кровообігу внаслідок звуження ниркових судин. Оскільки судинам мозкової речовини нирок вазоконстрикція не властива, кровопостачанням краще забезпечується не коркова, а мозкова речовина нирок. При цьому канальцева реабсорбція збільшується, що і виявлено в обстежених нами хворих на ЦД 2-го типу з наявністю НАЖХП, що підсилює патогенетичні зміни у судинах нирок.
Висновки
1. Наявність НЖХП у хворих на ЦД 2-го типу потенціює розвиток ДН.
2. У хворих на ЦД 2-го типу з НЖХП констатується підсилення канальцевої реабсорбції, що виникає внаслідок порушення співвідношення «вазоконстрикція/вазодилатація».
3. Креатинін сечі можна вважати стабільним показником серед параметрів печінкових проб та раннім маркером прогресування ДН у хворих на ЦД 2-го типу з НЖХП.
Список литературы
1. Standards of Medical Care in Diabetesd 2015 [Text] / American Diabetes Association (ADA) // Diabetes Care. — 2015. — Vol. 38, Suppl. 1. — P. S.1-S.2.
2. Диабетическая нефропатия: достижения в диагностике, профилактике и лечении [Текст] / М.В. Шестакова, Л.А. Чугунова, М.Ш. Шамхалова [и др.] // Сахарный диабет. — 2005. — № 3. — С. 22-25.
3. Граніна О.В. Ефективність застосування коригуючої терапії при цукровому діабеті 2-го типу з метаболічним синдромом та нефропатією / О.В. Граніна // Міжнародний ендокринологічний журнал. — 2012. — № 5. — С. 10-12.
4. Diagnostic value of the combined measurement of serum hcy, serum cys C, and urinary microalbumin in type 2 diabetes mellitus with early complicating diabetic nephropathy [Text] / T. Wang, Q. Wang, Z. Wang [et al.] // ISRN Endocrinol. — 2013. — Vol. 2013. — P. 407-452.
5. Levin A. Cardiovascular disease in chronic renal insufficiency [Text] / A. Levin, R.N. Foley // Am. J. Kidney Dis. — 2000. — Vol. 36(3). — P. 24-30.
6. Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention [Text] / M.J. Sarnak, A.S. Levey, A.C. Schoolwerth [et al.] // Hypertension. — 2003. — Vol. 42(5). — P. 1050- 1065.
7. Chronic kidney disease and mortality risk: a systematic review [Text] / M. Tonelli, N. Wiebe, B. Culleton [et al.] // J. Am. Soc. Nephrol. — 2006. — Vol. 17(7). — P. 2034-2047.
8. Тронько М.Д. Основні показники діяльності ендокринологічної служби України за 2003 р. [Текст] / М.Д. Тронько. — К., 2004. — 32 с.
9. Тронько М.Д. Довідник основних показників діяльності ендокринологічної служби України за 2013 р. [Текст] / М.Д. Тронько // Ендокринологія. — 2014. — Т. 19, № 1. — 40 с.
10. Foley R.N. Epidemiology of cardiovascular disease in chronic renal disease [Text] / R.N. Foley, P.S. Parfrey, M.J. Sarnak // J. Am. Soc. Nephrol. — 1998. — Vol. 9(12). — P. 16-23.
11. International Diabetes Federation (IDF). Chapter 14: Kidney damage [Text] // Global Guideline for Type 2 Diabetes. — 2005. — P. 54-58.
12. American Diabetes Assotiation (ADA) Position Statement. Standarts of medical care in diabetes [Text] // Diabetes Care. — 2007. — Vol. 30. — P. 19-21.
13. Abdelhafiz A.H. Microalbuminuria: marker or maker of cardiovascular disease [Text] / A.H. Abdelhafiz, S. Ahmed, M. El Nahas // Nephron. Exp. Nephrol. — 2011. — Vol. 119(1). — P. 6-10.
14. Carotid stiffness and microalbuminuria in patients with type 2 diabetes [Text] / W.W. Zhan, Y.H. Chen, Y.F. Zhang [et al.] // Endocrine. — 2009. — Vol. 35(3). — P. 409-413.
15. Usefulness of microalbuminuria in predicting cardiovascular mortality in treated hypertensive men with and without diabetes mellitus. Risk Factor Intervention Study Group [Text] / S. Agewall, J. Wikstrand, S. Ljungman [et al.] // Am. J. Cardiol. — 1997. — Vol. 80(2). — P. 164-169.
16. Themeli Y. Диабетическая нефропатия и «немая» ишемия миокарда у больных с бессимптомным сахарным диабетом 2-го типа / Y. Themeli, F. Agaci, V. Bajrami et al. // Міжнародний ендокринологічний журнал. — 2012. — № 8. — С. 16-24.
17. Glycemic control and all-cause mortality risk in type 1 diabetes patients: the EURODIAB prospective complications study [Text] / D.A. Schoenaker, D. Simon, N. Chaturvedi [et al.] // J. Clin. Endocrinol. Metab. — 2014. — Vol. 99(3). — P. 800-807.
18. Pulsed-wave color Doppler echography of the intrarenal vessels in patients with insulin-dependent diabetes mellitus and incipient nephropathy [Text] / M. Sperandeo, G. D’Amico, A. Varriale [et al.] // Arch. Ital. Urol. Androl. — 1996. — Vol. 68(5). — P. 183-187.
19. Дедов И.И. Диабетическая нефропатия [Текст] / И.И. Дедов, М.В. Шестакова. — М.: Универсум Паблишинг, 2000. — 239 с.
20. Соколов Е.И. Диабетическое сердце [Текст] / Е.И. Соколов. — М.: Медицина, 2002. — C. 335-337.
21. Рабочая группа РКО, НОНР, РАЭ, РМОАГ, НОА, РНМОТ. Национальные рекомендации. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции [Текст] / Рабочая группа РКО, НОНР, РАЭ, РМОАГ, НОА, РНМОТ // Российский кардиологический журнал. — 2014. — № 8(112). — С. 7-37.
22. Cystatin C: an emerging biomarker in cardiovascular disease [Text] / C. Angelidis, S. Deftereos, G. Giannopoulos [et al.] // Curr. Top. Med. Chem. — 2013. — Vol. 13(2). — P. 164-179.
23. Комитет экспертов Всероссийского научного общества кардиологов. Кардиоваскулярная профилактика. Национальные рекомендации [Текст] / Комитет экспертов ВНОК // Кардиоваскулярная терапия и профилактика. — 2011. — № 10(6). — 64 с.
24. Salgado J.V. Kidney Disease: Improving Global Outcomes (KDIGO). CKD Work Group KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease [Text] / J.V. Salgado, F.L. Souza, B.J. Salgado // Kidney Int. Suppl. — 2013. — Vol. 3. — P. 1-150.
25. Usefulness of serum cystatin C in Japanese patients with type 2 diabetes mellitus and nephropathy [Text] / T. Kimura, H. Ikeda, J. Fujikawa [et al.] // Diabetes Res. Clin. Pract. — 2009. — Vol. 83(2). — P. e58-e61.
26. Cystatin C is associated with an increased coronary atherosclerotic burden and a stable plaque phenotype in patients with ischemic heart disease and normal glomerular filtration rate [Text] / G. Niccoli, M. Conte, R. Della Bona [et al.] // Atherosclerosis. — 2008. — Vol. 198. — P. 373-380.
27. Evaluation of glomerular filtration rate using cystatin C in diabetic patients analysed by multiple factors including tubular function [Text] / P.P. Zhang, J.F. Zhan, H.L. Xie [et al.] // J. Int. Med. Res. — 2010. — Vol. 38(2). — P. 473-483.
28. Cystatin C as an early biomarker of nephropathy in patients with type 2 diabetes [Text] / Y.K. Jeon, M.R. Kim, J.E. Huh [et al.] // J. Korean. Med. Sci. — 2011. — Vol. 26(2). — P. 258-263.
29. Association between chronic kidney disease detected using creatinine and cystatin C and death and cardiovascular events in elderly Mexican Americans: the Sacramento Area Latino Study on Aging [Text] / C.A. Peralta, A. Lee, M.C. Odden [et al.] // J. Am. Geriatr. Soc. — 2013. — Vol. 61(1). — P. 90-95.
30. Кравчун Н.О. Сучасні діагностичні маркери діабетичної нефропатії [Текст] / Н.О. Кравчун, Ю.О. Кривовяз // Пробл. ендокрин. патології. — 2012. — № 3. — С. 104-112.
31. Association between serum cystatin C levels and cardiovascular disease in type 2 diabetic patients [Text] / S. Triki, O. Fekih, I. Hellara [et al.] // Ann. Biol. Clin. — 2013. — Vol. 71(4). — P. 438-442.
32. Higher cystatin C level predicts long-term mortality in patients with peripheral arterial disease [Text] / G. Urbonaviciene, G.P. Shi, S. Urbonavicius [et al.] // Atherosclerosis. — 2011. — Vol. 216(2). — P. 440-445.
33. Cystatin C is independently associated with total and cardiovascular mortality in individuals undergoing coronary angiography. The Ludwigshafen Risk and Cardiovascular Health (LURIC) study [Text] / R.P. Woitas, M.E. Kleber, A. Meinitzer [et al.] // Atherosclerosis. — 2013. — Vol. 229(2). — P. 541-548.
34. Use of cystatin C-based estimations of glomerular filtration rate in patients with type 2 diabetes [Text] / R.A. Chudleigh, R.L. Ollerton, G. Dunseath [et al.] // Diabetologia. — 2009. — Vol. 52(7). — P. 1274-1278.
35. Cystatin-based estimated GFR versus creatinine-based and creatinine- and cystatin-based estimated GFR for ESRD and mortality risk in diabetes [Text] / J. Skupien, J.H. Warram, P.H. Groop [et al.] // Am. J. Kidney Dis. — 2013. — Vol. 62(1). — P. 184-186.
36. Combined association of albuminuria and cystatin C-based estimated GFR with mortality, coronary heart disease, and heart failure outcomes: the Atherosclerosis Risk in Communities (ARIC) Study [Text] / S. Waheed, K. Matsushita, Y. Sang [et al.] // Am. J. Kidney Dis. — 2012. — Vol. 60(2). — P. 207-216.
37. Combined association of creatinine, albuminuria, and cystatin C with all-cause mortality and cardiovascular and kidney outcomes[Text] / S. Waheed, K. Matsushita, B.C. Astor [et al.] // Clin. J. Am. Soc. Nephrol. — 2013. — Vol. 8(3). — P. 434-442.
38. Dynamic evaluation of renal resistive index in normoalbuminuric patients with newly diagnosed hypertension or type 2 diabetes [Text] / R.M. Bruno, E. Daghini, L. Landini [et al.] // Diabetologia. — 2011. — Vol. 54(9). — P. 2430-2439.
39. Renal duplex sonographic evaluation of type 2 diabetic patients [Text] / M. Mancini, M. Masulli, R. Liuzzi [et al.] // J. Ultrasound Med. — 2013. — Vol. 32(6). — P. 1033-1040.
40. Relations between ACE gene and ecNOS gene polymorphisms and resistive index in type 2 diabetic patients with nephropathy [Text] / H. Taniwaki, E. Ishimura, N. Matsumoto [et al.] // Diabetes Care. — 2001. — Vol. 24(9). — P. 1653-1660.
41. Milovanceva-Popovska M. Progression of diabetic nephropathy: value of intrarenal resistive index (RI) [Text] / M. Milovanceva-Popovska, S. Dzikova // Prilozi. — 2007. — Vol. 28(1). — P. 69-79.
42. The resistive index is a marker of renal function, pathology, prognosis, and responsiveness to steroid therapy in chronic kidney disease patients [Text] / K. Hanamura, A. Tojo, S. Kinugasa [et al.] // Int. J. Nephrol. — 2012. — Article ID139565.
43. Hashimoto J. Central pulse pressure and aortic stiffness determine renal hemodynamics: pathophysiological implication for microalbuminuria in hypertension [Text] / J. Hashimoto, S. Ito // Hypertension. — 2011. — Vol. 58(5). — P. 839-846.
44. Schiffrin E.L. Chronic kidney disease: effects on the cardiovascular system [Text] / E.L. Schiffrin, M.L. Lipman, J.F. Mann // Circulation. — 2007. — Vol. 116(1). — P. 85-97.
45. Microvascular degenerative complications are associated with increased aortic stiffness in type 2 diabetic patients [Text] / C.R. Cardoso, M.T. Ferreira, N.C. Leite [et al.] // Atherosclerosis. — 2009. — Vol. 205(2). — P. 472-476.
46. Estimated glomerular filtration rate and urinary albumin excretion are independently associated with greater arterial stiffness: the Hoorn Study [Text] / M.M. Hermans, R. Henry, J.M. Dekker [et al.] // J. Am. Soc. Nephrol. — 2007. — Vol. 18(6). — P. 1942-1952.
47. Decrease in glomerular filtration rate in Japanese patients with type 2 diabetes is linked to atherosclerosis [Text] / H. Taniwaki, Y. Nishizawa, T. Kawagishi [et al.] // Diabetes Care. — 1998. — Vol. 21(11). — P. 1848-1855.
48. The correlation between pulse wave velocity and diabetic angiopathy [Text] / T. Takegoshi, J. Hirai, T. Shimada [et al.] // Nihon Ronen Igakkai Zasshi. — 1991. — Vol. 28(5). — P. 664-667.
49. Associations between cardio-ankle vascular index and microvascular complications in type 2 diabetes mellitus patients [Text] / K.J. Kim, B.W. Lee, H.M. Kim [et al.] // J. Atheroscler. Thromb. — 2011. — Vol. 18(4). — P. 328-336.
50. Increased renal resistive index in atherosclerosis and diabetic nephropathy assessed by Doppler sonography [Text] / Y. Ohta, K. Fujii, H. Arima [et al.] // J. Hypertens. — 2005. — Vol. 23(10). — P. 1905-1911.
51. The relationship between renal resistive index, arterial stiffness, and atherosclerotic burden: the link between macrocirculation and microcirculation [Text] / J. Calabia, P. Torguet, I. Garcia [et al.] // J. Clin. Hypertens. (Greenwich). — 2014. — Vol. 16(3). — P. 186-191.
52. Renal resistive index and cardiovascular and renal outcomes in essential hypertension [Text] / Y. Doi, Y. Iwashima, F. Yoshihara [et al.] // Hypertension. — 2012. — Vol. 60(3). — P. 770-777.
53. Munakata M. Higher brachial-ankle pulse wave velocity as an independent risk factor for future microalbuminuria in patients with essential hypertension: the J-TOPP study [Text] / M. Munakata, Y. Miura, K. Yoshinaga, J-TOPP study group // J. Hypertens. — 2009. — Vol. 27(7). — P. 1466-1471.
54. Mulè G. Unfavourable interaction of microalbuminuria and mildly reduced creatinine clearance on aortic stiffness in essential hypertension [Text] / G. Mulè, S. Cottone, P. Cusimano // Int. J. Cardiol. — 2010. — Vol. 145(2). — P. 372-375.
55. Central blood pressure and pulse wave velocity: relationship to target organ damage and cardiovascular morbidity-mortality in diabetic patients or metabolic syndrome. An observational prospective study. LOD-DIABETES study protocol [Text] / M.A. Gomez-Marcos, J. I. Recio-Rodriguez, E. Rodriguez-Sanchez [et al.] // BMC Public Health. — 2010. — Vol. 10. — P. 143.
56. Goldsmith D. Vascular calcification: a stiff challenge for the nephrologist: does preventing bone disease cause arterial disease? [Text] / D. Goldsmith, E. Ritz, A. Covic // Kidney Int. — 2004. — Vol. 66(4). — P. 1315-1333.
57. Lankin V.Z. Free radical lipoperoxidation during atherosclerosis and antioxidative therapy of this disease [Text] / V.Z. Lankin, A.K. Tikhaze // Free Radicals, Nitric Oxide, and Inflammation: Molecular, Biochemical, and Clinical Aspects, NATO Science Series. — 2003. — Vol. 344. — P. 218-231.
58. Окислительный стресс. Патологические состояния и заболевания [Текст] / Е.Б. Меньщикова, Н.К. Зенков, В.З. Ланкин [и др.]. — Новосибирск: АРТА, 2008. — 283 с.
59. Yla-Herttuala S. Macrophages and oxidized low density lipoproteins in the pathogenesis of atherosclerosis [Text] / S. Yla-Herttuala // Ann. Med. — 1991. — Vol. 23(5). — P. 561-567.
60. Lankin V.Z. The enzymatic systems in the regulation of free radical lipid peroxidation [Text] / V.Z. Lankin // Free Radicals, Nitric Oxide, and Inflammation: Molecular, Biochemical, and Clinical Aspects, NATO Science Series. — 2003. — Vol. 344. — P. 8-23.
61. Окислительный стресс. Прооксиданты и антиоксиданты [Текст] / Е.Б. Меньщикова, В.З. Ланкин, Н.К. Зенков [и др.]. — М.: Слово, 2006. — 553 с.
62. Ланкин В.З. Свободнорадикальные процессы при заболеваниях сердечно-сосудистой системы [Текст] / В.З. Ланкин, А.К. Тихазе, Ю.Н. Беленков // Кардиология. — 2000. — № 40(7). — P. 48-61.
63. Diabetic retinopathy is associated with oxidative stress and mitigation of gene expression of antioxidant enzymes [Text] / M.F. El-Bab, N.S. Zaki, M.A. Mojaddidi [et al.] // Int. J. Gen. Med. — 2013. — Vol. 6. — P. 799-806
64. The Effect of Natural Dicarbonyls on Activity of Antioxidant Enzymes in Vitro and in Vivo [Text] / V.Z. Lankin, G.G. Кonovalova, A.K. Tikhaze [et al.] // Biomedical Chemistry. — 2012. — Vol. 6(1). — P. 81-86.
65. Ланкин В.З. Особенности модификации липопротеидов низкой плотности в развитии атеросклероза и сахарного диабета типа 2 [Текст] / В.З. Ланкин, А.К. Тихазе, Е.М. Кумскова // Кардиологический вестник. — 2008. — № 3(1). — С. 60-67.
66. Kandhro A.J. Capillary gas chromatographic determination of methylglyoxal from serum of diabetic patients by precolumn derivatization using meso-stilbenediamine as derivatizing reagent [Text] / A.J. Kandhro, M.A. Mirza, M.Y. Khuhawar // J. Chromatogr. Sci. — 2008. — Vol. 46(6). — P. 539-543.
67. Baynes J.W. Role of oxidative stress in development of complications in diabetes [Text] / J.W. Baynes // Diabetes. — 1991. — Vol. 40. — P. 405-441.
68. Окислительный стресс при атеросклерозе и диабете [Текст] / В.З. Ланкин, М.О. Лисина, Н.Е. Арзамасцева [и др.] // Бюл. экспер. биол. мед. — 2005. — № 140(7). — С. 48-52.
69. Ahmed N. Advanced glycation endproducts: what is their relevance to diabetic complications? [Text] / N. Ahmed, P.J. Thornalley // Diabbetes Obes. Metab. — 2007. — Vol. 9(3). — P. 233-245.
70. Aldehyde-dependent modification of low density lipoproteins [Text] / V.Z. Lankin, A.K. Tikhaze, G.G. Konovalova [et al.] // Publish. Inc. — 2010. — P. 85-107.
71. Механизмы окислительной модификации липопротеидов низкой плотности при окислительном и карбонильном стрессе [Текст] / В.З. Ланкин, А.К. Тихазе, В.И. Капелько [и др.] // Биохимия. — 2007. — № 72(10). — C. 1330-1341.
72. The Influence of Glucose on the Free Radical Peroxidation of Low Density Lipoproteins in Vitro and in Vivo [Text] / V.Z. Lankin, G.G. Konovalova, A.K. Tikhaze [et al.] // Biomedical Chemistry. — 2011. — Vol. 5(3). — P. 284-292.
73. Lipid peroxide levels in diabetics with micro- and macro-angiopathies [Text] / H.S. Chittar, K.D. Nihalani, P.K. Varthakavi [et al.] // J. Nutr. Biochem. — 1994. — Vol. 5. — P. 442-445.
74. Niedowicz D.M. The role of oxidative stress in diabetic complications [Text] / D.M. Niedowicz, D.L. Daleke // Cell. Biochem. Biophys. — 2005. — Vol. 43(2). — P. 289-330.
75. The initiation of free radical peroxidation of low-density lipoproteins by glucose and its metabolite methylglyoxal: a common molecular mechanism of vascular wall injure in atherosclerosis and diabetes [Text] / V.Z. Lankin, G.G. Konovalova, A.K. Tikhaze [et al.] // Mol. Cell. Biochem. — 2014. — Vol. 395(1–2). — P. 241-52.
76. Zieman S. Advanced glycation end product cross-linking: pathophysiologic role and therapeutic target in cardiovascular disease [Text] / S. Zieman, D. Kass // Congest. Heart Fail. — 2004. — Vol. 10(3). — P. 144-149.
77. Glucose autoxidation induces functional damage to proteins via modification of critical arginine residues [Text] / S. Chetyrkin, M. Mathis, V. Pedchenko [et al.] // Biochemistry. — 2011. — Vol. 50(27). — P. 6102-6012.
78. Advanced glycation end-product cross-link breakers. A novel approach to cardiovascular pathologies related to the aging process [Text] / G.L. Bakris, A.J. Bank, D.A. Kass [et al.] // Am. J. Hypertens. — 2004. — Vol. 17(12). — P. 23-30.
79. Yuen A. Methylglyoxal-modified collagen promotes myofibroblast differentiation [Text] / A. Yuen, C. Laschinger, I. Talior // Matrix Biol. — 2010. — Vol. 29(6). — P. 537-548.

/157.jpg)
/161.jpg)
/162.jpg)
/163.jpg)