Статья опубликована на с. 37-40
Остеоартроз (ОА) — гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими и клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондрального участка кости, синовиальной оболочки, связок, капсулы, периартикулярных мышц. Распространенность ОА увеличивается с возрастом: 1 % населения болеет в возрасте до 30 лет, 10 % — до 40 лет, а более 50 % — старше 60 лет. К 70-летнему возрасту поражение коленных суставов выявляется приблизительно у 30–40 % населения. Рентгенологические признаки остеоартроза коленных суставов обнаруживаются у 30 % лиц обоих полов старше 65 лет, среди которых лишь одна треть отмечает наличие клинических симптомов.
В настоящее время патогенетическая терапия остеоартроза направлена на подавление синовиального воспаления и снижение активности провоспалительных ферментов. И здесь в существенно большей степени, чем при каком-либо другом заболевании, актуален вопрос о безопасности фармакотерапии, так как, с одной стороны, хроническая боль и депрессия, тяжелые функциональные нарушения оказывают негативное воздействие на прогноз заболевания, с другой — многие лекарственные средства, используемые при остеоартрозе, способны вызывать тяжелые, потенциально смертельные осложнения, риск которых особенно велик из-за наличия множественных коморбидных заболеваний у людей пожилого возраста. В первую очередь это касается назначения нестероидных противовоспалительных препаратов (НПВП), являющихся эффективным патогенетическим средством лечения боли, связанной с тканевым повреждением и воспалением. Однако клинические достоинства НПВП во многом уменьшает серьезный риск развития класс-специфических осложнений, опасность которых в пожилом возрасте весьма велика.
Именно поэтому особое значение придается безопасной болезнь-модифицирующей терапии, которая способна не только эффективно влиять на боль и воспаление, снижая частоту и тяжесть клинических рецидивов заболевания, но и воздействовать на структуру хряща, замедляя прогрессирование заболевания и нарастание инвалидизации на длительное время.
13 мая 2015 года в г. Киеве состоялась научно-практическая конференция с международным участием «Международные и отечественные лечебно-диагностические стандарты для врача общей практики», в рамках которой были рассмотрены важнейшие вопросы терапии остеоартроза, в том числе применение медленнодейcтвующих симптом-модифицирующих препаратов (SYSАDOA), открывающих новые возможности и перспективы лечения данного заболевания.
С докладом «Эффективная и рациональная терапия остеоартроза: что предпочесть?» выступил доктор медицинских наук Д.Г. Рекалов (Запорожский государственный медицинский университет).
Остеоартроз — одно из наиболее распространенных заболеваний суставов у пациентов во всем мире. Согласно отчету ВОЗ о социальных последствиях данной патологии, гонартроз занимает четвертое место среди причин нетрудоспособности у женщин и восьмое — у мужчин, в 25 % случаев приводит к инвалидизации. Ежегодные расходы, связанные с ОА, поистине огромны, что обусловлено как широкой распространенностью заболевания, так и высокими затратами на лечение. Например, ежегодное количество визитов к врачу, обусловленных остеоартрозом, составляет 46 млн. Количество госпитализаций с данной патологией достигает 3,7 млн в год, что в 20–30 раз больше, чем аналогичный показатель для ревматоидного артрита. В связи с этим большое значение сегодня приобретают методы терапии ОА, которые могли бы способствовать уменьшению проявления симптомов этого заболевания, замедлению его прогрессирования, снижению частоты обращений пациентов за медицинской помощью и предотвращению потери трудоспособности.
На сегодншний день в рекомендациях по лечению остеоартроза выделяют нефармакологическую и фармакологическую терапию. Нефармакологическая терапия представляет собой обучение пациентов и социальную поддержку, коррекцию массы тела, физическую активность, физиотерапевтические процедуры, ортопедические пособия и самообразование. Фармакологическая терапия включает применение ацетаминофена, анальгетиков, топических и пероральных –НПВП, в том числе ингибиторов ЦОГ-2. В случае их неэффективности при остеоартрозе прибегают к хирургическому лечению, назначению опиоидов и акупунктуры. Также в течение последних двух десятилетий в международные рекомендации по лечению ОА включают препараты SYSADOA, к которым относятся: глюкозамина сульфат, хондроитина сульфат, неомыляемые экстракты сои и авокадо, диацереин, гиалуроновая кислота внутрисуставно. Так, в рекомендациях ESCEO (The European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis) предложено использование рецептурного SYSADOA, при необходимости с парацетамолом, в качестве сопутствующей фармакологической терапии 1-й линии для лечения остеоартроза коленного сустава. В рекомендациях EULAR изложена информация о существовании убедительных данных, подтверждающих эффективность SYSADOA в качестве симптом-модифицирующих препаратов.
Структурно-модифицирующий эффект глюкозамина сульфата при максимально раннем назначении был доказан в 3-летнем наблюдении; другие рандомизированные клинические исследования продемонстрировали длительное, сохраняющееся на протяжении 6 месяцев и более превосходство глюкозамина сульфата в сравнении с плацебо, в отличие от неоригинальных продуктов и глюкозамина хлорида. Подобная эффективность при лечении начальных и умеренных проявлений остеоартроза свойственна и хондроитину сульфату, что подтверждено данными длительных наблюдений. Не меньший интерес в лечении остеоартроза представляют неомыляемые соединения масел сои и авокадо (препарат Пиаскледин®), обладающие доказанной клинической эффективностью и потенциальными хондропротективными свойствами.
Изучение терапевтического действия Пиаскледина было начато профессором Henri Thiers и датируется 50-ми годами ХХ века. В 1971 году показано успешное лечение данным препаратом заболеваний кожи и хряща (склеродермия), что определило его как вещество, активирующее эпидермис, мукозный и коллагеновый слой кожи и кости. В период с 1972 по 1978 г. были продемонстрированы анальгетические свойства Пиаскледина при лечении остеоартроза тазобедренного сустава, а также показано замедление прогрессирования заболевания при его применении.
Механизм действия Пиаскледина обусловлен разнообразным влиянием на патологически значимые активные соединения, участвующие в деградации хряща. Так, было установлено, что он повышает экспрессию трансформирующего фактора роста β1 и β2; повышает экспрессию ингибитора активатора плазминогена; стимулирует синтез протеогликанов и образование коллагеновых волокон; ингибирует и блокирует ИЛ-1, подавляя его коллагенолитический эффект на хондроциты и синовиоциты; при воздействии на человеческие хондроциты Пиаскледин ингибирует синтез коллагеназы, стромелизина, ИЛ-6 и ИЛ-8, а также простагландина Е2, т.е. тех биологических субстанций, которые активно участвуют в развитии воспалительной реакции и как следствие — в последующем повреждении хряща при остеоартрозе.
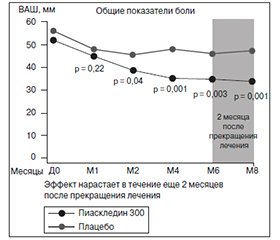
Эффективность и безопасность Пиаскледина были оценены в ряде рандомизированных клинических исследований. Так, в проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном Maheu et al. (1998), было продемонстрировано симптом-модифицирующее действие Пиаскледина. В исследовании приняли участие 164 пациента с остеоартрозом коленных (n = 114) и тазобедренных суставов (n = 50) с умеренными или сильными болями в течение 3 месяцев и более и с продолжительностью активной фазы заболевания не менее 6 месяцев. Все больные были распределены на 2 группы: Пиаскледина и плацебо. Длительность исследования составила 6 месяцев с последующим наблюдением еще в течение 2 месяцев. Оценка состояния проводилась по функциональному индексу Лекена; интенсивность боли — по визуальной аналоговой шкале (ВАШ); общему баллу недееспособности; уровню успешности лечения (наличие или отсутствие потребности в НПВП).
Результаты исследования показали симптоматическую эффективность Пиаскледина в отношении боли и функционального индекса Лекена при лечении остеоартроза. Данный эффект отмечался со второго месяца приема препарата и продолжался по окончании курса лечения еще в течение 2 месяцев (рис. 1).
При этом потребность в НПВП в интервале между 60-м и 90-м днями терапии была достоверно меньше в группе Пиаскледина — 43,4 % против 69,7 % в группе плацебо.
В двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании (Blotman et al., 1997) была оценена потребность в НПВП у 163 больных с умеренными и сильными болями при остеоартрозе коленных и тазобедренных суставов, получавших либо 300 мг/сут Пиаскледина, либо плацебо. В качестве дополнительного анальгетика использовали парацетамол (в режиме «по требованию»). Длительность исследования составила 3 месяца. Первичной конечной точкой являлось количество пациентов, возобновивших прием НПВП после первой половины исследования (45-й день), и время приема НПВП. В качестве вторичной конечной точки (45–90-й день) — кумулятивная и среднесуточная доза НПВП; количество пациентов, которые отказались от приема НПВП на протяжении второй половины исследования; изменение индекса Лекена.
В ходе исследования было установлено, что на фоне приема Пиаскледина потребность в нестероидных противовоспалительных препаратах оказалась достоверно меньше в сравнении с плацебо (43,4 и 69,7 % соответственно; р < 0,001). Кроме того, в основной группе отмечалось достоверно большее улучшение функционального индекса Лекена: в среднем 2,3 и –1,0 балла (р < 0,001).
В 3-месячном многоцентровом рандомизированном клиническом исследовании, проведенном Аppel–boom et al. (2001), оценивались эффективность и безопасность разных доз Пиаскледина (300 и 600 мг/сут) у 260 пациентов с гонартрозом. Результаты исследования показали, что эффективность Пиаскледина в дозах 300 и 600 мг/сут была значительно выше плацебо во всех контрольных точках, разницы между двумя дозировками обнаружено не было. Кроме того, 71 % больных, принимавших Пиаскледин, смогли уменьшить дозу НПВП больше чем в 2 раза, тогда как в группе плацебо такой эффект был достигнут только у 36 % пациентов.
Исследование, проведенное M. Lequesne et al. в 2002 г., включало 163 пациента с одно- или двухсторонним коксартрозом. Стадия по Kellgren-Lawrence к началу исследования была I–II. Обязательными критериями включения в исследование были регистрируемое рентгенологически сужение щели тазобедренного сустава, постоянная боль в пораженных суставах продолжительностью не менее 6 месяцев, индекс Лекена — 4 балла и более.
Пациенты путем рандомизации были разделены на 2 группы: 85 больных на протяжении всего времени исследования получали 300 мг/сут Пиаскледина, 78 пациентов — плацебо. По демографическим и клиническим параметрам группы были сопоставимы.
Результаты исследования продемонстрировали, что в обеих группах отмечались сходные изменения суставной щели. Однако среди больных, имевших ширину суставной щели в начале исследования менее 2 мм, прием Пиаскледина уменьшил отрицательную динамику по сравнению с плацебо практически в 2 раза: при приеме Пиаскледина уменьшение ширины щели в год составило 0,24 мм, и на фоне плацебо — 0,47 мм (p < 0,05) (рис. 2).
В 2009 г. Maheu и соавт. представили результаты исследования структурно-модифицирующего действия Пиаскледина у 399 больных коксартрозом (ERADIAS). Пациенты были стратифицированы по тяжести коксартроза (ширина суставной щели < 2,5 или > 2,5 мм) и рандомизированы в 2 группы, одна из которых получала 300 мг/сут Пиаскледина (166 больных), а другая — плацебо (179 больных) в течение 3 лет. И хотя различие в сужении суставной щели за 3 года между группами Пиаскледина и плацебо оказалось статистически недостоверным (–0,64 и –0,67 мм соответственно; р = 0,72), больных с прогрессированием остеоартроза в группе Пиаскледина было на 20 % меньше, чем в группе плацебо (р = 0,039), что свидетельствует о наличии у препарата структурно-модифицирующих свойств.
В большом сравнительном исследовании, в которое были включены 364 больных ОА коленных суставов, проведенном Pavelka и соавт. (2010), изучались эффективность и безопасность Пиаскледина (300 мг/сут) в сравнении с хондроитина сульфатом (400 мг 3 раза в сутки) в течение 6 месяцев лечения. Препараты показали сходные результаты. В середине и в конце исследования у больных обеих групп функциональные индексы WOMAC и Лекена уменьшились приблизительно на 50 %, а в течение последующих 2 месяцев наблюдения эти показатели продолжали снижаться, демонстрируя наличие эффекта последействия (рис. 3).
Почти 80 % пациентов в сравниваемых группах оценили эффективность терапии как «значительное улучшение» и «улучшение», и практически все больные смогли снизить суточную дозу НПВП. Переносимость Пиаскледина, как и хондроитина сульфата, была хорошей. Также авторы отметили, что однократный прием Пиаскледина наиболее удобен для больных и может значительно повысить комплайентность терапии.
Метаанализ 4 контролируемых клинических исследований Пиаскледина (Maheu; Blotman; Appelbloom и Lequesne) включал в себя 664 пациента с остеоартрозом тазобедренных (41,4 %) и коленных суставов (58,6 %), из которых 336 больных получали активный препарат по 300 мг/сут и 328 — плацебо в течение 6 месяцев (Christensen R. еt al., 2008). Было показано, что Пиаскледин превосходит плацебо по влиянию на боль (среднее уменьшение боли по ВАШ составило 10,7 % при гонартрозе и 11,3 % при коксартрозе; р = 0,04) и функциональный индекс Лекена (р = 0,0003).
Также во всех клинических исследованиях была отмечена высокая безопасность Пиаскледина: ни в одном из них не было зарегистрировано каких-либо значимых побочных эффектов или случаев передозировки препарата, даже при длительном его приеме. Кроме того, немаловажным аспектом безопасности являлось отсутствие значимых лекарственных взаимодействий Пиаскледина с известными лекарственными средствами, что особенно важно для пожилых больных, страдающих остеоартрозом и вынужденных принимать довольно широкий набор препаратов для лечения сопутствующих заболеваний.
Таким образом, на основании всего вышеизложенного можно сделать следующие выводы:
— несмотря на существующие в настоящий момент мультидисциплинарные согласованные рекомендации по многим аспектам медикаментозного и немедикаментозного лечения остеоартроза, при выборе тактики целесообразно использование клинического врачебного опыта для разработки плана терапии, согласованного с пациентом;
— учитывая клинические и экспериментальные данные, использование медленнодействующих симптом-модифицирующих препаратов (SYSADOA) в качестве длительного лечения остеоартроза является необходимой и эффективной составляющей успешной терапии;
— в качестве препаратов первой линии следует использовать оригинальные молекулы, включенные в стандарт лечения и рекомендованные EULAR и OARSI;
— учитывая клиническую подтвержденную эффективность и безопасность, исходя из данных рандомизированных клинических исследований, указывающих на наличие структурно- и симптом-модифицирующего эффекта, целесообразно использовать неомыляемые соединения сои и авокадо (Пиаскледин), при необходимости — в сочетании с парацетамолом, в качестве терапии первой линии для лечения остеоартроза тазобедренного и коленного суставов.
/38.jpg)

/39.jpg)