Статья опубликована на с. 53-56
Половое развитие — генетически обусловленный процесс превращения детского организма во взрослый, способный к воспроизводству. На сроки начала пубертата влияет ряд факторов: немодифицируемые (генетические) и модифицируемые (эндокринные заболевания, наличие избыточной массы тела, уровень физической нагрузки, социальные условия, экзогенное поступление гормонов). Модифицируемые факторы потенциально поддаются коррекции.
Период полового созревания — важный этап развития ребенка. Активация эндокринных механизмов регуляции полового развития у девочек происходит в возрасте 6–7 лет, однако стартовое звено инициации пубертата остается неясным. Инициация полового развития у 99,6 % здоровых девочек происходит в возрасте 8–13 лет. Ведущие позиции занимает гипотеза достижения критической массы тела: менархе наступает после набора массы тела 44–47 кг. Непрерывный процесс полового созревания обычно подразделяется на дискретные стадии, предложенные в качестве критерия визуальной оценки в 1969–1970 гг. W. Marshall и J. Tanner; в дальнейшем методика была утверждена Всемирной организацией здравоохранения.
Телархе — первый признак полового созревания у девочек. Наблюдается в среднем в возрасте 10,5 года. За 2 года молочные железы достигают зрелого размера и формы, соски становятся четко выраженными. Размеры и форма молочных желез у девушек имеют выраженные индивидуальные различия. Пубархе появляется через несколько месяцев после начала роста молочных желез. У 15 % девочек этот признак появляется первым. Менархе обычно наступает через 2 года после начала роста молочных желез. В течение пубертата под влиянием высокого уровня эстрогенов происходит рост костей таза в ширину, в результате чего бедра становятся шире. Нарастает жировая ткань, жир откладывается в основном в области молочных желез, бедер, ягодиц, плечевого пояса, лобка.
Преждевременным половым развитием (ППР) является появление вторичных половых признаков у девочек до 8 лет. Распространенность ППР зависит от нозологического варианта, пола, возраста. В последние годы данное заболевание наблюдается все чаще. Актуальность данной проблемы обусловлена развитием таких осложнений ППР (при отсутствии лечения), как низкорослость (результат преждевременного закрытия зон роста трубчатых костей), диспластическое телосложение (короткие конечности, длинное туловище, широкий таз), ранняя сексуальность, навязчивость, нарушения функции репродуктивной системы (пубертатные маточные кровотечения, дисфункциональные маточные кровотечения в репродуктивном возрасте, синдром поликистозных яичников, ранний климакс). Поэтому необходимость диагностики и лечения ППР общепризнана.
Классификация ППР (у девочек)
I. Гонадотропинзависимое ППР обусловлено преждевременной активацией гипоталамо-гипофизарно-гонадной системы:
— гипоталамическая гамартома;
— объемные образования головного мозга (глиомы и арахноидальные кисты хиазмально-селлярной области и дна третьего желудочка);
— органическое поражение центральной нервной системы;
— идиопатическое ППР.
II. Гонадотропиннезависимое ППР обусловлено активацией стероид-секретирующих элементов гонад без участия гонадотропинов:
— синдром Мак-Кьюна — Олбрайта — Брайцева;
— персистирующие фолликулярные кисты.
III. Ложное ППР обусловлено автономной секрецией половых стероидов надпочечниками или опухолью:
— изосексуальное ППР у девочек обусловлено секрецией эстрогенов (эстрогенпродуцирующие опухоли яичников или надпочечников);
— гетеросексуальное ППР у девочек обусловлено повышенной секрецией андрогенов (андрогенпродуцирующие опухоли яичников или надпочечников, врожденная дисфункция коры надпочечников: дефицит 21-гидроксилазы или 11β-гидроксилазы).
IV. Изолированные формы ППР:
— изолированное преждевременное телархе;
— изолированное преждевременное адренархе.
Диагностика ППР должна проходить в 2 этапа.
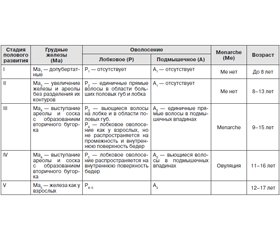
Первый этап — подтверждение ППР. Клиническая диагностика основана на оценке стадии полового развития по шкале J. Tanner (табл. 1).
Обязательными являются антропометрия и подсчет скорости роста ребенка за предшествующие 6–12 мес. Превышение показателей роста (относительно нормы для данного возраста) и скорости роста более 2 SD за предшествующий период свидетельствуют в пользу ППР.
Необходимое исследование, позволяющее оценить костный возраст, — рентгенография кистей с лучезапястными суставами. Опережение костного возраста по сравнению с паспортным более чем на 2 года подтверждает ППР.
Второй этап — дифференциальная диагностика нозологических форм ППР с целью определения тактики лечения. Этот этап включает проведение инструментальных и лабораторных методов исследования. При диагностическом поиске в первую очередь учитываются результаты клинического осмотра.
Развитие ППР у девочек по гетеросексуальному типу (аномальное строение наружных половых органов, появление оволосения) требует исключения патологий, обусловленных повышенной секрецией андрогенов (врожденная дисфункция коры надпочечников (ВДКН), андрогенпродуцирующие опухоли яичников или надпочечников). Акцент при обследовании — на лабораторной диагностике. Обязательным является определение стероидного гормона 17-ОН-прогестерона (17-ОНП), кортизола, дегидроэпиандростерона сульфата (ДГЭА-С), андростендиона и тестостерона. При выявлении повышенного содержания 17-ОНП и/или ДГЭА-С и тестостерона в крови проводится малая проба с дексаметазоном. Методика проведения пробы: дексаметазон принимают внутрь в течение 2 дней, суточная доза составляет 40 мкг/кг. Забор венозной крови осуществляется утром (в 8 ч) накануне приема препарата и утром (в 8 ч) третьего дня (после второго дня приема).
Критерии оценки малой пробы с дексаметазоном:
— в норме содержание 17-ОНП, ДГЭА-С и тестостерона снижается на 50 % и более;
— отсутствие динамики концентрации гормонов предполагает наличие андрогенпродуцирующей опухоли.
Подозрение на андрогенпродуцирующую опухоль требует дальнейшей инструментальной диагностики — проведение ультразвукового исследования (УЗИ)/магнитно-резонансной томографии (МРТ) органов малого таза (ОМТ), надпочечных желез.
При обнаружении повышенного уровня 17-ОНП, ДГЭА-С и пониженного или нормального содержания кортизола необходимо исключить неклассическую форму ВДКН. Проводится проба с синтетическим адренокортикотропным гормоном короткого или пролонгированного действия (тетракозактидом). Методика проведения пробы: в 8–9 ч утра осуществляется забор для определения базальных уровней 17-ОНП и кортизола. Затем подкожно или внутривенно вводят тетракозактид в дозе 0,25–1 мг. Повторный забор крови для определения стимулированных уровней 17-ОНП и кортизола осуществляется при введении препарата короткого действия — через 30 и 60 мин, после введения препарата пролонгированного действия — как минимум через 9 ч.
Критерии оценки пробы с тетракозактидом:
— при повышении базального значения 17-ОНП на 20–30 % (у девочки с преждевременным пубархе) можно предположить неклассическую форму ВДКН;
— в норме: кортизол > 500 нмоль/л, 17-ОНР ≤ 36 нмоль/л (11,9 нг/мл), при дефиците 21-гидроксилазы: 17-ОНР > 45 нмоль/л (14,9 нг/мл) [1].
Согласно рекомендациям Международного эндокринологического общества определять 17-ОНП необходимо ранним утром в фолликулярную фазу: в норме базальный 17-ОНП 2–4 нг/мл, стимулированный 17-ОНП < 10 нг/мл [2].
Для подтверждения моногенных форм ППР (ВДКН) используются молекулярно-генетические методы исследования.
Терапевтическая тактика определяется этиологическим вариантом ППР. Лечение ППР направлено на регрессирование вторичных половых признаков, прекращение менструаций, улучшение ростового прогноза путем замедления ускоренных темпов оссификации скелета.
При выявлении гормонально-активных опухолей надпочечников, яичников применяют хирургические методы лечения. Кроме того, хирургическое лечение применяют при необходимости коррекции наружных половых органов у девочек на фоне ВДКН.
Лечение гетеросексуального ППР на фоне ВДКН — заместительная гормонотерапия глюкокортикоидами. Контроль лечения осуществляется по уровню 17-ОНП (целевой уровень — верхняя граница нормы), также контролируют тестостерон (1 р/год) и ренин крови.
Клинические проявления ППР у девочек по изосексуальному типу сходны с изменениями, наблюдающимися в период полового созревания: увеличение молочных желез с последующим появлением полового оволосения, феминизация фигуры.
Наибольшая информативность в диагностике гонадотропинзависимого ППР принадлежит лютеинизирующему гормону (ЛГ). Обязательные условия при лабораторном обследовании: использование высокочувствительных методик и наличие в лаборатории допубертатных норм. Меньшей диагностической ценностью обладает фолликулостимулирующий гормон (ФСГ). Использование гонадотропного индекса (ЛГ/ФСГ) помогает дифференцировать быстро прогрессирующие формы ППР (соотношение выше) от медленно прогрессирующих, не требующих лечения. Эстрадиол позволяет подтвердить диагноз ППР уже при выраженной прогрессии полового развития и не является информативным на ранних стадиях.
Дополнительным показателем, который позволяет подтвердить ППР, является антимюллеров гормон. Уровень данного гормона практически не определяется у девочек до периода полового созревания, на фоне пубертата отмечается рост показателя [3].
С целью дифференциальной диагностики гонадотропинзависимых форм ППР от гонадотропиннезависимых и от изолированного телархе проводится стимуляционная проба с гонадотропин-рилизинг-гормоном (ГнРГ) [4] (табл. 2).
Критерии оценки пробы:
— повышение ЛГ более 10 Ед/л свидетельствует в пользу гонадотропинзависимого ППР;
— отсутствие стимуляции ЛГ свидетельствует в пользу гонадотропиннезависимого ППР;
— превышение ФСГ над ЛГ свидетельствует в пользу изолированного телархе.
Следующим шагом в диагностическом поиске является использование инструментальных методов. Ультразвуковое исследование ОМТ позволяет не только диагностировать признаки ППР, но и является дополнительным методом дифференциальной диагностики между истинным ППР и изолированным телархе.
Ультразвуковые признаки ППР следующие [5]:
— увеличение размеров матки более 3,4 см;
— формирование угла между шейкой матки и телом;
— появление эндометрия (М-эхо) — 100% признак, но чувствительность данного критерия невысока (42–87 %);
— увеличение размеров яичников более 1–3 мл.
Наличие единичных фолликулов не позволяет дифференцировать ППР от изолированного телархе. Обнаружение кист яичников помогает в диагностике гонадотропиннезависимых форм ППР (синдром МакКьюна — Олбрайта — Брайцева и фолликулярных кист яичников).
Инструментальная диагностика при ППР может также включать проведение МРТ ОМТ, МРТ головного мозга. МРТ головного мозга проводится при доказанном гонадотропинзависимом характере ППР: у девочек младше 6 лет — обязательна, девочкам с дебютом ППР в промежутке от 6 до 8 лет проводится при наличии неврологической симптоматики и признаков гипопитуитаризма.
Для лечения истинного ППР в настоящее время применяются аналоги гонадотропин-рилизинг-гормона. Непременное условие терапии пролонгированными аналогами ГнРГ — непрерывность терапии, ведение календаря и соблюдение режима инъекций.
Оценка эффективности терапии проводится не раньше чем через 3 мес. от начала лечения, затем каждые 6 мес. по совокупности клинических и лабораторных показателей и включает:
— осмотр ребенка 1 раз в 6 мес. (антропометрия, оценка полового развития);
— рентгенография кистей 1 раз в год (при высоких темпах роста и прогрессии полового развития — 1 раз в 6 мес.);
— проведение инструментальных исследований (ультразвуковое исследование органов малого таза — 1 раз в 6 мес.);
— лабораторное обследование. Определение уровня ЛГ, ФСГ, эстрадиола — 1 раз в 6 мес. (анализы проводятся за 1–3 дня до очередной инъекции препарата), проведение пробы с ГнРГ через 6 мес. от начала терапии и при прогрессии полового развития. Умеренно повышенный уровень ФСГ не является признаком отсутствия эффекта от терапии.
Единых общепринятых схем терапии гонадотропиннезависимых форм преждевременного полового развития (синдром Мак-Кьюна — Олбрайта — Брайцева) в настоящее время не существует. Проводятся научные исследования по лечению девочек с синдромом Мак-Кьюна — Олбрайта — Брайцева антиэстрогенами (тамоксифен, торемифен, фулвестрант).

/54.jpg)
/55.jpg)