Статья опубликована на с. 96-100
В настоящее время оптимальным методом лечения неактивных аденом гипофиза (НАГ) в большинстве случаев является консервативная терапия агонистами дофамина, приводящая к нормопролактинемии и уменьшению объема опухоли у 80 % больных [2, 4, 7]. На фоне лечения должны полностью восстановиться половые функции и фертильность, а также зрение, исчезнуть галакторея, повыситься до нормы плотность костной ткани, исчезнуть или значительно уменьшиться в размерах опухоль (по возможности без нарушения функций гипофиза или гипоталамуса или с их восстановлением) [3, 9]. Дофамин, который секретируется нейронами дугообразного ядра, является основным фактором, угнетающим секрецию пролактина через D2-рецепторы, локализованные в мембранах лактотропоцитов [5, 10]. Одновременно установлено, что γ-аминомасляная кислота, гонадотропин-связывающий пептид, гастрин, соматостатин, а также стимуляция холинергической иннервации также участвуют в высвобождении пролактина [11]. В настоящее время препаратом выбора при лечении НАГ является каберголин. Большая эффективность каберголина, пролонгированность действия, удобная дозировка и хорошая переносимость делают его назначение наиболее клинически обоснованным для лечения как неактивных, так и гормонально-активных аденом гипофиза [8, 11]. С учетом вышеизложенного представляет особый интерес вопрос влияния каберголина на клиническое течение НАГ.
Эффективность каберголина в отношении уменьшения размеров опухоли мы наблюдали у больного К., 23 лет, который поступил в отделение нейроэндокринологии РСНПМЦЭ в ноябре 2013 года с жалобами на полидипсию, полиурию, эпизоды выраженной головной боли преимущественно в теменной и лобной областях, двоение при взгляде влево и вверх, общую слабость, повышенную утомляемость, зябкость, постоянную сонливость, ухудшение памяти, уменьшение массы тела, плохой аппетит. Из анамнеза: считает себя больным с 2011 г., когда на фоне полного здоровья появились жажда (пил до 7 л жидкости в сутки) и учащенное мочеиспускание. В апреле 2011 г. при обследовании в поликлинике по месту жительства был установлен несахарный диабет. При этом визуализирующие методы обследования головного мозга не проводились, а была назначена терапия десмопрессином с удовлетворительным эффектом. Однако с этого времени больной стал отмечать эпизоды сильных головных болей, постепенно нарастающую слабость, головокружение, выраженную сонливость, снижение аппетита, уменьшение массы тела, отечность конечностей. С мая 2013 года появились боли в коленных и голеностопных суставах. Из-за резкого снижения зрения пациент обратился к окулисту. При проведении МРТ гипоталамо-гипофизарной области была выявлена опухоль гипофиза. Для уточнения тактики лечения пациент направлен на консультацию к нейроэндокринологу. Объективно: нормостенического телосложения. Кожные покровы бледные, сухие. Небольшая отечность лица, пастозность голеней и стоп. Припухлость левого века, левосторонний птоз. ЧСС 70 уд/мин, АД 130/85 мм рт.ст. Внутренние органы — без особенностей. Щитовидная железа не увеличена, мягко-эластичной консистенции. Половой статус: оволосение на лобке горизонтальное, мошонка со складчатостью, слабой пигментации, яички Vs = Vd = 20 мл. Половой жизнью не живет в течение пяти последних лет, отсутствует половое влечение. Утренние эрекции редкие. По вопросу нарушения половых функций не обследовался, так как считал это возрастными изменениями. Отмечается двухсторонняя истинная гинекомастия. Общий анализ крови: Hb — 113 г/л (норма — 120–140), эритроциты — 3,7 × 1012/л (3,9–4,7), лейкоциты — 4,5 × 109/л (4,0–9,0), лимфоциты — 25 % (19–39), палочкоядерные — 2 % (1–5), сегментоядерные — 66 % (47–72), эозинофилы — 2 % (1–6), моноциты — 5 % (3–11), СОЭ — 10 мм/ч (0–15). Общий анализ мочи: относительная плотность — 1010, белок (–), эп. пл. — 1–2 в п/з, лейкоциты — 3–4 в п/з. Биохимический анализ крови: АЛТ — 18 U/L (0–40); АСТ — 22 U/L (0–35); билирубин общий — 10,2 мкмоль/л (8,5–20,5); мочевина — 5,9 ммоль/л (2,5–8,3); креатинин — 75,9 мкмоль/л (61–132); общий белок — 75,9 г/л (63–85); альбумин — 42,0 г/л (35–55); кальций — 2,0 ммоль/л (2,1–2,6); калий — 3,4 ммоль/л (3,5–5,4); натрий — 145,8 ммоль/л (130–150); хлориды — 102,8 ммоль/л (97–105). Липидограмма: холестерин — 5,8 ммоль/л (3,7–5,2); триглицериды — 0,97 ммоль/л (до 1,7); ХС ЛПВП — 1,06 ммоль/л (более 1,6); ХС ЛПНП — 2,4 ммоль/л (2,4–5,4); ХС ЛПОНП — 0,44 ммоль/л (0,25–0,55); гликированный гемоглобин — 5,9 %, сахар крови натощак — 5,0 ммоль/л. Гормональные анализы крови: ЛГ — 0,6 МЕд/л (1,8–10,0), ФСГ — 1,5 МЕд/л (1,3–11,5), ПРЛ — 20,3 нг/мл (1–18), тестостерон — 1,25 нмоль/л (10,4–41,6), св. Т4 — 8,7 пмоль/л (11,5–23); ТТГ — 0,8 мМЕ/л (0,17–4,05), АКТГ — 11,6 нг/мл (< 50), кортизол — 208,1 нмоль/л (260–720). Анализ мочи по Зимницкому: суточный диурез 4600 мл на фоне двух капель десмопрессина в сутки; дневной — 1800 мл, ночной — 2800 мл, удельный вес — 1001–1014. ЭКГ — ритм синусовый, брадикардия. Умеренные метаболические изменения миокарда. Протокол МРТ головного мозга: на серии томограмм турецкое седло расширено, деформировано. В селлярной области определяется крупное неправильной формы образование, распространяющееся кверху с проникновением в хиазмальную цистерну вдоль воронки гипофиза. Тенденция распространения опухоли латероселлярно влево. Образование с четкими неровными контурами, однородной структуры, размером 23 × 21 × 12 мм. Свечение от нейрогипофиза снижено. Пещеристые синусы и видимые отделы внутренних сонных артерий без особенностей. Заключение: МРТ-признаки объемного образования селлярной области (аденома гипофиза) с супраселлярным и латероселлярным преимущественно влево ростом. Консультация офтальмолога: VOD = 0,3–0,4; VOS = 0,3–0,4. Поля зрения — битемпоральная гемианопсия. Отек верхнего века OS, ограничение подвижности его вверх, репозиция затруднена. Глазное дно: диски зрительных нервов с четкими контурами, обычной окраски.
В отделении проводилась терапия препаратами глюкокортикоидов для парентерального введения (гидрокортизона ацетат 25% по 2,0 утром и 1,0 в 16:00), терапия препаратами тиреоидных гормонов (левотироксин натрия по 50 мкг), препаратами десмопрессина — интраназально (доза была увеличена — по 1 капле каждые 8 часов) и назначен каберголин в дозе 0,5 мг каждые 48 часов.
Больной выписан из отделения с диагнозом: макроаденома гипофиза с супра- и параселлярным влево ростом (НАГ). Осложнения: пангипопитуитаризм, вторичный гипокортицизм, вторичный гипотиреоз, гипогонадотропный гипогонадизм. Центральный несахарный диабет. Функциональная гиперпролактинемия. Двухсторонняя амблиопия.
Была выбрана тактика динамического наблюдения за пациентом с повторным осмотром через 3 месяца и рекомендовано: кортизона ацетат по 25 мг 2 раза в день, левотироксин натрия по 50 мкг в день, омнадрен 250 1 мл внутримышечно 1 раз в 4 недели; десмопрессин по 1 капле каждые 8 часов, каберголин в дозе по 0,5 мг каждые 48 часов в течение 6–12 месяцев. Больной назначенную терапию переносил без побочных явлений, через 3 месяца от начала терапии стал отмечать повышение АД, склонность к отекам. Доза десмопрессина сначала была снижена до двух капель в сутки, затем через 1,5 месяца препарат был полностью отменен. При контрольном анализе мочи без применения десмопрессина наблюдался нормальный удельный вес. Несмотря на отмену десмопрессина, сохранялись тенденция к повышению АД, склонность к повышенному аппетиту. Была снижена доза кортизона ацетата до 25 мг и левотироксина натрия — до 25 мкг в день.
При повторном визите пациента через 6 месяцев гормональные анализы крови показали нормальные уровни кортизола в 8 часов и нормальные уровни свободного кортизола в суточной моче, нормостенурию без препаратов десмопрессина. Далее доза каберголина была снижена до 0,5 мг каждые 72 часа, и рекомедовано продолжить прием левотироксина натрия по 25 мкг с достижением эутиреоза. На фоне приема омнадрена симптомы гипоандрогении нивелировались, что позволило увеличить интервал вводимой дозы препарата от трех недель до 1–1,5 месяца.
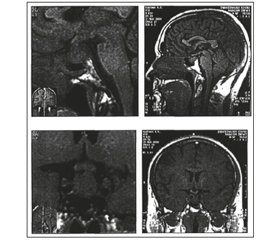
При исследовании через 6 месяцев результаты МРТ головного мозга были следующими: турецкое седло не расширено, отмечается значительная положительная динамика опухоли — отсутствие супраселлярного распространения. Опухоль однородной структуры, размером 17 × 15 × 9 мм. Нейрогипофиз без особенностей. Пещеристые синусы и видимые отделы внутренних сонных артерий без особенностей. Заключение: МРТ-признаки состояния после лечения аденомы гипофиза, значительная положительная динамика опухоли — отсутствие супраселлярного распространения (рис. 1).
/98.jpg)
Таким образом, лечение каберголином больного с гормонально-неактивной опухолью гипофиза и гипоталамо-гипофизарной недостаточностью способствовало уменьшению объема опухоли более чем на 50 % от исходного и привело к практически полному восстановлению нарушенных гипоталамо-гипофизарных функций и к возможности сократить заместительную гормональную терапию, назначенную за 7 месяцев до начала лечения каберголином. Доза каберголина была уменьшена до 0,5 мг каждые 72 часа. Следует отметить, что данный больной не имел семейно-ассоциированного анамнеза НАГ.
Вместе с тем при лечении каберголином наблюдаются случаи резистентности к препарату. Так, больная З., 1985 г.р., обратилась в РСНПМЦ эндокринологии в мае 2012 года с жалобами на головные боли, нарушение менструальной функции и бесплодие в течение двух лет. Из анамнеза: считает себя больной с 2010 г. Связывает свою болезнь с замужеством. Больная в 2010 году вышла замуж, и через 2–3 месяца после замужества у нее нарушился менструальный цикл. Больная обратилась к гинекологу по месту жительства. Было назначено противовоспалительное и гормональное лечение, однако положительных результатов от лечения не было. Со временем стала отмечать периодические головные боли, купирующиеся аналгетиками. Aнамнез жизни: второй ребенок в семье. Родилась с весом 3400 г, ростом 50 см. Беременность и роды у матери протекали без особенностей. В детстве ничем не болела. Аллергологический анамнез не отягощен. Семейный анамнез: родители больной являются двоюродными братом и сестрой. У отца больной в возрасте 45 лет была выявлена неактивная аденома гипофиза. Объективный статус: общее состояние относительно удовлетворительное. Нормостенического телосложения. Рост 165 см, масса тела 65 кг. Кожные покровы и слизистые обычной окраски, нормальной влажности, стрии отсутствуют. Лимфатические узлы не увеличены. Выявлена лакторея. ЧСС 88 в минуту, АД 110/70 мм рт.ст. Внутренние органы без особенностей. Суточный диурез 1500 мл. Стул: склонность к запорам.
Из данных лабораторного обследования: общий анализ крови, биохимические анализы крови, общий анализ мочи без отклонений; гормональные анализы крови: ПРЛ — 45,7 нг/мл (норма 1–27), тестостерон — 1,25 нмоль/л (0,7–3,1), эстрадиол — 50,0 нг/мл (фол. ф. (среднее значение) — 57–277), св. Т4 — 22,7 пмоль/л (11,5–23); ТТГ — 3,1 мМЕ/л (0,17–4,05), АКТГ — 22,4 нг/мл (< 50), кортизол — 358,4 нмоль/л (260–720), СТГ — 0,67 (0–20). ЭКГ: ритм синусовый, умеренные метаболические изменения в миокарде левого желудочка. УЗИ внутренних органов без особенностей. Консультация нейроофтальмолога: глазное дно бледно-розового цвета, границы слегка стушеванные, экскавация выражена. Артерии неравномерного калибра, вены незначительно расширены. Макулярный рефлекс «+». Visus: OD — 0,9; OS — 0,9. Диагноз: ангиопатия сосудов сетчатки.
МРТ гипоталамо-гипофизарной области: гипофиз обычной формы, размеры: передне-задний — 1,0 см, поперечный — 1,4 см, вертикальный — 0,7 см. Аденогипофиз с четкими ровными контурами, неоднородными сигнальными характеристиками за счет наличия умеренно-гипоинтенсивного участка слева до 0,4 см в диаметре. Нейрогипофиз расположен обычно, с четкими ровными контурами, однородными гиперинтенсивными сигнальными характеристиками. Воронка гипофиза расположена центрально, шириной 0,2 см. Заключение: признаки микроаденомы гипофиза.
На основании результатов обследования больной выставлен следующий диагноз. Основной: неактивная аденома гипофиза интраселлярной локализации (семейно-ассоциированная форма). Функциональная гиперпролактинемия. Осложнение: лакторея-дисменорея. Бесплодие I (2 года).
Рекомендовано каберголин по 0,25 мг каждые 72 часа в течение шести месяцев, контрольный –осмотр через 3 месяца. Больная в указанное время не явилась на повторное обследование и консультацию, а через 1,5 года вновь поступила с жалобами на головные боли, аменорею и ухудшение зрения. Выяснилось, что после первого визита больная забеременела и родила ребенка. Через 1 год после рождения ребенка состояние больной ухудшилось, головные боли не купировались аналгетиками, ухудшилось зрение. Аменорею она связывала с кормлением ребенка грудью, 3 месяца назад она прекратила кормление грудью без возобновления менструального цикла.
При МРТ гипоталамо-гипофизарной области установлено, что турецкое седло расширено, деформировано. В селлярной области определяется крупное неправильной формы образование, распространяющееся кверху проникновением в хиазмальную цистерну вдоль воронки гипофиза. Тенденция распространения опухоли латероселлярно вправо. Образование с четкими неровными контурами, однородной структуры, размером 21 × 24 × 15 мм. Нейрогипофиз без особенностей. Пещеристые синусы и видимые отделы внутренних сонных артерий без особенностей. Заключение: МРТ-признаки объемного образования селлярной области (аденома гипофиза) с эндо-, супра- и латероселлярным вправо ростом. Опухоль тесно прилежит к хиазме зрительных нервов.
Результаты гормонального обследования: ПРЛ — 86,3 нг/мл (1–27), тестостерон — 3,25 нмоль/л (0,7–3,1), св. Т4 — 10,7 пмоль/л (11,5–23), ТТГ — 1,1 мМЕ/л (0,17–4,05), АКТГ — 12,9 нг/мл (< 50), кортизол — 221,4 нмоль/л (260–720), СТГ — 0,06 (0–20), ЛГ — 22,0 МЕ/л (лютеин. ф. 0,7–24,3), ФСГ — 3,5 МЕ/л (лютеин. ф. 1,3–10).
На основании результатов обследований больной выставлен следующий диагноз. Основной: неактивная аденома гипофиза с эндо-, супра- и латероселлярным вправо ростом (семейно-ассоциированная форма). Рецидивирующее течение. Функциональная гиперпролактинемия. Осложнения: нормогонадотропная яичниковая недостаточность. Аменорея II (3 мес.). Вторичный гипотиреоз средней степени тяжести.
Больной после консультации нейрохирурга рекомендовано оперативное лечение: трансназальная-транссфеноидальная аденомэктомия гипофиза (ТАГ). Больная отказалась от оперативного лечения. Поэтому были назначены каберголин по 0,5 мг каждые 48 часов и повторное обследование через 3 месяца. После трех месяцев лечения больной проведено повторное МРТ-обследование гипоталамо-гипофизарной области, при котором не было положительной динамики (рис. 2). После консультации нейрохирурга больной была произведена ТАГ в отделение нейрохирургии РСНПМЦЭ.
Таким образом, анализ клинических случаев показал, что наличие наследственной предрасположенности или семейно-ассоциированных случаев НАГ является диагностически и прогностически неблагоприятным фактором. Полученные данные необходимо учитывать при проведении обследования и разработке тактики лечения при выявлении больных НАГ с наследственной предрасположенностью.
/98.jpg)
/99.jpg)