Статья опубликована на с. 51-58
Почему существует необходимость данного консенсуса?
Синтез кортикостероидов в 1940-х годах трансформировал прежде смертельное заболевание — первичную надпочечниковую недостаточность (ПНН, болезнь Аддисона) в курабельное хроническое состояние. Тем не менее сохраняются как риск смертельного исхода при надпочечниковом кризе, так и связанные с терапией глюкокортикоидами остеопороз, сердечно-сосудистые и другие осложнения [14, 15]; снижены качество жизни и трудоспособность пациентов. Невзирая на то, что распространенность ПНН составляет около 10–15 на 100 000 в популяции и большинство специалистов (даже эндокринологов) редко наблюдают более нескольких пациентов с данной патологией, широкая встречаемость симптоматики, клиническая тяжесть заболевания определяют исключительную важность своевременной высокоточной диагностики.
Симптоматика при ПНН обусловлена нарушением глюкокортикоидной и минералокортикоидной функции надпочечников, независимо от этиологии заболевания. В Европе доминируют аутоиммунные причины [1]. Примерно у половины пациентов с ПНН выявляются сосуществующие аутоиммунные заболевания [1–5, 7–9], комбинации которых классифицируют как несколько аутоиммунных полиэндокринных синдромов (АПС) [10–13].
Рекомендации по диагностике ПНН
Диагностика ПНН требует 2 шагов. Первый — исследование функции коры надпочечников, второй — выяснение этиологии установленной ПНН (так как этиология может повлиять на тактику лечения и последующего наблюдения).
Шаг 1. Исследование функции коры надпочечников. Диагноз ПНН следует рассматривать у всех пациентов с необъяснимыми коллапсами, гипотонией, рвотой или диареей. Гиперпигментация, гипонатриемия, гиперкалиемия, ацидоз и гипогликемия также характерны для ПНН. При подозрении на острую надпочечниковую недостаточность лечение не может быть отложено из-за диагностических процедур (диагноз всегда можно установить позже, даже если лечение началось). Диагностический тест первого ряда при ПНН — одновременное измерение уровня кортизола в сыворотке и адренокортикотропного гормона (АКТГ) в плазме. В сомнительных случаях проводится стимуляционная проба (стандарт: пациенту вводится 0,25 мг косинтропина (синактен, тетракозактид) внутримышечно или внутривенно, а затем измеряется уровень кортизола в сыворотке через 30 и/или 60 мин). Одно из ее значений в норме должно превышать 500 или 550 нмоль/л. Тесты с синактеном также необходимо проводить пациентам с риском развития ПНН (пациенты с аутоантителами к 21-гидроксилазе (21OH-Ab) без явной ПНН и пациенты с АПС-1 без ПНН). Кортизол в сыворотке < 250 нмоль/л (МЛ «ДІЛА» < 9,06 мкг/дл) и повышение АКТГ при наличии острого состояния с симптомами, при которых возникает подозрение на надпочечниковый криз, являются диагностическими при ПНН. Кортизол в сыворотке < 400 нмоль/л (МЛ «ДІЛА» < 14,5 мкг/дл) и повышение АКТГ при наличии симптомов надпочечникового криза — высокоподозрительны на ПНН.
Шаг 2. Диагностика этиологии ПНН представлена в табл. 1 [12, 21–25].
Руководство по заместительной терапии
Замещение глюкокортикоидами
Глюкокортикоиды выделяются в системный кровоток в пульсирующем (ультрадианном) и циркадном ритме, с пиком в первой половине дня и достижением нижней точки в полночь. Лица с нормальной функцией надпочечников продуцируют 5–10 мг кортизола на 1 м2 площади поверхности тела в день [28], что эквивалентно пероральной заместительной дозе 15–25 мг/сутки гидрокортизона. Предпочтительны и равноценны препараты как гидрокортизона, так и кортизона ацетата. Кортизона ацетат начинает действовать несколько позже ввиду необходимости активации до гидрокортизона 11β-гидроксистероиддегидрогеназой 1-го типа, вырабатываемой печенью (табл. 2).
CYP3A4, являющийся ключевым ферментом лекарственного метаболизма, влияет на клиренс гидрокортизона и прием сопутствующих препаратов, что может изменять эффективность гидрокортизона (данные приведены в табл. 3).
АКТГ плазмы и кортизол в сыворотке не пригодны для контроля эффективности лечения. Мониторинг базируется на клинике. Симптомы и признаки передозировки: прибавка веса, бессонница и периферические отеки, в то время как недостаточность заместительной терапии характеризуют вялость, тошнота, плохой аппетит, потеря веса и нарастание пигментации, часто неравномерное. В дополнение к информации о колебаниях веса пациента коррекция ежедневной дозы гидрокортизона может быть проведена по результатам детального опроса о ежедневном приеме таблеток, общем чувстве энергии, тонуса, умственной концентрации, сонливости в дневное время и изменениях пигментации. Данные о слабости, снижении общего тонуса в определенное время дня, времени отхода ко сну и легкости засыпания также информативны.
При подозрении на нарушение всасывания гидрокортизона наиболее информативен для коррекции схемы лечения по времени и количеству мониторинг кривой уровней кортизола в слюне или сыворотке: утром, пиковый уровень после приема препарата и уровни снижения перед последующими принимаемыми дозами.
Коррекция дозы глюкокортикоидов в различных ситуациях
Назначения дексаметазона следует избегать. В настоящее время изучаются возможности применения недавно предложенного в Европе препарата с модифицированным высвобождением гидрокортизона для однократного приема — пленадрена.
Отсутствие аппетита или тошнота и рвота по утрам — общие симптомы у пациентов с ПНН. Предварительное пробуждение для приема первой дозы с последующим возвращением ко сну может облегчить эти симптомы. Пациентам, работающим в ночное время, необходимо скорректировать свой график приема препарата в соответствии с графиком работы (например, первая доза не в 07:00 ч, а 10 мг после пробуждения перед выходом на работу).
Заместительная терапия минералокортикоидами
Потребность в синтетическом минералокортикоиде — 9а-флудрокортизоне (представлен таблетками 0,1 и 0,05 мг, принимается 1 раз утром) соответствует индивидуальному приему/потерям жидкости и электролитов: как правило, достаточно 50–200 мкг/сутки за один прием после пробуждения, но иногда детям, пациентам молодого возраста, женщинам в последнем триместре беременности требуется более высокая доза [31]. Важным компонентом терапии является подсаливание пищи и отсутствие ограничения употребления соленых продуктов, следует также избегать приема так называемой «здоровой» калиевой соли. Эффективность заместительной минералокортикоидной терапии оценивается клинически, путем опрашивания пациента о тяге к соленой пище, измерения артериального давления в положении лежа и в положении стоя, а также выявления периферических отеков. При лечении гипертонической болезни у пациента с ПНН возможно рассмотреть добавление вазодилататоров без отмены минералокортикоидов, доза которых при необходимости может быть снижена. Частой и возможно предрасполагающей к рецидивам надпочечниковых кризов причиной является недостаточность заместительной дозы флудрокортизона, в некоторых случаях компенсирующаяся передозировкой глюкокортикоидов. Факторы, интерферирующие с флудрокортизоном, указаны в табл. 4 [32].
/54.jpg)
Заместительная терапия надпочечниковыми андрогенами
Недостаточная секреция надпочечниковых андрогенов (в том числе дегидроэпиандростерона (ДГЭА)) у пациентов с ПНН может приводить к тяжелому дефициту андрогенов у женщин. Женщинам с ПНН, отсутствием либидо и/или низким тонусом, несмотря на оптимизированную глюкокортикоид- и минералокортикоидзаместительную терапию, может быть рекомендован пробный прием препаратов ДГЭА (10–50 мг 1 раз в день) в течение 6 месяцев, который возможно продолжить при клинической эффективности лечения. Необходим контроль уровней ДГЭА, андростендиона и тестостерона в сыворотке утром до приема препарата (должны соответствовать нормальному уровню). Неизвестны долгосрочные эффекты заместительной терапии препаратами ДГЭА или тестостерона, в связи с чем вышеуказанный режим лечения должен быть использован с осторожностью.
Заместительная терапия глюкокортикоидами при беременности
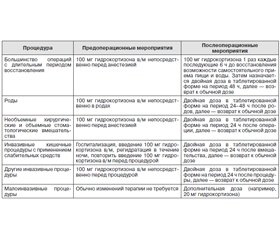
Уровень свободного кортизола повышается в течение третьего триместра, что приводит к увеличению потребности в гидрокортизоне на 2,5 или 10 мг в день. Прогестерон в сыворотке обладает антиминералокортикоидной активностью, соответственно, часто доза флудрокортизона должна быть увеличена в конце беременности (до 500 мкг/день) [31]. Активность ренина плазмы не является адекватным параметром для коррекции дозы флудрокортизона, так как уровни ренина плазмы обычно увеличены во время беременности. Лучшими параметрами мониторинга лечения остаются ощущение потребности в соленом у пациента, артериальное давление и электролиты сыворотки. Заместительная терапия глюкокортикоидами во время родов, послеродового периода, во время хирургических вмешательств и медицинских процедур представлена в табл. 5.
Заместительная терапия глюкокортикоидами во время физической активности
Пациенты с ПНН, занимающиеся регулярными неинтенсивными, ограниченными во времени физическими нагрузками, как правило, не нуждаются в коррекции дозы. Увеличение дозы гидрокортизона и потребления соли может быть необходимым при интенсивной, продолжительной нагрузке (например, при марафоне возможен дополнительный прием 5 мг гидрокортизона до начала соревнований). В условиях высокой температуры окружающей среды или во время активной деятельности необходим прием дополнительного количества жидкости и соли для компенсации их потерь с потом. Пациентам, которые планируют интенсивную или продолжительную нагрузку, следует рекомендовать коррекцию схемы лечения перед физической активностью; однако не существует никаких систематических исследований заместительной терапии во время напряженной физической активности.
Руководство по лечению надпочечникового криза
Надпочечниковый криз является опасным для жизни состоянием, требующим немедленного распознавания и лечения. Даже умеренная дисфункция желудка может нарушать всасывание препаратов. Частота острых надпочечниковых кризов у больных с ПНН — 6–8 на 100 пациенто-лет, провоцирующими факторами часто являются рвота и/или диарея, инфекции, хирургические процедуры, травмы, инфаркт миокарда, тяжелые аллергические реакции, тяжелая гипогликемия у больных сахарным диабетом и нарушение схемы лечения малообразованными или некомплайентными пациентами.
Диагноз
Симптомами надпочечникового криза являются недомогание, усталость, тошнота, рвота, боли в животе (иногда из-за раздражения брюшины), боль в мышцах или судороги, обезвоживание, ведущее к гипотонии и шоку. Нередки нарушения когнитивной функции, в том числе спутанность, потеря сознания и кома. Типичные лабораторные показатели — гипонатриемия, гиперкалиемия, повышение уровня креатинина (вызвано преренальной почечной недостаточностью), гипогликемии (у детей), возможна умеренная гиперкальциемия.
Неотложная терапия (табл. 6).
Лечение больных с симптоматикой возможного надпочечникового криза не должно быть отложено из-за диагностических процедур. По возможности до начала лечения должен быть произведен забор крови для исследования кортизола в сыворотке, АКТГ, Na, K, креатинина, мочевины, глюкозы, проведены другие исследования для выявления причины, спровоцировавшей криз (бактериальные или вирусные инфекции). Внутривенное медленное введение физиологического раствора следует продолжать в течение 24–48 ч. Парентеральное введение глюкокортикоидов следует проводить в течение 1–3 дней при сохраняющихся провоцирующих факторах или затянувшемся, осложненном кризе до перевода на пероральную поддерживающую дозу глюкокортикоидов. Заместительная терапия минералокортикоидами (флудрокортизон) должна быть восстановлена, как только доза гидрокортизона снижается < 50 мг/сут.
Предотвращение надпочечниковых кризов в дальнейшем
Важны:
1) диагностика провоцирующих криз причин (недосаливание пищи, длительный прием недостаточной дозы препаратов, нарушение комплайенса, в том числе ввиду психиатрических заболеваний);
2) обучение пациента коррекции доз препаратов во время интеркуррентных заболеваний, рвоты, травмы, других стрессовых факторов;
3) информирование о необходимости обратиться за медицинской помощью, прежде чем пациент достигает состояния, при котором невозможно осуществить самопомощь.
Руководство по дальнейшему ведению пациентов с ПНН
Ежегодная консультация должна включать вопросы, касающиеся выполнения домашних и профессиональных обязанностей, самооценку состояния и наличия характерных для ПНН жалоб. При физикальном обследовании показателями достаточности заместительной терапии являются нормальные цвет кожи и артериальное давление (постуральная гипотензия отражает неадекватную минералокортикоидную терапию и/или низкое потребление соли). Потеря веса является существенным симптомом недостаточности дозы гидрокортизона/кортизона ацетата, стрессовой ситуации или дополнительного заболевания эндокринной (тиреотоксикоз) или неэндокринной (целиакия) систем.
Регулярное лабораторное обследование включает исследование в сыворотке натрия и калия. Исследование кортизола в моче и случайных уровней кортизола в сыворотке, как правило, невозможно интерпретировать. При подозрении на недостаточность заместительной дозы гидрокортизона рекомендован утренний тест поглощения и элиминации гидрокортизона или исследование кривой изменений кортизола в слюне или сыворотке в течение дня (до и через 2, 4, 6 ч после приема утренней дозы). Пациентам с ускоренной элиминацией гидрокортизона предпочтителен режим частого приема препарата. Оценка активности ренина плазмы имеет значение для пациентов с признаками минералокортикоидной недостаточности.
Скрининг сопутствующих состояний (табл. 7).
— Женщины репродуктивного возраста должны быть проинформированы о возможности развития преждевременного истощения яичников, особенно при наличии аутоантител к ферменту, расщепляющему боковую цепь холестерина (20,22-десмолаза, P450scc — кодируется геном CYP11A1) [34].
— Витилиго и очаговая алопеция — частые признаки и считаются маркерами аутоиммунных нарушений.
— У некоторых больных с характерными клиническими признаками необходимо учитывать возможность развития других, менее частых аутоиммунных нарушений.
Ресурсы для врачей и пациентов
Организации для пациентов созданы во многих странах, и общение через Интернет (в том числе http://www.euradrenal.org/) помогает распространять передовой опыт в самоуправлении заболеванием, что делает болезнь более безопасной и переносимой.
Выводы
Первичная надпочечниковая недостаточность (болезнь Аддисона) — потенциально смертельная, но курабельная патология. Заболевание у многих пациентов выявляется уже в состоянии надпочечникового криза, часто приводящего к смерти, при этом своевременная неотложная терапия, оказанная себе самостоятельно хорошо обученным пациентом или помощником, может предотвратить летальный исход. Продолжительность жизни пациентов, получающих адекватную терапию и регулярное наблюдение, не отличается от среднестатистической, при этом снижение субъективных показателей здоровья у многих пациентов остается объектом дальнейшего улучшения терапии, что должно быть целью последующих научных исследований.
Основными положениями протокола по диагностике, лечению, наблюдению пациентов с ПНН являются следующие:
1. Диагноз ПНН следует рассматривать у всех пациентов с необъяснимыми коллапсами, гипотонией, рвотой или диареей. Гиперпигментация, гипонатриемия, гиперкалиемия, ацидоз и гипогликемия также характерны для ПНН.
2. При подозрении на острую надпочечниковую недостаточность лечение не может быть отложено из-за диагностических процедур.
3. Диагностический тест первого ряда при ПНН — одновременное измерение уровня кортизола в сыворотке и АКТГ в плазме (в сомнительных случаях проводится стимуляционная проба (косинтропин — синактен, тетракозактид).
Кортизол в сыворотке < 250 нмоль/л (МЛ «ДIЛА» — < 9,06 мкг/дл) и повышение АКТГ при наличии острого состояния с симптоматикой надпочечникового криза являются диагностическими при ПНН. Кортизол в сыворотке < 400 нмоль/л (МЛ «ДIЛА» — < 14,5 мкг/дл) и повышение АКТГ при наличии симптомов надпочечникового криза — высокоподозрительны на ПНН.
4. Выяснение этиологии ПНН должно начинаться с исследования в сыворотке аутоантител к 21-гидроксилазе надпочечников. Если результат отрицательный, рекомендуется КТ-исследование. У пациентов мужского пола необходимо провести исследование очень длинноцепочечных жирных кислот для исключения Х-сцепленной адренолейкодистрофии.
5. Диагноз АПС-1 следует рассматривать у детей и молодых людей, имеющих наряду с ПНН и другие диагностические клинические проявления (например, гипопаратиреоз и кандидоз).
6. Всем пациентам с гипокортицизмом следует носить сигнальный медицинский идентификационный браслет и иметь при себе карту-оповещение с указанием диагноза и доз принимаемых препаратов, в том числе информации о самостоятельных инъекциях глюкокортикоидов. Пациенты должны быть обучены и уметь как корректировать ежедневную терапию и дозирование препаратов при появлении легких и умеренно выраженных сопутствующих заболеваний, так и делать себе инъекции.
7. Большинству пациентов с ПНН требуется 15–25 мг гидрокортизона (18,75–31,25 мг кортизона ацетата) ежедневно. В протоколе приведены схемы приема препаратов и рекомендации относительно комфортного амбулаторного мониторинга заместительной терапии гипокортицизма по кривой изменений результатов высокоточного исследования «кортизол в слюне» в течение дня.
8. Большинству пациентов с ПНН следует принимать 50–200 мкг флудрокортизона ежедневно однократно. Детям и пациентам молодого возраста могут потребоваться более высокие дозы. При развитии первичной артериальной гипертензии доза флудрокортизона должна быть уменьшена, но не отменена. Следует учитывать интерференции препаратов и других факторов. Пациентам не следует ограничивать потребление соли и соленых продуктов.
9. Существует недостаточно доказательств в пользу заместительной терапии андрогенами.
10. Хирургические вмешательства и инвазивные медицинские процедуры часто требуют внутривенного или внутримышечного введения гидрокортизона и увеличения пероральных дозировок. Коррекция доз гидрокортизона и флудрокортизона необходима во время беременности, особенно в течение последнего триместра; во время родов гидрокортизон должен вводиться парентерально.
11. При надпочечниковом кризе необходимо немедленное в/в или в/м введение 100 мг гидрокортизона с последующим введением 100 мг за 6–8 часов до восстановления состояния. Требуется введение 0,9% раствора хлорида натрия с начальной скоростью 1 л/час
до гемодинамического улучшения. Как только лечение было начато, необходимо установить основную причину возникновения надпочечникового криза (например, инфекция).
12. Наблюдение. Пациенты с ПНН должны быть обследованы не реже 1 раза в год, включая оценку общего состояния, измерение массы, артериального давления и электролитов сыворотки. Необходим мониторинг возникновения новых аутоиммунных заболеваний, в частности гипотиреоза. Оценка осложнений глюкокортикоидной терапии должна включать мониторинг минеральной плотности костной ткани каждые 3–5 лет.
Список литературы
1. Erichsen M.M., Lovas K., Skinningsrud B. et al. Clinical, immunological, and genetic features of autoimmune primary adrenal insufficiency: observations from a Norwegian registry // J. Clin. Endocrinol. Metab. 2009; 94: 4882-90.
2. Soderbergh A., Winqvist O., Norheim I. et al. Adrenal autoantibodies and organ-specific autoimmunity in patients with Addison’s disease // Clin. Endocrinol. 1996; 45: 453-60.
3. Betterle C., Dal Pra C., Mantero F., Zanchetta R. Autoimmune adrenal insufficiency and autoimmune polyendocrine syndromes: autoantibodies, autoantigens, and their applicability in diagnosis and disease prediction // Endocr. Rev. 2002; 23: 327-64.
4. Fichna M., Fichna P., Gryczynska M., Walkowiak J., Zurawek M., Sowinski J. Screening for associated autoimmune disorders in Polish patients with Addison’s disease // Endocrine 2010; 37: 349-60.
5. Reato G., Morlin L., Chen S. et al. Premature ovarian failure in patients with autoimmune Addison’s disease: clinical, genetic, and immunological evaluation // J. Clin. Endocrinol. Metab. 2011; 96: E1255-61.
6. Soderbergh A., Myhre A.G., Ekwall O. et al. Prevalence and clinical associations of 10 defined autoantibodies in autoimmune polyendocrine syndrome type I // J. Clin. Endocrinol. Metab. 2004; 89: 557-62.
7. Myhre A.G., Aarsetoy H., Undlien D.E., Hovdenak N., Aksnes L., Husebye E.S. High frequency of coeliac disease among patients with autoimmune adrenocortical failure // Scand. J. Gastroenterol. 2003; 38: 511-5.
8. Ghaderi M., Gambelunghe G., Tortoioli C. et al. MHC2TA single nucleotide polymorphism and genetic risk for autoimmune adrenal insufficiency // J. Clin. Endocrinol. Metab. 2006; 91: 4107-11.
9. Elfstrom P., Montgomery S.M., Kampe O., Ekbom A., Ludvigsson J.F. Risk of primary adrenal insufficiency in patients with celiac disease // J. Clin. Endocrinol. Metab. 2007; 92: 3595-8.
10. Neufeld M., Maclaren N., Blizzard R. Autoimmune polyglandular syndromes // Pediatr. Ann. 1980; 9: 154-62.
11. Perheentupa J. Autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy // J. Clin. Endocrinol. Metab. 2006; 91: 2843-50.
12. Husebye E.S., Perheentupa J., Rautemaa R., Kampe O. Clinical manifestations and management of patients with autoimmune polyendocrine syndrome type I // J. Intern. Med. 2009; 265: 514-29.
13. Eisenbarth G.S., Gottlieb P.A. Autoimmune polyendocrine syndromes // N. Engl. J. Med. 2004; 350: 2068-79.
14. Bjornsdottir S., Sundstrom A., Ludvigsson J.F., Blomqvist P., Kampe O., Bensing S. Drug prescription patterns in patients with Addison’s disease: a Swedish population-based cohort study // J. Clin. Endocrinol. Metab. 2013; 98: 2009-18.
15. Bjornsdottir S., Saaf M., Bensing S., Kampe O., Michaelsson K., Ludvigsson J.F. Risk of hip fracture in Addison’s disease: a population-based cohort study // J. Intern. Med. 2011; 270: 187-95.
16. Arlt W., Callies F., van Vlijmen J.C. et al. Dehydroepiandrosterone replacement in women with adrenal insufficiency // N. Engl. J. Med. 1999; 341: 1013-20.
17. Ahonen P., Myllarniemi S., Sipila I., Perheentupa J. Clinical variation of autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy (APECED) in a series of 68 patients // N. Engl. J. Med. 1990; 322: 1829-36.
18. Cooper M.S., Stewart P.M. Corticosteroid insufficiency in acutely ill patients // N. Engl. J. Med. 2003; 348: 727-34.
19. Hangaard J., Andersen M., Grodum E., Koldkjaer O., Hagen C. Pulsatile thyrotropin secretion in patients with Addison’s di–sease during variable glucocorticoid therapy // J. Clin. Endocrinol. Metab. 1996; 81: 2502-7.
20. Winqvist O., Karlsson F.A., Kampe O. 21-Hydroxylase, a major autoantigen in idiopathic Addison’s disease // Lancet 1992; 339: 1559-62.
21. Meager A., Visvalingam K., Peterson P. et al. Anti-interferon autoantibodies in autoimmune polyendocrinopathy syndrome type 1 // PLoS Med. 2006; 3: e289.
22. Oftedal B.E., Wolff A.S., Bratland E. Radioimmunoassay for autoantibodies against interferon omega; its use in the diagnosis of autoimmune polyendocrine syndrome type I // Clin. Immunol. 2008; 129: 163-9.
23. Ahlgren K.M., Moretti S., Lundgren B.A. et al. Increased IL-17A secretion in response to Candida albicans in autoimmune polyendocrine syndrome type 1 and its animal model // Eur. J. Immunol. 2011; 41: 235-45.
24. Sanaker P.S., Husebye E.S., Fondenes O., Bindoff L.A. Clinical evolution of Kearns-Sayre syndrome with polyendocrinopathy and respiratory failure // Acta Neurol. Scand. Suppl. 2007; 187: 64-7.
25. Falorni A., Laureti S., De Bellis A. et al. Italian addison network study: update of diagnostic criteria for the etiological classification of primary adrenal insufficiency // J. Clin. Endocrinol. Metab. 2004; 89: 1598-604.
26. Mitchell A.L., Pearce S.H. Autoimmune Addison disease: pathophysiology and genetic complexity // Nat. Rev. Endocrinol. 2012; 8: 306-16.
27. Skinningsrud B., Husebye E.S., Gilfillan G.D et al. X-linked congenital adrenal hypoplasia with hypogonadotropic hypogonadism caused by an inversion disrupting a conserved noncoding element upstream of the NR0B1 (DAX1) gene // J. Clin. Endocrinol. Metab. 2009; 94: 4086-93.
28. Esteban N.V., Loughlin T., Yergey A.L. et al. Daily cortisol production rate in man determined by stable isotope dilution/mass spectrometry // J. Clin. Endocrinol. Metab. 1991; 72: 39-45.
29. Barbetta L., Dall’Asta C., Re T., Libe R., Costa E., Ambrosi B. Comparison of different regimens of glucocorticoid replacement therapy in patients with hypoadrenalism // J. Endocrinol. Invest. 2005; 28: 632-7.
30. Ekman B., Bachrach-Lindstrom M., Lindstrom T., Wahlberg J., Blomgren J., Arnqvist H.J. A randomized, double-blind, crossover study comparing two- and four-dose hydrocortisone regimen with regard to quality of life, cortisol and ACTH profiles in patients with primary adrenal insufficiency // Clin. Endocrinol. 2012; 77: 18-25.
31. Lebbe M., Arlt W. What is the best diagnostic and therapeutic management strategy for an Addison patient during pregnancy? // Clin. Endocrinol. 2013; 78: 497-502.
32. Methlie P., Husebye E.E., Hustad S., Lien E.A., Lovas K. Grapefruit juice and licorice increase cortisol availability in patients with Addison’s disease // Eur. J. Endocrinol. 2011; 165: 761-9.
33. Gurnell E.M., Hunt P.J., Curran S.E. et al. Long-term DHEA replacement in primary adrenal insufficiency: a randomized, controlled trial // J. Clin. Endocrinol. Metab. 2008; 93: 400-9.
34. Winqvist O., Gustafsson J., Rorsman F., Karlsson F.A., Kampe O. Two different cytochrome P450 enzymes are the adrenal antigens in autoimmune polyendocrine syndrome type I and Addison’s disease // J. Clin. Invest. 1993; 92: 2377-85.
/54.jpg)
/56.jpg)

/52.jpg)
/53.jpg)
/55.jpg)