Статтю опубліковано на с. 59-66
Вступ
Ожиріння в сучасному світі визнано однією з найпоширеніших медико-соціальних проблем, що відіграє значну роль у формуванні патології людини, знижує репродуктивний потенціал, негативно впливає на загальний стан, працездатність та якість життя хворих.
За останніми оцінками Всесвітньої організації охорони здоров’я, від надмірної маси тіла в сучасному світі страждають близько 1,5 млрд дорослих людей, ще 350 млн схильні до ожиріння. Близько 20 млн дітей віком до 8 років мають проблеми із зайвою вагою [28]. В Україні кожний четвертий житель має надлишкову масу тіла, а поширеність ожиріння серед працездатного населення становить 30 % [9, 12]. Поширеність ожиріння прогресує з віком як у чоловіків, так і у жінок, сягаючи при цьому найбільших значень у старших вікових групах (понад 50 років) [5]. А закордонні експерти стверджують, що епідемія ожиріння пов’язана не стільки з непомірністю споживання їжі й низьким рівнем активності, скільки з глобальними змінами в способі життя людства [22, 31].
Ожиріння входить до складу метаболічного синдрому (МС), що являє собою поєднання патологічних станів — інсулінорезистентності (ІР), порушення вуглеводного і ліпідного обміну, артеріальної гіпертензії (АГ). У 2005 році Міжнародна діабетична федерація (International Diabetic Federation — IDF) презентувала своє нове визначення МС. Критерії МС, рекомендовані IDF: наявність ожиріння вісцерального типу з визначенням окружності талії (ОТ) (см) з урахуванням специфіки для різних етнічних груп (європейці: > 94 см у чоловіків, > 80 см у жінок) плюс наявність будь-яких двох чинників із чотирьох перерахованих показників: підвищений рівень тригліцеридів (ТГ): > 1,7 ммоль/л або проведення специфічної гіполіпідемічної терапії; знижений рівень ліпопротеїнів високої щільності (ЛПВЩ): < 1,03 ммоль/л у чоловіків і < 1,29 ммоль/л у жінок або проведення специфічної терапії з приводу дисліпідемії; АГ (рівень систолічного артеріального тиску (АТ) > 130 мм рт.ст. або рівень діастолічного АТ > 85 мм рт.ст.) або гіпотензивна терапія з приводу раніше діагностованої АГ; підвищений рівень глюкози в плазмі крові натще > 5,6 ммоль/л або раніше діагностований цукровий діабет (ЦД) 2-го типу.
Клініка МС зумовлена його основними проявами — ожирінням, АГ, дисліпідемією, ІР та захворюваннями, що асоційовані з нею: захворюваннями серця і судин, полікістозом яєчників, апное уві сні, неалкогольною жировою хворобою печінки (НАЖХП), де–якими формами раку. Ожиріння як один із компонентів МС характеризується ураженням серцево-судинної, гепатобіліарної систем, опорно-рухового апарату [18, 33, 35].
Результати фундаментальних досліджень останніх років змінили наше уявлення про адипоцити, що не розглядаються більше як пасивне депо накопичення надлишку енергії у формі ТГ, а визначаються як клітини, які активно регулюють шляхи, відповідальні за енергетичний баланс, і активність яких контролюється комплексною мережею нейрогуморальних сигналів. Так, A.G. Pittas та співавт. висвітлили ключову роль жирової тканини як ендокринного органа, який секретує гормони aдипоцитокіни [30]. Зі збільшенням маси вісцерального жирового депо зростає секреція вільних жирних кислот, фактора некрозу пухлини α, інтерлейкінів, адипокінів (ліпоцитокіни: лептин, адипонектин, резистин, вісфатин, грелін) та інших факторів, що знижують чутливість тканин до інсуліну та сприяють розвитку ІР [18, 24, 27]. Окрім вищезгаданих ліпоцитокінів, жирова тканина секретує низку інших біоактивних сполук, зокрема адипсин і стимулюючий ацилірування протеїн; деякі компоненти комплементу; металопротеїнази; інгібітор тканинного активатора плазміногену 1; судинну молекулу клітинної адгезії 1; протеїни РАС: ангіотензиноген, ренін, ангіотензин І, ангіотензин ІІ, рецептори до ангіотензиногенів, ангіотензинперетворюючий фермент (АПФ). Ці фактори регулюють енергетичний обмін, зсідання крові, імунний захист, запальні реакції, функції ендотелію та диференціювання ліпоцитів і теж чинять вплив на тканинну ІР [1, 11, 35].
Отже, значення жирової тканини як незвичайного багатофункціонального ендокринного органа, що різноманітно й глибоко впливає на організм, не викликає сумніву. Продовження інтенсивних досліджень фізіологічних, клітинних та молекулярних механізмів, що регулюють функцію жирових клітин, взаємодії жирової тканини з іншими системами організму, ідентифікація й характеристика інших нових адипокінів, без сумніву, розширять наші уявлення про ендокринну функцію жирової тканини й різні аспекти регуляції енергетичного обміну як в нормі, так і при патології, відкриють нові перспективи в розробці ефективних технологій у лікуванні ожиріння та його метаболічних наслідків.
Дослідженнями останніх років встановлено вплив гормонів щитоподібної залози (ЩЗ) на дію інсуліну, взаємозв’язок між функцією ЩЗ та ІР, хоча ці зв’язки є досить складними [2, 4, 8]. Яким же чином гіпотиреоз сприяє розвитку інсулінорезистентності? Відповідь на питання слід шукати у факторах, що формують ІР: вісцеральне ожиріння, дисліпідемія, запалення, оксидативний стрес, ендотеліальна дисфункція, АГ, активація симпатоадреналової та ренін-ангіотензин-альдостеронової системи, генетична зумовленість, порушення системи гемостазу [13, 19, 21]. Останніми роками дослідники вивчають роль адипонектину, резистину й лептину в регуляції основного обміну в пацієнтів на тлі зниженої функції ЩЗ. У той же час вирішення питання про справжню роль адипоцитокінів у формуванні асоційованої з ожирінням резистентності до інсуліну є складним завданням через наявність низки суперечливих даних. Результати досліджень щодо участі адипоцитокінів у патогенетичних процесах як при маніфестному, так і при субклінічному гіпотиреозі не дають однозначної відповіді. Останні дослідження показали, що у хворих із синдромом гіпотиреозу значно збільшується вміст цитокінів, які спричиняють порушення тканинної мікроциркуляції та гіпоксію, що провокує активацію та накопичення вільних радикалів, пошкодження серця, ендотеліальну судинну дисфункцію з подальшим посиленням тканинної гіпоксії та порушенням окислювальних процесів. Причому замісна гормональна терапія не завжди нормалізує вміст цитокінів [8, 21, 32].
Останніми десятиріччями встановлено, що одним з патогенетичних механізмів розвитку ІР при ЦД 2-го типу є формування НАЖХП. Печінковою маніфестацією МС є розвиток НАЖХП: неалкогольного стеатозу печінки та неалкогольного стеатогепатиту (НАСГ). Печінкова маніфестація МС — це поєднання основних кластерів синдрому ІР (ожиріння, ЦД 2-го типу, ІР, АГ, дисліпідемія тощо), що чітко асоційовані з НАЖХП [6]. У 63 % осіб, хворих на ЦД, наявний стеатоз печінки, а при ожирінні — у 93 % обстежених [15, 16]. Печінка відіграє ключову роль в обміні вуглеводів, ліпідів, білків, у ній відбуваються процеси синтезу та розпаду ендогенного полімеру глюкози — глікогену, що забезпечує стабільний гомеостаз глюкози в організмі, глюконеогенез. Порушення функцій печінки за умов НАЖХП може сприяти виникненню розладів вуглеводного обміну на тлі гіперінсулінемії, зумовленої зниженням інтенсивності знешкодження інсуліну в печінці та прогресуванням периферичної ІР [23].
Головною метою лікування ожиріння є зменшення ризику від супутніх захворювань та покращення стану хворого загалом, оскільки доведена роль ожиріння в генезі ЦД 2-го типу, АГ, атеросклерозу, подагри, остеоартритів, синдрому нічного апное, репродуктивної дисфункції, деяких онкологічних захворювань — раку прямої кишки, простати, у жінок — раку ендометрію, шийки матки, яєчників, молочних залоз. До лікування ожиріння потрібно підходити всебічно, включаючи: низькокалорійну дієту; збільшення фізичної активності; модифікацію способу життя; медикаментозне лікування; баріатричну хірургію. Також лікування ожиріння має бути підібраним у кожному конкретному випадку і повинно враховувати: стать, вік, ступінь ожиріння, індивідуальний ризик для здоров’я, психологічний статус індивідуума, результати попередніх методів боротьби з ожирінням. У профілактиці, а також у комплексній терапії МС можуть використовуватись: нефармакологічні методи лікування й профілактики: дієта, фізична активність, освіта й самоосвіта; фармакологічні методи лікування: цукрознижуючі препарати, корекція гіперліпідемії (статини), корекція АГ: інгібітори АПФ, діуретики, блокатори рецепторів ангіотензину II, антагоністи кальцію, вплив на систему гемокоагуляції. Першочерговими повинні бути заходи, спрямовані на втручання у спосіб життя: зниження маси тіла, досягнення цільових рівнів глікемії, рівнів ліпідів крові, рівня AT [10, 14]. Відзначено, що навіть немедикаментозна терапія, пов’язана з корекцією способу життя, поліпшує метаболічний і глікемічний контроль, знижує частоту мікро- та макросудинних ускладнень, захворюваність і смертність.
Головним чинником у лікуванні гіпотиреозу, безумовно, є замісна гормональна терапія левотироксином. Разом із тим використовують і симптоматичне лікування, а саме застосування гіполіпідемічних, антигіпертонічних (інгібітори АПФ, блокатори ангіотензинових рецепторів, сечогінні) засобів, а також препаратів, що зменшують масу тіла, вдаються до зміни способу життя, включаючи зміни режиму та раціону харчування, підвищення фізичної активності, відмову від куріння, вживання алкоголю та дієту з низьким вмістом солі.
Фактично понад 80 % прихильних до лікування пацієнтів не здатні досягти зниження маси тіла при модифікації харчової поведінки і способу життя. Модифікація способу життя не має достатнього впливу на зниження маси тіла, що змушує звернути увагу на ефективні додаткові методи профілактичного лікування [29, 31]. Одним з таких видів лікування є застосування препаратів для лікування ожиріння, вплив яких на зниження маси тіла очевидний. Проте залишається неясним вплив препаратів для лікування ожиріння на фактори кардіоваскулярного ризику [25, 29, 34].
Нещодавно було проведено кілька рандомізованих контрольованих клінічних досліджень з вивчення препаратів для лікування ожиріння. Згідно з проведеними дослідженнями, препарати для лікування ожиріння можуть знижувати масу тіла, рівень загального холестерину, ліпопротеїнів низької щільності (ЛПНЩ), глюкози крові натще, відіграють важливу роль в зниженні рівнів систолічного АТ та діастолічного АТ, що, у свою чергу, сприяє зниженню кардіоваскулярного ризику [17, 20, 25, 26]. Однак, незважаючи на великий обсяг фактичного наукового матеріалу, численність методів лікування та медикаментозних засобів, проблема лікування та профілактики ожиріння залишається остаточно не вирішеною, що спонукає до пошуку нових патогенетичних підходів та розробки алгоритму диференційованого лікування. У зв’язку з цим постає проблема поглибленого вивчення механізмів лікувального впливу та терапевтичної ефективності нових лікарських засобів — коректорів порушень метаболічної ланки гомеостазу, ІР, імунної системи.
Безпечним підходом до ефективного лікування ожиріння можна вважати застосування препарату Гуарем — перорального гіпоглікемізуючого лікарського засобу. Гуарем — смола гуарова — харчова клітковина, яку одержують з ендосперму насіння Cyamopsis tetragonolobus. Смола гуарова є полісахаридом, що утворює з водою в’язкий гель, значно подовжує спорожнення шлунка, а також абсорбцію вуглеводів у тонкому кишечнику. Таким чином вона знижує гіперглікемію та концентрацію інсуліну. Вважається, що ефект зниження рівня холестерину в сироватці зумовлений зниженою абсорбцією холестерину, підвищеною секрецією жовчних кислот, а також підвищеним метаболізмом холестерину в печінці [3, 7].
Мета дослідження: вивчення впливу терапії пероральним гіпоглікемізуючим, гіполіпідемічним лікарським засобом Гуарем (смола гуарова) на клінічний перебіг захворювання, показники вуглеводного обміну, ліпідного обміну, ймовірний вплив на ступінь ІР у хворих на ЦД 2-го типу з МС та у хворих на первинний гіпотиреоз з ожирінням, а також вивчення переносимості препарату Гуарем.
Матеріали і методи
Відповідно до мети дослідження групу обстежених становили 39 хворих, з них 15 — із ЦД 2-го типу та ожирінням (І група), 12 — із ЦД 2-го типу, ожирінням та НАЖХП (ІІ група), 12 — із ЦД 2-го типу, ожирінням та гіпотиреозом (ІІІ група). Серед обстежених — 15 (39 %) чоловіків та 24 (61 %) жінки, які перебували на амбулаторному лікуванні в диспансерному ендокринологічному відділенні Івано-Франківської обласної клінічної лікарні. Також обстежено 15 практично здорових осіб (ПЗО), які на першому етапі становили групу контролю.
У подальшому залежно від застосованих методик лікування всі обстежені хворі з ЦД 2-го типу були розподілені на три групи, репрезентативні за віком, статтю, ступенем компенсації ЦД: група 1А (контрольна, n = 15) — хворі, які отримували базове лікування (метформін, похідні сульфонілсечовини, при необхідності — левотироксин); група 2А — хворі на ЦД 2-го типу, ожиріння та НАЖХП, які отримували базове лікування + Гуарем; група 3А — хворі на ЦД 2-го типу, ожиріння та гіпотиреоз, які отримували базове лікування + Гуарем.
Для виявлення ознак МС в обстежених осіб використовувались критерії IDF (2005 р.). При проведенні дослідження поряд із опитуванням хворих, фізичним обстеженням, загальноприйнятими клінічними, лабораторними, біохімічними, інструментальними дослідженнями обов’язковий обсяг лабораторних досліджень включав загальний клінічний аналіз крові та сечі, проводилось ретельне лабораторне визначення глюкози крові натще та постпрандіальної глікемії, глікемічний профіль крові визначали глюкозооксидазним методом за допомогою апарату «Екзан». Ступінь ІР встановлювали за індексами ІР, зокрема за індексом HOMA-IR (Homeostasis Model Assessment Insulin Resistance) та індексом Caro. Глікований гемоглобін (HbA1c) визначали методом іонообмінної хроматографії за допомогою аналізатора BIO-RAD D-10, реактивів фірми BIO-RAD (США). Визначення концентрації ендогенного інсуліну (EI) проводилось методом імуноферментного аналізу в імунологічній лабораторії Івано-Франківської обласної клінічної лікарні з використанням автоматичного аналізаторa Stat Fax-303 та набору реактивів DRG (USA).
Ліпідний спектр крові вивчали за вмістом у крові загального холестерину (ХС), ТГ, ЛПНЩ, ЛПДНЩ та ЛПВЩ. Загальний ХС і ТГ визначали ферментативним методом за допомогою реактивів фірми Humаn, ЛПВЩ — реактивів фірми «Діакон ДС» на автоматичному аналізаторі Аccent-200. Визначення активності аспартатамінотрансферази, аланінамінотрансферази проводили діагностичними наборами чеської фірми Lachema на спектрофотометрі Сф-46.
НАСГ діагностували, керуючись критеріями діагностики жирової хвороби печінки (К 76.0). Для визначення наявності структурних змін печінки застосовували ультразвукове дослідження на апараті Elegra Simens Medicol Systems (№ SS N 4322), оцінку ступеня стеатозу печінки здійснювали за класифікацією С.С. Бацкова (1995).
Лікування хворих на ЦД 2-го типу з ожирінням проводилось відповідно до уніфікованих клінічних протоколів первинної та вторинної (спеціалізованої) медичної допомоги (Наказ МОЗ України від 21.12.12 № 1118) [10]. Усім хворим було призначено базову терапію: дієтичне низькокалорійне харчування; цукрознижуючі препарати групи бігуанідів: метформін до 2550 мг/добу та препарати групи сульфонілсечовини: глімепірид 4–6 мг на добу або гліклазид 60–120 мг на добу. Хворі отримували також гіпотензивні препарати: інгібітори АПФ, блокатори кальцієвих каналів, антагоністи рецепторів до ангіотензину ІІ, діуретики, кардіомагніл, хворі третьої групи отримували левотироксин. Використовували препарат Гуарем у добовому дозуванні 15 г (по 5 г тричі на добу під час їжі). Терапію гуаровою смолою починали з низької дози — 2,5 г (половина дози), таким чином уникали небажаних ефектів з боку шлунково-кишкового тракту, спричинених препаратом. Гуарем пацієнти завжди приймали або змішуючи з їжею, або з відповідною рідиною (вода, сік, молоко) разом з їжею, не менше однієї склянки рідини. Стан хворих оцінювали при огляді в диспансерному ендокринологічному відділенні та через 5 місяців. Контрольну групу обстеження становили 15 хворих на ЦД 2-го типу та ожиріння, які отримували базове лікування.
Для проведення статистичної обробки використовували параметричні та непараметричні методи аналізу: обчислювали середнє арифметичне (М), середнє квадратичне відхилення (σ), середню похибку (τ), вірогідність різниці результатів (р). Поряд з одномірною статистикою проводили двовибіркову (t-критерій Стьюдента). Кореляційний аналіз проводили шляхом визначення та аналізу вибіркового коефіцієнта кореляції Пірсона (r) у разі нормального розподілу сукупностей. В інших випадках кореляційний аналіз проводили шляхом використання непараметричного коефіцієнту кореляції Спірмена.
Результати
Серед обстежених нами хворих домінували особи віком від 45 до 60 років. У більше ніж половини хворих — 24 пацієнтів (62 %) — тривалість ЦД була в межах від одного до шести років. 20 % випадків (8 пацієнтів) припадало на тривалість ЦД до одного року. Тривалість ЦД понад 6 років була в семи пацієнтів, що становило 17 % від загальної кількості обстежених хворих. Розподіл хворих за тривалістю захворювання в різних групах суттєво не відрізнявся.
У клінічній картині хворих на ЦД зареєстровано низку клінічних синдромів: астенічний, диспептичний, абдомінально-больовий, гепатомегалія. У клініці переважали астенічний, диспептичний синдроми, незначна гепатомегалія.
Аналіз проведених досліджень показав, що у хворих всіх досліджуваних груп встановлено істотне підвищення рівня глікемії натще в середньому в 2 рази (р < 0,05) порівняно з групою контролю (табл. 1).
У той же час постпрандіальна глікемія у хворих всіх обстежених груп перевищувала рівень базальної глікемії в середньому в 1,2 раза.
Результати дослідження ступеня глікування гемоглобіну показали вірогідне збільшення відносного вмісту HbA1c у хворих I та II груп — в 1,8 раза, III групи — в 1,9 раза порівняно з ПЗО (р < 0,05). Дослідження вмісту інсуліну в крові натще виявило вірогідну гіперінсулінемію в усіх групах порівняння (р < 0,05), яка у хворих I групи перевищувала показник у групі ПЗО у 8,2 раза, у той час як у хворих II, III груп вміст ендогенного інсуліну перевищував норму в 6,9 та 10,7 (рI–III < 0,05) раза відповідно. Було вірогідне збільшення ОТ у жінок I, II та III груп на 46, 42 та 54 % порівняно з ПЗО (рI–III < 0,05).
Клінічним підтвердженням наявності синдрому периферичної тканинної ІР у чоловіків є вірогідне збільшення ОТ у I, II та III групах на 27, 22 і 27 % порівняно з ПЗО (рI–III < 0,05).
Даними, що підтверджують ІР, є зростання індексу HOMA-IR у всіх групах спостереження. Зокрема, у хворих I групи індекс HOMA-IR перевищував норму в 16 разів, II групи — у 20 разів, у хворих III групи — у 22 рази (рI–III < 0,05). Метаболічними передумовами розвитку НАЖХП була гіперглікемія натще та постпрандіальна, гіперінсулінемія, зростання ступеня глікування гемоглобіну, ІР. Отже, у хворих з НАЖХП на тлі ЦД 2-го типу та ожиріння була істотно виражена ІР. Отримані нами дані достатньою мірою засвідчують зв’язок ІР з поглибленням явищ ушкодження гепатоцитів при НАЖХП у поєднанні з ЦД 2-го типу і МС. Також, виходячи з наведеного вище, можемо говорити, що особ-ливістю хворих на ЦД 2-го типу в поєднанні з явним або субклінічним гіпотиреозом та ожирінням було формування найвищого ступеня ІР (за показниками ендогенного інсуліну та HOMA-IR).
Відповідний аналіз результатів дослідження показників вуглеводного обміну показав прямий кореляційний взаємозв’язок між HbA1c і рівнем ендогенного інсуліну (r = 0,597, р = 0,000), між HbA1c і показником HOMA-IR (r = 0,565, р = 0,001).
Ступінь компенсації ЦД асоціюється з підвищеним рівнем ендогенного інсуліну, що доводить взаємозв’язок компенсації ЦД з ІР. Ми встановили прямий кореляційний взаємозв’язок між показниками HOMA-IR і ОТ у чоловіків (r = 0,419, р = 0,0008) та HOMA-IR і ОТ у жінок (r = 0,475, р = 0,000), –HOMA-IR і ІМТ (r = 0,205, р = 0,0078), що достатньою мірою свідчить про зв’язок ІР з вісцеральним ожирінням. Було також встановлено прямий кореляційний взаємозв’язок між показниками HOMA-IR і рівнем тиреотропного гормону, що відображає функціональний стан ЩЗ (r = 0,583, р = 0,000) і підтверджує зв’язок ІР з функцією ЩЗ.
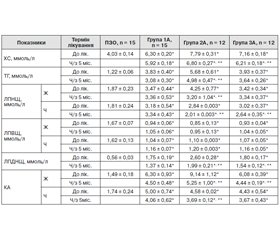
Аналіз проведених досліджень показав наявність гіперхолестеринемії в усіх групах порівняння (р < 0,05). У хворих I групи показник здорових людей перевищувався в 1,5 раза, у хворих II, III груп рівень ХС перевищував норму відповідно в 1,5 та 1,8 (рII–III < 0,05) раза (табл. 2).
/63.jpg)
Аналогічна тенденція змін спостерігалася й щодо вмісту в крові ТГ: у хворих I групи вміст ТГ перевищував показник у групі ПЗО в 3,5 раза, у хворих II та III груп вміст ТГ перевищував норму відповідно в 3,5 та 5,2 (рI–III < 0,05) раза. Нами виявлено вірогідне зростання вмісту в крові ЛПДНЩ в усіх групах порівняння (р < 0,05): у хворих I групи — у 3,4 раза, хворих II групи — у 3,4 раза проти 5,2 раза у хворих на ЦД 2-го типу з ожирінням та гіпотиреозом порівняно з показником у групі ПЗО (р < 0,05), відзначено наявність вірогідної різниці лише між групами I, II та III (р < 0,05). Концентрація ЛПНГ перевищувала нормативні показники у хворих I групи — в 1,8 раза у жінок та вдвічі у чоловіків, II групи — в 1,5 раза у жінок та в 2,2 раза у чоловіків, III групи — у 2 рази в жінок та в 2,6 раза у чоловіків порівняно з контролем (р < 0,05), наявна вірогідна різниця між I групою та II і III групами (р < 0,05).
Аналіз впливу базової терапії та комбінованої терапії з Гуаремом при курсовому призначенні хворим на ЦД 2-го типу з ожирінням на перебіг захворювання виявив такі результати: покращення самопочуття, зменшення ознак астенізації, диспептичних явищ було виявлено лише на 10–12-й день після початку лікування. До п’ятого місяця лікування у пацієнтів усіх підгруп зникли спрага й сухість у роті. У той же строк у більшості хворих зменшувались біль та відчуття важкості в правій підреберній ділянці, диспептичні явища. Слід також підкреслити, що в досліджуваній групі динаміка набрякового синдрому, трофічних змін шкіри та депресивного настрою під впливом тільки базової терапії була незадовільною.
У табл. 3 подана динаміка показників вуглеводного обміну у хворих на ЦД 2-го типу, ожиріння та гіпотиреоз під впливом базового лікування та при використанні Гуарему. Через 5 місяців від початку лікування було зареєстровано вірогідне зниження рівня глікемії натще у хворих усіх груп на 26–31 % порівняно з показниками до лікування (р1–3 < 0,05). Аналогічно змінювався рівень постпрандіальної глікемії: у хворих усіх груп він вірогідно зменшився на 23–26 % (р1–3 < 0,05). Аналіз дослідження HbA1c свідчить, що під впливом базової терапії вміст його у крові через 5 місяців лікування вірогідно знизився на 14,4 %, у 2А групі — на 21 %, а в 3А групі — на 15 % (р1–3 < 0,05).
/64.jpg)
Слід також наголосити, що компенсації ЦД за рівнем глікемії та HbA1c під впливом терапії вдалося досягнути в 36 % пацієнтів, 64 % перебували в стані субкомпенсації. Вміст у крові інсуліну натще через 5 місяців лікування вірогідно не змінився під впливом базової терапії. Водночас через 5 місяців після лікування вміст у крові інсуліну у хворих 2А групи (хворі на ЦД 2-го типу, ожиріння та НАЖХП) та 3А групи (хворі на ЦД 2-го типу, ожиріння та гіпотиреоз), які отримували базове лікування + Гуарем, знизився на 34,3 та 34,12 % (р2–3 < 0,05) відповідно.
Обговорення
Отримані результати вказують на істотний внесок терапії Гуаремом у подолання гіперінсулінемії та ІР у цілому.
На доказ даного твердження свідчить динаміка змін індексу ІР НОМА-IR, який у хворих досліджуваних 2А та 3А груп після проведеного курсу лікування знизився в 3,1 та 2 рази, однак не нормалізувався і був вірогідно вищим від показників у групі ПЗО –(р2–3 < 0,05).
Під впливом комбінованої терапії з Гуаремом вдалося досягнути вірогідного зменшення ІМТ на 10 %. Зауважимо також, що спостерігалось вірогідне зменшення ОТ у жінок та чоловіків тільки в групах комбінованого лікування з Гуаремом — 2А та 3А — на 10,2 та 9,2 % у жінок (р < 0,05) та на 7,3 та 9,1 % у чоловіків (р < 0,05).
Отже, використання тільки базової терапії свідчить про те, що 5-місячний курс лікування недостатній для досягнення стабільної нормалізації показників вуглеводного обміну та усунення синдрому ІР на тривалий період часу. Однак за час прийому препарату Гуарем в досліджуваних групах була відзначена тенденція до зниження маси тіла, середньодобового систолічного й діастолічного АТ, вірогідного зниження ОТ.
Аналізуючи показники ліпідного обміну (табл. 4) в динаміці базового лікування хворих (метформін + ПСС, при необхідності левотироксин), слід констатувати відсутність потужних метаболічних впливів базової терапії щодо корекції ліпідного дисбалансу у хворих 1А групи (контрольної), хоча показники ХС, ЛПНЩ, ЛПДНЩ, ТГ мали тенденцію до зниження, а ЛПВЩ — до збільшення через 5 місяців лікування (р > 0,05).
/65.jpg)
Однак, аналізуючи показники ліпідного обміну в динаміці лікування, слід підкреслити важливу роль Гуарему щодо корекції ліпідного дисбалансу у хворих на ЦД із ожирінням, НАЖХП та гіпотиреозом. Динамічні показники вмісту ліпідів крові у цих групах (2А та 3А) були вірогідно вищими від показників після лікування у хворих контрольної групи (р < 0,05). Зокрема, вміст ХС через 5 місяців лікування у хворих 2А групи знизився на 12,7 %, у 3А групі — на 13,3 % (р2–3 < 0,05). Уміст у крові ЛПНЩ у жінок 2А та 3А груп після лікування не лише зменшувався, але й був вірогідно нижчим від показників конт–ролю (р < 0,05). Виявлено вірогідне зменшення ЛПНЩ у чоловіків 2А групи — на 29,3 %, 3А групи — на 12,6 % (р2–3 < 0,05). На противагу цим даним у групі контролю зміни вмісту в крові ЛПНЩ були невірогідними, хоч і мали тенденцію до зниження (р > 0,05). Важливим аспектом фармакологічних властивостей Гуарему є його вплив на корекцію вмісту ТГ у крові, що становлять патогенетичну основу НАЖХП за умов ЦД.
Після п’яти місяців лікування у хворих на ЦД 2-го типу з НАЖХП на тлі ожиріння вміст ТГ у крові знизився на 12,3 %. При цьому нами також встановлено, що вміст у крові ТГ після лікування у хворих групи 2А не лише зменшувався, але й був вірогідно меншим від показників групи контролю (р < 0,05). Отримані нами результати показали, що на тлі прийому препарату Гуарем у групах пацієнтів рівень одного класу протиатерогенних ліпопротеїнів — ЛПВЩ — залишився вірогідно незмінним.
Водночас констатовано вірогідне зниження через 5 місяців лікування рівня ЛПДНЩ у 2А групі — на 23,4 %, у 3А групі — на 14,5 % (р < 0,05). Аналогічним чином змінювалися показники КА жінок та чоловіків у 2А та 3А групах. У зв’язку з цим зазначимо, що призначення препарату Гуарем призвело до тривалої стабілізації ліпідного спектра крові (5 місяців) на відміну від показників у групах контролю, де навіть через 5 місяців після лікування показники ліпідного профілю вірогідно не відрізнялися від його вихідних параметрів (р > 0,05). Необхідно також відзначити, що цільових рівнів ліпідів за допомогою комбінованої терапії з Гуаремом вдалось досягти тільки в 16,2 % пацієнтів.
За період проведення дослідження більшість пацієнтів відзначали добру переносимість препарату (89,7 %). Сім пацієнтів (17,9 %), які тривало страждали від запорів, відзначали нормалізацію випорожнень. У трьох пацієнтів (7,7 %) були зареєстровані розлади випорожнень. В одному випадку з перших днів прийому препарату виникли скарги на діарею, з причини чого пацієнтку виключили з дослідження. У другому випадку протягом першого тижня лікування відзначалася схильність до рідких випорожнень, що самостійно минули без зміни дози препарату. У третьому випадку пацієнт скаржився на закреп, хоча, вірогідно, він був пов’язаний не з прийомом препарату, а з порушенням моторики шлунково-кишкового тракту при гіпотиреозі. Ніяких інших побічних дій зареєстровано не було.
Висновки
1. На тлі прийому препарату Гуарем спостерігається вірогідне зниження маси тіла, зменшення окружності талії й стегон. Вміст у крові ендогенного інсуліну у хворих на ЦД 2-го типу, ожиріння, гіпотиреоз та НАЖХП, які отримували Гуарем разом з базовим лікуванням, вірогідно знизився на 34 %, що вказує на істотний внесок терапії Гуаремом у подолання гіперінсулінемії та ІР у цілому.
2. Прийом препарату Гуарем в складі базової терапії призводить до вірогідного зниження рівня загального холестерину, ЛПНЩ, ЛПДНЩ, ТГ, що дозволяє зробити висновок про його гіполіпідемічний ефект. Важливим аспектом фармакологічних властивостей Гуарему є його вплив на корекцію вмісту тригліцеридів у крові, що становлять патогенетичну основу НАЖХП за умови ЦД 2-го типу.
3. Більшість пацієнтів відзначали добру переносимість препарату (89,7 %), що свідчить про добрий профіль безпеки й переносимості препарату Гуарем.
4. Багатофакторний вплив препарату Гуарем відкриває перспективні можливості в комплексній терапії хворих на цукровий діабет 2-го типу в поєднанні з дисліпідемією, метаболічним синдромом, гіпотиреозом.
Перспективи подальших досліджень. Подальші наукові пошуки доцільно спрямувати на вивчення впливу Гуарему на біомаркери імунного запалення, адипоцитокіни у хворих на гіпотиреоз та ЦД 2-го типу з МС.
Конфлікт інтересів: не заявлений.
Список литературы
1. Глоба Є.В. Сучасні уявлення про гормони жирової тканини та інші біоактивні речовини як чинник розвитку підвищеної маси тіла і цукрового діабету 2 типу / Є.В. Глоба // Ендокринологія. — 2004. — № 1. — С. 78-88.
2. Демидова Т.Ю. Роль гипофункции щитовидной железы в развитии метаболического синдрома / Т.Ю. Демидова, О.Р. Галиева // Терапевтический архив. — 2009. — № 4. — С. 69-73.
3. Інструкція до препарату Гуарем. Компендіум.
4. Кіхтяк О.П. Зміни показників вуглеводного і ліпідного обміну у хворих на синдром гіпотиреозу / О.П. Кістяк, Н.В. Скрипник, Н.В. Пасєчко // Вісник наукових досліджень. — 2012. — № 2 (67). — С. 27-28.
5. Коваленко В.М. Харчування і хвороби системи кровообігу: соціальні і медичні проблеми / В.М. Коваленко // Нова медицина. — 2004. — № 3 (14). — С. 12-16.
6. Кравчун Н.А. Неалкогольная жировая болезнь печени и сахарный диабет 2 типа: клиника, диагностика, терапия / Н.А. Кравчун, О.В. Земляницина, О.В. Тяжелова // Ліки України. — 2012. — № 3–4. — С. 18-21.
7. Митченко Е.И. Диагностика и лечение метаболического синдрома, сахарного диабета, предиабета и сердечно-сосудистых заболеваний. Методические рекомендации Рабочей группы по проблемам метаболического синдрома, сахарного диабета, предиабета и сердечно-сосудистых заболеваний Украинской ассоциации кардиологов и Украинской ассоциации эндокринологов. — К., 2009.
8. Оптимізація лікування дисліпідемій та порушень вуглеводного обміну у хворих на артеріальну гіпертензію з метаболічним синдромом та дисфункцією щитоподібної залози / О.І. Мітченко, А.І. Логвиненко, В.Ю. Романов та ін. // Український кардіологічний журнал. — 2010. — № 1. — С. 73-80.
9. Паньків В.І. Ожиріння як медико-соціальна проблема / В.І. Паньків // Практ. ангіол. — 2006. — № 4 (5). — С. 36-42.
10. Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при цукровому діабеті 2 типу: Наказ Міністерства охорони здоров’я від 21.12.2012 № 1118. — К., 2012. — 116 с.
11. Ройтберг Г.Е. Метаболический синдром: Руководство / Г.Е. Ройтберг. — М.: МЕДпрес-информ, 2007. — С. 224.
12. Смірнова І.П. Ожиріння / І.П. Смирнова // Нова медицина. — 2004. — № 3 (14). — С. 17-19.
13. Скрипник Н.В. Спосіб діагностики гіпотиреоз-індукованого метаболічного синдрому / Н.В. Скрипник // Буковинський медичний вісник. — 2009. — № 3. — С. 83-88.
14. Тронько М.Д. Аналіз, пріоритети, шляхи виконання державної цільової програми «Цукровий діабет» на 2009–2013 роки / М.Д. Тронько: Доповідь на І конгресі Асоціації ендокринологів України «Новітні технології в діабетології» // Здоров’я України. — 2010. — № 18 (247). — С. 42-43.
15. Хворостінка В.М. Вплив жирової дистрофії печінки в поєднанні з метаболічним синдромом на особливості перебігу цукрового діабету / В.М. Хворостінка, А.В. Власенко // Международный эндокринологический журнал. — 2007. — № 5 (11). — С. 65-70.
16. Хухліна О.С. Неалкогольна жирова хвороба печінки та інсулінорезистентність: етіологія, патогенез, клініка, діагностика, лікування глутаргіном / О.С. Хухліна, М.І. Коломоєць. — Чернівці, 2008. — 320 с.
17. ADAGIO-Lipids Investigators. Effect of Rimonabant on the High-Triglyceride/Low HDL-Cholesterol Dyslipidemia, Intraabdominal Adiposity, and Liver Fat: The ADAGIO-Lipids Trial // Arterioscler. Thromb. Vase. Biol. — 2009. — Vol. 29. — P. 416-423.
18. An increased visceral adipose tissue is associated with resistant hypertension in men / Joji Ishikawa, Hajime Haimoto, Satoshi Hoshide еt al. // The Journal of clinical hypertension. — 2009. — Vol. 11 (4). — P. A1.
19. Brenta G. Why can insulin resistance be a natural consequence of thyroid dysfunction? / G. Brenta // J. Thyroid. Res. — 2011. — Vol. 3. — P. 129-143.
20. Cardiovascular effects of Sibutramine in the treatment of obese adolescents: results of a randomized, double-blind, placebo-controlled study / S.R. Daniels, L. Barbara, C. Scott et al. // Pediatrics. — 2007. — Vol. 120. — P. 147-157.
21. Chubb S.A.P. Interactions among Thyroid Function, Insulin Sensitivity, and Serum Lipid Concentrations: The Fremantle Diabetes Study / S.A.P. Chubb, W.A. Davis, T.M.E. Davis // J. Clin Endocrinol Metab. — 2005. — Vol. 90 (9). — P. 5317-5320.
22. Coutinho W.F. The obesity older female patient: CVrisk and the SCOUT study / W.F. Coutinho // Int. J. Obes. — 2007. — Vol. 31. — Р. 26-30.
23. Day C.P. Non-alcoholic steatohepatitis (NASH): where are we now and where are we going? / C.P. Day // Gut. — 2002. — Vol. 50, № 5. — P. 585-588.
24. Development and progression of atherosclerotic disease in relation to insulin resistance and hyperinsulinemia / Т. Fujiwara, S. Saitoh, S. Takagi, H. Takeuchi et al. // Hypertens. Res. — 2005. — Vol. 28 (8). — P. 665-670.
25. Effect of orlistat on cardiovascular disease risk in obese adults / Swinbum B.A., Carey D., Hills A.P. et al. // Diabetes, Obesity and Metabolism. — 2005. — Vol. 7. — P. 254-262.
26. Effect of orlistat on weight regain and cardiovascular risk factors following a very-lowenergy diet in abdominally obese patients: a 3-year randomized, placebocontrolled study / В. Richelsem, S. Tonstad, S. Toubro et al. // Diabetes Care. — 2007. — Vol. 30. — P. 27-32.
27. Joseph Y. Obesity management interventions: a review of the evidence / Y. Joseph, W.T. Richard, N. Goldfarb // Population Health Management. — 2009. — P. 12. — P. 305-316.
28. National Task Force on the Prevention and Treatment of Obesity. Overweight, obesity, and health risk //Arch. Intern. Med. — 2000. — Vol. 160. — P. 898-904.
29. OBES-002 Study Group. A randomized double-blind placebo-controlled study of the long-term efficacy and safety of topiramate in the treatment of obese subjects // Int. J. Obes. — 2004. — Vol. 28. — P. 1399-1410.
30. Pittas A.G. Adipocytokines and insulin resistance / A.G. Pittas, N.A. Joseph, A.S. Greenberg // J. Clin. Endocrinol. Metab. — 2004. — Vol. 89, № 2. — P. 447-452.
31. SCOUT'Investigators. Effect of Sibutramine on cardiovascular outcomes in overweight and obese subjects // N. Engl. J. Med. — 2010. — Vol. 363. — P. 905-917.
32. Thyroid function in humans with morbid obesity / M.A. Michalaki, A.G. Vagenakis, A.S. Leonardou et al. // Thyroid. — 2006. — Vol. 16. — P. 73-78.
33. Wahb I.M. Obesity and obesity-initiated metabolic syndrome : mechanistic links to chronic kidney disease / I.M. Wahb, R.H. Мак // Clin. J. Am. Soc. Nephrol. — 2007. — Vol. 2. — P. 550-562.
34. Weight loss in obese Mexican Americans treated for 1-year with orlistat and lifestyle modification / W.S.C. Boston, R.S. Reeves, C.K. Haddock et al. // Obes. — 2003. — 27. — P. 1486-1493.
35. Ye J. Emerging role of adipose tissue hypoxia in obesity and insulin resistance / J. Ye // International Journal of Obesity. — 2009. — Vol. 33. — P. 54-66.

/63.jpg)
/64.jpg)
/65.jpg)