Статья опубликована на с. 42-60
Клиническую эффективность Gla-300 оценили в шести многоцентровых рандомизированных открытых 6-месячных клинических исследованиях фазы 3а в параллельных группах серии EDITION. Исследования EDITION охватили более 3500 лиц с неконтролируемым диабетом, при этом исследования EDITION-1–3 включали лиц с СД-2, а EDITION-4 — с СД-1. Исследования EDITION JP-1 и EDITION JP-2 провели среди японцев с СД-1 и СД-2 соответственно. К настоящему времени опубликованы статьи по результатам EDITION-1–4, выполнена экспертная оценка литературы (patient-level-метаанализ) для EDITION-1, EDITION-2 и EDITION-3. Остальные результаты исследований фазы 3а были представлены на научных форумах, которые проходили в течение 2014 и 2015 годов.
Во всех исследованиях серии EDITION основным критерием эффективности выступало изменение исходного уровня HbA1с по истечении шести месяцев. Если не указаны иные условия, все результаты изменений уровня HbA1с, показателей набора веса и частоты случаев гипогликемии приведены за период от исходного обследования до истечения шестого месяца испытаний. Подтвержденные либо тяжелые явления гипогликемии определяли как уровень глюкозы в плазме ≤ 3,9 ммоль/л (≤ 70 мг/дл) и/или состояние, требующее оказания медицинской помощи (гипогликемические события были категоризированы соответственно определению ADA) [132]. Исходные демографические данные участников исследований EDITION приведены в табл. 1; изменения уровня HbA1с и массы тела — в табл. 2, частота случа в гипогликемии изложена в табл. 3 (события/участник-год), а также отображена на рис. 4, 5 (% участников с событием) и 6 (события/участник-год и % участников с событием).
Сахарный диабет 1-го типа
В клиническом исследовании EDITION-4 приняли участие 549 пациентов с СД-1, получавших базальный инсулин в сочетании с инъекциями прандиального инсулина, режим лечения которых предполагал введение препаратов Gla-300 (n = 274) или Gla-100 (n = 275) один раз в день утром или вечером с дополнительными инъекциями прандиального инсулина во время еды [53–55]. Через 6 месяцев в группе Gla-300 отмечали более существенное увеличение дозы препарата (0,19 ЕД/кг), чем в группе Gla-100 (0,1 ЕД/кг). Изменения средних значений уровня HbA1с были одинаковыми в обеих группах лечения и составили –0,42 и –0,44 % соответственно. При этом показатель среднего увеличения массы тела был существенно меньше у пациентов, получавших Gla-300 (различие: –0,6 кг (95% ДИ от –1,1 до 0,03), р = 0,037). Подтвержденные или тяжелые случаи гипогликемии (один или более на протяжении шести месяцев) в любое время суток и ночное время диагностированы среди субъектов группы Gla-300 в 93 и 69 %, в группе Gla-100 — в 94 и 70 % соответственно. Соответствующие темпы частоты составили 78,4 и 72,5 события/участник-год для любого времени суток и 8,0 и 9,0 события/участник-год для ночных гипогликемий (различия незначимы, отношение темпов составило соответственно 1,09 (95% ДИ от 0,94 до 1,25) и 0,90 (95% ДИ от 0,71 до 1,74)). Вместе с тем верифицировано значимое 31% снижение относительного риска (события/участник-год) ночных подтвержденных или тяжелых гипогликемий с Gla-300 в первые 8 недель инсулинотерапии (ОР 0,69 (95% ДИ от 0,53 до 0,91)). Вечернее или утреннее время выполнения инъекций не оказывало влияния на гликемический контроль (HbA1с, 8-точечный профиль самоопределенной глюкозы) или частоту случаев гипогликемии [53–55]. Последнее обусловливает преимущества Gla-300 для людей с СД, создавая свободу выбора во времени инъекции (утренняя или вечерняя) и снижая тем самым груз терапии для некоторых людей с СД-1 (персональный выбор времени инъекции). Доза базального инсулина была несколько выше через 6 месяцев для Gla-300, а именно 0,47 (0,22) ЕД/кг/сутки vs 0,40 (0,18) ЕД/кг/сутки для Gla-100.
/45.jpg)
В клиническом исследовании EDITION JP-1 приняли участие японцы с СД-1 (n = 243), которые получали базальный инсулин в сочетании с дополнительными болюсными инъекциями во время приема пищи [78, 79]. Участников рандомизировали к введению инсулина во время приема пищи в сочетании с базальным инсулином Gla-300 или Gla-100, доза которого была титрована до достижения целевого уровня глюкозы в плазме натощак (ГПН) 4,4–7,2 ммоль/л. После 6-месячной терапии изменения средних значений уровня HbA1с были одинаковы в обеих группах и составили –0,30 % (Gla-300), –0,43 % (Gla-100). При этом показатель среднего повышения массы тела был существенно ниже у людей с СД-1, получавших Gla-300 (различие составило –0,6 кг; р = 0,0347). Минимум один подтвержденный или тяжелый случай гипогликемии в любое время суток зафиксирован среди 96,7 и 97,5 % участников групп Gla-300 и Gla-100 соответственно (ОР 0,99 (95% ДИ от 0,95 до 1,04)). Также как минимум один подтвержденный или тяжелый случай гипогликемии в ночное время на протяжении 6-месячной терапии отмечали у 68,9 и 81,0 % участников групп Gla-300 и Gla-100 соответственно (ОР 0,85 (95% ДИ от 0,73 до 0,99), т.е. темп гипогликемических событий на 15 % меньше с Gla-300 [78]. На 29 % меньше участников, которые принимали Gla-300 vs Gla-100, имели низкий сахар крови в ночное время во время первых восьми недель терапии. Более того, Gla-300 хорошо переносился на протяжении 12-месячной терапии, при этом отмечено значимо меньшее количество подтвержденных (< 3 ммоль/л (< 54 мг/дл)) или тяжелых ночных гипогликемий при использовании Gla-300 vs Gla-100 (ОР составил 0,42 (95% ДИ от 0,39 до 0,97)) [80]. Cледует подчеркнуть, что изменения веса были небольшими спустя 12 месяцев терапии для Gla-300 и Gla-100 и составили 0,06 (0,21) кг и 0,41 (0,19) кг (среднее SE) соответственно.
/46.jpg)
В недавнем исследовании европейской популяции людей с СД-1, находившихся на базис-болюсном режиме (отношение базального инсулина к общему количеству составляло 0,5), методом постоянного мониторирования глюкозы крови верифицированы более стабильные уровни глюкозы и более низкая вариабельность между пациентами в течение дня и между днями независимо от времени введения базального инсулина (утром или вечером), так же как и снижение темпа подтвержденных (< 3,0 ммоль/л (< 54 мг/дл)) или тяжелых гипогликемий в любое время суток и в ночное время на Gla-300 по сравнению с Gla-100 [15, 16]. Отсутствие различий в глюкозной вариабельности на фоне Gla-300 vs Gla-100 при постоянном мониторировании глюкозы у японской популяции людей с СД-1 и наличие только тенденции к уменьшению числа пациентов, имевших ≥ 1 гипогликемического события в любое время суток (24 часа) и ночью для Gla-300 vs Gla-100, вероятнее всего, связаны с малым количеством пациентов (n = 20), открытым дизайном (open-label design), отсутствием периода «отмывки» и коротким периодом терапии, а не с расовыми отличиями, что, по мнению авторов, обосновывает необходимость дальнейших исследований количественно большей популяции [66].
Сахарный диабет 2-го типа
Клиническая разработка программы для нового инсулина гларгин 300 ЕД/мл (Gla-300) охватывает широкий спектр стадий СД-2. Три исследования (фаза 3а) сравнили эффективность и безопасность Gla-300 с инсулином гларгин 100 ЕД/мл (Gla-100) в различающихся популяциях людей с СД-2 [23, 101, 136]. В два из этих исследований были включены лица с диабетом, получающие базальный инсулин, в EDITION-1 — больные с СД-2, недостаточно контролированные базальным и прандиальным инсулинами в комбинации с ПАДП [101], в EDITION-2 — больные, которые получали ранее базальный инсулин в комбинации с ПАДП [136]. В EDITION-3 участники были «инсулин-наивными» и получали только ПАДП [23].
В клиническом исследовании EDITION-1 приняло участие 807 больных с СД-2 [101]. В начале исследования средняя общая доза инсулина и доза базального инсулина составляли 1,2 ± 0,47 и 0,67 ± 0,25 ЕД/кг соответственно. Участников рандомизировали в соотношении 1 : 1 для введения Gla-300 (n = 404) или –Gla-100 (n = 403) один раз в сутки вечером. Все субъекты продолжали вводить инсулин во время приема пищи. Также выполнено титрование дозы базального инсулина для достижения целевого уровня ГПН 4,4–5,6 ммоль/л.
Gla-300 и Gla-100 демонстрировали сопоставимое действие на гликемический контроль: не зафиксировано существенных отличий показателей уровня HbA1с (изменение средних значений составило –0,83 % для обеих групп), ГПН, глюкозы в плазме перед инъекцией и 8-точечного профиля самостоятельного отслеживания уровня глюкозы. Получена одинаковая частота случаев подтвержденной или тяжелой гипогликемии в любое время суток среди групп Gla-300 (81,9 %) и –Gla-100 (87,8 %; ОР 0,93 (95% ДИ от 0,88 до 0,98)). Но при этом в ночное время количество подобных случаев в группе Gla-300 (44,6 %) было ниже, чем в Gla-100 (57,5 %; ОР 0,78 (95% ДИ от 0,68 до 0,89)) [99, 101]. Более того, пропорции участников с одним подтвержденным и более (≤ 3,9 ммоль/л) или тяжелым ночным гипогликемическим событием между началом девятой недели и шестым месяцем составили 36 % (146 событий у 404 лиц) на Gla-300 по сравнению с 46 % на Gla-100 (174 события у 400 лиц), что обосновывает превосходство Gla-300 vs Gla-100 (относительный риск ОР 0,79 (95% ДИ 0,67–0,93), р = 0,0045, т.е. на 21 % меньше пораженных участников на Gla-300.
После 6-месячного «слепого» периода лечения все пациенты продолжали получать Gla-300 или Gla-100 на протяжении 6 месяцев открытого продолжения исследования [99]. В течение 12 месяцев терапии, которую прошли 89 и 88 % лиц групп Gla-300 и Gla-100 соответственно, средняя доза базального инсулина была выше у участников группы Gla-300 (1,03 ЕД/кг vs 0,90 ЕД/кг).
Улучшение контроля гликемии относительно исходных показателей отмечали на протяжении 12 месяцев в обеих группах исследования, но у участников, получавших Gla-300, зафиксировано большее снижение уровня HbA1с (среднее различие составило –0,17 % (95% ДИ от –0,30 до –0,05) для HbA1с и –0,34 ммоль/л (95% ДИ от –0,69 до 0,01) для ГПН. Количество участников, испытавших хотя бы один раз явление гипогликемии в любое время суток, было одинаковым в обеих группах: 85,9 % — на Gla-300 и 91,5 % — на Gla-100 (ОР 0,94; 95% ДИ от 0,89 до 0,99). При этом в двух группах наблюдалась существенная разница данного показателя для ночного времени суток, а именно 54,5 % vs 64,7 % (ОР 0,84; 95% ДИ от 0,75 до 094; р = 0,0070). Случаи тяжелой гипогликемии встречались у 6,7 и 7,5 % участников групп Gla-300 и Gla-100 соответственно [99]. Таким образом, Gla-300 и Gla-100 имеют сопоставимый потенциал контроля гипергликемии, но Gla-300 обладает преимуществом относительно коррекции явлений гипогликемии, особенно в ночное время суток. Увеличение веса было одинаковым у лиц на Gla-300 и Gla-100 через 6 месяцев (на 0,9 кг в обеих группах) и 12 месяцев (соответственно 1,40 (95% ДИ от 1,05 до 1,76) и 1,17 (95% ДИ от 0,82 до 1,53) кг).
В клиническом исследовании EDITION-2 сравнивали действие Gla-300 и Gla-100 у больных с СД-2, которые имели неудовлетворительный гликемический контроль с применением базального инсулина и ПАДП [137]. Все 811 участников рандомизированы в соотношении 1 : 1 для получения Gla-300 или Gla-100 в сочетании с ПАДП один раз в день на протяжении шести месяцев. После первичного 6-месячного периода лечения следовало открытое продолжение терапии. Полное 12-месячное лечение прошли 315 (78 %) и 314 (77 %) участников из группы Gla-300 и Gla-100 соответственно [136]. В результате сопоставимое улучшение контроля гликемии верифицировано после шести месяцев терапии, среднее уменьшение исходного показателя HbA1с составило 0,57 и 0,56 % среди участников, получавших Gla-300 и Gla-100 соответственно. Эффект сохранялся на протяжении 12 месяцев у представителей обеих групп исследования. Во время 6-месячного периода наблюдался меньший процент участников, испытавших ≥ 1 гипогликемического события (подтвержденного или тяжелого), которые находились на Gla-300 (70,0 %), по сравнению с Gla-100 (77,3 %) (ОР 0,9; 95% ДИ 0,83–0,98). В частности, с начала девятой недели и по шестой месяц терапии это снижение составило 23 % (р = 0,038). При этом верифицировано также значимое снижение годовых темпов как ночных гипогликемий (события/участник-год) с Gla-300 (ОР 0,52; 95% ДИ от 0,35 до 0,77; p = 0,0010), так и в течение 24 часов (ОР 0,77; 95% ДИ от 0,63 до 0,96; р = 0,0175) (табл. 3).
/44.jpg)
На 12-м месяце терапии количество участников, испытавших хотя бы один раз подтвержденное или тяжелое явление гипогликемии в любое время суток или ночью, составило соответственно 78,4 и 37,5 % в группе Gla-300, 82,0 и 44,6 % — в группе Gla-100. Верифицированное снижение риска данного явления в ночное время суток на одного участника за 12 месяцев было на 37 % меньше при использовании препарата Gla-300 по сравнению с Gla-100 (ОР 0,63; 95% ДИ от 0,42 до 0,96) [137]. Следует отметить, что показатель среднего повышения массы тела был существенно ниже среди участников группы Gla-300 через 6 месяцев (0,08 vs 0,66 кг, различие составило 0,58 кг; р = 0,015) и 12 месяцев (0,42 кг; 95% ДИ от 0,04 до 0,80 vs 1,14 кг; 95% от ДИ от 0,76 до 1,52; р = 0,0091) терапии.
Клинические исследования EDITION-1 и -2 включали два трехмесячных открытых подысследования, в которых сравнивали фиксированный интервал (ФИ) введения дозы препарата Gla-300 вечером c гибким (адаптируемым) интервалом (ГИ), который допускал выполнение инъекции в течение 24 ± 3 часа как минимум дважды в неделю [65, 100]. Лиц с СД-2, которые уже проходили лечение инсулином и получали Gla-300 в клинических исследованиях EDITION-1 и -2, на шестом месяце терапии повторно рандомизировали для проведения дополнительного трехмесячного лечения, которое предполагало либо продолжение режима ФИ, либо переход на режим с ГИ введения дозы.
В подысследовании EDITION-1 модифицированная популяция, получившая лечение, состояла из 53 и 55 участников групп ФИ и ГИ соответственно. Снижение средних исходных значений уровня HbA1с составило 0,21 (0,11) % и 0,15 (0,12) % в двух соответствующих группах. Данные 53 участников группы ФИ и 56 участников группы ГИ (safety population — выборка для оценки безопасности) показали, что частота случаев гипогликемии ночью или в любое время суток являлась одинаковой при обоих исследуемых интервалах введения дозы препарата (ФИ 22,6 и 66,0 % соответственно; ГИ 26,8 и 57,1 % соответственно). Частота инъекций в пределах интервалов дозирования (24 ± < 1 часа, 1–2,5 часа либо > 2,5 часа) колебалась между 87,7; 8,4 и 3,9 % в группе ФИ и 63,4; 13,5 и 23,0 % в группе ГИ [100]. Подобное отсутствие модулирующего влияния ФИ vs ГИ введения инсулина Gla-300 на гликемический контроль и частоту гипогликемий верифицировано в EDITION-2 (модифицированная популяция по режимам введения препарата состояла из 42 и 44 участников соответственно).
Следует подчеркнуть, что post-hoc-анализ результатов EDITION-1 и -2 показал, что люди c СД-2, переведенные с двухкратного ежедневного введения базального инсулина на однократное ежедневное введение Gla-300, достигали сопоставимого гликемического контроля с меньшим количеством гипогликемий по сравнению с пациентами, переведенными на Gla-100 [108].
Сравнение безопасности и эффективности препаратов Gla-300 и Gla-100 продолжили в клиническом исследовании EDITION-3 у больных с СД-2, которые ранее не применяли инсулин и имели неудовлетворительный гликемический контроль диабета [21–24]. Испытание включало 878 участников, получавших Gla-300 или Gla-100 вечером после прекращения приема препаратов группы сульфонилмочевины. Изменение средних исходных значений уровня HbA1с было одинаковым при использовании обеих форм инсулина. При этом отмечали снижение показателя на 1,42 % в группе Gla-300 и на 1,46 % в группе Gla-100 (различие между группами равнялось 0,04 % (95% ДИ от –0,09 до 0,17). Количество участников, испытавших хотя бы один раз подтвержденное или тяжелое явление гипогликемии на протяжении 6-месячного исследования в любое время суток, составило 46,2 и 52,5 % для Gla-300 и Gla-100 соответственно (ОР 0,88; 95% ДИ от 0,77 до 1,01), подобные явления в ночное время суток наблюдались как минимум 1 раз у 17,9 и 23,5 % участников в группах –Gla-300 и –Gla-100 соответственно (ОР 0,76; 95% ДИ от 0,59 до 0,99, т.е. отмечалось 24% снижение относительного риска в группе с Gla-300) [22]. Годовой темп подтвержденных или тяжелых гипогликемий (события/участник-год) был значимо ниже в группе с Gla-300 в любое время суток (6,4 vs 8,5; ОР 0,75; 95% ДИ от 0,57 до 0,99; р = 0,042) в течение шести месяцев и демонстрировал более выраженное снижение в течение первых восьми недель (4,5 vs 8,5 события/участник-год; ОР 0,61; 95% ДИ от 0,43 до 0,86). Отсутствовали значимые отличия в увеличении веса между группами (табл. 2), различие через 6 месяцев составило 0,22 кг.
Данные трех клинических исследований EDITION (1, 2 и 3) с участием лиц, страдающих СД-2, также опубликованы в составе patient-level-метаанализа [102–104]. Следует подчеркнуть, что метаанализ на основе индивидуальных данных пациентов превосходит метаанализ интегральных данных в случае потенциального модифицирующего влияния характеристик пациента на терапевтический эффект исследуемого воздействия [70, 121]. Объединенный анализ EDITION-1–3 содержит сравнение 6-месячного профиля эффективности и безопасности препаратов Gla-300 и Gla-100 среди широкой популяции людей с СД-2 (1247 лиц с СД-2 в группе Gla-300 и 1249 участников в группе Gla-100). Данные объединенного анализа модифицированной популяции людей с СД-2, получавшей лечение (1239 участников в группе Gla-300 и 1235 участников в группе Gla-100), показали, что изменение средних исходных значений уровня HbA1с было одинаковым при введении обеих форм инсулина (табл. 2). Доза базального инсулина увеличивалась в обеих группах на протяжении 6-месячного периода исследования: средняя (стандартное отклонение) доза инсулина на шестом месяце была 0,85 (0,36) ЕД/кг/сутки в группе с Gla-300 и 0,76 (0,32) ЕД/кг/сутки — с Gla-100, соответственно, у участников группы с Gla-300 на 12 % выше доза, но меньше увеличение веса (небольшое увеличение веса составило 0,51 (0,10) и 0,79 (0,10) кг для Gla-300 и –Gla-100 соответственно, среднее различие было –0,28 (95% ДИ от –0,55 до –0,01; р = 0,039).
Что касается частоты случаев гипогликемии в любое время суток, количество участников, испытавших хотя бы одно подобное явление любого типа, подтвержденную или тяжелую гипогликемию, а также тяжелую гипогликемию, в группах Gla-300 и Gla-100 составило 67,8 и 73,8 %, 65,5 и 72,0 %, 2,3 и 2,6 % соответственно. Для тех же показателей в ночное время суток частота возникновения составляла 31,7 и 41,3 %, 30,0 и 39,8 %, 0,6 и 1,0 % соответственно [103, 110]. Годовой темп (события/участник-год) подтвержденных (≤ 3,9 ммоль/л) или тяжелых гипогликемий в любое время суток (24 часа) на протяжении 6-месячного периода исследования составил 15,22 для группы с Gla-300 и 17,73 — с Gla-100 (отношение темпа (rate ratio) 0,86; 95% ДИ от 0,77 до 0,97; р = 0,0116), соответствующее относительное различие между группами — 14 % в пользу Gla-300.
Годовые темпы ночных событий за 6-месячный период были меньше в группе с Gla-300 (2,10 vs 3,06, отношение темпа 0,69 (95% ДИ от 0,57 до 0,84); р = 0,0002), т.е. 31% различие в темпе было в пользу Gla-300.
Следует подчеркнуть, что более низкий годовой темп гипогликемий в группе с Gla-300 по сравнению с Gla-100 был уже очевиден в течение первых восьми недель терапии, так же как и во время остального 6-месячного периода терапии (рис. 6 А, Б).
/49.jpg)
Следует подчеркнуть, что уменьшение годового темпа гипогликемических событий наблюдалось в течение первых восьми недель исследования, когда имело место наибольшее увеличение дозы инсулина (относительное уменьшение составило 23 % в первые 8 недель и 9 % в поддерживающий период лечения (с девятой недели до шести месяцев) для любых гипогликемий и 42 % в первые 8 недель по сравнению с 25 % в поддерживающий период лечения для ночных гипогликемий). Боязнь гипогликемии часто является препятствием к эффективному подбору доз [32, 73, 90], поэтому более низкий риск гипогликемий во время периода титрации с –Gla-300 мог бы, следовательно, обеспечить более плавный старт к инсулинотерапии и вести к улучшенному доверию относительно увеличения доз как у врача, так и у лиц с диабетом, позволяя тем самым более быстрое достижение оптимума доз.
Более низкий темп гипогликемий верифицирован в ночное время и за пределами предопределенного ночного периода (00:00–05:59) в группе с Gla-300 по сравнению с Gla-100. События были наиболее частыми между 06:00 и 14:00 часами, а именно 4777 (8,14 события/участник-год) в группе Gla-300 и 5925 (10,13 события/участник-год) в группе Gla-100, соответствуя 20% уменьшению в пользу Gla-300, и особенно между 06:00 и 10:00 часами. Уменьшение процента участников, имевших ≥ 1 подтвержденной или тяжелой гипогликемии в любое время суток (24 часа) и в ночное время, группы Gla-300 по сравнению с группой Gla-100 согласуется с годовыми темпами (рис. 6 А, Б). Количество участников с СД-2, которые могли бы нуждаться в терапии Gla-300 для предупреждения подтвержденного (≤ 3,9 ммоль/л) или тяжелого гипогликемического события у одного участника, было 16. Годовой темп гипогликемических событий и процент участников с подтвержденной (≤ 3,9 ммоль/л) или тяжелой гипогликемией были сопоставимыми у лиц с СД-2 ≥ 65 лет и < 65 лет, и не наблюдалось значимой гетерогенности терапевтического эффекта (все р > 0,05) [102, 103]. Вместе с тем post-hoc-анализ у пожилых участников (≥ 65 лет) подтверждал сопоставимый гликемический контроль с меньшей частотой гипогликемий для –Gla-300 vs Gla-100 у потенциально более ранимых пожилых участников [135].
Следует подчеркнуть, что в объединенном анализе СД-2-исследований (EDITION-1, 2 и 3, 6-месячные данные) [102–104] риск ночных подтвержденных и тяжелых гипогликемий уменьшался на 31 % у участников, леченных Gla-300 с большей на 12 % дозой инсулина и меньшим увеличением веса.
Таким образом, в данном объединенном анализе [102, 103], включавшем большую по численности и с широким спектром эволюционных стадий заболевания группу участников с СД-2, показано, что Gla-300 обладал сопоставимой эффективностью с Gla-100 в улучшении гликемического контроля на протяжении шести месяцев. В добавление Gla-300 приводил к уменьшению гипогликемических событий в любое время суток (24 часа), включая ночь, и к легкому замедлению прироста веса по сравнению с Gla-100. Результаты согласовывались с результатами поданализа, где из исследования EDITION-1 были исключены участники, использующие быстродействующие аналоги инсулина. Эти находки стали возможными благодаря подобному дизайну 3а-фазы исследований EDITION. Более того, объединенный анализ результатов 12-месячной терапии Gla-300 показал более поддерживаемый гликемический контроль без увеличенного риска гипогликемий. Это было связано с более постоянным и продолженным фармакокинетическим и фармакодинамическим профилем Gla-300 по сравнению с –Gla-100 [105]. Так, среднее различие в приросте массы тела в пользу Gla-300 составило –0,40 кг (95% ДИ от +0,7 до –0,09), р = 0,0117.
Колебания между отдельными исследованиями EDITION (1, 2, 3) отражают различия в изученных популяциях. Так, участники EDITION-3 имели меньше характеристик, которые предсказывали гипогликемию [127], по сравнению с EDITION-1 и -2: они были «инсулин-наивными» (не получали инсулинотерапии до включения в исследование), вероятнее, с оставшейся большей эндогенной секрецией инсулина и более короткой длительностью диабета [23, 101, 136]. Следует еще раз подчеркнуть, что, несмотря на эти колебания, преимущества Gla-300 над Gla-100 четко показаны в большом объединенном анализе диабетической популяции, представляющей широкий спектр стадий болезни, а именно СД-2. Эти находки позволяют думать о том, что преимущества Gla-300, наблюдаемые у людей с СД-2, находящихся на базальной инсулинотерапии в исследованиях EDITION-1 и -2, могут быть перенесены на людей с диабетом с более ранними стадиями заболевания. Уменьшение гипогликемий на фоне применения Gla-300 утром (между 6:00 и 8:00 часами) и рано после полудня (до 14 часов) может, следовательно, уменьшить влияние диабета на дневную активность (работа, посещение школы или вождение), что вызывает серьезную социальную дезорганизацию для людей с диабетом [56]. Этот эффект может быть отнесен к более стабильному и пролонгированному фармакокинетическому и фармакодинамическому профилям Gla-300 по сравнению с Gla-100 [14], что позволяет думать о его потенциале для большого количества больных в достижении хорошего гликемического контроля с помощью однократной в сутки инъекции инсулина. Однократное в сутки введение, соединенное с уменьшенным темпом гипогликемий, может помочь уменьшить бремя менеджмента СД, улучшая приверженность больного к инсулиновым режимам и увеличивая его терапевтическую вынос-ливость [90]. Это могло бы в конечном счете улучшить долгосрочный контроль глюкозы крови для тех людей с диабетом, которые не могут достичь гликемических целей при применении существующих терапевтических методов. Годовой темп тяжелых гипогликемий был низок и составил 0,11 события на участника в год, он был подобен сообщенным в обсервационных наблюдениях людей с СД-2 (от 0,1 до 0,2 события на пациента в год) [72, 129]. Таким образом, Gla-300 в широкой популяции почти 2500 лиц с СД-2 обеспечивал сопоставимый с Gla-100 гликемический контроль при меньшей частоте гипогликемий в любое время суток (24 часа) и особенно более выраженное снижение гипогликемии ночью и во время первых 8 недель терапии [126]. Следует отметить, что эффекты Gla-300 на HbA1с, снижение гипогликемии и веса, анализированные соответственно в подгруппах по возрасту, ИМТ и длительности диабета, не отличались от результатов, верифицированных для всей популяции пациентов [22, 101, 122, 123, 128, 136].
Доза базального инсулина увеличивалась в обеих группах (Gla-300 и Gla-100) в течение 6-месячного периода, особенно в первые 12 недель лечения, во всех трех исследованиях EDITION и была на 12 % больше в группе Gla-300 vs Gla-100. Причина такого различия в дозах инсулина в настоящее время умозрительна. Метаболит М1 является главной активной молекулой, циркулирующей после инъекции как Gla-300, так и Gla-100 [118], однако более вероятно, что большее время нахождения в подкожном пространстве Gla-300 vs Gla-100 [14] может вести к увеличению ферментативной активности тканевых пептидаз в месте инъекции [104]. Это наблюдение формирует мысль о несколько более низкой биодоступности Gla-300 по сравнению с Gla-100. Следует заметить, что, несмотря на более высокую дозу Gla-300 vs Gla-100, сопоставимый гликемический контроль достигался с меньшей частотой гипогликемий. Кроме этих преимуществ в частоте гипогликемий, больные с СД-2, получавшие Gla-300, имели меньший прирост веса по сравнению с получавшими Gla-100. Причина этого неизвестна и требует дальнейшего изучения.
В клиническом исследовании EDITION JP-2 проводили сравнение эффективности и безопасности препаратов Gla-300 и Gla-100 среди японцев с СД-2 (n = 241), которые получали базальный инсулин и ПАДП [122, 123]. Участников рандомизировали к введению Gla-300 или Gla-100, дозировки препаратов титровали до получения целевого значения ГПН 4,4–5,6 ммоль/л. Снижение средних значений уровня HbA1с составило 0,45 и 0,55 % в группах Gla-300 или Gla-100 соответственно, а среднее изменение исходного показателя массы тела зафиксировано в пределах –0,62 кг для участников, получавших Gla-300, и 0,37 кг — получавших Gla-100 (различие составило –1,0 кг; р = 0,0003). Частота случаев подтвержденной (≥ 3,9 ммоль/л) или тяжелой гипогликемии (% участников с ≥ 1 событием) в ночное и любое время суток составляла 28,3 и 65,0 % в группе Gla-300, 45,8 и 76,7 % — в группе Gla-100 (ОР для Gla-300 vs Gla-100 составил для ночных гипогликемий 0,62 (95% ДИ от 0,44 до 0,88) и для гипогликемий в течение 24 часов — 0,86 (95% ДИ от 0,73 до 1,01)). Таким образом, верифицировано 38% уменьшение частоты ночных гипогликемий (≥ 1 события) на протяжении 6-месячной терапии для Gla-300 vs Gla-100.
Безопасность и переносимость
Во всех клинических исследованиях, проведенных до настоящего времени, сообщено о безопасности и хорошей переносимости препарата Gla-300. Также не отмечалось разницы в частоте возникновения нежелательных явлений между Gla-300 и Gla-100. В подысследованиях EDITION-1 и -2 было продемонстрировано, что применение фиксируемых и гибких (адаптируемых) интервалов введения доз не оказывает влияния на профиль безопасности Gla-300 [65, 100, 119].
Наиболее распространенным серьезным нежелательным явлением, соотносимым c проведенной терапией, была реакция в месте введения препарата, о которой сообщали 0,7 и 2,7 % участников групп –Gla-300 и Gla-100 соответственно. Реакции гиперчувствительности наблюдались у 13 (3,2 %) и 16 (3,9 %) пациентов с диабетом, получавших две соответствующие лекарственные формы инсулина соответственно. В EDITION-2 на протяжении первых шести месяцев лечения зафиксировано три летальных исхода — два в группе Gla-300 и один в группе Gla-100, но ни один из них не был связан с применением исследуемого препарата инсулина [136].
Данные клинического исследования фазы 3а EDITION-1 показали, что наиболее частыми нежелательными явлениями проведенной терапии являются инфекции, нарушения со стороны желудочно-кишечного тракта и мышечно-скелетной системы [101]. Частота возникновения данных явлений была одинаковой в двух группах лечения. Также в обеих группах зафиксирован аналогичный уровень нежелательных явлений, возникших во время терапии, которые привели к преждевременному исключению участников из исследования (n = 6 — 1,5 % и n = 7 — 1,7 % в двух соответствующих группах). Среди людей с диабетом, получавших Gla-300 и Gla-100, реакции в месте инъекции отмечались у 9 (2,2 %) и 6 (1,5 %) участников соответственно, при этом серьезные нежелательные явления, которые, возможно, были вызваны проведенной терапией, включая 2 случая гипогликемической комы, были зафиксированы у 26 (6,4 %) и 21 (5,2 %) участника соответственно. Пять пациентов с диабетом умерли: три — в ходе лечения (один в группе Gla-300 и два в группе Gla-100), два — после прекращения исследуемой терапии (оба в группе Gla-300) [101].
Заключение
В клинических исследованиях EDITION (фаза 3а), проведенных среди людей с СД-1, гликемический контроль при введении Gla-300 (Toujeo®) сохранялся в течение 32–34 часов по сравнению с 29 часами в случае использования Gla-100. Gla-300 также продемонстрировал меньшее колебание и лучшую воспроизводимость концентраций инсулина. По сравнению с введением Gla-100 применение Gla-300 утром или вечером не влияет на частоту явлений гипогликемии. Клинические исследования фазы 3а EDITION показали, что Gla-300 и Gla-100 имеют сопоставимый потенциал контроля гликемии, но при этом для Gla-300 характерна более низкая частота случаев гипогликемии, особенно в ночное время суток. Бóльшая длительность действия Gla-300 по сравнению с Gla-100 позволяет однократное введение в сутки для всех больных СД и обеспечивает большую гибкость интервалов между инъекциями, что может создавать преимущества для тех пациентов, которые не могут вводить базальный инсулин в одно и то же время каждый день.
Все полученные данные говорят о том, что Gla-300 является более оптимальным по сравнению с Gla-100 препаратом и в будущем можно ожидать постепенное замещение применения Gla-100 у многих пациентов. Следует еще раз подчеркнуть, что относительно гликемического контроля клинические исследования фазы 3а EDITION верифицировали сопоставимый потенциал Gla-300 и Gla-100 к снижению уровня HbA1с. Более того, предыдущие исследования продемонстрировали эквивалентную эффективность Gla-100 и детемира в снижении уровня HbA1с у людей с СД-1 [47, 51, 91, 96, 107, 120]. Основные препятствия в достижении удовлетворительного контроля гликемии у людей с диабетом, получающих инсулинотерапию, включают сложность режима лечения и частоту инъекций. Оба эти фактора влияют на приверженность людей с диабетом к режиму терапии [33, 90]. B этом контексте Gla-300 является очень удобным, поскольку оказывает эффективное действие при введении препарата один раз в сутки. При этом, в отличие от Gla-100, инъекции можно выполнять как утром, так и вечером. Еще один фактор, препятствующий началу или интенсификации инсулинотерапии, – склонность к повышению веса на фоне лечения инсулином [93]. Во всех исследованиях EDITION Gla-300 (Toujeo®) демонстрировал весовой нейтралитет относительно базального уровня (увеличение веса меньше чем на 1 кг после 6 месяцев) [21–23, 53–55, 78, 79, 101, 122, 123, 136]. В EDITION-1 и EDITION-3 прирост веса колебался между Gla-300 и Gla-100 (Toujeo® и Lantus®), а именно: в EDITION-1 увеличение составило 0,9 кг в обеих группах; в EDITION-3 различие через 6 месяцев было 0,22 кг.
Более того, прирост веса был значительно меньше на фоне применения терапии Gla-300 (Toujeo®) по сравнению с терапией Gla-100 (Lantus®) в исследовании EDITION-2 (различие в весе через 6 месяцев: –0,58 кг; р = 0,015) [101]; EDITION-4 (различие через 6 месяцев: –0,56 кг, р = 0,037) [53–55] и EDITION –JP-1 (различие через 6 месяцев: –0,6 кг; р = 0,0347) [78, 79]. В EDITION JP-2 пациенты, леченные Toujeo®, теряли вес по сравнению с небольшим его увеличением в группе на Lantus® (–0,6 кг vs 0,4 кг соответственно, различие через 6 месяцев: –1,0 кг; р = 0,003) [122, 123].
С учетом того, что людям с диабетом зачастую необходимо проведение пожизненной инсулинотерапии, снижение прибавки массы тела при назначении Gla-300 является его преимуществом перед Gla-100, особенно для людей с СД-2, которые изначально имеют лишний вес или даже ожирение. Gla-300 также может способствовать улучшению следования режимам терапии, поскольку при необходимости введения большой дозы инсулина использование Gla-300 позволит осуществить задачу за одну инъекцию. При назначении в такой ситуации более слабого препарата Gla-100 может потребоваться две инъекции.
Особый акцент следует сделать на преимуществе Gla-300 перед Gla-100 относительно гипогликемий, поскольку развитие гипогликемии, к сожалению, является огромным недостатком существующих препаратов инсулина. Гипогликемия отрицательно влияет на эффективность и безопасность антидиабетических лекарственных средств. В настоящее время считается общепризнанным, что главной причиной потери массы панкреатических β-клеток при СД является усиленный апоптоз [26, 81], снижение его интенсивности рассматривается как новая перспективная мишень для свое-временной инсулинотерапии людей с СД 1-го и 2-го типа [144]. В связи с этим следует подчеркнуть имеющиеся свидетельства того, что не только гипер-, но и гипогликемия способна вызвать апоптоз панкреатических β-клеток [77, 98], в свете чего предпочтение при выборе инсулина должно отдаваться тем препаратам, которые доказали свою клиническую эффективность и безопасность в отношении развития гипогликемических состояний [34, 95].
Более того, экспериментальные данные показывают увеличение гипогликемией экспрессии ряда генов, сверхактивированных гипергликемией [69]. Так, на модели первичных эндотелиальных клеток пупочной вены человека, культивированных в среде с разным содержанием глюкозы (5,5, 25,5 и 2,75 ммоль/л), обнаружено, что как гипер-, так и гипогликемия приводили к значимому увеличению количества мРНК генов, избыток продуктов которых, как показано in vitro при гипергликемии, приводит к развитию сосудистых осложнений через оксидативный стресс и апоптоз (супероксиддисмутаза-1 и р65-субъединица транскрипционного фактора NF-kB соответственно).
Снижение частоты гипогликемий при инсулинотерапии с Gla-300 может также формировать его потенциальные преимущества относительно феномена «плохой» гликемической памяти [143], поскольку к настоящему времени получены убедительные экспериментальные доказательства большей активации р53 и метаболической памяти колебаниями глюкозы, чем постоянно высоким ее уровнем в эндотелиальных клетках человека [112]. Целесообразно заметить, что результаты эпидемиологических исследований и клинических испытаний формируют мнение о том, что гипогликемия может иметь отрицательное влияние на кардиоваскулярную заболеваемость и/или смертность [83, 134, 140].
Что касается инсулина с клинической точки зрения, то страх гипогликемии может быть причиной отказа от начала терапии или увеличения ее интенсивности. Также вероятно ухудшение соблюдения режима лечения, поскольку пациенты корректируют дозу препарата во избежание повторений эпизодов гипогликемии. Описывая результаты лечения, нужно отметить, что случаи гипогликемии негативно влияют на качество жизни человека, усугубляя тяжесть заболевания и проявляя непосредственные результаты низкого уровня глюкозы в крови (например, несчастные случаи, связанные с вождением, и падения). Данный фактор представляет особую опасность для пожилых людей с СД, которые часто имеют почечную недостаточность, поскольку при данной патологии вероятность гипогликемии значительно выше, а ее последствия серьезнее [3]. Кроме того, случаи гипогликемии снижают экономическую эффективность антидиабетического лечения, особенно эпизоды, требующие оказания медицинской помощи или госпитализации. В клинических исследованиях EDITION у участников, получавших Gla-300, зафиксировано меньшее количество случаев гипогликемии по сравнению с участниками группы Gla-100.
Целесообразно отметить, что препарат Gla-100 демонстрировал относительно низкую частоту возникновения гипогликемии по сравнению со стандартным лечением [60, 82]. Объединенный анализ (patient-level) исследований EDITION-1, -2 и -3 показал, что количество людей с СД-2, перенесших хотя бы один или > 1 эпизода гипогликемии в любое время суток, было приблизительно на 6 % меньше в группах препарата –Gla-300. Этот процент показывает результат группы Gla-300, где зафиксировано на 78 случаев меньше хотя бы одного эпизода гипогликемии. Что касается ночных эпизодов гипогликемии, которые представляют особый интерес из-за отсутствия искажающих факторов в виде потребления углеводов, введения прандиального инсулина и физической активности, разница между группами Gla-300 и Gla-100 была более существенная, чем для случаев гипогликемии в любое время суток. По сравнению с Gla-100 в группе Gla-300 примерно на 10 % меньше участников (или 121 человек) сообщали хотя бы об одном ночном эпизоде гипогликемии. Таким образом, в отношении случаев гипогликемии препарат Gla-300 имеет преимущество перед Gla-100. Следует еще раз подчеркнуть, что во всех исследованиях EDITION Gla-300 не уступал Gla-100 по снижению HbА1с, в то же время демонстрируя уменьшение риска гипогликемий, главным образом ночных, у людей с СД-2 [21–23, 101, 122, 123, 144]. Вместе с тем в исследовании 549 участников с СД-1 (EDITION-4) не получено убедительных различий в гипогликемии, за исключением снижения их частоты в первые 8 недель [53–55], хотя Gla-300 приводил к 34% уменьшению риска ночных и 20% уменьшению гипогликемий за 24 часа в исследовании 243 японцев с СД-1 (EDITION –JP-1) [78, 79]. В объединенном анализе СД-2 исследований (EDITION-1, -2 и -3, 6-месячные данные) [102–104] риск ночных подтвержденных и тяжелых гипогликемий уменьшался на 31 %. Эти результаты достигались на фоне приема –Gla-300 с большей на 10–17 % дозой инсулина и меньшим увеличением веса, различие было умеренным в абсолютном выражении (≈ 0,26 кг при СД-2 и ≈ 0,56 кг при СД-1), но постоянно присутствовало во всех исследованиях EDITION и было значимым. Вышеотмеченное повышение дозы инсулина могло быть связано с тем, что часть дозы Gla-300 разрушалась локально быстрее, чем полностью абсорбировалась. Маловероятно, что небольшое уменьшение в приросте веса — результат меньшего компенсаторного приема пищи, необходимого для противодействия гипогликемии, так как это наблюдалось и когда Gla-300 уменьшал риск гипогликемии [78, 79], и когда не влиял на него [53–55].
В дополнение к уменьшенному темпу ночных событий низкого содержания сахара в крови (гипогликемии) во время фазы поддерживающей терапии (3–6-й месяцы) Gla-300 демонстрировал снижение событий (гипогликемий) в первые 8 недель терапии (post-hoc-анализ), потенциально демонстрируя более безопасную титрацию до цели по сравнению с Gla-100 –(Gla-100).
Так, в EDITION-1 и -2 частота любого тяжелого или подтвержденного ночного эпизода низкого содержания сахара в крови (% людей с не менее чем одним эпизодом) была меньше в группе Gla-300 (Toujeo®) в течение первых восьми недель, когда наблюдались наибольшие изменения в дозе инсулина, по сравнению с группой, принимавшей Gla-100 (EDITION-1: ОР 0,79 (95% ДИ от 0,64 до 0,98); EDITION-2: ОР 0,53 (95% ДИ от 0,39 до 0,72)) [101, 144].
В объединенном анализе EDITION-1–3 более выраженное, значимое уменьшение частоты ночных событий низкого содержания сахара в крови (% больных с не менее чем одной гипогликемией) наблюдалось во время первых восьми недель на фоне наибольших изменений дозы инсулина: –17 % в любое время cуток и –31 % во время ночи при сравнении Toujeo® с Gla-100 (post-hoc-анализ) [102–104].
EDITION-1 и -2 также показали уменьшение частоты любой тяжести или подтвержденной гипогликемии, включая симптоматическую, в любое время суток (за 24-часовый период) на протяжении 6-месячного периода терапии (включая первые 8 недель; EDITION-1: OP 0,93 (95% ДИ от 0,88 до 0,99); EDITION-2: OP 0,90 (95% ДИ от 0,83 до 0,98)), особенно во время первых восьми недель (EDITION-1: OP 0,86 (95% ДИ от 0,78 до 0,94); EDITION-2: ОР 0,78 (95% ДИ от 0,69 до 0,89)) [102–104, 144].
При СД-1 результаты исследования EDITION-4 свидетельствуют о 31% снижении относительного риска (значимо; отношение темп/участник-год 0,69 [0,53–0,91]) ночных подтвержденных или тяжелых эпизодов низкого содержания сахара в крови в первые 8 недель (post-hoc-анализ) для Toujeo® vs Gla-100 [53–55]. В EDITION JP-1 на 29 % меньше больных с СД-1 испытывали эпизоды низкого содержания сахара в крови на фоне приема Toujeo® по сравнению с –Gla-100 во время первых восьми недель лечения (post-hoc-анализ) [78, 79].
В завершение следует подчеркнуть целесообразность получения в будущем дополнительных данных относительно Gla-300 (Тожео): так, ФК/ФД должна быть изучена при индивидуальных дозах в реальной жизни людей с СД-1. Следует также исследовать пациентов с СД-2, потому что ФК/ФД отличается от такового у пациентов с СД-1, и циркадные изменения в чувствительности к инсулину влияют на ФД инъецируемого инсулина [95]. Безопасность Gla-300 уже исследована, и представлен его метаболизм после подкожной инъекции с образованием метаболита 1 [118], подобно Gla-100 [74]. Так как Gla-300 в подкожном депо выделяет гларгин, то кардиоваскулярная безопасность, показанная для Gla-100 в исследовании ORIGIN, должна быть применима и для Gla-300 [41, 146].
Рассчитанные на основе данных по ФК/ФД [14] преимущества Gla-300, состоящие не только в уменьшении гипогликемий, особенно ночных, но также в более эффективной инсулинизации на протяжении 24 часов после инъекции Gla-300 vs –Gla-100, следует определить в широкой популяции людей с СД-1. –Гибкость во времени введения при СД-1 и СД-2 следует также изучить за пределами представленного на сегодня ± 3-часового интервала [65]. Это очень важный аспект персонализированной инсулинотерапии, обычно высоко оцениваемый людьми с диабетом, получающими инсулин. Наблюдаемая в настоящее время растущая исследовательская активность в области разработки базальных инсулинов в после-НПХ эру является позитивной, так как мы имеем и будем иметь несколько опций для замещения базального инсулина при СД-1 и СД-2. С другой стороны, мы нуждаемся в глубоком знании индивидуальных характеристик новых длительнодействующих аналогов инсулина для понимания их пользы и ограничений в интересах людей с диабетом. Необходимы также глубокие head-to-head-исследования новых аналогов инсулина, в частности деглюдека vs Тожео [24]. В настоящее время продолжается только клиническое исследование DEVOTE, сравнивающее частоту главных кардиоваскулярных событий во время терапии с инсулином деглюдек vs инсулина гларгин (Gla-100) y людей с СД-2 при наличии высокого риска кардиоваскулярных событий [9]; его результаты, ожидаемые в ближайшие годы, обеспечат четкие доказательства относительно кардиоваскулярной безопасности инсулина деглюдек, что позволит определить, какая молекула имеет предпочтение в качестве базального инсулина [75].
Глоссарий (для обеих частей обзора)
Patient-level meta-analysis — метаанализ индивидуальных данных пациента. Он имеет преимущества по сравнению с метаанализом суммарных данных пациентов в объяснении гетерогенности терапевтических эффектов, поскольку позволяет исследовать потенциальные модификаторы, а именно особенности (характерные черты) больного, имеющие отношение к терапевтическим эффектам [70, 121].
Head-to-head trial — клиническое исследование, где два препарата сравниваются напрямую в одном исследовании.
Open-label-design — термин используется для описания ситуации, когда и исследователь, и участник исследования знают о терапии, которую получает участник. Этот тип исследования противоположен двойному слепому исследованию, когда ни исследователь, ни участник не знают, какую терапию получает участник.
Клэмпинг (clamping) — определение секреции и действия инсулина; инфузия раствора глюкозы в темпе, урегулированном периодически для поддержания заранее определенной концентрации глюкозы крови. Эугликемический клэмпинг — это техники клэмпа, в которых уровни глюкозы крови поддерживаются в пределах нормального диапазона [35].
Исследования фармакодинамики гларгина проведены с использованием клэмп-технологий. Клэмп-методы (от англ. «закреплять», «фиксировать») основаны на временном искусственном поддержании в крови определенных концентраций глюкозы и инсулина, интересующих исследователя. По уровню поддерживаемой гликемии клэмп может быть гипо-, эу- и гипергликемическим. Часто используется гиперинсулинемический (его также называют эугликемическим) клэмп, который подразумевает создание заведомо избыточной концентрации инсулина и введение глюкозы с той скоростью, которая нужна для поддержания нормогликемии. Так как пациент при таком исследовании находится в покое, можно считать, что скорость введения глюкозы, необходимая для поддержания нормогликемии, отражает внутри- и межиндивидуальную вариабельность фармакологических свойств инсулина. Применение клэмп-методик показало более раннее начало и более равномерный профиль действия, с достижением стабильного плато у гларгина по сравнению с инсулинами НПХ (нейтральный протамин Хагедорна).
Фармакокинетика в равновесном состоянии — исследование параметров фармакокинетики препарата после достижения равновесного состояния (при многократном введении лекарственного средства).
Равновесное состояние — состояние, при котором общее поступление лекарственного средства находится в динамическом равновесии с его выведением.
Параметры фармакокинетики:
— Тmах — время достижения максимальной концентрации. Сmax — величина максимальной концентрации, AUCo-t — площадь под фармакокинетической кривой (AUC-area under curve);
— treatment ratio — T/R (T — treatment Gla-300, R — reference Gla-100) — отношение обработки (лечения);
— rate ratio — отношение риска или относительный риск (OR) — отношение риска специфического исхода в группе воздействия к риску для контроля.
Post-hoc-анализ — встречается в двух значениях: 1) статистические или другие анализы, проведенные без предварительной экспериментальной гипотезы, после постановки эксперимента наобум, или просто проведенные задним числом для анализа какой-либо ситуации. Именно в этом значении употреблено в нашем контексте. На русский язык чаще переводится как «ретроспективный анализ», реже — как анализ post hoc (обычно только в философии и методологии науки); 2) частный вид анализа (точечные сравнения) в схеме дисперсионного анализа (т.е. в схемах ANOVA, MANOVA).
Метод наименьших квадратов (МНК) (Least squares method (LSM)) — математический метод, применяемый для решения различных задач, основанный на минимизации суммы квадратов отклонений некоторых функций от искомых переменных. Он может использоваться для решения переопределенных систем уравнений (когда количество уравнений превышает количество неизвестных), для поиска решения в случае обычных (неопределенных) нелинейных систем уравнений, для аппроксимации точечных значений некоторой функции. МНК является одним из базовых методов регрессионного анализа для оценки неизвестных параметров регрессионных моделей по выборочным данным.
В сложных научных проектах, когда клинические исследования выполняются по единому плану в разных научных центрах (многоцентровое исследование), возникает статистическая проблема. Ее порождает неизбежная неоднородность исследования (количество наблюдений, пол, вариации исходных уровней ряда параметров). Хотя эффекты, полученные в разных центрах при испытании одного и того же фактора, могут быть однонаправленными (например, везде фактор увеличивает изучаемый показатель), при объединении данных может получиться парадоксальный результат — фактор уменьшает значение показателя (парадокс Симпсона).
Если многоцентровые исследования сбалансированы по численности и другим ковариантам, то проблема корректировки не возникает. В случае же гетерогенности исследования, например по числу объектов, использование простых средних арифметических приведет к искажению итоговой величины, но также может создать впечатление, обратное истинному. Для того чтобы избежать этой ошибки, используется не простая средняя арифметическая, а так называемая LSM (least squares means, marginal means — сбалансированная средняя, среднеквадратическая средняя), т.е. средняя, полученная методом наименьших квадратов, в отличие от обычных средних — means. Алгоритм расчета LSM есть в программе SAS (marginal means or EMM — estimated marginal means) (https://en.wikipedia.org/w/index.php?title=Least_squares&oldid=676037803).
LOESS (LOcal regrESSion), известная также как LOWESS (weighted scatterplot smoothing), является одним из многих современных моделирующих методов, которые строятся на классических методах, таких как линейная и нелинейная наименьших квадратов регрессия. Cовременные регрессионные методы разработаны для ситуаций, в которых классические процедуры невозможно провести хорошо или нельзя эффективно применить без затруднений. LOESS объединяет многое из простоты линейной регрессии наименьших квадратов с гибкостью нелинейной регрессии. Это делается путем подгонки простых моделей к локализованным (ограниченным) поднаборам (subsets) данных для построения функции, которая описывает детерминирующую часть вариаций данных, т.е. точка за точкой. По сути, одной из главных привлекательных черт этого метода яляется то, что от проводящего анализ не требуется точно определить глобальную функцию любой формы для подгонки модели ко всему массиву данных, а только для подгонки к сегментам данных. Этот метод был предложен Clevelend (1973) и дальше разработан Clevelend и Devlin (1988), он более известен как локально взвешенная (многочленная) регрессия. В каждой точке набора данных многочлен низкой степени подгоняют к поднабору данных с объяснительными уровнями переменных вблизи точки, ответ которой определяют. Многочлен подгоняют, используя взвешенные наименьшие квадраты, что обеспечивает больший вес для точек, близких к точке, чей ответ определяют, и меньший вес для отдаленных точек. Затем получают уровень регрессионной функции для точки путем оценки локального многочлена, используя объяснительные уровни переменных для точечных данных. Эти статистические методы разработаны специально для применения современных компьютерных возможностей, обеспечивающих достижение цели, которая является трудно достижимой с использованием только традиционных подходов (https://en.wikipedia.org/wiki/Local_regression).
Список литературы
(для обеих частей обзора)
1. Ahsen B. Avoiding hypoglycemia: a key to success for glucose-lowering therapy in type 2 diabetes // Vasc. Healht. Risk. Man. — 2013. — Vol. 9. — P. 155-163.
2. American Diabetes Association. Standarts of medical care in diabetes — 2014 // Diabetes Care. — 2014. — Vol. 37. — P. S14-S80.
3. Andrews M.A., O’Malley P.G. Diabetes overtreatment in eldery individuals: risky business in need of better management // JAMA. — 2014. — Vol. 311. — P. 2326-2327.
4. Approval package for application number NDA 21-081/S-024, 2007. [Electronic resourse]. — Available from: www.accessdata.fda.gov/drugsatfda_docs/nda/2007/0210810 rig1s024.pdf
5. Arnolds S., Kuglin B., Kapitza C. et al. How pharmacokinetic and pharmacodynamic principles pave the way for optimal basal insulin therapy in type 2 diabetes // Int. J. Clin. Pract. — 2010. — Vol. 64. — P. 1415-1424.
6. Atkinson M.A., Eisenbarth G.S., Michels A.W. Type 1 diabetes // Lancet. — 2014. — Vol. 383. — P. 69-82.
7. Atkinson M.A., George S., Eisenbarth G.S. 1947–2012 // Diabetologia. — 2013. — Vol. 56. — P. 435-438.
8. Atkinson M.A., Herrath M., Powers A.C., Clare-Salzer M. Current concepts of the pathogenesis of type 1 diabetes — consi-derations for attempts to prevent and reverse the disease // Diabetes Care. — 2015. — Vol. 38 — P. 979-988.
9. A Trial Comparing Cardiovascular safety of insulin degludec versus insulin glargine in subjects with type 2 diabetes at high risk of cardiovascular events (DEVOTE). ClinicalTrials.gov; US National Institutes of Health. [Electronic resourse]. — Available from: http//www.clinicaltrial.gov/ct2/show/NTC01959529?term-devote+degludec&rank = 1.
10. Barlocco D. Insulin detemir. Novo Nordisk // Curr. Opin. Investig. Drugs. — 2003. — Vol. 4. — P. 449-454.
11. Barnett A.H. Insulin glargine in the treatment of type 1 and type 2 diabetes // Vask. Health Risk Manag. — 2006. — Vol. 2. — P. 59-67.
12. Becker R.H.A., Hahn A.D., Boderke P. et al. 2011. European Patent Applicator Long-acting formulations of insulins. European Patent Office (Application No. 11166415.7) // Available from https://data.epo.org.
13. Becker R.H.A., Nowotny I., Teichert L. et al. Low within- and between-day variability in exposure to new insulin glargine 300 U.ml-1 // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 892-P.
14. Becker R.H.A., Dahmen R., Bergmann K. et al. New insulin glargin 300 U.mL-1 provides a more even activity profile and prolonged glycemic control at steady state compared with insulin glargine 100 U.ml-1 // Diabetes Care. — 2015. — Vol. 38. — P. 637-643.
15. Bergenstal R., Bailey T., Robard D. et al. Insulin glargine 300 U/ml vs 100 U/ml: glucose profiles of morning vs evening injections in adults with T1DM measured with continuous glucose monitoring (CGM) // Diabetes Technol. Ther. — 2015. — Vol. 17. — P. A16-17 (abstract 39).
16. Bergenstal R.M., Bailey T.S., Rodbard D. et al. Insulin glargine 300 U/ml vs 100 U/ml: glucose profiles of morning vs evening injections in adults with T1DM measured with continuous glucose monitoring (CGM) // 50th Annual meeting of the European Association for the Study Diabetes: Vienna, Austria, 15–19 September 2014. — 2014. — Abstract 949.
17. Bergenstal R.M., Rosenstock J., Arakaki R.F. et al. A randomized controlled study of once-daily LY2605541, a novel long-acting basal insulin, versus insulin glargine in basal insulin-treated patients with type 2 diabetes // Diabetes Care. — 2012. — Vol. 35. — P. 2140-2147.
18. Bolli G.B., Owens D.R. Insulin glargine // Lancet. — 2000. — Vol. 356. — P. 443-445.
19. Bolli G.B., Andreoli A.M., Lucidi P. Optimizing the replacement of basal insulin in type 1 diabetes mellitus: no longer an elusive goal in the post-NPH era // Diabetes Thechnol. Ther. — 2011. — Vol. 13, Suppl. 1. — P. S43-S52.
20. Bolli G.B., Hahn A.D., Schmidt R. et al. Plasma exposure to insulin glargine and its metabolites M1 and M2 after subcutaneous injection of therapeutic and supratherapeutic doses of glargine in subjects with type 1 diabetes // Diabetes Care. — 2012. — Vol. 35. — P. 2626-2630.
21. Bolli G.B., Riddle M.C., Bergenstal R.M. et al. New insulin glargine 300 U/ml: glycaemic control and hypoglycaemia in insulin-naive people with type 2 diabetes mellitus (EDITION 3) // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 947.
22. Bolli G.B., Riddle M.C., Bergenstal R.M. et al. New insulin Glargine 300 U/ml: glycaemic control and hypoglycaemia in insulin naïve people with T2DM (EDITION 3) // 50th Annual meeting of the European Association for the Study Diabetes, Vienna, Austria, 15–19 September 2014. — 2014. — Abstract 947.
23. Bolli G.B., Riddle M.C., Bergenstal R. M. et al. New insulin glargine 300 U/ml compared with glargine 100U/ml in insulin naïve people with type 2 diabetes on oral glucose-lowering drugs: a randomized controlled trial (EDITION 3) // Diabetes Obes. Metab. — 2015. — Vol. 17. — P. 386-394.
24. Bolli G.B., De Vries J.H. New long-acting insulin analogs: from clamp studies to clinical practice // Diabetes Care. — 2015. — Vol. 38. — P. 541-543.
25. Bron M., Marynchenko M., Yang H. et al. Hypoglycemia, treatment discontinuation, and costs in patients with type 2 diabetes mellitus on oral antidiabetic drugs // Postgrad. Med. — 2012. — P. 124-132.
26. Butler A.E., Galasso R., Meier J.J. et al. Modestly increased beta cell apoptosis but no increased beta cell replication in recen-tonset type 1 diabetic patients who died of diabetic ketoacidosis // Diabetologia. — 2007. — Vol. 50. — P. 2323-2331.
27. Calvert M.J., McManus R.J., Freemantle N. et al. Mana-gement of type 2 diabetes with multiple oral hypoglycaemic agents or insulin in primary care: retrospective cohort study // Br. J. Gen. Pract. — 2007. — Vol. 57. — P. 455-460.
28. Camprioni M., Tofolo G., Basu R. et al. Minimal model assessment of hepatic insulin extraction during an oral test from standard insulin kinetic parameters // Am. J. Physiol. Endocrinol. Metab. — 2009. — Vol. 297. — P. E941-E948.
29. Chapman T.M., Perry C.M. Insulin detemir: a review of its use in the management of type 1 and 2 diabetes mellitus // Drugs. — 2004. — Vol. 64. — P. 2577-2595.
30. Dahmen R., Bergmann K., Lehmann A. et al. New insulin glargine U300 formulation events and prolongs steady state PK and PD profiles during euglycemic clamp in patients with type 1 diabetes (T1DM) // Diabetes. — 2013. — Vol. 62, Suppl. 1. — P. A29.
31. Data on file-Real-World Data On Hypos following Basal Insulin Initiation (Value@Access team).
32. Davies M. The reality of glycemic control in insulin trea-ted diabetes: defining the clinical challenges // Int. J. Obes. Relat. Metab. Disord. — 2004. — Vol. 28, Suppl. 2. — P. S14-S22.
33. Davies M.J., Gagliardino J.J., Gray L.J. et al. Real-world factors affecting adherence to insulin therapy in patients with type 1 or type 2 diabetes mellitus: a systematic review // Diabet. Med. — 2013. — Vol. 30. — P. 512-524.
34. Deiss D., Kordonouri O., Hartmann R. Treatment with insulin glargine reduces asymptomatic hypoglycemia detected by continuous subcutaneous glucose monitoring in children and adolescents with type 1 diabetes // Pediatr. Diabetes. — 2007. — Vol. 8. — P. 157-162.
35. Dorland’s illustrated medical dictionary, edition 28, W.B. Saunders company.
36. Eaton R.P., Allen R.C., Shade D.S. et al. «Normal» insulin secretion: the goal of artifical insulin delivery systems? // Diabetes Care. — 1980. — Vol. 3 — P. 270-273.
37. Eaton R.P., Allen R.C., Shade D.S. Hepatic removal of insulin in normal man: dose response to endogenous insulin secretion // J. Clin. Endocrinol. Metab. — 1983. — Vol. 56. — P. 1294-1300.
38. Evans M., Schumm-Draeger P.M., Vora J. et al. A review of modern insulin analogue pharmacokinetic and pharmacodynamic profiles in type 2 diabetes: improvements and limitations // Diabetes Obes. Metab. — 2011. — Vol. 8. — P. 677-684.
39. Fagot J.P., Blotiere P.O., Ricordeau P. et al. Does insuline glargine increase the risk of cancer compared with other basal insulins? A French nationwide cohort study based on national administrative databases // Diabetes Care. — 2013. — Vol. 36. — P. 294-301.
40. Garber A.J., King A.B., Del Prato S. et al. Insulin Degludec an ultra-longating basal insulin, versus insulin glargine in basal bolus treatment with mealtime insulin apart in type 2 diabetes (BEGIN Basal-Bolus Type 2): a phase 3, randomized open-label, treat-to-target non-inferiority trial // Lancet. — 2012. — Vol. 379. — P. 1498-1507.
41. Gerstein H.C., Bosch J., Dagenais G.R. et al. ORIGIN Trial Investigators. Basal insulin and cardiovascular and other outcomes in dysglycemia // N. Engl. J. Med. — 2012. — Vol. 367. — P. 319-328.
42. Gough S.C., Harris S., Woo V. et al. Insulin degludec: overview of a novel ultra long-acting basal insulin // Diabetes Obes. Metab. — 2013. — Vol. 15. — P. 301-309.
43. Goykhman S., Drincic A., Desmangles J.C. et al. Insulin glargine a review 8 years after its introduction // Expert Opin. Pharmacother. — 2009. — Vol. 10. — P. 705-718.
44. Grimaldi-Bensouda L., Cameron D., Marty M. et al. Risk of breast cancer by individual insulin use: an international multicenter study // Diabetes Care. — 2014. — Vol. 37. — P. 134-143.
45. Gualandi-Signorini A.M., Giorgi G. Insulin formulations — a review // Eur. Rev. Med. Pharmacol. Sci. — 2001. — Vol. 5. — P. 73-83.
46. Heise T., Nosek L., Bottcher S.G. et al. Ultra-long-acting insulin degludec has a flat and stable glucose-lowering effect in type 2 diabetes // Diabetes Obes. Metab. — 2012. — Vol. 14. — P. 944-950.
47. Heller S., Koenen C., Bode B. Comparison of insulin glargine in a basal-bolus regimen, with insulin aspart as the mealtime insulin, in patients with type 1 diabetes a 52-week, multinational, randomized open-label, parallel group, treat-to-target, noninferiority trial // Clin. Ther. — 2009. — Vol. 31. — P. 2086-2097.
48. Henricksen J.H., Tronier B., Bülow J.B. Kinetics of circulating endogenous insulin, C-peptide, and proinsulin in fasting nondiabetic man // Metabolism. — 1987. — Vol. 36. — P. 463-468.
49. Hilgenfeld R., Seipke G., Berchold H. et al. The evolution of insulin glargine and its continuing contribution to diabetes care // Drugs. — 2014. — Vol. 74. — P. 911-927.
50. Hirsh I.B., Bergenstal R.M., Parkin Ch.G. et al. A Real-World Approach to Insulin Therapy in Primary Care Practice // Clin. Diabetes. — 2005. — Vol. 23. — P. 78-86.
51. Hollander P., Cooper J., Bregnhoi J. et al. A 52-week, multinational open-label parallel-group noninferiority treat-to-target trial comparing insulin detemir with insulin glargine in a basal-bolus regimen with mealtime insulin aspart in patients with type 2 diabetes // Clin. Ther. — 2008. — Vol. 30. — P. 1976-1987.
52. Holman R.R., Farmer A.J., Davies M.J. et al. Three-year efficacy of complex insulin regimens in type 2 diabetes // N. Engl. J. Med. — 2009. — Vol. 361. — P. 1736-1747.
53. Home P.D., Bergenstal R.M., Riddle M.C. et al. Glycaemic control and hypoglycaemia with new insulin Glargine 300 U/mL in people with type 1 diabetes (EDITION 4) // Diabetologia. — 2014. — Vol. 57, Suppl. 1. — P. S69.
54. Home P.D., Bergenstal R.M., Riddle M.C. et al. Glycemic control and hypoglycemia with new insulin glargine 300 U/ml in people with T1DM (EDITION 4) // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 80-LB.
55. Home P.D., Bergenstal R.M., Bolli G.B. et al. New insulin glargine 300Units/ml versus glargine 100 Units/mL in people with type 1 diabetes: a randomized, phase 3a, open-label clinical trial (EDITION 4) // Diabetes Care. — 2015 Publish Ahead of Print.
56. Hopkins D. Exercise-induced and other daytime hypoglycemic events in patients with diabetes: prevention and treatment // Diabetes Res. Clin. Pract. — 2004. — Vol. 65, Suppl. 1. — P. S35-S39.
57. Horvath K., Jeitler K., Berghold A. et al. Long-acting insulin analogues versus NPH insulin (human isophane insulin) for type 2 diabetes mellitus // Cochane Database Syst. Rev. — 2007. — CD005613
58. Iglesias P., Diez J.J. Insulin therapy in renal disease // Diabetes Obes. Metab. — 2008. — Vol. 10. — P. 811-823.
59. International Diabetes Federation. Diabetes Atlas. — 6th edition. — Brussels; Belgium: International Diabetes Federation, 2013.
60. Investigators O.T., Gerstein H.C., Bosch J. et al. Basal insulin and cardiovascular and other outcomes in dysglycaemia // N. Engl. J. Med. — 2012. — Vol. 367. — P. 319-328.
61. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Management of hyperglycemia in type 2 diabetes: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. — 2012. — Vol. 35. — P. 1364-1379.
62. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) // Diabetes Care. — 2015. — Vol. 38. — P. 140-149.
63. Ishii H., Iwamoto Y., Tajima N. An Exploration of Barriers to Insulin Initiation for Physicians in Japan: Findings from the Diabetes Attitudes, Wishes and Needs (DAWN) JAPAN Study // Plos. One. — 2012. — Vol. 7. — P. e36361.
64. Jax J., Heise T., Dahmen R. et al. New insulin glargine formulation has a flat and prolonged steady state profile in subjects with type 1 diabetes // Diabetologia. — 2013. — Vol. 56. — P. A1029.
65. Jeandidier N., Riddle M.C., Bolli G.B. et al. New insulin Glargine 300 U/ml: efficacy and safety of flexible vs fixed dosing intervals in people with 2 diabetes mellitus // 50th Annual meeting of the European Association for the Study Diabetes, Vienna, Austria, 15–19 September 2014. — 2014. — Abstract 961.
66. Jinnouchi H., Koyama M., Amano A. et al. Continuous Glucose monitoring during basal-bolus therapy using Glargine
300 U ml-1 and Glargine 100 U ml-1 in Japanese People with Type 1 Diabetes Mellitus: A Crossover pilot study // Diabetes Ther. — 2015.
67. Jørgensen K.H., Hansen A.K., Buschard K. Five fold increase of insulin concentration delays the absorption of subcutaneously injected human insulin suspensions in pigs // Diabetes Res. Clin. Pract. — 2000. — Vol. 50. — P. 161-167.
68. Kuerzel G.U., Shukla U., Scholtz H.E. et al. Biotransformation of insulin glargine after subcutaneous injection in healthy subjects // Curr. Med. Res. Opin. — 2003. — Vol. 19. — P. 34-40.
69. Kuricova K., Pacal L., Kankova K. Hypoglycemia Increa-ses Expression of Several Genes Upregulated by Hyperglycemia // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 401-P.
70. Lambert P.C., Sutton A.J., Abrams K.P., Jones D.R. A comparison of summary patient-level covariates in meta-regression with individual patient data meta-analysis // J. Clin. Epidemiol. — 2002. — Vol. 55. — P. 86-94.
71. Lamy A., Tong W., Jung H. et al. Cost implications of the use of basal insulin glargine in people with early dysglycemia: the ORIGIN trial // J. Diabetes Complications. — 2014. — Vol. 28. — P. 553-558.
72. Leese G.P.,Wang J., Broomhall J. et al. Frequency of severe hypoglycemia requiring emergency treatment in type 1 and type 2 diabetes: a population-based study of health service resource use // Diabetes Care. — 2003. — Vol. 26. — P. 1176-1180.
73. Leiter L.A., Yale J.-F., Chiasson J.-L. et al. Assessment of the impact of fear of hypoglycemic episodes on glycemic and hypoglycemia management // Can. J. Diabetes. — 2005. — Vol. 29. — P. 186-192.
74. Lucidi P., Porcellati F., Candeloro P. et al. Glargine metabolism over 24 h following its subcutaneous injection in patients with type 2 diabetes mellitus: a dose-response study // Nutr. Metab. Cardiovasc. Dis. — 2014. — Vol. 24. — P. 709-716.
75. Mannucci E., Giannini S., Dicembrini I. Cardiovascular effects of basal insulins // Drugs, healthcare and patient safety. — 2015. — Vol. 7. — P. 113-120.
76. Markussen J., Diers I., Hougaard P. et al. Soluble, prolonged-acting insulin derivatives. III. Degree of protraction, crystallizability and chemical stability of insulins substituted in positions A21, B13, B23, B27 and B30 // Protein Eng. — 1988. — Vol. 2. — P. 157-166.
77. Martens G.A., Van de Casteele M. Glycemic control of apoptosis in the pancreatic beta cell: danger of extremes? // Antioxid. Redox. Sygnal. — 2007. — Vol. 9. — P. 309-317.
78. Matsuhisa M., Koyama M., Cheng X. et al. EDITION JP 1 Study Group. New insulin Glargine 300 U/ml: glycaemic control and hypoglycaemia in Japanese people with T1DM (EDITION JP 1) // 50th Annual meeting of the European Association for the Study Diabetes, Vienna, Austria, 15–19 September 2014. — 2014. — Abstract 975.
79. Matsuhisa M., Koyama M., Cheng X. et al. New insulin glargine 300 U/mL: glycemic control and hypoglycemia in Japanese people with T1DM (EDITION JP I) // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 88-LB.
80. Matsuhisa M., Koyama M., Cheng X. et al. Sustained glycemic control and less nocturnal hypoglycemia with new insulin glargine 300 U/mL compared with glargine 100 U/mL over 12 months in Japanese people with T1DM (EDITION JP 1) on behalf of the EDITION JP 1 study group // 75th Scientific sessions of ADA, Boston, USA, 5–9 June 2015. — 2015. — Abstract 987-P.
81. Meier J.J. Beta cell mass in diabetes: a realistic therapeutic target? // Diabetоlogia. — 2008. — Vol. 51. — P. 703-713.
82. Mellbin L.G., Ryden L., Riddle M.C. et al. Does hypoglycaemia increase the risk of cardiovascular events? A report from the ORIGIN trial // Eur. Heart. J. — 2013. — Vol. 34. — P. 3137-3144.
83. Monami M., Adalsteinsson J.E., Desireri C.M. et al. Fas-ting and post-prandial glucose and diabetic complication. A meta-analysis // Nurt. Metab. Cardiovasc. Dis. — 2013. — Vol. 23. — P. 591-598.
84. Monti L.D., Poma R., Caumo A. et al. Intravenous infusion of diarginylinsulin, an insulin analogue: effects on glucose turnover and lipid levels in insulin-treated type 2 diabetic patients // Metabolism. — 1992. — Vol. 41. — P. 540-544.
85. Mullins P., Sharplin P.,Yki-Jarvinen H. et al. Negative binomial meta-regression analysis of combined glycosylated hemoglobin and hypoglycemia outcomes across eleven Phase III and IV studies of insulin glargine compared with neutral Hagedorn insulin in type 1 and 2 diabetes mellitus // Clin. Ther. — 2007. — Vol. 29. — P. 1607-1619.
86. Nieuwesteeg A., Pouwer F., van der Kamp R. et al. Quality of life of children with type 1 diabetes: a systematic review // Curr. Diabetes Rev. — 2012. — Vol. 8. — P. 434-443.
87. Nolan C.J., Damm P., Prentki M. Type 2 diabetes across generations: from pathophysiology to prevention and management // Lancet. — 2011. — Vol. 378. — P. 169-181.
88. Owens D.R. Insulin preparations with prolonged effect // Diabetes Technol. Ther. — 2011. — Vol. 13, Suppl. 1. — P. S5-S14.
89. Owens D.R., Matfin G., Monnier L. Basal insulin analogues in the management of diabetes mellitus: what progress have we made? // Diabetes Metab. Res. Rev. — 2014. — Vol. 30. — P. 104-119.
90. Peyrot M., Barnett A.H., Meneghini L.F. et al. Insulin adherence behaviors and barriers in the multinational global attitudes of patients and physicians in insulin therapy study // Diabet. Med. — 2012. — Vol. 29. — P. 682-689.
91. Pieber T.R., Treichel H.C., Hompresch B. et al. Comparison of insulin detemir and insulin glargine in subjects with type 1 diabetes using intensive insulin // Diabet. Med. — 2007. — Vol. 24. — P. 635-642.
92. Polonsky W.H., Fisher L., Guzman S. et al. Pshycological insulin resistance in patients with type 2 diabetes: the score of the problem // Diabetes Care. — 2005. — Vol. 28. — P. 2543-2545.
93. Pontiroli A.E., Miele L., Morabito A. Increase of body weight during the first year of intensive insulin treatment in type 2 diabetes: systematic review and meta-analysis // Diabetes Obes. Metab. — 2011. — Vol. 13. — P. 1008-1019.
94. Porcellati F., Rossetti P., Busciantella R.N. et al. Comparison of Pharmacokinetics and Dynamics of the Long-Acting Insulin Analogs Glargine and Detemir at Steady State in Type 1 Diabetes: a double-blind, randomized, crossover study // Diabetes Care. — 2007. — Vol. 30. — P. 2447-2452.
95. Porcellati F., Lucidi P., Cioli P. et al. Pharmacokinetics and pharmacodynamics of insulin glargine given in the evening as compared with in the morning in type 2 diabetes // Diabetes Care. — 2015. — Vol. 38. — P. 503-512.
96. Raskin P., Gylvin T., Weng W. et al. Comparison of insulin detemir and insulin glargine using a basal-bolus regimen in a randomized, controlled clinical study in patients with type 2 diabetes // Diabetes Metab. Res. Rev. — 2009. — Vol. 25. — P. 542-548.
97. Ratner R.E., Hirsch I.B., Neifing J.L. et al. Less hypoglycemia with insulin Glargine in intensive insulin therapy for type 1 diabetes. US Study Group of insulin Glargine in type 1 diabetes // Diabetes Care. — 2000. — Vol. 23. — P. 639-643.
98. Ricci C., Pastukh V., Mozafarri M., Shaffer S.W. Insulin withdrawal induces apoptosis via a free radical mediated mechanism // Can. J. Physiol. Pharmacol. — 2007 — Vol. 85. — P. 455-464.
99. Riddle M.C., Bolli G.B., Yki-Jarvinen H. et al. Sustained glycemic control and hypoglycemia with new insulin glargine 300 U/mL compared with 100 U/ml: one-year results in people with T2DM using basal + mealtime insulin (EDITION 1) // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 81-LB.
100. Riddle M.C., Bolli G.B., Home P.D. et al. New insulin glargine 300 U/ml: efficacy and safety of adaptable vs fixed dosing intervals in people with T2DM // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 919-P.
101. Riddle M.C., Bolli G.B., Ziemen M. et al. New insulin glargine 300 units/ml versus glargine 100 Units/ml in people with type 2 diabetes using basal and mealtime insulin: glucose control and hypoglycemia in a 6-month randomize controlled trial –(EDITION 1) // Diabetes Care. — 2014. — Vol. 37. — P. 2755-2762.
102. Ritzel R., Rousell R., Bolli G. et al. New insulin Glargine 300 U/ml: glycaemic control and hypoglycaemia in a meta-analysis of phase 3a EDITION Clinical trials in people with T2DM // 50th Annual meeting of the European Association for the Study Diabetes, Vienna, Austria, 15–19 September 2014. — 2014. — Abstract 963.
103. Ritzel R., Roussel R., Bolli G. et al. New insulin glargine 300 U/ml: glycaemic control and hypoglycaemia in a meta-ana-lysis of phase 3a EDITION clinical trials in people with T2DM // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 90-LB.
104. Ritzel R., Roussel R., Bolli G.B. et al. Patient-level meta-analysis of the EDITION 1, 2 and 3 studies: glycaemic control and hypoglycaemia with new insulin glargine 300 U/ml versus glargine 100 U/ml in people with type 2 diabetes // Diabetes Obes. Metab. — 2015. — Vol. 9. — P. 859-867.
105. Ritzel R., Roussel R., Giaccari A. et al. Glycemic control and hypoglycemia with insulin glargine 300 U/mL (Gla-300) vs glargine 100 U/mL (Gla-100) in type 2 diabetes (T2DM) in a patient-level meta-analysis of 1-year phase 3a EDITION studies // 75th Scientific sessions of ADA, Boston, USA, 5–9 June 2015. — 2015. — Abstract 1030-P.
106. Rosenstock J., Dailey G., Massi-Benedetti M. et al. Reduced hypoglycemia risk with insulin glargine: a meta-analysis comparing insulin glargine with human NPH insulin in type 2 diabetes // Diabetes Care. — 2005. — Vol. 28. — P. 950-955.
107. Rosenstock J., Davies M., Home P.D. et al. A randomized, 52-week, treat-to-target trial comparing insulin detemir with type 2 diabetes // Diabetologia. — 2008. — Vol. 51. — P. 408-416.
108. Roussel R., d’Emden M. C., Fisher M. et al. Switching from twice-daily basal insulin to once-daily new insulin glargine 300 U/mL (Gla-300): an analysis in people with T2DM –(EDITION 1 and 2) // 75th Scientific sessions of ADA, Boston, USA, 5–9 June 2015. — 2015. — Abstract 1021-P.
109. Rubino A., McQuay L.J., Gough S.C., Kvasz M., Tennis P. Delayed initiation of subcutaneous insulin therapy after fai-lure of oral glucose-lowering agents in patients with Type 2 diabetes: a population-based analysis in the UK // Diabet. Med. — 2007. — Vol. 24. — P. 1412-1418.
110. Ryden L., Grant P.J., Anker S.D. et al. ESC Guidelines on diabetes, prediabetes, and cardiovascular disease developed in collaboration with EASD // Eur. Heart. J. — 2013. — Vol. 34. — P. 3035-3087.
111. Sanofi. Clinical study results. Phase I in Japanese patients with type 1 diabetes mellitus 2013. [Electronic resourse]. — Avai-lable from: http://cn.sanofi.com/img/content/study/pdf2777-summary.pdf.
112. Schisano B., Tripathi G., McGee K. et al. Glucose oscillations, more than constant high glucose, induce p53 activation and a metabolic memory in human endothelial cells // Diabetologia. — 2011. — Vol. 54. — P. 1219-1226.
113. Shiramoto M., Eto T., Irie S. et al. Single-dose insulin glargine 300 U/ml provides prolonged, stable glycaemic control in Japanese and European people with type 1 diabetes // Diabetes Obes. Metab. — 2015. — Vol. 17. — P. 254-260.
114. Shiramoto M., Eto T., Watanabe A. et al. Single dose of new insulin glargine Gla-300 formulation has a flatter and prolonged PK/PD profile than Gla-100 in Japanese subjects with type 1 diabetes // Diabetologia. — 2013. — Vol. 56. — P. A1031.
115. Sinha V.P., Howey D.C., Choi S.L. et al. Steady-state pharmacokinetics and glucodynamics of the novel, long-acting basal insulin LY2605541 dosed once-daily in patients with type 2 diabetes mellitus // Diabetes Obes. Metab. — 2014. — Vol. 16. — P. 344-350.
116. Simon A.C., DeVries J.H. The future of basal insulin supplementation // Diabetes Technol. Ther. — 2011. — Vol. 13 (Suppl. 1). — P. S103-S108
117. Sommerfled M.R., Muller G., Tschank G. et al. In vitro metabolic and mitogenic signaling of insulin glargine and its metabolites // PLoS One. — 2010. — Vol. 5. — P.e9540.
118. Steinstaresser A., Schmidt R., Bergmann K. et al. Investigational new insulin glargine 300 U/ml has the same metabolism as insulin glargine 100 U/ml /research letter // Diabetes Obes. Metab. — 2014. — Vol. 16. — P. 873-876.
119. Sutton G., Minguet J., Ferrero C., Bramlage P. U300, A novel long-acting insulin formulation // Expert Opin. Biol. Ther. — 2014. — Vol. 14. — P.1849-1860.
120. Swinnen S.G., Dain M.P., Aronson R. et al. A 24-week, randomized, treat-to-target trial comparing initiation of insulin glargine once-daily with insulin detemir twice-daily in patients with type 2 diabetes inadequately controlled on oral glucose-lowering drugs // Diabetes Care. — 2010. — Vol. 33. — P. 1176-1178.
121. Teramukai S., Matsuyama Y., Mizuno S. et al. Individual patient-level and study-level meta-analysis for investigating modifiers of treatment effect // Jpn. J. Clin. Oncol. — 2004. — Vol. 34. P. 717-721.
122. Terauchi Y., Koyama M., Cheng X. et al. Glycemic control and hypoglycaemia in Japanese people with T2DM receiving New insulin Glargine 300 U/ml in combination with OADs (EDITION JP 2) // 50th Annual meeting of the European Association for the Study Diabetes, Vienna, Austria, 15–19 September 2014. — 2014. — Abstract 976.
123. Terauchi Y., Koyama M., Cheng X. et al. Glycaemic control and hypoglycaemia in Japanese people with T2DM recei-ving new insulin glargine 300 U/ml in combination with OADSs –(EDITION JP 2) // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 94-LB.
124. Tibaldi J.M. Evolution of insulin development: focus on key parameters // Adv. Ther. — 2012. — Vol. 29. — P. 590-619.
125. Tillner J.A., Bergmann K., Teichert L. et al. Euglycemic clamp profile of new insulin glargine U300 formulation in patients with type 1 diabetes (T1DM) is different from glargine U100 // Diabetes. — 2013. — Vol. 62, Suppl. 1. — P. A234.
126. Toujeo® (U300)-ePress Pack. [Electronic resourse] Value and access team. Data on file — Real-World on hypos following basal insulin initiation.
127. Tschope D., Bramlage P., Binz C. et al. Incidence and predictors of hypoglycaemia in type 2 diabetes — an analysis of the prospective // DiaRegis. registry. BMC Endocr. Disord. — 2012. — Vol. 12. — P. 23.
128. Twigg S.M., Escalada J., Grisoni M.-L. et al. Age, BMI, and diabetes duration: effect on glycemic control and hypoglycemia with insulin glargine 300 U/mL in type 2 diabetes (T2DM) // 75th Scientific sessions of ADA, Boston, USA, 5–9 June 2015. — 2015. — Abstract 1017-P.
129. UK Hypoglycaemia Study Group. Risk of hypoglycaemia in types 1 and 2 diabetes: effects of treatment modalities and their duration // Diabetologia. — 2007. — Vol. 50. — P. 1140-1147.
130. Vague P., Selam J.L., Skiele S. et al. Insulin detemir is associated with more predicable glycemic control and reduced risk of hypoglycemia than NPH-insulin in patients with type 1 diabetes on basal-bolus regimen with premeal, insulin apart // Diabetes Care. — 2003. — Vol. 26. — P. 590-596.
131. Wood J.R., Miller K.M., Maahs D.M. et al. Type 1 Diabetes exchange clinic registry do not meet American Diabetes Association or international Society for Pediatric and adolescent. Diabetes clinical guidelines // Diabetes Care. — 2013. — Vol. 36. — P. 2035-2037.
132. Workgroup on hypoglycemia, American Diabetes Association. Defining and reporting hypoglycemia // Diabetes Care. — 2005 — Vol. 28. — P. 1245-1249.
133. Xie L., Wei W., Pan C., Baser O. Real-world rates, predictors and associated costs of hypoglycemia among patients with type 2 diabetes mellitus treated with insulin glargine: results of a pooled analysis of six retrospective observational studies // J. Med. Econ. — 2013. — Vol. 16. — P. 1137-1145.
134. Yakubovich N., Gerstein H.C. Serious cardiovascular outcomes in diabetes: the role of hypoglycemia // Circulation. — 2011. — Vol. 123. — P. 342-348.
135. Yale J-F., Aroda V. R., Charbonnel B. et al. Older people with type 2 diabetes: glycemic control and hypoglycemia risk with new insulin glargine 300 U/mL // 75th Scientific sessions of ADA, Boston, USA, 5–9 June 2015. — 2015. — Abstract 991-P.
136. Yki-Jarvinen H., Bergenstal R., Ziemen M. et al. New insulin glargine 300 U/mL versus glargine 100 U/mL in people with type 2 diabetes using oral agents and basal insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial –(EDITION 2) // Diabetes Care. — 2014. — Vol. 37. — P. 3235-3243.
137. Yki-Jarvinen H., Bergenstal R.M., Bolli G.B. et al. Less nocturnal hypoglycemia and weight gain with new insulin glargine 300 U/ml compared with 100 U/ml: 1-year results in people with T2DM using basal insulin with OADs (EDITION 2) // 74th Scientific sessions of ADA, San Francisco, USA, 13–17 June 2014. — 2014. — Abstract 93-LB.
138. Zhang P., Zhang X., Brown J. et al. Global healthcare expenditure on diabetes for 2010 and 2030 // Diabetes Res. Clin. Pract. — 2010. — Vol. 87. — P. 293-301.
139. Zinman B., Fulcher G., Rao P.V. et al. Insulin degludec, an ultra-long-acting basal insulin, once a day or three times a week versus insulin glargine once a day in patients with type 2 diabetes: a 16-week, randomised, open-label, phase 2 trial // Lancet. — 2011. — Vol. 377. — P. 924-931.
140. Zongas S., Patel A., Chamers J. et al. Severe hypoglycemia and risks of vascular events and death // N. Engl. J. Med. — 2010. — Vol. 363. — P. 1410-1418.
141. Ефимов А.С., Полторак В.В. Аутоиммунные аспекты инсулинзависимого сахарного диабета. Попытки иммунокоррекции на ранних стадиях заболевания // Пробл. эндокринологии. — 1989. — Т. 35. — С. 85-90.
142. Полторак В.В., Караченцев Ю., Горшунська I. Оптимізація глікемічного контролю у хворих на цукровий діабет новими аналогами інсуліну (фізіологічні моделі замісної інсулінотерапії) // Ліки України. — 2005. — T. 91. — C. 63-68.
143. Полторак В.В., Красова Н.С., Горшунская М.Ю. Гликемическая память как патогенетическое основание для формирования алгоритма современной антидиабетической терапии // МЭЖ. — 2014. — T. 59. — C. 15-22.
144. Полторак В.В., Красова Н.С., Горшунская М.Ю. Апоптоз панкреатических бета-клеток как новая мишень для инсулинотерапии больных сахарным диабетом 1-го и 2-го типа // Проблемы эндокринной патологии. — № 1. — 2015. — C. 90-102.
145. Препарат Тожео (Toujeo®) затверджений у Європейському союзі для лікування діабету у дорослих — новий базальний інсулін показав глікемічний контроль із меншою кількістю випадків підтвердженої гіпоглікемії // МЭЖ. — 2015. — Т. 67. — С. 96-98.
146. Тронько М.Д., Полторак В.В., Соколова Л.К. Дослі–дження ORIGIN (передумови, результати) // МЭЖ. — 2013. — № 1 (49). — С. 15-22.
147. Тронько Н.Д., Зак К.П., Попова В.В., Бутенко А.К. Сахарный диабет. Иммунитет. Цитокины. — К.: Книга-плюс, 2015. — 488 с.
148. Чернобровий А.Д., Тронько М.Д. Довідник основних показникiв дiяльностi ендокринологiчної служби України за 2013 рiк. — К., 2014. — 40 с.

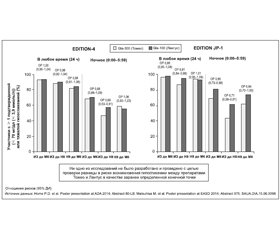
/43.jpg)
/45.jpg)
/46.jpg)
/44.jpg)
/49.jpg)