Международный эндокринологический журнал 8 (72) 2015
Вернуться к номеру
Профиль факторов риска сердечно-сосудистых заболеваний при ишемической болезни сердца у лиц с нормальным и нарушенным углеводным обменом
Авторы: Чернявская И.В. - Государственное высшее учебное заведение «Ивано-Франковский национальный медицинский университет»
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
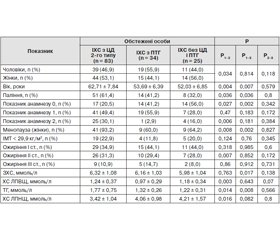
Мета дослідження: провести порівняльний аналіз профілю чинників ризику розвитку серцево-судинних захворювань у хворих на ішемічну хворобу серця (ІХС) з нормальним і порушеним вуглеводним обміном. Матеріали і методи. Під спостереженням перебували 142 пацієнти. З метою оцінки частоти різних форм ІХС залежно від стану вуглеводного обміну були сформовані такі групи: перша група — 83 хворі на цукровий діабет (ЦД) 2-го типу, друга група — 34 хворі з порушенням толерантності до глюкози (ПТГ), третя група — 25 пацієнтів із нормальним вуглеводним обміном. Для виявлення ішемічних змін міокарда проводили амбулаторний добовий моніторинг електрокардіограми з обов’язковим досягненням субмаксимальної частоти серцевих скорочень у процесі дослідження. Результати. Безбольова ішемія міокарда була виявлена у 19 (22,9 %) хворих на ЦД 2-го типу, у 3 (8,8 %) осіб із ПТГ і у 2 (8,0 %) пацієнтів із нормальним вуглеводним обміном. Паління, обтяжена спадковість, порушення в системі гемостазу вірогідно частіше траплялися в групі хворих на ЦД 2-го типу з безбольовою ішемією міокарда порівняно з хворими на ЦД 2-го типу без ІХС. Профіль загальнопопуляційних чинників ризику розвитку серцево-судинних захворювань у хворих на ІХС і цукровий діабет 2-го типу належить до найбільш несприятливих. У той же час у пацієнтів із ранніми порушеннями вуглеводного обміну і нормальним вуглеводним обміном він статистично значимо не розрізняється. Висновки. Хворі на ЦД 2-го типу з безбольовою ішемією міокарда порівняно з хворими на ЦД 2-го типу без ІХС мають вірогідно більш виражені порушення показників загальнопопуляційних чинників ризику розвитку серцево-судинних захворювань.
Цель исследования: провести сравнительный анализ профиля факторов риска развития сердечно-сосудистых заболеваний у больных ишемической болезнью сердца (ИБС) с нормальным и нарушенным углеводным обменом. Материалы и методы. Под наблюдением находились 142 пациента. С целью оценки частоты различных форм ИБС в зависимости от состояния углеводного обмена были сформированы следующие группы: первая группа — 83 больных сахарным диабетом (СД) 2-го типа, вторая группа — 34 больных с нарушением толерантности к глюкозе (НТГ), третья группа — 25 пациентов с нормальным углеводным обменом. Для выявления ишемических изменений миокарда проводили амбулаторный суточный мониторинг электрокардиограммы с обязательным достижением субмаксимальной частоты сердечных сокращений в процессе исследования. Результаты. Безболевая ишемия миокарда была выявлена у 19 (22,9 %) больных СД 2-го типа, у 3 (8,8 %) лиц с НТГ и у 2 (8,0 %) пациентов с нормальным углеводным обменом. Курение, отягощенная наследственность, нарушения системы гемостаза достоверно чаще встречались в группе больных СД 2-го типа с безболевой ишемией миокарда в сравнении с больными СД 2-го типа без ИБС. Профиль общепопуляционных факторов риска развития сердечно-сосудистых заболеваний у больных ИБС и СД 2-го типа принадлежит к наиболее неблагоприятным. В то же время у пациентов с ранними нарушениями углеводного обмена и нормальным углеводным обменом он статистически значимо не различается. Выводы. Больные СД 2-го типа с безболевой ишемией миокарда по сравнению с больными СД 2-го типа без ИБС имеют достоверно более выраженные нарушения показателей общепопуляционных факторов риска развития сердечно-сосудистых заболеваний.
The aim of research was to conduct the comparative analysis of the profile of cardiovascular risk factors in patients with coronary heart disease (CHD) and normal either impaired carbohydrate metabolism. Materials and methods. One hundred and forty two patients were observed. In order to estimate the rate of different forms of CHD depending on the state of carbohydrate metabolism such groups were formed: the first group consisted of 83 patients with type 2 diabetes mellitus (DM), the second group involved 34 patients with impaired glucose tolerance (IGT), the third group consisted of 25 patients with normal carbohydrate metabolism. The ischemic changes of myocardium were detected by ambulatory ECG monitoring with the obligatory achievement of submaximal heart rate during the research. Results. Silent myocardial ischemia was educed in 19 (22.9 %) patients with type 2 DM, in 3 (8.8 %) persons with IGT and in 2 (8.0 %) patients with normal carbohydrate metabolism. Smoking, burdened heredity, violation in the haemostatic system more often occurred in the group of patients with type 2 DM and silent myocardial ischemia in comparison with the patients with type 2 DM without CHD. The profile of general population cardiovascular risk factors in patients with CHD and type 2 DM belongs to the most unfavorable. At the same time for patients with early violations of carbohydrate metabolism and normal carbohydrate metabolism such profile statistically does not differentiate meaningfully. Conclusions. Patients with type 2 DM and silent myocardial ischemia as compared to patients with type 2 DM without CHD have more expressed violations of indexes of general population cardiovascular risk factors for certain.
цукровий діабет, порушення толерантності до глюкози, ішемічна хвороба серця, чинники ризику.
сахарный диабет, нарушение толерантности к глюкозе, ишемическая болезнь сердца, факторы риска.
diabetes mellitus, impaired glucose tolerance, ischemic heart disease, risk factors.
Статтю опубліковано на с. 83-87
Цукровий діабет (ЦД) — одна з найактуальніших медико-соціальних проблем сьогодення. Це пов’язано як зі стрімким зростанням поширеності цього захворювання, так і з високою частотою гострих і хронічних ускладнень патології, що призводить до передчасної втрати працездатності та смерті пацієнта. За даними Міжнародної діабетичної федерації, станом на грудень 2015 року у світі налічується 415 млн хворих на ЦД [1].
Матеріали і методи
Результати
Обговорення
Висновки
1. Diabetes Atlas, IDF. — 7th ed., 2015.
2. Bulugahapitiya U., Siyambalapitiya S., Sithole J., Idris I. Is diabetes a coronary risk equivalent? Systematic review and meta-analysis // Diabet. Med. — 2009. — Vol. 26. — P. 142-148. — Doi: 10.1111/j.1464-5491.2008.02640.x.
3. Timbie J.W., Hayward R.A., Vijan S. Variation in the net benefit of aggressive cardiovascular risk factor control across the US population of patients with diabetes mellitus // Arch. Intern. Med. — 2010. — Vol. 170. — P. 1037-1044. — Doi: 10.1001/archinternmed.2010.150.
4. Wannamethee S.G., Shaper A.G., Whincup P.H. et al. Impact of diabetes on cardiovascular disease risk and all-cause mortality in older men: influence of age at onset, diabetes duration, and established and novel risk factors // Arch. Intern. Med. — 2011. — Vol. 171. — P. 404-410. — Doi: 10.1001/archinternmed.2011.2.
5. Rydén L., Grant P.J., Anker S.D. et al. ESC guidelines on diabetes, prediabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD) // Eur. Heart J. — 2013. — Vol. 34. — P. 3035-3087. — Doi: 10.1093/eurheartj/eht108.
6. Rodriguez-Poncelas A., Coll-de-Tuero G., Saez M. et al. Comparison of different vascular risk engines in the identification of type 2 diabetes patients with high cardiovascular risk // BMC Cardiovasc. Disord. — 2015. — Vol. 15(1). — P. 121. — Doi: 10.1186/s12872-015-0120-3.
7. Shah A.D., Langenberg C., Rapsomaniki E. et al. Type 2 diabetes and incidence of a wide range of cardiovascular diseases: a cohort study in 1,9 million people // Lancet. — 2015. — Vol. 26(385), Suppl. 1. — S. 86. — Doi: 10.1016/S0140-6736(15)60401-9.
8. Seshasai S.R., Kaptoge S., Thompson A. et al. Diabetes mellitus, fasting glucose, and risk of cause-specific death. The Emerging risk factors collaboration // N. Engl. J. Med. — 2011. — Vol. 364. — P. 829-884. — Doi: 10.1056/NEJMoa1008862.
1.Diabetes Atlas, IDF, 7th ed., 2015.
2.Bulugahapitiya U, Siyambalapitiya S, Sithole J, Idris I. Is diabetes a coronary risk equivalent? Systematic review and meta-analysis. Diabet. Med. 2009; 26; 142-8. doi: 10.1111/j.1464-5491.2008.02640.x.
3.Timbie JW, Hayward RA, Vijan S. Variation in the net benefit of aggressive cardiovascular risk factor control across the US population of patients with diabetes mellitus. Arch. Intern. Med. 2010; 170: 1037-44. doi: 10.1001/archinternmed.2010.150.
4.Wannamethee SG, Shaper AG, Whincup PH. Impact of diabetes on cardiovascular disease risk and all-cause mortality in older men: influence of age at onset, diabetes duration, and established and novel risk factors. Arch. Intern. Med. 2011; 171: 404-10. doi: 10.1001/archinternmed.2011.2.
5.Rydén L, Grant PJ, Anker SD. ESC guidelines on diabetes, prediabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur. Heart J. 2013; 34: 3035-87. doi: 10.1093/eurheartj/eht108.
6.Rodriguez-Poncelas A, Coll-de-Tuero G, Saez M. Comparison of different vascular risk engines in the identification of type 2 diabetes patients with high cardiovascular risk. BMC Cardiovasc. Disord. 2015; 15(1): 121. doi: 10.1186/s12872-015-0120-3.
7.Shah AD, Langenberg C, Rapsomaniki E. Type 2 diabetes and incidence of a wide range of cardiovascular diseases: a cohort study in 1.9 million people. Lancet. 2015; 26 (385): 86. doi: 10.1016/S0140-6736(15)60401-9.
8.Seshasai SR, Kaptoge S, Thompson A. Diabetes mellitus, fasting glucose, and risk of cause-specific death. The Emerging risk factors collaboration. N. Engl J. Med. 2011; 364: 829-84. doi: 10.1056/NEJMoa1008862.

/85.jpg)