Международный эндокринологический журнал 1 (73) 2016
Вернуться к номеру
Влияние метформина на показатели тиреоидной панели, углеводного и липидного обмена у больных с диффузным токсическим зобом и инсулинорезистентностью
Авторы: Лищук О.З. - Львовский национальный медицинский университет имени Данила Галицкого, кафедра эндокринологии, г. Львов, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Метою дослідження було вивчення впливу метформіну на показники тиреоїдних гормонів, вуглеводного та ліпідного обміну хворих з дифузним токсичним зобом та наявною інсулінорезистентністю. У статті наводяться результати дослідження, у якому взяв участь 21 хворий з дифузним токсичним зобом. Лікування проводили у два етапи по 3 місяці кожен. На першому етапі усі пацієнти отримували тиреостатичну терапію тирозолом, а на другому етапі з метою корекції інсулінорезистентності додатково було призначено метформін. Отримані результати свідчать на користь нормалізації індексу HOMA-IR за рахунок зниження рівня глюкози та інсуліну натще, а також деякого підвищення тиреотропного гормона та зниження вільного тироксину в межах референтних норм на тлі комбінованого лікування тирозолом з метформіном.
Целью исследования было изучение влияния метформина на показатели тиреоидных гормонов, углеводного и липидного обмена больных с диффузным токсическим зобом и имеющейся инсулинорезистентностью. В статье приводятся результаты исследования, в котором принял участие 21 больной с диффузным токсическим зобом. Лечение проводили в два этапа по 3 месяца каждый. На первом этапе все пациенты получали тиреостатическую терапию тирозолом, а на втором этапе с целью коррекции инсулинорезистентности дополнительно был назначен метформин. Полученные результаты свидетельствуют в пользу нормализации индекса HOMA-IR за счет снижения уровня глюкозы и инсулина натощак, а также некоторого повышения тиреотропного гормона и снижения свободного тироксина в пределах референтных норм на фоне комбинированного лечения тирозолом с метформином.
The goal of this investigation was to study the influence of metformin on the indices of thyroid hormones, carbohydrate and lipid metabolism in patients with diffuse toxic goiter and insulin resistance. The article presents the results of the study of 21 patients with diffuse toxic goiter. Treatment was conducted in two phases and each phase lasted for 3 months. During the first phase all patients received thyreostatic therapy with thyrozol, metformin was additionally prescribed in order to correct insulin resistance on the second phase. The obtained results are the evidence in favor of HOMA-IR index normalization by reducing glucose and fasting insulin, and slight increase in thyroid stimulating hormone and free thyroxine reduction within the referential standards against the background of combined treatment with thyrozol and metformin.
дифузний токсичний зоб, інсулінорезистентність, тирозол, метформін.
диффузный токсический зоб, инсулинорезистентность, тирозол, метформин.
diffuse toxic goiter, insulin resistance, thyrozol, metformin.
Статтю опубліковано на с. 21-24
Робота є фрагментом комплексної наукової-дослідної роботи кафедри ендокринології Львівського національного медичного університету імені Данила Галицького «Особливості метаболічних та функціонально-структурних порушень серцево-судинної системи та органів травлення у хворих на цукровий діабет» (номер державної реєстрації 0111U000131, шифр роботи IH.09.0001.11).
Вступ
Матеріали і методи
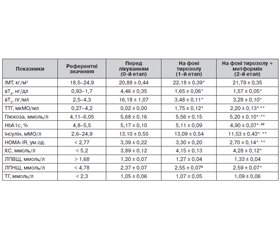
Результати й обговорення
Висновки
1. Боровиков В. STATISTICA: Искусство анализа данных на компьютере. Для профессионалов / В. Боровиков. — СПб.: Питер, 2001. — 656 с.
2. Уніфікований клінічний протокол первинної та вторинної (спеціалізованої) медичної допомоги. Цукровий діабет 2 типу // Міжнарод. ендокрин. журн. — 2013. — № 1. — С. 116-169.
3. American Association of Clinical Endocrinologists’ comprehensive diabetes management algorithm consensus statement / A.J. Garber, M.J. Abrahamson, J.I. Barzilay [et al.] // Endocr. Pract. — 2013. — Vol. 19, № 2. — P. 536-557.
4. Beylot M. Thyroid hormones and intermediary metabolism / М. Beylot, М. Laville // The thyroid and tissues. — Stuttgart and New York: Schattauer. — 1994. — Р. 47-59.
5. Brenta G. Potential therapeutic applications of thyroid hormone analogs / G. Brenta, S. Danzi, I. Klein // Nature Clinical Practice Endocrinology and Metabolism. — 2007. — Vol. 3. — P. 632-640.
6. Brenta G. Diabetes and thyroid disorders / G. Brenta // Bri–tish Journal of Diabetes & Vascular Disease. — 2010. — № 10(4). — Р. 172-177.
7. Coller F.A. Effect of hyperthyroidism upon diabetes mellitus: striking improvement in diabetes mellitus from thyroidectomy / F.A. Coller, C.B. Huggins // Annals of Surgery. — 1927. — Vol. 86. — P. 877-884.
8. Correction of insulin resistance in methimazole — treated patients with Graves’ disease / C. Tene, A. Zarete, L. Basurto [et al.] // Rew. Invest. Clin. — 2001. — Vol. 53, № 6. — P. 531-535.
9. Duntas L.H. The Interface between thyroid and diabetes mellitus / L.H. Duntas, J. Orgiazzi, G. Brabant // Clin. Endocrinol. (Oxf.). — 2011 Feb 24. — Doi 10.1111/j.1365–2265.2011.04029.
10. Insulin sensitivity and exogenous insulin clearance in Graves’ disease / J. Pierre, L. Tappy, B. Scazziga [et al.] // Diabetes. — 2014. — Vol. 35 (2). — P. 178-181.
11. Kadiyala R. Thyroid dysfunctionin patients with diabetes: clinical implications and screening strategies / R. Kadiyala, R. Peter, O. Okosieme // International Journal of Clinical Practice. — 2010. — Vol. 64. — P. 1130-1139.
12. Kapadia K., Bhatt P., Shah J. Association between altered thyroid state and insulin resistance // Journal of Pharmacology and Pharmacotherapeutics. — 2012. — Vol. 3. — P. 156-160.
13. Thyroid hormone modulates glucose production via a sympathetic pathway from the hypothalamic paraventricular nucleus to the liver / L.P. Klieverik, S.F. Janssen, A. Riel [et al.] // Proc. Natl. Acad. Sci. U.S.A. — 2009. — № 106. — Р. 5966-5971.
14. TSH-lowering effect of metformin in type 2 diabetic patients: differences between euthyroid, untreated hypothyroid, and euthyroid on L-T4 therapy patients / C. Cappelli, M. Rotondi, I. Pirola [et al.] // Diabetes Care. — 2009. — Vol. 32, № 9. — P. 1589-1590.
15. Sundaram V. Both hypothyroidism and hyperthyroidism enhance low density lipoprotein oxidation / V. Sundaram, A. Hanna, N. Koneru // Journal of Clinical Endocrinology and Metabolism. — 1997. — Vol. 82 (10). — P. 3421-3424.
1. Borovikov V. Statistica: the art of analysis on PC. For professionals. S-Pb: Piter, 2001. – 656 p. Russian
2. Unified clinical protocol of primary and secondary (specialized) medical aid. Type 2 diabetes mellitus / International journal of endocrinology. 2013;1:116-169. Ukrainian
3. Garber A.J., Abrahamson M.J., Barzilay J.I. [et al.]. American Association of Clinical Endocrinologists’ comprehensive diabetes management algorithm consensus statement. Endocr. Pract. 2013;19(2):536–557.
4. Beylot M. Laville М. Thyroid hormones and intermediary metabolism. The thyroid and tissues. Schattauer, Stuttgart and New York.1994;21(3):47–59.
5. Brenta G., Danzi S., Klein I. Potential therapeutic applications of thyroid hormone analogs. Nature Clinical Practice Endocrinology and Metabolism.2007;3:632–640.
6. Brenta G. Diabetes and thyroid disorders. British Journal of Diabetes & Vascular Disease. 2010;10(4):Р. 172–177.
7. Cappelli C., Rotondi M., Pirola I. et al. TSH-lowering effect of metformin in type 2 diabetic patients: differences between euthyroid, untreated hypothyroid, and euthyroid on L-T4 therapy patients. Diabetes Care. 2009;32(9):1589–1590.
8. Coller F.A., Huggins C.B. Effect of hyperthyroidism upon diabetes mellitus: striking improvement in diabetes mellitus from thyroidectomy. Annals of Surgery. 1927;86:877–884.
9. Duntas L.H., Orgiazzi J., Brabant G. The Interface between thyroid and diabetes mellitus. Clin. Endocrinol. (Oxf.). 2011 Feb 24. – Doi 10.1111/j.1365–2265.2011.04029.
10.Kadiyala R., Peter R., Okosieme O. Thyroid dysfunctionin patients with diabetes: clinical implications and screening strategies. International Journal of Clinical Practice. 2010;64:P.1130–1139.
11.Kapadia K., Bhatt P., Shah J. Association between altered thyroid state and insulin resistance. Journal of Pharmacology and Pharmacotherapeutics. 2012;3:156-160.
12.Klieverik L.P., Janssen S.F., Riel A. et al. Thyroid hormone modulates glucose production via a sympathetic pathway from the hypothalamic paraventricular nucleus to the liver. Proc. Natl. Acad. Sci. U. S. A. 2009;106:5966–5971.
13.Pierre J., Tappy L., Scazziga B. еt аl. Insulin sensitivity and exogenous insulin clearance in Graves’ disease. Diabetes. 2014;35(2):178–181.
14.Sundaram V. Hanna A. Koneru N. Both hypothyroidism and hyperthyroidism enhance low density lipoprotein oxidation. Journal of Clinical Endocrinology and Metabolism. 1997;82(10):3421–3424.
15.Tene C., Zarete A., Basurto L. et al. Correction of insulin resistance in methimazole – treated patients with Graves’ disease. Rew Invest Clin. 2001;53(6):531–535.

/23.jpg)