Международный эндокринологический журнал 1 (73) 2016
Вернуться к номеру
Субклинический гиперкортицизм: необходимость диагностического поиска
Авторы: Кваченюк А.Н. - ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев; Луценко Л.А. - Киевский городской клинический эндокринологический центр, г. Киев, Украина
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
С учетом определенных трудностей в диагностике субклинического гиперкортицизма целью данной работы было сфокусировать внимание врачей различных специальностей на необходимости тщательного обследования пациентов с патологическими состояниями, которые могут быть проявлениями синдрома Кушинга (артериальная гипертензия, ожирение, нарушения углеводного обмена, остеопороз). Инструментом для раннего выявления субклинического гиперкортицизма является лабораторная диагностика.
З урахуванням певних труднощів у діагностиці субклінічного гіперкортицизму метою даної роботи було сфокусувати увагу лікарів різних спеціальностей на необхідності ретельного обстеження пацієнтів із патологічними станами, що можуть бути проявами синдрому Кушинга (артеріальна гіпертензія, ожиріння, порушення вуглеводного обміну, остеопороз). Інструментом для раннього виявлення субклінічного гіперкортицизму є лабораторна діагностика.
Considering certain difficulties in subclinical hypercorticism diagnosis, the object of this work is to focus attention of doctors in different areas on the necessity of thorough examination of patients with pathological conditions that may be the manifestation of Cushing’s syndrome (arterial hypertension, obesity, impaired carbohydrate metabolism and osteoporosis). The laboratory diagnosis is the instrument for early subclinical hypercorticism detection.
гиперкортицизм, ожирение, сахарный диабет, артериальная гипертензия, кортизол слюны.
гіперкортицизм, ожиріння, цукровий діабет, артеріальна гіпертензія, кортизол слини.
hypercorticism, obesity, diabetes mellitus, arterial hypertension, saliva cortisol.
Статья опубликована на с. 49-52
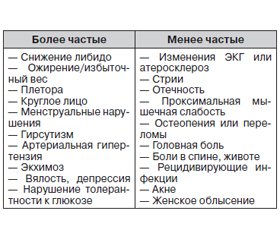
В последние годы внимание врачей все чаще привлекает проблема ранней диагностики субклинических форм эндокринных заболеваний, распространенность которых значительно выше клинически выраженных форм [1]. Одной из таких проблем является ранняя диагностика субклинического синдрома Кушинга (СК). С учетом отсутствия яркой клинической картины, характерной для гиперкортицизма, выявление данного состояния вызывает определенные трудности. Однако существуют клинические проявления, указывающие на необходимость более тщательного обследования пациента с целью диагностики субклинического СК. При этом группа пациентов для проведения скрининга данной патологии может формироваться на приеме не только у эндокринолога, но и у терапевта, кардиолога, семейного врача и врачей других специальностей.
/49.jpg)
1. Melmed S.Williams textbook of endocrinology. — 12 th ed. / S. Melmed et al. — Philadelphia, 2012. — 1920 р.
2. Findling J.W. Screening and diagnosis of Cushing’s syndrome / J.W. Findling, H. Raff // Endocrinol. Metab. Clin. North Am. — 2005. — Vol. 34, № 2. — P. 385-402.
3. Nieman L. Cushing’s syndrome: update on signs, symptoms and biochemical screening / L. Nieman // Eur. J. Endocrinol. — № 173. — M33-M38. doi: 10.1530/EJE-15-0464. First published online 8 July 2015.
4. Chanson P. Metabolic syndrome in Cushing’s syndrome / P. Chanson, S. Salenave // Neuroendocrinology. — 2010. — № 92(suppl. 1). — Р. 96-101.
5. Anderson G. The effect of age on prevalence of secondary forms of hypertension in 4,429 consecutively referred patients / G. Anderson, N. Blakeman, D.H. Streeten // J. Hypertens. — 1994. — Vol. 12, № 5. — P. 609-615.
6. Prospective study on the prevalence of secondary hypertension among hypertensive patients visiting a general outpatient clinic in Japan / M. Omur et al. // Hypertens. Res. — 2004. — Vol. 27, № 3. — P. 193-202.
7. Cardiovascular risk factors and common carotid artery caliber and stiffness in patients with Cushing’s disease during active disease and 1 year after disease remission / A. Faggiano et al. // J. Clin. Endocrinol. Metab. — 2003. — № 88. — Р. 2527-2533.
8. Effect of surgical treatment on hypertension in Cushing’s syndrome / F. Fallo et al. // Am. J. Hypertens. — 1996. — № 9. — Р. 77-80.
9. Metabolic and cardiovascular outcomes in patients with Cushing’s syndrome of different aetiologies during active disease and 1 year after remission / R. Giordano et al. // Clin. Endocrinol. (Oxf). — 2011. — № 75. — Р. 354-360.
10. Occult Cushing’s syndrome in type-2 diabetes / B. Catargi et al. // J. Clin. Endocrinol. Metab. — 2003. — № 88. — Р. 5808-5813.
11. Screening of Cushing’s syndrome in adult patients with newly diagnosed diabetes mellitus / G. Reimondo et al. // Clin.Endocrinol. (Oxf). — 2007. — № 67. — Р. 225-229.
12. Association of subclinical hypercortisolism with type 2 diabetes mellitus: a case-control study in hospitalized patients / I. Chiodini et al. // Eur. J. Endocrinol. — 2005. — Vol. 153, № 6. — P. 837-844.
13. Morning cortisol is lower in obese individuals with normal glucose tolerance / E.P. Praveen et al. // Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. — 2011. — № 4. — P. 347-352.
14. Obesity and Type 2 Diabetes Do Not Alter Splanchnic Cortisol Production in Humans / R. Basu et al. // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90, № 7. — P. 3919-3926.
15. Overnight dexamethasone suppression test: a reliable screen for Cushing’s syndrome in the obese / R. Ness-Abramof et al. // Obes. Res. — 2002. — Vol. 10. — P. 1217-1221.
16. Screening for Cushing’s syndrome in obese patients / О. Tiryakioglu et al. // Clinics (Sao Paulo). — 2010. — Vol. 65, № 1. — P. 9-13.
17. Отдаленные результаты хирургического лечения синдрома Кушинга, обусловленного кортикостеромой // Материалы 9-го (11-го) Рос. симпозиума по хирургической эндокринологии «Современные аспекты хирургической эндокринологии». — Челябинск, 2000. — С. 180-185.
18. Subclinical hypercortisolism among outpatients referred for osteoporosis / I. Chiodini et al. // Ann. Intern. Med. — 2007. — Vol. 147, № 8. — P. 541-548.
19. Zografos G.N. Subclinical Cushing’s syndrome: current concepts and trends / G.N. Zografos, I. Perysinakis, E. Vassilatou // Hormones (Athens). — 2014. — № 13(3). — Р. 323-337.
20. Reevaluation of the combined dexamethasone suppression-corticotropin-releasing hormone test for differentiation of mild Cushing’s disease from pseudoCushing’s syndrome / B. Gatta et al. // J. Clin. Endocrinol. Metab. — 2007. — № 92(11). — Р. 4290-4293.
21. The Diagnosis of Cushing’s syndrome: аn endocrine society clinical practice guideline / L.K. Nieman et al. // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93, № 5. — Р. 1526-1540.
22. Terzolo M. Subclinical Cushing’s syndrome: definition and management / M. Terzolo, A. Pia, G. Reimondo // Clinical Endocrinology. — 2012. — № 76. — Р. 12-18.
23. American association of clinical endocrinologists and American association of endocrine surgeons medical guidelines for the management of adrenal incidentaloma / M. A. Zeiger et al. // Endocrine practice. — 2009. — Vol. 15, July — August. — Р. 1-20.
24. Объемные образования надпочечников (диагностика и дифференциальная диагностика)׃ Методические рекомендации для врачей, оказывающих специализированную медицинскую помощь / Е.А. Трошина и др.; под ред. И.И. Дедова, Г.А. Мельниченко // Consilium Medicum. — 2009. — Т. 11, № 12. — С. 76-94.
1. Melmed S. Williams textbook of endocrinology. – 12th ed./S.Melmed [et al]. Philadelphia, 2012. 1920 р.
2. Findling JW, Raff H. Screening and diagnosis of Cushing’s syndrome. Endocrinol. Metab. Clin. North Am. 2005.;34:385-402.
3. Nieman L. Cushing’s syndrome: update on signs, symptoms and biochemical screening. Eur. J. Endocrinol. 2015; 173:33-38, doi: 10.1530/EJE-15-0464.
4. Chanson P, Salenave S. Metabolic syndrome in Cushing’s syndrome. Neuroendocrinology. 2010; 92(suppl 1): 96-101.
5. Anderson G, Blakeman N, Streeten DH.. The effect of age on prevalence of secondary forms of hypertension in 4,429 consecutively referred patients. J. Hypertens. 1994;12: 609-615.
6. Omura M. Prospective study on the prevalence of secondary hypertension among hypertensive patients visiting a general outpatient clinic in Japan. Hypertens. Res. 2004; 27: 193-202.
7. Faggiano A. Cardiovascular risk factors and common carotid artery caliber and stiffness in patients with Cushing’s disease during active disease and 1 year after disease remission. J. Clin. Endocrinol. Metab. 2003; 88: 2527-2533.
8. Fallo F. Effect of surgical treatment on hypertension in Cushing’s syndrome. Am. J.Hypertens. 1996; 9: 77-80.
9. Giordano R. Metabolic and cardiovascular outcomes in patients with Cushing’s syndrome of different etiologies during active disease and 1 year after remission. Clin. Endocrinol. (Oxf). 2011; 75: 354-360.
10. Catargi B. Occult Cushing’s syndrome in type-2 diabetes. J. Clin. Endocrinol. Metab. 2003; 88: 5808-5813.
11. Reimondo G. Screening of Cushing’s syndrome in adult patients with newly diagnosed diabetes mellitus. Clin Endocrinol (Oxf). 2007; 67: 225-229.
12. Chiodini I. Association of subclinical hypercortisolism with type 2 diabetes mellitus: a case-control study in hospitalized patients. Eur. J. Endocrinol. 2005; 153: 837-844.
13. Praveen EP. Morning cortisol is lower in obese individuals with normal glucose tolerance. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy. 2011; 4: 347-352.
14. Basu R. Obesity and Type 2 Diabetes Do Not Alter Splanchnic Cortisol Production in Humans. J. Clin. Endocrinol. Metab. 2005; 90: 3919-3926.
15. Ness-Abramof R. Overnight dexamethasone suppression test: a reliable screen for Cushing’s syndrome in the obese. Obes. Res. 2002; 10: 1217-1221.
16. Tiryakioglu O. Screening for Cushing’s syndrome in obese patients. Clinics (Sao Paulo). 2010; 65: 9-13.
17. Otdalennyie rezultatyi hirurgicheskogo lecheniya sindroma Kushinga, obuslovlennogo kortikosteromoy // Materialyi 9-go (11-go) Ros.simpoziuma po hirurgicheskoy endokrinologii [«Sovremennyie aspektyi hirurgicheskoy endokrinologii»] – Chelyabinsk, 2000. – S. 180 – 185.
18. Chiodini I. Subclinical hypercortisolism among outpatients referred for osteoporosis. Ann. Intern. Med. 2007; 147: 541-548.
19. Zografos GN, Perysinakis I, Vassilatou E. Subclinical Cushing's syndrome: current concepts and trends. Hormones (Athens). 2014;13 (3): 323-337.
20. Gatta B. Reevaluation of the combined dexamethasone suppression-corticotropin-releasing hormone test for differentiation of mild Cushing’s disease from pseudoCushing’s syndrome. J. Clin. Endocrinol. Metab. 2007; 92(11): 4290-4293.
21. Nieman LK. The Diagnosis of Cushing's syndrome: аn endocrine society clinical practice guideline. J. Clin. Endocrinol. Metab. 2008; 93: 1526-1540.
22. Terzolo M, Pia A, Reimondo G. Subclinical Cushing’s syndrome: definition and management. Clinical Endocrinology. 2012; 76:12-18.
23. Zeiger MA. American association of clinical endocrinologists and American association of endocrine surgeons medical guidelines for the management of adrenal incidentaloma. Endocrine practice. 2009;15: 1-20.
24. Ob'emnyie obrazovaniya nadpochechnikov (diagnostika i differentsialnaya diagnostika): metodicheskie rekomendatsii dlya vrachey, okazyivayuschih spetsializirovannuyu meditsinskuyu pomosch / E. A. Troshina [i dr.]. Pod red. I. I. Dedova, G. A. Melnichenko // Consilium Medicum. 2009; 11, # 12. – S. 76-94.