Резюме
Мета. Вивчити можливості збільшення ефективності патогенетичної терапії пацієнтів з хронічними цереброваскулярними захворюваннями (ЦВЗ) (дисциркуляторна енцефалопатія, ДЕ) на фоні метаболічного синдрому (МС) з використанням препарату Вітаксон®. Особливістю роботи було виявлення стратегічних ділянок мозку при когнітивних та емоційних розладах у пацієнтів з МС та за його відсутності. Матеріали та методи. Спостерігали 49 пацієнтів з ДЕ ІІ ст. віком від 37 до 73 років на фоні МС. Основна група — 30 пацієнтів — у складі лікування отримувала препарат Вітаксон®. Контрольна група становила 19 пацієнтів з ДЕ ІІ ст. на фоні МС, порівнянних за віком і стадією захворювання, які не приймали препарат Вітаксон®. Пацієнтів спостерігали протягом 12 тижнів. Крім неврологічних, загальноклінічних обстежень, визначення ознак МС, застосовували нейропсихологічне тестування за шкалою Mini Mental State Examination (MMSE) та шкалою оцінки когнітивних функцій Montreal Cognitive Assessment (МоСА), шкалою тривоги Спілбергера; шкалою депресії Бека; дослідження уваги: пошук чисел за таблицями Шульте з оцінкою часу виконання завдання. Головний мозок і його лікворну систему у 41 пацієнта (27 пацієнтів з МС — перша група та 14 пацієнтів без МС — друга група) оцінювали за допомогою методу волюметрії (вимірювання об’ємів окремих ділянок мозку) на МРТ-сканері Toshiba Vantage Titan 1,5. Результати. Когнітивні порушення в обох групах проявлялись у зниженні пам’яті, порушенні уваги, уповільненні психічних процесів. На 12-му тижні медіана за шкалою ММSE вірогідно збільшилась на 3,3 % (р < 0,05 порівняно з першим тестуванням) у групі пацієнтів, які приймали препарат Вітаксон®. За шкалою МоСА, що чутливіша при визначенні легких когнітивних порушень, у групі, де пацієнти приймали препарат Вітаксон®, когнітивні функції покращились на 5 %, а в групі контролю — на 1,66 %. За шкалою Спілбергера показники реактивної тривожності покращились більше в тій групі, де пацієнти приймали досліджуваний препарат; на початку лікування — 42,4 ± 3,4 бала та 24,6 ± 2,8 бала на 12-му тижні (р < 0,05). Було визначено, що показники когнітивної функції за шкалою МоСА обернено залежні від показників глікованого гемоглобіну. Результати волюметричних досліджень показали вірогідне (р < 0,05) зменшення об’єму речовини мозку, об’єму кори та білої речовини великих півкуль мозку, скроневої частки у пацієнтів з ЦВЗ на фоні МС порівняно з пацієнтами аналогічного віку без ознак МС. Крім того, у пацієнтів з МС визначалось вірогідне зменшення площі мозолистого тіла (р < 0,05) порівняно з пацієнтами без МС. Висновки. При лікуванні пацієнтів з ЦВЗ на фоні МС слід ураховувати тривожно-астенічні стани та когнітивні порушення, що часто виникають при цій патології. Додавання до загальноприйнятої терапії препарату Вітаксон® сприяє відновленню психоемоційних розладів. У пацієнтів з хронічними ЦВЗ на фоні МС ступінь атрофії кори та білої речовини великих півкуль мозку, лобної та скроневої часток, а також мозолистого тіла визначався вірогідно більшим (р < 0,05) порівняно з хворими без МС.
Цель. Изучить возможности увеличения эффективности патогенетической терапии пациентов с хроническими цереброваскулярными заболеваниями (ЦВЗ) (дисциркуляторная энцефалопатия, ДЭ) на фоне метаболического синдрома (МС) с использованием препарата Витаксон®. Особенностью работы было определение стратегических участков мозга при когнитивных и эмоциональных расстройствах у пациентов с МС и при отсутствии МС. Материалы и методы. Наблюдали 49 пациентов в возрасте от 37 до 73 лет с ДЭ ІІ ст. на фоне МС. Основная группа (30 пациентов) в составе лечения получала препарат Витаксон®. Контрольная группа (19 пациентов с ДЭ ІІ ст. на фоне МС), сопоставимая по возрасту и стадии заболевания, не принимала препарат Витаксон®. Пациентов наблюдали 12 недель. Кроме неврологических, общеклинических обследований, определения признаков МС, использовали нейропсихологическое тестирование по шкале Mini Mental State Examination (MMSE) и шкале оценки когнитивных функций Montreal Cognitive Assessment (МоСА); шкале тревоги Спилбергера; шкале депрессии Бека; исследование внимания: поиск чисел по таблицам Шульте с оценкой времени выполнения задания. Головной мозг и его ликворную систему у 41 пациента (27 пациентов с МС — первая группа и 14 пациентов без МС — вторая группа) оценивали с помощью метода волюметрии (измерение объемов отдельных участков мозга) на МРТ-сканере Toshiba Vantage Titan 1,5. Результаты. Когнитивные нарушения в обеих группах проявлялись в снижении памяти, нарушении внимания, замедлении психических процессов. На 12-й неделе медиана по шкале ММSE достоверно увеличилась на 3,3 %
(р < 0,05 по сравнению с первым тестированием) в группе пациентов, принимавших препарат Витаксон®. По шкале МоСа, которая более чувствительна при определении легких когнитивных нарушений, в группе, где пациенты принимали препарат Витаксон®, когнитивные функции улучшились на 5 %, а в группе контроля — на 1,66 %. По шкале Спилбергера показатели реактивной тревожности улучшились больше в той группе, которая принимала исследуемый препарат; в начале лечения — 42,4 ± 3,4 балла и 24,6 ± 2,8 балла на 12-й неделе (р < 0,05). Выявлено, что показатели когнитивной функции по шкале МоСА обратно зависимы от показателей гликированного гемоглобина. Результаты волюметрических исследований показали достоверное (р < 0,05) уменьшение объема вещества мозга, объема коры и белого вещества больших полушарий мозга, височной доли у пациентов с ЦВЗ на фоне МС в сравнении с пациентами аналогичного возраста без признаков МС. Кроме того, у пациентов с МС определялось достоверное уменьшение площади мозолистого тела (р < 0,05) в сравнении с пациентами без МС. Выводы. При лечении пациентов с ЦВЗ на фоне МС следует учитывать тревожно-астенические состояния и когнитивные нарушения, часто встречающиеся при данной патологии. Добавление к общепринятой терапии препарата Витаксон® способствует восстановлению психоэмоциональных расстройств. У пациентов с хроническими ЦВЗ на фоне МС степень атрофии коры и белого вещества больших полушарий, лобной и височной долей, а также мозолистого тела определялась достоверно большей (р < 0,05) в сравнении с больными без МС.
Objective. To study the opportunities to increase the efficiency of pathogenetic therapy in patients with chronic cerebrovascular diseases (CVD) (discirculatory encephalopathy, DE) on the background of metabolic syndrome (MS) using the drug Vitaxon®. The feature of the work was to identify strategic areas of the brain in cognitive and emotional disorders in patients with MS and its absence. Materials and methods. We observed 49 patients with DE II degree aged 37 to 73 years against the background of MS. The main group — 30 patients — received Vitaxon® as a part of treatment. The control group consisted of 19 patients with DE degree II following MS, comparable in the age and stage of the disease, who were not taking Vitaxon®. Patients were observed for 12 weeks. In addition to neurological, general clinical examinations, detection of MS signs, we have used neuropsychological tests by Mini Mental State Examination (MMSE) and Montreal Cognitive Assessment (МоСА), Spielberger anxiety scale; Beck depression scale; study of attention: search of numbers by Schulte tables with the assessment of task-performance time. The brain and its liquor system in 41 patients (27 patients with MS — the first group and 14 patients without MS — the second group) were evaluated using the method of volumetry (measuring the volume of certain brain regions), on the magnetic resonance imaging scanner Toshiba Vantage Titan 1.5. Results. Cognitive impairment in both groups manifested by the loss of memory, attention disorders, slowing of mental processes. After 12 weeks, the median by the MMSE significantly increased by 3.3 % (p < 0.05 compared with the first test) in patients who received Vitaxon®. By МоСА, which is more sensitive when determining the mild cognitive impairment, in a group of Vitaxon® cognitive functions improved by 5 %, while in the control group — by 1.66 %. By Spielberger scale, state anxiety indicators improved more in the group of patients who received study drug: at baseline — 42.4 ± 3.4 points and 24.6 ± 2.8 points at week 12 (p < 0.05). It was determined that cognitive performance by МоСА scale was inversely dependent on the parameters of glycated hemoglobin. Results of volumetric studies showed significant (p < 0.05) reduction in the volume of the brain substance, cortex and the volume of white matter of the cerebral hemispheres, temporal lobe in patients with CVD on the background of MS compared with those of similar age with no signs of MS. In addition, patients with MS had the likely decrease in the area of the corpus callosum (p < 0.05) compared to patients without MS. Conclusions. During the treatment of patients with CVD following MS, it is necessary to consider anxiety-asthenic conditions and cognitive disorders that often occur at this pathology. Addition of Vitaxon® to the generally accepted drug therapy helps to eliminate psycho-emotional disorders. In patients with chronic CVD on the background of MS, the degree of the atrophy of the cortex and white matter of the cerebral hemispheres, the frontal and temporal lobes, as well as the corpus callosum, was significantly higher (p < 0.05) compared to patients without MS.
Статтю опубліковано на с. 61-69
Вступ
Вплив метаболічного синдрому (МС) на функціональний і структурний стан головного мозку останнім часом широко висвітлюється у вітчизняній та закордонній літературі. Особливий інтерес викликає вплив МС на перебіг хронічних цереброваскулярних захворювань (ЦВЗ). Під хронічним ЦВЗ розуміють дисциркуляторну енцефалопатію (ДЕ) — синдром хронічного прогресуючого багатовогнищевого або дифузного ураження мозку різної етіології, що проявляється неврологічними, нейропсихологічними та психічними порушеннями, що розвиваються внаслідок повторних гострих порушень мозкового кровообігу (ГПМК) і/або хронічної недостатності кровопостачання головного мозку [1–3]. Під повторними ГПМК розуміють «німі» інфаркти мозку (рідше — «німі» мікрокрововиливи), перебіг яких не має вираженої клініки інсульту, але з частковою симптоматикою, що може призводити до певних клініко-неврологічних розладів [1]. Вважається, що механізми розвитку інсульту та хронічної церебральної ішемії подібні («ішемічний каскад») та різняться тільки вираженістю та гостротою процесу. Як наслідок, при хронічних порушеннях церебральної перфузії та системного кровотоку, мікроциркуляції, а також гіпоксемії у пацієнтів з хронічною церебральною ішемією формуються мікролакунарні зони ішемії. Наслідком цих патологічних процесів при хронічній церебральній ішемії є клінічні зміни у вигляді суб’єктивної та об’єктивної симптоматики, що виникають внаслідок порушень корково-стріарних та корково-стовбурових зв’язків. Але слід зважати на те, що інтенсивність нейрохімічних процесів може мати принципове значення. Прикладом є глутамат- та NMDA-рецептори. З їх збудженням пов’язують важливі етапи розвитку ішемічного ураження мозку (глутаматно-кальцієвий стрес). Однак при хронічній патології, що повільно розвивається, глутамат у необхідних дозах стимулює утворення нейротрофічних факторів. Тому зайве пригнічення активності глутаматних рецепторів може мати двоякий ефект: зменшення токсичної дії глутамату і в той же час пригнічення синтезу мозкових нейротрофічних факторів [4]. Про це слід пам’ятати при виборі медикаментозної терапії для лікування ЦВЗ.
Закономірно, що у пацієнтів з повним МС (поєднання цукрового діабету (ЦД) 2-го типу, артеріальної гіпертензії (АГ), абдомінального ожиріння, дисліпідемії) вірогідно частіше діагностуються хронічні ЦВЗ — початкові порушення недостатності кровопостачання мозку та ДЕ порівняно з пацієнтами, у яких визначається неповна форма МС. Суттєвий вклад у розвиток ЦВЗ вносить ожиріння [5]. Основні неврологічні прояви, що виникають у пацієнтів з ЦВЗ на фоні МС, представлені астеноневротичним, цефалгічним і кохлеовестибулярним синдромами, а найчастішими скаргами, незалежно від стадії захворювання, є головний біль, запаморочення, хиткість при ходьбі [5]. При цьому прогресування хронічних форм ЦВЗ у групах початкових порушень кровопостачання мозку та ДЕ більш виражене та «злоякісне», ніж у пацієнтів без МС [6].
Щодо виникнення когнітивних порушень у пацієнтів з МС у літературі існують суперечливі дані. Ряд авторів поєднують МС зі зниженням когнітивних функцій і розвитком деменції судинного та нейродегенеративного генезу. В дослідженнях виявлено взаємозв’язок деменції з АГ, ЦД та МС [7]. Існують дані, що поєднання МС з АГ II ст. призводить до зниження когнітивних функцій у 52 % випадків, а поєднання МС з АГ III ст. викликає порушення когнітивних функцій у 100 % спостережень [7]. Було визначено, що у пацієнтів з предіабетом і гіперінсулінемією, АГ, дисліпідемією й ожирінням когнітивні показники гірші та знижуються швидше [8, 9]. Можливість розвитку хвороби Альцгеймера у хворих без ЦД, але за наявності МС описана в літературі. Ризик розвитку деменції вищий у пацієнтів з поєднанням ЦД 2-го типу і АГ, ніж з ізольованими ЦД або АГ [10, 11], а поєднання ЦД з високим артеріальним тиском збільшує ризик розвитку судинної деменції в 6 разів [10, 12, 13]. Співіснування цереброваскулярної патології з ЦД 2-го типу посилює кореляцію з помірним когнітивним зниженням і деменцією [10, 14]. За даними дослідження B.H. Brummett et al., в якому спостерігали впродовж восьми років за особами, що здійснювали догляд за родичами з хворобою Альцгеймера, хронічний дистрес у наглядачів, які мали МС, сприяв погіршенню когнітивних функцій. Крім того, хронічний стрес, що був пов’язаний з доглядом за близькою людиною, сприяв ризику виникнення серцево-судинних подій [15].
ДЕ не виявляє специфічних патологічних змін за даними МРТ і КТ. Значення дрібновогнищевих змін повністю не з’ясоване. Згідно з літературними даними, вони можуть відповідати природному старінню мозку і траплятися практично в усіх людей віком понад 65 років [16]. Численні дослідження щодо впливу МС на головний мозок показали, що у головному мозку утворюються перивентрикулярні, субкортикальні гіперінтенсивні вогнища [17] та «німі» лакунарні інфаркти, лейкоареоз [17]. Існують докази того, що наявність субкортикальних вогнищ у білій речовині головного мозку пацієнтів призводить до розвитку когнітивного дефіциту [17]. У хворих на МС серед когнітивних розладів найчастіше спостерігали зниження швидкості обробки інформації [18], навіть у відносно молодих осіб [17, 19].
За даними літератури, у хворих виявлено зв’язок між МС, уповільненням швидкості обробки інформації та ураженням білої речовини головного мозку [17, 19]. Особливо вираженими були кореляції з ураженням мозолистого тіла та лобної частки. B. Segura та співавтори вважають, що у пацієнтів з МС зв’язок між зниженням швидкості обробки інформації та ураженням білої речовини головного мозку може бути значною мірою обумовлений впливом самого МС, а не лише віковими змінами в головному мозку пацієнтів [19]. Вважають, що одним із факторів, що відіграє значну роль у взаємозв’язку між МС та когнітивними порушеннями, є гіперглікемія, яка призводить до ушкодження інсулінових рецепторів гематоенцефалічного бар’єра, порушується транспорт інсуліну до мозку і зменшуються ацетилхолінова нейротрансмісія та мозковий кровоток [20]. Крім того, сама по собі гіперглікемія призводить до апоптозу нейронів через активацію перекисного окиснення ліпідів, підвищення рівня вільних радикалів, кінцевих продуктів глікування [17]. Іншим можливим механізмом, що призводить до виникнення когнітивних порушень, є поява та збільшення кількості судинних вогнищ, які є наслідком впливу на мозок таких компонентів МС, як АГ, порушення толерантності до вуглеводів і дисліпідемія. Саме тому, за даними попередніх досліджень з використанням МРТ, у пацієнтів із МС значно частіше виявляли «німі» інфаркти головного мозку та лейкоареоз.
Отже, судинні фактори ризику, що входять до складу МС, сприяють розвитку цереброваскулярних порушень та нейродегенеративних процесів, що викликають ранні ураження головного мозку, призводячи до прогресування когнітивних порушень, та прискорюють процес старіння.
Дебют МС зазвичай реєструють у людей 35–40 років, тобто в найбільш активному в соціальному плані віці. В цих умовах посилюються коморбідні особистісні розлади, зниження фізичної активності поєднується з прогресуючими змінами психологічного статусу пацієнтів, блокуються актуальні потреби і плани, домінує тривожна оцінка перспективи, збільшується загроза розвитку психосоматичних порушень [2]. Проспективні спостереження показали, що протягом десяти років після дебюту ЦД у 48 % молодих людей розвиваються психічні розлади, що асоціюються з несприятливим прогнозом захворювання. Насамперед це стосується депресивних розладів, що є факторами ризику погіршення гіпоглікемічного контролю, розвитку ускладнень. Показники поширеності коморбідних депресій варіюють від 14,4 до 41,3 %, причому тяжкість депресивних розладів корелює з багатьма симптомами МС [21]. Наразі визнають наявність біологічного субстрату, загального для депресії і ЦД 2-го типу. Як відомо, при депресії виявляються ознаки гіперактивності гіпоталамо-гіпофізарно-надниркової системи з посиленням вироблення кортизолу, збільшенням гіпофіза і надниркових залоз, а також кількості нейронів, які секретують кортикотропін-рилізинг-фактор. Концентрація кортизолу в плазмі таких хворих прямо корелює з тяжкістю депресії. Хронічна гіперкортизолемія призводить до формування інсулінорезистентності, АГ, гіперглікемії, гіперхолестеринемії, які підвищують ризик серцево-судинних ускладнень.
Потенційна користь вітамінів групи В для мозку зрозуміла, адже відомо, що їх дефіцит пов’язаний з неврологічними проявами (синдром Верніке — Корсакова, включаючи амнезію, атаксію, сплутаність свідомості, психоз та ін.). У популяції розвинутих країн виділяють дві групи підвищеного ризику недостатності вітамінів: особи зі стресовим способом життя, зумовленим професійною діяльністю і поганим харчуванням; люди похилого віку. Крім того, останні публікації свідчать, що у пацієнтів з ЦД 2-го типу зменшується вміст вітамінів групи В [22, 24]. Причина цього явища поки що не зрозуміла. Але найбільше знижується рівень вітаміну В12 в крові у пацієнтів з МС та ЦД, що тривало приймають метформін [22, 23]. Численні клінічні дослідження з вивчення ефективності застосування вітамінів групи В з метою запобігання прогресуванню когнітивних порушень показали суперечливі результати. У зв’язку з цим була зроблена спроба вивчити вплив тривалого (12 тижнів) застосування вітчизняного препарату Вітаксон® виробництва фармацевтичної компанії «Фармак» у пацієнтів з хронічними ЦВЗ на фоні МС.
Мета дослідження — вивчити клінічну ефективність, безпечність, вплив на когнітивні показники, тривогу вітчизняного препарату Вітаксон® у пацієнтів з хронічними ЦВЗ на фоні МС. Особливістю роботи було визначення ділянок головного мозку, що страждають при когнітивних та емоційних розладах у пацієнтів з ЦВЗ, і порівняння результатів у пацієнтів з МС та без нього.
Матеріали та методи
Спостерігали 49 пацієнтів віком від 37 до 73 років з ДЕ ІІ ст. на фоні МС. В основній групі (30 пацієнтів) у складі лікування застосовували препарат Вітаксон®. Контрольна група складалася з 19 пацієнтів, порівнянних за віком і стадією захворювання, з ДЕ ІІ ст. на фоні МС, які не отримували препарат Вітаксон®.
Пацієнтів спостерігали впродовж 12 тижнів. Вони були оглянуті до лікування, через 4 і 12 тижнів. При наборі пацієнтів використовували метод рандомізації. Пацієнти обох груп отримували базову терапію, що була максимально уніфікована і включала прийом діуретиків, гіпотензивних, цукрознижуючих, кардіальних, антиагрегантних препаратів, метформіну за показаннями. Впродовж лікування не призначались вазоактивні, ноотропні, психотропні препарати. Препарат Вітаксон® призначався за такою схемою: щоденно по 2,0 мл (1 ампула) внутрішньом’язово впродовж 10 днів, потім переходили на таблетки — по одній таблетці тричі на добу до 12 тижнів.
До групи контролю увійшли 19 пацієнтів, які отримували аналогічну базову терапію, препарат Вітаксон® не застосовувався. Основна та контрольна групи були порівнянні за статтю, віком, стадією ЦВЗ.
Всім пацієнтам проводили клініко-неврологічне обстеження (вивчення скарг, анамнезу, неврологічного статусу), дослідження серцево-судинної системи, вимірювання артеріального тиску, ЕКГ, дуплексне сканування екстракраніальних судин, визначення показників загального аналізу крові, сечі, глюкози, гемокоагуляційних показників, загального холестерину, тригліцеридів, ліпопротеїнів низької та високої щільності, індексу НОМА і глікованого гемоглобіну (HbA1с). Лабораторні, інструментальні дослідження проводились до та після лікування (в перший день і на 12-му тижні).
Пацієнтам також визначали антропометричні показники: масу тіла (в кг), зріст (у см), окружність талії і стегон (у см), вираховували індекс маси тіла. Визначали наявність у пацієнтів МС за критеріями АТР III.
Нейропсихологічне тестування включало: скринінг — оцінку психічного стану за шкалою Mini Mental State Examination (MMSE) та за шкалою оцінки когнітивних функцій Montreal Cognitive Assessment (МоСА), шкалою тривоги Спілбергера, шкалою депресії Бека; дослідження уваги: пошук чисел за таблицями Шульте з оцінкою часу виконання завдання.
За допомогою методу волюметрії (вимірювання об’ємів окремих ділянок мозку) оцінювали головний мозок та його лікворну систему у 41 пацієнта (27 пацієнтів з МС — перша група та 14 пацієнтів без МС — друга група) на МРТ-сканері Toshiba Vantage Titan 1,5. Робоча станція для подальшої обробки зображень: Vitrea. Були використані МР-послідовності: T1-зважене зображення, Т2-зважене зображення, Isotropic, Flair, DWI, T2*, FSBB. При аналізі отриманих даних оцінювали такі параметри: об’єм речовини мозку; об’єм білої речовини мозку; об’єм сірої речовини мозку; кількість інфарктів; об’єм інфарктів; об’єм кори скроневої частки; об’єм кори лобної частки; об’єм білої речовини лобної частки; об’єм білої речовини скроневої частки; об’єм бокових шлуночків; об’єм гіпокампів правого та лівого; об’єм лейкоареозу; площу мозолистого тіла. Вимірювання проводили у см3.
Ефективність терапії визначали за 5-бальною системою, переносимість препаратів — за 4-бальною системою.
Статистичну обробку результатів дослідження проводили за допомогою сучасних методів математичного аналізу з використанням статистичних програм Statistica 6. Вираховували середні показники та похибки середніх, медіану і процентилі. Як критерій вірогідності відхилення показників використовували параметричний критерій Стьюдента та непараметричний критерій U (Вілкоксона — Манна — Уїтні).
Результати
Когнітивні порушення (легкі та помірні) були виявлені у 26 хворих основної групи і 18 хворих контрольної групи. При оцінці психічного статусу показники становили від 24 до 29 балів. В основній групі до лікування результат за шкалою MMSE (медіана, процентилі) був такий: Me = 26 балів; Q1 = 25; Q3 = 28; у групі контролю: Me = 27 балів; Q1 = 25; Q3 = 28. Когнітивні порушення в обох групах особливо проявлялись у зниженні пам’яті, порушенні уваги, уповільненні психічних процесів. Знаходили певні порушення також в обмеженні здатності до планування і контролю. На 4-му тижні не визначалось суттєвих змін у когнітивних функціях обох груп. Лише на 12-му тижні терапії показники результатів за шкалою ММSE почали змінюватись. В основній групі вони становили: Me = 27,5 бала; Q1 = 26,0; Q3 = 28,5; у контрольній групі: Me = 27 балів; Q1 = 26; Q3 = 28. Отже, в основній групі Ме показників збільшилась на 1 бал, що становить 3,3 %. Результат був вірогідним порівняно з першим тестуванням. Медіана в контрольній групі не змінилась, але Q1 збільшився на 1 бал. Це свідчить про те, що найнижчі показники дещо підвищились.
Чутливість шкали МоСА для виявлення легких когнітивних порушень дозволяє застосовувати її при слабких розладах [24]. Тому особливо ретельно проводили аналіз результатів саме за цією шкалою. Результати наведені в табл. 1. Порушення спостерігались у таких когнітивних сферах: увага і концентрація, пам’ять, оптико-просторові навички, абстрактне мислення та лічба. Максимально вираженими були порушення уваги і концентрації, пам’яті, дещо менші — зорово-конструктивні навички.
Після проведення 12-тижневого курсу лікування в групі, яка приймала препарат Вітаксон®, визначалось покращення показників когнітивних функцій за даними шкали МоСА. В розділі, що визначає порушення уваги, середній бал в основній групі збільшився з 3,1 ± 0,5 бала до 4,8 ± 0,5 бала; повторення слів після певного часу збільшилось з 2,2 ± 0,5 бала до 3,9 ± 0,5 бала. Спостерігалось деяке покращення показників тесту малювання годинника з 1,9 ± 0,5 бала до 2,1 ± 0,5 бала.
З огляду на дані табл. 1 та рис. 1, покращення показників когнітивних функцій за період лікування відбулось в обох групах. Але в групі, де пацієнти приймали препарат Вітаксон®, когнітивні функції покращились на 1,5 бала (5 %), а в групі контролю — на 0,5 бала (1,66 %). Отже, в результаті додавання до загальноприйнятої терапії препарату Вітаксон® визначалась позитивна динаміка переважної більшості когнітивних функцій, особливо пам’яті та концентрації уваги.
У пацієнтів з ДЕ на фоні МС часто розвиваються патологічна тривога, астенічний і вегетативний симптомокомплекси. З одного боку, гіпоксичні та ішемічні процеси в головному мозку сприяють розвитку психоемоційних порушень, а з іншого — тривалий стрес, викликаний усвідомленням хворого свого захворювання, стану, в якому він опинився, сприяє прогресуванню проявів ішемії мозку. Визначали вплив лікування препаратом Вітаксон® на прояви тривоги та депресії за допомогою шкали Спілбергера, що вказує на реактивну та особистісну тривожність.
Як подано в табл. 2, показники реактивної тривожності, що залежить від ситуації, в якій перебуває пацієнт, покращились більше в тій групі, яка приймала досліджуваний препарат; на початку лікування — 42,4 ± 3,4 бала та 24,6 ± 2,8 бала на 12-му тижні. В контрольній групі суттєвої різниці відповідних показників не було (41,2 ± 3,2 бала та 39,1 ± 2,1 бала). Зміни особистісної тривоги, що характеризує властивості особистості та мало залежить від ситуації після лікування, також покращились в групі, яка приймала препарат Вітаксон®, та відзначались статистичною значимістю (р < 0,05).
Зменшення тривожності, покращення когнітивних функцій у пацієнтів з ЦВЗ на фоні МС відбувалось, ймовірно, тому, що переважна більшість пацієнтів змінили ставлення до лікування основного захворювання та МС. Систематична корекція артеріального тиску, глікемії та ліпідного спектра крові, регулярні фізичні навантаження, вітамінотерапія сприяли покращенню не тільки лабораторних показників, але й психоемоційних розладів.
Вже на вихідному рівні тестування звернули увагу на зв’язок між показниками HbA1c та зниженням показників когнітивних функцій за шкалою МоСА, змінами психічного виснаження за шкалами Шульте та стійкістю уваги за результатами коректурної проби у пацієнтів обох груп, а також ознаками тривоги.
З огляду на дані рис. 2, показники когнітивної функції за шкалою МоСА обернено залежні від показників HbA1c.
Результати волюметричних досліджень
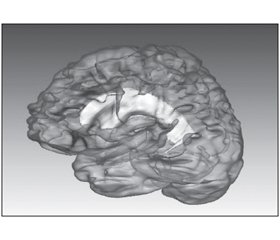
Визначали об’єми окремих церебральних структур за допомогою МРТ (рис. 3, 4). Для цього провели порівняння об’ємів окремих церебральних структур у 27 пацієнтів з МС (перша група) і 14 пацієнтів без МС (друга група).
Згідно з наведеними даними (табл. 3), показники загальної кількості речовини мозку вірогідно відрізнялись. Визначалось вірогідне (р < 0,05) зменшення об’єму речовини мозку у пацієнтів з ЦВЗ на фоні МС.
Маючи на увазі те, що об’єм головного мозку може змінюватись з віком, ми враховували дані пацієнтів аналогічного віку: перша група (пацієнти з МС), вік хворих — Me = 62 [Q1 = 54; Q3 = 70]); друга група (пацієнти без МС) — Ме = 64 [Q1 = 56; Q3 = 70]). Тим самим була виключена похибка за віковим параметром.
Об’єм білої і сірої (кори) речовини півкуль головного мозку наведено в табл. 4.
Як видно з наведених даних (табл. 4), визначається вірогідна різниця об’єму кори та білої речовини великих півкуль мозку (р < 0,05) у пацієнтів першої і другої груп.
Відповідно до даних табл. 5, кількість сірої (кори) та білої речовини скроневої частки мала вірогідну різницю між хворими з МС та без МС (р < 0,05).
На рис. 5 чітко виділені шлуночки мозку та гіпокампи у пацієнта без МС. На рис. 6 показано збільшений шлуночок, що свідчить про внутрішню гідроцефалію; майже не виділяються значно зменшені в об’ємі гіпокампи у пацієнтки з МС. Об’єми бокових шлуночків мозку наведено в табл. 6.
Наведені дані (табл. 6) свідчать, що у пацієнтів з МС об’єм шлуночкової системи вірогідно збільшений порівняно з пацієнтами без МС.
При визначенні об’ємів і вимірюванні показників окремих структур мозку звернули увагу на зменшення розмірів площі мозолистого тіла у деяких пацієнтів.
Обговорення
Аналізуючи дані табл. 7, можна стверджувати, що у пацієнтів з ЦВЗ на фоні МС визначається вірогідне зменшення площі мозолистого тіла (р < 0,05) порівняно з пацієнтами без МС.
Ймовірно, зменшення площі мозолистого тіла відображає ушкодження асоціативних волокон, що відіграють важливу роль у забезпеченні інтегративної діяльності мозку, наслідком чого є знайдена в подальшому кореляція між змінами його площі та вираженістю когнітивних порушень при ЦВЗ. Відбувається порушення міжпівкульної взаємодії і, відповідно, порушення скоординованої роботи двох півкуль великого мозку.
Дослідження показало безпечність терапії препаратом Вітаксон® у комплексі зі стандартною терапією для лікування хронічних ЦВЗ. Препарат не викликав суттєвої побічної дії. Всі пацієнти отримали лікування в повному обсязі та оцінили ефективність терапії як «добре» (26 пацієнтів) і «задовільно» (4 пацієнти).
Висновки
1. При лікуванні пацієнтів з ЦВЗ на фоні МС слід ураховувати тривожно-астенічні стани та когнітивні порушення, що часто трапляються при даній патології. Додавання до загальноприйнятої терапії препарату Вітаксон® сприяє відновленню психоемоційних розладів.
2. У пацієнтів з хронічними ЦВЗ на фоні МС ступінь атрофії кори та білої речовини великих півкуль мозку, лобної та скроневої часток визначався вірогідно більшим порівняно з хворими без МС.
Відсутність значимих побічних явищ препарату Вітаксон® дозволяє рекомендувати його для лікування хронічних ЦВЗ у пацієнтів з МС.
Перспективи подальших досліджень
Отримані результати дослідження потребують подальшого вивчення. Визначення та аналіз волюметричних показників окремих структур головного мозку сприятиме покращенню діагностики когнітивних порушень у пацієнтів з МС та своєчасному превентивному лікуванню.
Зважаючи на потенційний ефект вітамінів групи В, доцільно і надалі проводити дослідження їх впливу на когнітивні функції.
Список литературы
1. Захаров В.В. Лечение когнитивных нарушений при дисциркуляторной энцефалопатии / Захаров В.В., Степкина Д.А. // Российский медицинский журнал. — 2015. — № 1. — С. 953-956.
2. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция / Под ред. Н.Н. Яхно. — М., 2002. — С. 85.
3. Дамулин И.В. Нарушения кровообращения в головном и спинном мозге / Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. // Болезни нервной системы: рук-во для врачей / Под ред. Н.Н. Яхно, Д.Р. Штульмана. — М., 2005. — С. 231-302.
4. Варакин Ю.Я. Особенности выявления пациентов с начальными проявлениями хронической цереброваскулярной патологии при обследовании населения / Варакин Ю.Я., Горностаева Г.В., Кравченко М.А. // Материалы 14-й Международной конференции «Возрастные аспекты неврологии». — 2012. — С. 2-5.
5. Кудухова А.В. Ишемические цереброваскулярные заболевания на фоне метаболического синдрома: состояние сердечно-сосудистой системы / А.В. Кудухова. — М., 2012. — 160 с.
6. Теленкова Н.Г. Гематовазальные взаимодействия при хронических цереброваскулярных заболеваниях на фоне метаболического синдрома: Дис... канд. мед. наук. — М., 2010. — 24 с.
7. Luchinger J.A., Tang M.X. et al. Hyperinsulinemia and risk of Alzheimier diseas. // Neurology. — 2004. — Vol. 63. — P. 1187-1192.
8. Hassing L.B., Grant M.D., Hofer S.M. et al. Type 2 diabetes mellitus contributes to cognitive decline in old age: a longitudinal population-based study // J. Int. Neuropsychol. Soc. — 2004. — Vol. 10. — Р. 599-607.
9. Komulainen P., Lakka T.A., Kivipelto M. et al. Metabolic syndrome and cognitive function: a population-based follow-up study in elderly women // Dement. Geriatr. Cogn. Disord. — 2007. — Vol. 23. — Р. 29-34.
10. Есин Р.Г. Современные представления о механизмах когнитивных расстройств при сахарном диабете / Р.Г. Есин, И.Х. Хайруллин, О.Р. Есин // Медицинский альманах. — 2013. — № 1(25). — С. 135-138.
11. Convit A., Wolf O.T., Tarshish C., de Leon M.J. Reduced glucose tolerance is associated with poor memory performance and hippocampal atrophy among normal elderly // Proc. Natl. Acad. Sci. — 2003. — Vol. 100. — Р. 2019-2022.
12. Hassing L.B., Hofer S.M., Nilsson S.E. et al. Comorbid type 2 diabetes mellitus and hypertension exacerbates cognitive decline: evidence from a longitudinal study // Age and Ageing. — 2004. — Vol. 33. — Р. 355-361.
13. Posner H.B., Tang M.-X., Luchsinger J. The relationship of hypertension in the elderly to AD, vascular dementia, and cognitive function // Neurology. — 2002. — Vol. 58. — Р. 1175-1181.
14. Peila R., Rodriguez B.L., Launer L.J. Honolulu-Asia Aging Study Type 2 diabetes, APOE gene, and the risk for dementia and related pathologies // Diabetes. — 2002. — Vol. 51. — Р. 1256-1262.
15. Brummett B.H. Long-Term Impact of Caregiving and Metabolic Syndrome with Perceived Decline in Cognitive Function 8 Years Later: A Pilot Study Suggesting Important Avenues for Future Research / B.H. Brummett, S.B. Austin, K.A. Welsh-Bohmer et al. // Open Journal of Medical Psychology. — 2013. — Vol. 2. — P. 23-28.
16. Холин А.В. Магнитно-резонансная томография при заболеваниях центральной нервной системы / Холин А.В. — СПб.: Гиппократ, 2000. — С. 69.
17. Копчак О.О. Когнітивні та нейровізуалізаційні характеристики (за даними МРТ) у хворих із дисциркуляторною енцефалопатією та метаболічним синдромом / Копчак О.О. // Международный неврологический журнал. — 2012. — № 8(54). — C. 14-18.
18. Шишкова В. Когнитивный дефицит у пациентов с метаболическим синдромом / Шишкова В., Осыченко М. // Врач. — 2012. — № 3. — С. 30.
19. Roosendaal S.D., Geurts J.J., Vrenken H. еt al. Regional DTI differences in multiple sclerosis patients // Neuroimage. — 2009. — Vol. 44(4). — Р. 1397-1403.
20. Craft S., Watson G.S. Insulin and neurodegenerative disease: shared and specific mechanisms // Lancet Neurology. — 2004. — Vol. 3. — P. 169-178.
21. Zimmer P., Shaw G., Alberti G. Preventing type 2 diabetes and the dysmetabolic syndrome in the real word: a realistic view // Diabetic. Medicine. — 2003. — Vol. 20(9). — P. 693-702.
22. Valdés-Ramos R. Vitamins and type 2 diabetes mellitus / Valdés-Ramos R., Guadarrama-López A.L., Martínez-Carrillo B.E., Benítez-Arciniega A.D. // Endocr. Metab. Immune Disord. Drug. Targets. — 2015. — Vol. 15(1). — P. 54-63.
23. Valdés-Ramos R. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial / de Jager J., Kooy A., Lehert P. et al. // BMJ. — 2010. — Vol. 340. — P. 2181. doi:10.1136/bmj.c2181.
24. Насонова Т.І. Корекція клініко-метаболічних порушень у хворих з цереброваскулярними захворюваннями на фоні метаболічного синдрому / Насонова Т.І. // Ендокринологія. — 2015. — T. 20, № 4. — С. 677-685.
1. Zaharov V.V. Lechenie kognitivnyih narusheniy pri distsirkulyatornoy entsefalopatii / Zaharov V.V., Stepkina D.A. // Rossiyskiy meditsinskiy zhurnal. – 2015. – #1. – S.953-956.
2. Damulin I.V. Bolezn Altsgeymera i sosudistaya dementsiya / Pod red. N.N.Yahno // M., 2002. – S.85.
3. Damulin I.V. Narusheniya krovoobrascheniya v golovnom i spinnom mozge / Damulin I.V., Parfenov V.A., Skoromets A.A., Yahno N.N.// Bolezni nervnoy sistemyi: rukovodstvo dlya vrachey / Pod redaktsiey N.N.Yahno, D.R.Schtulmana. – M., 2005. – S.231-302.
4. Varakin Yu.Ya. Osobennosti vyiyavleniya patsientov s nachalnyimi proyavleniyami hronicheskoy tserebrovaskulyarnoy patologiey pri obsledovanii naseleniya./ Varakin Yu.Ya., Gornostaeva G.V., Kravchenko M.A. // Materialyi 14-y Mezhdunarodnoy konferentsii «Vozrastnyie aspektyi nevrologii» – 2012. – S.2-5.
5. Kuduhova A.V. Ishemicheskie tserebrovaskulyarnyie zabolevaniya na fone metabolicheskogo sindroma: sostoyanie serdechno-sosudistoy sistemyi./ A.V. Kuduhova // M., 2012. – 160 s.
6. Telenkova N.G. Gematovazalnyie vzaimodeystviya pri hronicheskih tserebrovaskulyarnyih zabolevaniyah na fone metabolicheskogo sindroma./ Dissertatsiya na soiskanie uchenoy stepeni kandidata meditsinskih nauk. – M., 2010. – 24 s.
7. Luchinger JA, Tang MX et al. Hyperinsulinemia and risk of Alzheimier disease. Neurology 2004; 63: 1187-1192.
8.Hassing LB, Grant MD, Hofer SM et al. Type 2 diabetes mellitus contributes to cognitive decline in old age: a longitudinal population-based study. J Int Neuropsychol Soc. 2004; 10: 599-607.
9.Komulainen P, Lakka TA, Kivipelto M et al. Metabolic syndrome and cognitive function: a population-based follow-up study in elderly women. Dement Geriatr Cogn Disord. 2007; 23: 29-34.
10. Esin R.G. Sovremennyie predstavleniya o mehanizmah kognitivnyih rasstroystv pri saharnom diabete./ R.G.Esin, I.H. Hayrullin, O.R. Esin // Meditsinskiy almanah. – 2013-.#1 (25) -S.135-138.
11. Convit A, Wolf OT, Tarshish C, de Leon MJ. Reduced glucose tolerance is associated with poor memory performance and hippocampal atrophy among normal elderly. Proc Natl Acad Sci USA 2003; 2019-2022.
12. Hassing LB, Hofer SM, Nilsson SE et al. Comorbid type 2 diabetes mellitus and hypertension exacerbates cognitive decline: evidence from a longitudinal study. Age and Ageing. 2004; 33: 355-61.
13. Posner HB, Tang M-X, Luchsinger J. The relationship of hypertension in the elderly to AD, vascular dementia, and cognitive function. Neurology. 2002;58: 1175-81.
14. Peila R, Rodriguez BL, Launer LJ. Honolulu-Asia Aging Study Type 2 diabetes, APOE gene, and the risk for dementia and related pathologies. Diabetes. 2002;51: 1256-62.
15.Brummett BH, Austin SB, Welsh-Bohmer KA, Williams RB, Siegler IC. Long-Term Impact of Caregiving and Metabolic Syndrome with Perceived Decline in Cognitive Function 8 Years Later: A Pilot Study Suggesting Important Avenues for Future Research. Open Journal of Medical Psychology 2013; 2:23-8.
16. Holin A.V. Magnitno-rezonansnaya tomografiya pri zabolevaniyah tsentralnoy nervnoy sistemyi. / Holin A.V. rukovodstvo dlya vrachey. // Sankt-Peterburg. Izdatelstvo «Gippokrat» -2000. - S 69.
17. Kopchak O.O. KognItivnI ta neyrovIzualIzatsIynI harakteristiki (za danimi MRT) u hvorih Iz distsirkulyatornoyu entsefalopatIEyu ta metabolIchnim sindromom. / Kopchak O.O. // Mezhdunarodnyiy nevrologicheskiy zhurnal #8 (54) 2012.
18. Shishkova V. Kognitivnyiy defitsit u patsientov s metabolicheskim sindromom /Shishkova V., Osyichenko M. // Vrach. 2012. # 3. S. 30.
19. Roosendaal SD, Geurts JJ, Vrenken H еt al. Regional DTI differences in multiple sclerosis patients. Neuroimage. 2009; 44(4): 1397-403.
20. Craft S, Watson GS. Insulin and neurodegenerative disease: shared and specific mechanisms. Lancet Neurology. 2004; 3: 169-78.
21. Zimmer P, Shaw G, Alberti G. Preventing type 2 diabetes and the dysmetabolic syndrome in the real word: a realistic view. Deabetic medicine. 2003; 20 (9): 693-702.
22. Valdés-Ramos R, Guadarrama-López AL, Martínez-Carrillo BE, Benítez-Arciniega AD. Vitamins and type 2 diabetes mellitus. Endocr Metab Immune Disord Drug Targets. 2015;15(1):54-63.
23. de Jager J, Kooy A, Lehert P, Wulffelé MG, van der Kolk J, Bets D, Verburg J, Donker AJ, Stehouwer CD. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial. BMJ. 2010; 20;340: 2181. doi: 10.1136/bmj.c2181
24. Nasonova T.I. KorektsIya klInIko-metabolIchnih porushen u hvorih z tserebrovaskulyarnimi zahvoryuvannyami na fonI metabolIchnogo sindromu. EndokrinologIya. 2015;20,#4:S.677-685.
/64_2.jpg)

/64.jpg)
/65.jpg)
/65_2.jpg)
/66.jpg)
/66_2.jpg)
/67.jpg)