Международный эндокринологический журнал 1 (73) 2016
Факторы кардиоваскулярного риска у больных с артериальной гипертензией при различном уровне тиреотропного гормона
Авторы: Приходько В.Ю., Кононенко Е.А. - Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Резюме
Метою роботи було встановити вплив рівня тиреотропного гормону (ТТГ) на частоту і вираженість факторів кардіоваскулярного ризику у хворих на артеріальну гіпертензію (АГ). Були обстежені 123 хворі із АГ I–II ступенів віком 45–70 років. Методи дослідження: визначення показників ліпідограми, ТТГ, вільного тироксину, ехокардіографія, вимірювання офісного артеріального тиску (АТ), дуплексне сканування судин шиї, тестування за госпітальними шкалами тривоги і депресії. Серед обстежених хворих 12,4 % мали не діагностований раніше субклінічний гіпотиреоз, що асоціювався з більшою частотою дисліпідемії, порушення вуглеводного обміну, гіпертрофії лівого шлуночка і атеросклеротичного ураження сонних артерій, більш високими значеннями пульсового АТ, а також зі зменшенням швидкості клубочкової фільтрації і тривожно-депресивними розладами. При аналізі групи з нормальною функцією щитоподібної залози (ЩЗ) було виявлено, що високонормальний рівень ТТГ (2–4 мОд/л) також пов’язаний зі збільшенням частоти факторів кардіоваскулярного ризику і погіршенням стану органів-мішеней порівняно з особами із низьконормальним рівнем ТТГ. Отже, функціональний стан ЩЗ впливає на частоту та вираженість факторів ризику і уражень органів-мішеней при АГ, що потребує ретельного його контролю у хворих із кардіологічною патологією.
Целью работы было установление влияния уровня тиреотропного гормона (ТТГ) на частоту и выраженность факторов кардиоваскулярного риска у пациентов с артериальной гипертензией (АГ). Были обследованы 123 пациента с АГ I–II степени в возрасте 45–70 лет. Методы обследования: антропометрический, определение показателей липидограммы, ТТГ и свободного тироксина, измерение офисного артериального давления (АД), эхокардиография, дуплексное сканирование сосудов шеи, тестирование по госпитальным шкалам тревоги и депрессии. Среди обследованных у 12,4 % выявлен не диагностированный ранее субклинический гипотиреоз, который ассоциировался с большей частотой дислипидемии, нарушений углеводного обмена, гипертрофии левого желудочка и атеросклеротического поражения сонных артерий, более высокими значениями пульсового АД, а также с уменьшением скорости клубочковой фильтрации и тревожно-депрессивными расстройствами. При анализе группы с нормальной функцией щитовидной железы (ЩЖ) выявлено, что высоконормальный уровень ТТГ (2–4 мЕд/л) также связан с увеличением частоты факторов кардиоваскулярного риска и ухудшением состояния органов-мишеней по сравнению с лицами, имеющими низконормальный уровень ТТГ. Следовательно, функциональное состояние ЩЖ влияет на частоту и выраженность факторов риска и поражений органов-мишеней при АГ, что требует тщательного его контроля у пациентов с кардиологической патологией.
The objective was to determine the effect of thyroid stimulating hormone (TSH) levels on the incidence and severity of cardiovascular risk factors in patients with arterial hypertension (AH). We have examined 123 patients with AH I–II grades aged 45–70 years. Methods of examination: blood lipids, TSH, free thyroxine, echocardiography, office blood pressure (BP) measurement, duplex scanning of neck vessels, testing by hospital anxiety and depression scales. Among the examined patients, 12.4 % had subclinical hypothyroidism not previously diagnosed that was associated with greater incidence of dyslipidemia, carbohydrate metabolism disorders, left ventricular hypertrophy and carotid atherosclerotic lesions, higher values of pulse BP, as well as with a decrease in glomerular filtration rate and with anxiety-depressive disorders. Analysis of the group with normal thyroid function found that high normal TSH level (2–4 mU/L) is also associated with increased incidence of cardiovascular risk factors and the deterioration of target organs compared with those with low-normal TSH levels. Thus, the functional state of the thyroid gland has an impact on the incidence and severity of risk factors and target organ damage in AH that requires its careful monitoring in patients with cardiological diseases.
Ключевые слова
артеріальна гіпертензія, вік, фактори кардіоваскулярного ризику, функціональний стан щитоподібної залози.
артериальная гипертензия, возраст, факторы кардиоваскулярного риска, функциональное состояние щитовидной железы.
hypertension, age, cardiovascular risk factors, functional status of the thyroid gland.
Статтю опубліковано на с. 70-80
Вступ
Актуальною проблемою сучасної профілактичної медицини є недостатній контроль артеріального тиску (АТ) при артеріальній гіпертензії (АГ). У багатьох клінічних дослідженнях показано, що недостатній контроль АТ у пацієнтів пов’язаний із факторами серцево-судинного ризику — ожирінням, гіперхолестеринемією, високим рівнем ліпопротеїнів низької щільності (ЛПНЩ) [29]. Досить часто у людей середнього та літнього віку АГ поєднується із супутньою патологією, зокрема ендокринною. Причому слід підкреслити, що не тільки цукровий діабет (ЦД) і хронічна хвороба нирок (ХХН) мають з АГ взаємоускладнюючий вплив. Суттєву роль у погіршенні гемодинаміки може відігравати і патологія щитоподібної залози (ЩЗ). Останні наукові дані доводять, що різноманітну патологію ЩЗ виявляють приблизно у 42–52 % дорослого населення України, а в людей похилого віку — до 80 % випадків [8, 9]. Гіпотиреоз трапляється в загальній популяції у 0,2–2 %, у жінок сягаючи 10 %. І хоча в розумінні лікаря порушення функції ЩЗ за наявності АГ проявляється частіше гіпертиреозом, насправді це не так. Гіпертиреоз (тиреотоксикоз) діагностується у 3 % жінок та 0,3 % чоловіків, тоді як поширеність гіпотиреозу в жіночій популяції значно більша (до 10 %). Справжню проблему при цьому створює несвоєчасна діагностика гіпотиреозу у літньої людини. Якщо гіпертиреоз має яскраві клінічні прояви, що легко діагностуються, то симптоми гіпотиреозу (набряки, астенія, сонливість, сухість шкіри, задишка) практично повністю збігаються з типовими віковими змінами і розцінюються як ознаки старіння, а не хвороби. Тому увагу кардіологів, терапевтів і сімейних лікарів слід спрямувати на виявлення гіпотиреозу, що може імітувати ознаки серцево-судинних захворювань.
Окреме місце серед порушень функції ЩЗ посідає субклінічний гіпотиреоз (СГ), що трапляється частіше, ніж маніфестний. СГ — синдром, обумовлений стійким примежовим зниженням рівня тиреоїдних гормонів в організмі, при якому визначається нормальний рівень вільного тироксину (Т4) в поєднанні з помірно підвищеним рівнем тиреотропного гормону (ТТГ) — від 4,01 до 10 мОд/л, за нормою 0,4–4,0 мОд/л [6]. Загальна поширеність СГ становить 4–17,5 % серед жінок і 2–6 % серед чоловіків. У людей літнього віку (понад 60 років) поширеність цього стану збільшується до 20 % [7, 21, 23]. За даними дослідників, частота СГ збільшується пропорційно віку досліджуваних, що потребує ретельного обстеження хворих старших вікових груп на рівень ТТГ і гормонів ЩЗ [11]. При СГ виявляються помітні зміни органів і систем, що дозволяють його вважати мінімальною недостатністю ЩЗ, а отже, можна припустити, що СГ сприяє збільшенню в тому числі і серцево-судинного ризику у пацієнтів з АГ [3].
Опубліковано чимало робіт, присвячених впливу СГ на ліпідний обмін. В інших дослідженнях також виявлені ознаки порушення метаболізму глюкози, що теж є фактором серцево-судинного ризику [13]. У великому популяційному дослідженні літніх людей (3075 осіб віком 70 років і старше), проведеному в США, виявлено, що з рівнем ТТГ пов’язане підвищення вмісту тригліцеридів (ТГ) і зниження концентрації ліпопротеїнів високої щільності (ЛПВЩ), а також підвищення АТ. Такий зв’язок встановлено не тільки у пацієнтів із СГ, а й у осіб із високонормальним рівнем ТТГ (2,0–4,0 мОд/л). Зв’язку рівня ТТГ з ожирінням в цьому дослідженні встановлено не було [41].
Натепер загальноприйнятий референсний діапазон рівня ТТГ становить від 0,4 до 4,0 мОд/л. Останніми роками активно обговорюється виділення низько- (до 2,0 мОд/л) і високонормального (2,0–4,0 мОд/л) діапазонів рівня ТТГ. За результатами проведених клінічних досліджень встановлено негативний вплив високонормального рівня ТТГ на рівень серцево-судинного ризику. Так, у Німеччині проведено дослідження за участю 1333 осіб у стані еутиреозу і встановлено, що в осіб із рівнем ТТГ від 2,5 до 4,5 мОд/л ризик серцево-судинних захворювань був підвищений у 1,7 раза порівняно з групою, де ТТГ був ближче до нижньої межі норми. Схожі результати отримані й у Кореї при обстеженні 2205 жінок у постменопаузі [12, 29, 34]. Проте в цих дослідженнях не було ретельного аналізу інших факторів кардіоваскулярного ризику та ураження органів-мішеней у таких хворих. Незважаючи на певні результати, сьогодні немає чіткої позиції щодо впливу СГ на підвищення кардіоваскулярного ризику, адже є і роботи, що не підтверджують зв’язок СГ із дисліпідемією, атеросклерозом сонних артерій та ризиком розвитку ішемічної хвороби серця [16, 17, 37, 39]. Отже, дані щодо зв’язку СГ із факторами ризику є суперечливими. Необхідні додаткові дослідження, які б підтвердили чи спростували здатність СГ підвищувати серцево-судинний ризик, особливо у пацієнтів з АГ. Вплив СГ, а також стану з високонормальним рівнем ТТГ на перебіг АГ у пацієнтів різного віку залишається недостатньо вивченим. У доступній літературі знайдено лише одну роботу, присвячену цій проблемі [1].
Метою нашого дослідження було вивчення зв’язку різних рівнів ТТГ із рівнем серцево-судинного ризику у пацієнтів з АГ різного віку.
Матеріал і методи
У дослідження були включені 123 особи з гіпертонічною хворобою ІІ стадії, АГ ІІ ступеня. Вік хворих у середньому становив 66,08 ± 8,70 року (від 45 до 75 років). Тривалість АГ — 15,6 ± 6,2 року. Жінок було 91 (74 %), чоловіків — 33 (26 %). Жінок віком до 60 років — 26 (29,2 %), понад 60 років — 65 (70,8 %). Чоловіків віком до 60 років було 10 (35,0 %); понад 60 років — 23 (65,0 %). Усі включені в дослідження особи були розподілені на дві групи залежно від функціонального стану ЩЗ. До першої групи увійшло 16 хворих із супутнім СГ, до другої — 107 хворих без СГ. Пацієнти з СГ становили 12,4 % від усіх обстежених, що не відрізняється від популяційних даних, що наведені в літературних джерелах. У подальшому друга група була розподілена за рівнем ТТГ на дві підгрупи — з високонормальним (від 2,0 до 4,0 мОд/л) та низьконормальним (від 0,4 до 2,0 мОд/л) рівнями ТТГ, в які увійшли 54 та 53 пацієнти відповідно. Групи були порівнянні між собою за віком, статтю, тривалістю АГ, вихідними рівнями систолічного АТ (САТ), діастолічного АТ (ДАТ) і частотою серцевих скорочень (ЧСС). Додатково хворих було розподілено на дві групи за віком: група середнього віку (від 45 до 60 років) і група похилого віку (від 60 до 75 років).
Отже, група людей похилого віку була розподілена на три підгрупи за рівнем ТТГ: перша підгрупа — пацієнти із СГ (15 осіб); друга підгрупа — пацієнти з низьконормальним рівнем ТТГ (41 особа); третя підгрупа — пацієнти з високонормальним рівнем ТТГ (20 осіб). Група людей середнього віку була розділена на дві підгрупи: перша підгрупа — пацієнти з низьконормальним рівнем ТТГ (20 осіб); друга підгрупа — пацієнти з високонормальним рівнем ТТГ (15 осіб), оскільки серед осіб середнього віку лише в однієї був виявлений СГ.
Пацієнтам були проведені такі дослідження: антропометричні (зріст, маса тіла (МТ), індекс МТ (ІМТ), окружність талії (ОТ)); загальноклінічні дослідження, що містили вимірювання АТ методом М.С. Короткова; електрокардіографію (ЕКГ) у 12 відведеннях; добове моніторування АТ і ЕКГ, ехокардіографію (ЕхоКГ) з розрахунком показників інтракардіальної та системної гемодинаміки, дуплексне сканування судин шиї, тестування за шкалою Гамільтона (оцінка депресії), опитувальником А.М. Вейна, оцінку якості життя за візуально-аналоговою шкалою (ВАШ), УЗД органів черевної порожнини та ЩЗ, лабораторні методи. Поряд із загальним і біохімічним дослідженням крові та визначенням ліпідограми визначали рівень ТТГ і гормонів ЩЗ, креатиніну з розрахунком швидкості клубочкової фільтрації (ШКФ) за формулою СKD-EPI, відношення «альбумін/креатинін у сечі».
За рішенням засідання експертів НМАПО імені П.Л. Шупика схвалено клінічне дослідження як таке, що відповідає сучасним нормам і принципам щодо проведення клінічних досліджень (протокол засідання № 2 від 06.02.2013 р.).
Для аналізу результатів дослідження використовувались методи варіаційної статистики з розрахунком частотних характеристик досліджуваних показників (у %), середніх величин (середньої арифметичної — Х) та оцінки їх варіабельності (середнє квадратичне відхилення — σ). Дане дослідження проведено на вибірковій сукупності, тому для оцінки статистичної значимості клінічних результатів і динаміки показників визначалась середня похибка (m). Для кількісних даних проводили оцінку нормальності розподілу за критерієм Шапіро — Уїлка. Оцінка статистичної значимості різниці між порівнюваними групами для порівняння кількісних параметрів проводилась за t-критерієм (парні порівняння) та дисперсійним аналізом (ANOVA — порівняння трьох груп). У випадку невідповідності первинних даних параметрам нормального розподілу для порівняння кількісних показників у двох незалежних групах використовували критерій Манна — Уїтні та критерій Вілкоксона для пов’язаних сукупностей (у динаміці). Для вивчення сили та спрямованості зв’язку між досліджуваними показниками проводили кореляційний та регресійний аналіз. Оцінка статистичної значимості різниці між групами за критерієм хі-квадрат (із поправкою Йєтса) проводилась у випадку малого числа спостережень у підгрупах. Всі розраховані показники оцінювались (порівнювались) при заданому граничному рівні похибки першого роду (α) не вище 5 % — p < 0,05.
Первинна база сформована в Excel, статистичний аналіз проводився з використанням ліцензійного пакета Statistica 12.
Результати дослідження
На першому етапі дослідження порівнювались антропометричні дані в групах із СГ та без нього. Середня МТ пацієнтів групи СГ була 77,93 ± 2,77 кг; групи без СГ — 84,56 ± 0,78 кг, p < 0,05. Середній зріст у групі СГ становив 1,61 ± 0,02 м, а в групі без СГ — 1,66 м, p < 0,05. Показники ІМТ, ОТ та ОС вірогідної різниці в групах не мали.
Офісний АТ та ЧСС у хворих на АГ залежно від функціонального стану ЩЗ. Вимірювання офісного АТ проводилось усім пацієнтам згідно з Клінічними рекомендаціями з артеріальної гіпертензії Європейського товариства гіпертензії та Європейського товариства кардіологів (2013) [4]. Середні значення наведені в табл. 1.
При дослідженні офісного АТ ми виявили, що САТ у групі СГ був вірогідно вищим порівняно з особами без СГ. Це стосувалося людей як із низьконормальним, так і з високонормальним рівнем ТТГ. Різниця щодо САТ становила 10–14 мм рт.ст. і була найбільшою у групі з низьконормальним рівнем ТТГ. Середні значення ДАТ у групі СГ не набагато перевищували аналогічні показники в інших групах — різниця становила 4–5 мм рт.ст. і не була вірогідною. Відповідно, пульсовий АТ (ПАТ) був вірогідно вищим у групі з СГ порівняно з усіма іншими групами, в тому числі і з групою з високонормальним рівнем ТТГ.
Дані добового моніторингу АТ. Добовий профіль САТ у групі АГ + СГ характеризувався тим, що 50 % становили non-dipper, тобто у половини хворих на СГ не відбувалося достатнього нічного зниження САТ. При цьому має значення рівень ТТГ в осіб без СГ. У групі з високонормальним рівнем ТТГ кількість non-dipper дорівнювала 46 %, а в групі з низьконормальним рівнем ТТГ — 40 %. Пацієнти з добовим профілем ДАТ non-dipper у групі з СГ становили 32 %, що на 8 % більше, ніж у групі АГ без СГ, на 19 % більше, ніж в групі з високонормальним рівнем ТТГ, та на 21 % більше, ніж в групі з низьконормальним рівнем ТТГ.
Дослідження факторів кардіоваскулярного ризику. При дослідженні частоти дисліпідемії встановлено, що гіперхолестеринемія в групі АГ + СГ траплялася на 10 % частіше порівняно з групою АГ без СГ, підвищення рівня холестерину (ХС) ліпопотеїнів низької щільності (ЛПНЩ) було > 3,0 — на 10 % частіше, зниження вмісту ХС ЛПВЩ < 1,0, що на 6 % частіше порівняно з групою АГ без СГ. Щодо частоти гіпертригліцеридемії в двох групах суттєвої різниці не було. Варто зазначити, що до включення в дослідження пацієнти в обох групах приймали статини епізодично, нерегулярно, робили тривалі перерви.
Аналіз показників у пацієнтів різного віку. Серед осіб літнього віку людей з низьконормальним рівнем ТТГ було 57 %, із високонормальним — 22 %, із СГ — 21 %. Серед осіб середнього віку людей з низьконормальним рівнем ТТГ було 54 %, з високонормальним — 43 %, із СГ — 2,8 %. Спочатку проведено порівняння антропометричних показників у групах літнього віку з різним рівнем ТТГ (табл. 2, 3).
Після проведення аналізу пацієнтів літнього віку з різним рівнем ТТГ встановлено, що у пацієнтів із низьконормальним рівнем ТТГ (група 2) середні показники МТ, ОТ та ІМТ були вірогідно більшими порівняно з пацієнтами з першої та третьої груп, також пацієнтів з ожирінням у цій групі виявилось на 2 % більше, ніж у першій, і на 4,8 % більше, ніж у третій групі.
Проведено порівняння антропометричних показників між двома групами пацієнтів середнього віку з низьконормальним та високонормальним рівнями ТТГ та з відповідними групами пацієнтів літнього віку (табл. 4).
При аналізі цих даних у пацієнтів середнього віку було виявлено вірогідно більший відсоток ожиріння в групі з високонормальним рівнем ТТГ порівняно з низьконормальним (74 проти 40 %, р < 0,05). У пацієнтів старшого віку з низьконормальним рівнем ТТГ відсоток людей із нормальним ІМТ вірогідно більший за такий у групі з високонормальним рівнем ТТГ.
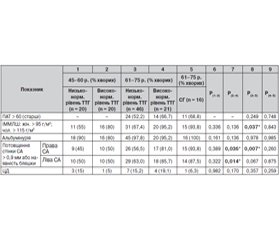
Важливими маркерами, що визначають прогноз у хворих на АГ, визнані такі ознаки субклінічного ураження органів-мішеней, як гіпертрофія міокарда, альбумінурія, підвищення ПАТ > 60 мм рт.ст. та ультразвукові ознаки ураження сонних артерій у вигляді збільшення показника «товщина інтими-медії» та атеросклеротичних бляшок [4]. Ми порівняли частоту наявної гіпертрофії лівого шлуночка (ГЛШ) та інших уражень органів-мішеней у групах АГ + СГ та АГ без СГ (табл. 5).
У групі АГ + СГ виявлено відносно більший відсоток пацієнтів із ГЛШ, підвищеним ПАТ, але різниця не була вірогідною. Вірогідно більшим виявився відсоток атеросклеротичного ураження сонних артерій у групі АГ + СГ, що відповідає літературним даним. Це погоджується з нашими даними про більшу частоту дисліпідемії у хворих на АГ із супутнім СГ.
Далі проаналізовано різні фактори серцево-судинного ризику, частоту виявлення уражень органів-мішеней і ЦД у пацієнтів, розподілених на 5 груп за віком та рівнем ТТГ (табл. 6, 7).
В осіб літнього віку при СГ вірогідно частіше виявляється ГЛШ, що можна пов’язати з більш високими значеннями САТ і ПАТ (табл. 1). У групі АГ + СГ виявлено найвищий відсоток ГЛШ — 87 %, в групі похилого віку з високонормальним рівнем ТТГ — на 12 % менше (75 %), у групі середнього віку з високонормальним рівнем ТТГ — на 50 % менше (37 %). У групах середнього та літнього віку з низьконормальним рівнем ТТГ показник становив 33 та 37 % відповідно. В усіх групах переважав ексцентричний тип гіпертрофії. Концентричну гіпертрофію виявлено тільки в групах СГ (14 %) та високонормального рівня ТТГ (9 %).
Нами було проведено тестування за шкалами тривоги та депресії HADS, опитувальником А.М. Вейна, ВАШ якості життя. Відсоток людей із вираженою тривогою та депресією з перевищенням балів за шкалою Вейна в групах АГ + СГ і АГ без СГ наведено у табл. 8.
За даними ВАШ якості життя (де враховувалась оцінка пацієнтом стану свого здоров’я на момент огляду за шкалою від 0 до 100), відсоток пацієнтів, які мали бали > 50, був такий: у групі АГ + СГ — 37,5 % (6 осіб), у групі АГ без СГ — 35,5 % (38 осіб), вірогідних відмінностей не виявлено.
Лабораторні показники у хворих на АГ залежно від рівня ТТГ. У групі АГ + СГ виявлено вірогідне підвищення вмісту сечовини (6,96 ± 0,59 ммоль/л) порівняно з групою низьконормального рівня ТТГ (6,01 ± 0,33 ммоль/л) та високонормального рівня ТТГ (5,30 ± 0,29 ммоль/л; р < 0,05), що підтверджує негативний вплив СГ на функцію нирок у пацієнтів з АГ. Інші середні значення лабораторних показників вірогідних відмінностей не мали. Було проаналізовано також лабораторні показники у хворих на АГ різного віку залежно від умісту ТТГ у крові і між групами з низьконормальним та високонормальним рівнями ТТГ: вірогідної різниці в показниках біохімічних аналізів крові немає.
Результати та обговорення
Аналізуючи антропометричні дані, ми очікували, що у хворих на СГ буде вірогідно більшою МТ, що природно було б пояснити зменшенням інтенсивності обмінних процесів і прихованими набряками у цих хворих. За нашими даними, середня МТ при СГ була вірогідно меншою порівняно з особами без СГ, але хворі на СГ мали також і вірогідно менший зріст, тому ІМТ не мав вірогідної різниці в групах. При аналізі груп за ІМТ виявлено, що серед осіб із СГ дещо більшою є частота ожиріння (50 проти 40 %). За відсутності вірогідних розбіжностей щодо ІМТ у групах була виявлена кореляція між рівнем ТТГ і ІМТ (r = 0,46; p < 0,05), що вказує на збільшення ІМТ у хворих із високим рівнем ТТГ. Але на обстеженій виборці ця тенденція не реалізувалась у вірогідних відмінностях по окремих групах. Зважаючи на відсутність вірогідних розбіжностей щодо МТ, ОТ, ОС, а також на незначні відмінності щодо частоти ожиріння, можна зробити висновок, що СГ не відіграє ролі у розвитку ожиріння, а пов’язане з СГ зростання кардіоваскулярного ризику не залежить від надмірної МТ. Схожі дані були отримані в дослідженні, проведеному в США [41]. Аналізуючи антропометричні дані в групах із різним рівнем нормального ТТГ, було встановлено, що в групах як середнього, так і літнього віку з низьконормальним рівнем ТТГ є вірогідно більший відсоток людей із нормальною МТ і вірогідно менший відсоток людей з ожирінням порівняно з групами з високонормальним рівнем ТТГ. При порівнянні старших вікових груп із різним рівнем ТТГ у групі з низьконормальним рівнем виявлено вірогідно більший відсоток людей із нормальним ІМТ. Інші показники не мали вірогідних відмінностей. У людей середнього віку з різним рівнем ТТГ у групі з низьконормальним рівнем було виявлено вірогідно більший відсоток людей із нормальною МТ, вірогідно менший відсоток людей з ожирінням.
При порівнянні груп із низьконормальним рівнем ТТГ різного віку виявлено у молодших вірогідно більший відсоток людей із нормальною МТ та вірогідно менший відсоток людей з ожирінням. При порівнянні груп із високонормальним рівнем ТТГ різного віку виявлено у молодших вірогідно більший відсоток людей із ожирінням. Беручи до уваги вищенаведені дані, можна зробити висновок про те, що у пацієнтів з АГ вплив рівня ТТГ на ІМТ залежить від віку. Так, у пацієнтів літнього віку вплив СГ та стану з високонормальним рівнем ТТГ на ІМТ виражений менше, ніж у пацієнтів середнього віку. Загалом, суттєвого зв’язку СГ і функції ЩЗ з ожирінням і надмірною МТ не встановлено.
Дані, отримані при дослідженні офісного АТ, вказують на зв’язок СГ з підвищенням САТ і, як наслідок, підвищенням ПАТ у пацієнтів з АГ. Відомо, що рівень ПАТ для людей старшого віку є фактором погіршення прогнозу, тому можна очікувати, що літні люди з СГ будуть мати більш високий кардіоваскулярний ризик. А от ЧСС у людей з СГ була дещо меншою (на 4–6 уд/хв), що, однак, не мало вірогідності.
Отримані дані добового моніторингу АТ дозволили вважати, що СГ асоціюється з недостатнім зниженням нічного САТ і ДАТ. Відомо, що недостатнє зниження АТ у нічний час навіть при м’якій та помірній АГ чітко корелює з розвитком та ускладненнями ішемічної хвороби серця та мозку, ураженням нирок і взагалі серцево-судинною смертністю. В групі з високонормальним рівнем ТТГ пацієнтів із профілем САТ non-dipper на 6 % більше, ніж у групі з низьконормальним рівнем ТТГ, а кількість пацієнтів з профілем ДАТ non-dipper у групах із високо- та низьконормальним рівнями ТТГ не відрізнялась, що може вказувати на відсутність впливу рівня ТТГ у межах референтних значень на нічне зниження ДАТ. Пацієнтів із добовим профілем night peaker та over-dipper серед обстежених в усіх групах були одиниці.
За даними літератури, знижена функція ЩЗ асоціюється з дисліпідемією, що є провідним фактором ризику атеросклерозу. Порівняно зі здоровими особами у пацієнтів із СГ виявлено знижений рівень ХС ЛПВЩ, підвищений рівень ХС ЛПНЩ, ТГ, загального ХС (ЗХС), збільшений індекс атерогенності [21, 43, 44]. Згідно з результатами Роттердамського дослідження зроблено висновок про те, що СГ є фактором ризику атеросклерозу аорти та інфаркту міокарда у жінок похилого віку [23]. У дослідженні, проведеному в ННЦ «Інститут кардіології імені академіка М.Д. Стражеска НАМН України», встановлено, що у жінок в постменопаузному періоді при гіпертонічній хворобі найбільш виражений кореляційний зв’язок спостерігається між рівнями ТТГ та рівнями ЗХС, ХС ЛПНЩ, що підтверджує патогенетичне значення СГ у розвитку атерогенної дисліпідемії [7].
За нашими даними, наявність СГ у хворих на АГ асоціюється з більш частою дисліпідемією з підвищенням рівня ХС ЛПНЩ та ЗХС, що може суттєво збільшити кардіоваскулярний ризик у цих хворих. Звертає на себе увагу, що у пацієнтів з АГ відзначається пряма кореляційна залежність між значеннями ТТГ та ЗХС і ЛПНЩ (r = 0,87; r = 0,84 відповідно, p < 0,05).
При дослідженні уражень органів-мішеней виявлено, що пацієнтів похилого віку з потовщенням стінки сонної артерії (СА) > 0,9 мм у групі СГ було на 37,3 % (p < 0,05) більше, а в групі високонормального рівня ТТГ на 24,5 % (p < 0,1) більше, ніж у групі того ж віку з низьконормальним рівнем ТТГ. Відсоток пацієнтів похилого віку з ГЛШ у групі СГ був на 26,4 % (p < 0,1) більше, а в групі високонормального рівня ТТГ — на 27,9 % (p < 0,05) більше порівняно з групою з низьконормальним рівнем ТТГ. У пацієнтів середнього віку кількість виявлених ГЛШ у групі високонормального рівня ТТГ була на 25 % (p < 0,1) більше порівняно з групою низьконормального рівня ТТГ. При порівнянні груп різного віку з високонормальним рівнем ТТГ виявлено, що у пацієнтів похилого віку потовщення стінки СА > 0,9 мм трапляється частіше на 31 % (p < 0,05), ніж у групі середнього віку. Альбумінурія була виявлена практично в усіх обстежених пацієнтів, статистично вірогідних розбіжностей між групами не було, що можна пояснити ураженням нирки при тривалій АГ і недостатньому контролі АТ в обстежених хворих. А от відсоток пацієнтів зі зниженою ШКФ у групі АГ + СГ був вірогідно більшим порівняно з групою АГ без СГ (50 проти 20,5 %). Кореляційний аналіз показав зворотну залежність середньої сили між рівнем ТТГ та ШКФ (r = 0,46; p < 0,05). Отже, можна припустити, що наявність навіть СГ може негативно відображуватися на функціональному стані нирок, сприяючи більш швидкому прогресуванню ХХН. У клінічній практиці ми дійсно спостерігаємо зменшення ШКФ у літніх людей зі зниженою функцією ЩЗ. Тому практичному лікарю можна порадити завжди досліджувати функціональний стан ЩЗ у людей старшого віку з АГ за наявності хронічної ниркової недостатності.
При дослідженні частоти факторів ризику в групах із СГ та різним рівнем нормального ТТГ виявлено, що відсоток пацієнтів із дисліпідемією був достатньо високим в усіх групах, адже ніхто з пацієнтів не приймав регулярно статини до включення в дослідження. Серед обстежених зустрічався переважно ІІб тип дисліпідемії (підвищення рівня ЗХС, ХС ЛПНЩ і ТГ), як і в загальній популяції.
У групі середнього віку з високонормальним рівнем ТТГ було більше пацієнтів із рівнем ТГ > 1,7 ммоль/л на 25 %. Група похилого віку з високонормальним рівнем ТТГ мала більше пацієнтів із рівнем ХС ЛПВЩ < 1,0 ммоль/л на 13 %, рівнем ТГ > 1,7 ммоль/л на 31 %, рівнем глюкози крові > 5,6 ммоль/л на 47 % (p < 0,05) порівняно з групою того ж віку з низьконормальним рівнем ТТГ. Група похилого віку з СГ мала вищий відсоток пацієнтів із рівнем ХС ЛПВЩ < 1,0 ммоль/л на 12 %, рівнем ХС ЛПНЩ > 3,0 ммоль/л на 21 %, рівнем глюкози крові > 5,6 ммоль/л на 44 % (p < 0,05), а також вірогідно більший відсоток пацієнтів із ГЛШ порівняно з групою того ж віку з низьконормальним рівнем ТТГ. Показники в групах похилого віку з високонормальним рівнем ТТГ та СГ вірогідних відмінностей не мали.
Кореляційний аналіз виявив міцний прямий зв’язок між рівнем ТТГ і глюкози крові (r = 0,81, p < 0,05). Порушення толерантності до глюкози розглядається як метаболічна стадія, що є проміжною між нормальним гомеостазом глюкози та ЦД. Стан вуглеводного обміну в групі з СГ характеризувався вірогідно більшим відсотком пацієнтів із підвищеним умістом глюкози в крові натще. При порівнянні частоти виявлення рівня глюкози > 5,6 ммоль/л у групах із різним рівнем ТТГ літнього та середнього віку найбільший відсоток (87,7 %) був у групах похилого віку з СГ та високонормальним рівнем ТТГ. Також, згідно з отриманими даними, високонормальний рівень ТТГ, як і СГ, асоціюється з більшою частотою ГЛШ у пацієнтів з АГ.
Отже, СГ і високонормальний рівень ТТГ асоціюються з метаболічними порушеннями, що пов’язані зі збільшенням кардіоваскулярного ризику в пацієнтів з АГ: дисліпідемією і порушенням вуглеводного обміну. Отримані нами результати підтверджуються і даними літератури. Так, у великому популяційному дослідженні, проведеному в Китаї за участю 3664 еутиреоїдних осіб, у групі з низьконормальним рівнем ТТГ (до 1,0 мОд/л) виявлена найнижча поширеність гіперхолестеринемії, що поступово збільшувалась із підвищенням рівня ТТГ. А зі збільшенням віку зв’язок ТТГ із гіперхолестеринемією посилювався і поширеність останньої збільшувалась [20]. Аналогічні результати отримані в дослідженні HUNT у Норвегії, а також у подібних дослідженнях, проведених у Кореї, Мексиці, США, Росії [1, 2, 14, 18, 19, 22, 26, 27, 29, 33, 35, 38].
Гіпотиреоз часто супроводжується психоемоційними порушеннями, це стосується також і його субклінічних форм. Автори одного з досліджень (Joffe R.T. та Levitt A.J.) дійшли висновку, що депресія при СГ відрізняється від такої без СГ наявністю відчуття паніки. За їхньою думкою, підтвердженою ще деякими авторами, СГ не є причиною розвитку депресії, але може знижувати поріг розвитку депресивних станів [5, 24, 25].
За нашими даними, наявність СГ асоціювалася з тривожно-депресивними розладами. Кількість пацієнтів із проявами депресії серед них була на 20 % більшою, ніж в осіб без СГ. Частота тривоги також була більшою (на 11 %), ніж у хворих без СГ. Ми не можемо ігнорувати психоемоційні зміни у хворих з АГ і високим кардіоваскулярним ризиком, зважаючи на останні дані про їх роль у погіршенні прогнозу. Згідно з даними літератури, депресія розглядається як незалежний фактор розвитку серцево-судинних ускладнень [10]. Депресія асоціюється зі збільшенням числа кардіоваскулярних ускладнень в 1,9 раза і погіршує прогноз у кардіологічних хворих у 2,4 раза (European Guidelines on Cardiovascular Disease Prevention in Clinical Practice, Version 2012).
Кількість пацієнтів із вегетативною дисфункцією також була на 33,5 % вищою в групі АГ + СГ, причому переважали ознаки гіперсимпатикотонії (схильність до серцебиття, збудження, коливань АТ при хвилюванні, відчуття ознобу, почервоніння обличчя). Вегетативні розлади (і зокрема, гіперсимпатикотонія) сьогодні розглядаються як одна зі сполучних ланок між тривожно-депресивними станами і кардіоваскулярними подіями. До того ж схильність до гіперсимпатикотонії може сприяти більшій варіабельності АТ, гіршому контролю АТ і недосягненню його цільових значень при лікуванні. Тому ми можемо припустити, що наявність тривожно-депресивних проявів і вегетативної дисфункції при СГ може сприяти складнощам при лікуванні таких хворих. Під час аналізу частоти психоемоційних розладів і вегетативних порушень у групах літнього та середнього віку залежно від рівня ТТГ при його нормальних значеннях суттєвої різниці між показниками не виявлено.
Цікаво, що за більшої кількості хворих із дисліпідемією при супутньому СГ середні значення показників ліпідограми не відрізнялися. Це ще раз підкреслює важливість і необхідність оцінки популяції хворих з точки зору поширеності факторів ризику і уражень органів-мішеней, що вказані в європейських і національних рекомендаціях.
Отже, аналіз поширеності факторів ризику, уражень органів-мішеней, показників АТ і його добового профілю у хворих на АГ залежно від функціонального стану ЩЗ дозволив нам зробити такі висновки.
Висновки
1. Серед обстежених амбулаторних хворих на АГ частота СГ становила 12,4 %, що не відрізняється від загальних популяційних даних. У групі літнього віку пацієнтів із низьконормальним рівнем ТТГ було 57 %, з високонормальним — 22 %. У групі середнього віку людей із низьконормальним рівнем ТТГ було 54 %, з високонормальним — 43 %. Поширеність СГ і його значення у збільшенні серцево-судинного ризику вимагає від практичного лікаря обстеження хворих на АГ щодо показників функції ЩЗ, не обмежуючись тільки УЗД ЩЗ.
2. Наявність СГ негативно впливає на стан ліпідного та вуглеводного обміну, а саме: в групі СГ було виявлено більший відсоток пацієнтів із факторами серцево-судинного ризику (ХС ЛПНЩ > 3,0 ммоль/л, ХС ЛПВЩ < 1,0 ммоль/л та ТГ > 1,7 ммоль/л, підвищення рівня глюкози натще). При цьому середні значення даних показників у групах із СГ та без нього не відрізнялися, що потребує індивідуальної оцінки серцево-судинного ризику в популяції людей з СГ, яка демонструє роль цього супутнього стану в погіршенні показників прогнозу у кардіологічних хворих.
3. Наявність СГ погіршує стан органів-мішеней у пацієнтів з АГ, а саме: в групі СГ найвищий відсоток людей із ГЛШ і атеросклеротичним ураженням СА, що веде до підвищення загального серцево-судинного ризику в осіб як середнього, так і літнього віку. Частота атеросклеротичного ураження СА може бути пов’язана з порушеннями ліпідного обміну. У пацієнтів похилого віку потовщення стінки СА > 0,9 мм трапляється вірогідно частіше, ніж у групі середнього віку.
4. Високонормальний рівень ТТГ має зв’язок із погіршенням стану органів-мішеней і підвищенням факторів серцево-судинного ризику у пацієнтів з АГ середнього і літнього віку. Так, група літнього віку з високонормальним рівнем ТТГ мала вірогідно вищий відсоток пацієнтів зі зниженим рівнем ХС ЛПВЩ, підвищеним рівнем ХС ЛПНЩ, підвищеним рівнем глюкози крові натще порівняно з групою з низьконормальним рівнем ТТГ. Група середнього віку з високонормальним рівнем ТТГ мала вірогідно вищий відсоток пацієнтів зі зниженим рівнем ХС ЛПВЩ та підвищеним рівнем ТГ, а також вірогідно більший відсоток пацієнтів із ГЛШ порівняно з групою відповідного віку з низьконормальним рівнем ТТГ. При порівнянні груп із високонормальним рівнем ТТГ середнього та літнього віку частота виявлення патологічних змін була більшою в останній групі, що вказує на негативний вплив вікових змін і одночасно потребує ретельного контролю функції ЩЗ у літніх людей з АГ.
5. У пацієнтів з АГ вплив рівня ТТГ на ІМТ залежить від віку. Так, у пацієнтів похилого віку вплив СГ і стану з високонормальним рівнем ТТГ на ІМТ виражений менше, ніж у пацієнтів середнього віку. Загалом, суттєвого зв’язку СГ і рівня ТТГ у межах референтних значень з ожирінням і надмірною МТ не встановлено, тому вплив СГ на фактори ризику реалізується не через збільшення МТ.
6. Наявність СГ пов’язана зі зниженням ШКФ у пацієнтів з АГ середнього та похилого віку, що може вказувати на роль цього стану в прогресуванні ХХН. Це потребує від лікаря контролю функції нирок у людей із гіпотиреозом, а також контролю функції ЩЗ в осіб з ураженням нирки, в тому числі при АГ.
7. Наявність СГ негативно впливає на психо-емоційний стан: асоціюється зі збільшенням частоти депресії у пацієнтів з АГ, частоти вегетативної дисфункції, що може відобразитись на якості контролю АТ.
8. У пацієнтів з АГ встановлено пряму кореляційну залежність між ТТГ і ІМТ (r = 0,46; p < 0,05), між ТТГ та ЗХС і ХС ЛПНЩ (r = 0,87; r = 0,84 відповідно, p < 0,05), між ТТГ та рівнем глюкози крові натще (r = 0,81; p < 0,05); а також зворотну залежність між ТТГ та ШКФ (r = 0,46; p < 0,05). Це може вказувати на роль зниження функції ЩЗ у збільшенні частоти і вираженості факторів серцево-судинного ризику і уражень органів-мішеней при АГ. Тому контроль стану ЩЗ у пацієнтів з АГ і високим кардіоваскулярним ризиком є обов’язковим.
Список литературы
1. Бакирова Н.М. Особенности течения артериальной гипертонии у пожилых больных с субклинической дисфункцией щитовидной железы: автореф. дис… канд. мед. наук. — Ижевск, 2013. — 21 с.
2. Бланкова З.Н. Гипотиреоз и сердечно-сосудистые заболевания / З.Н. Бланкова, Ф.Т. Агеев и др. // Новости медицины и фармации. — 2014. — № 512. — С. 5-13.
3. Будневский А.В. Качество жизни и особенности терапии субклинического гипотиреоза у больных ишемической болезнью сердца / А.В. Будневский, М.Ю. Каверзина // Прикладные информационные аспекты медицины. — 2014. — № 14(1). — С. 52-57.
4. Клінічні рекомендації з артеріальної гіпертензії Європейського товариства гіпертензії (ESH) та Європейського товариства кардіологів (ESC) 2013 року / Науковий редактор перекладу Сіренко Ю.М. // Артеріальна гіпертензія. — 2013. — № 4. — 160 с.
5. Левченко И.А. Субклинический гипотиреоз / И.А. Левченко, В.В. Фадеев // Проблемы эндокринологии. — 2002. — № 2. — С. 13-22.
6. Мельниченко Г.А. Субклинический гипотиреоз: проблемы лечения / Г.А. Мельниченко, В.В. Фадеев // Врач. — 2002. — № 7. — С. 41-43.
7. Мітченко О.І. Ранні маркери атеросклерозу в жінок з гіпертонічною хворобою та метаболічним синдромом на тлі субклінічного гіпотиреозу / О.І. Мітченко, Ю.В. Романов, М.В. Гвоздик // Український кардіологічний журнал. — 2014. — № 1. — С. 42-48.
8. Митник З.М. та ін. Стан ендокринологічної служби України в 2007 р. та перспективи розвитку медичної допомоги хворим з ендокринною патологією // Статистично-аналітичний довідник МОЗ України та Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин. — К., 2008. — С. 49.
9. НАМН України, ДУ «Національний науковий центр Інститут кардіології імені акад. М.Д. Стражеска». Хвороби системи кровообігу як медико-соціальна і суспільно-політична проблема (Аналітично-статистичний посібник). — К., 2014. — 279 с.
10. Смулевич А.Б. Психокардиология / А.Б. Смулевич, А.Л. Сыркин. — М.: Медицина, 2005. — 777 с.
11. Феськова А.А. Значение субклинического гипотиреоза в патогенезе заболеваний сердечно-сосудистой системы (обзор литературы) / А.А. Феськова, Е.С. Дробышева // Молодой ученый. — 2014. — № 17. — С. 207-210.
12 Брента Г. Сахарный диабет и щитовидная железа / Пер. О.И. Виноградской; под ред. В.В. Фадеева // Тиронет (Електронний ресурс). — 2011. — № 3.
13. Al Sayed. A Subclinical hypothyroidism is associated with early insulin resistance in Kuwaiti women / Al Sayed, Y. Abbas, E. Alfadhli // Endocrine Journal. — 2006. — № 53. — Р. 653-657.
14. Asvold B.O. The associationт between TSH within the reference range and serum lipid concentrations in a population-based study. The HUNT Study / Vatten L.J., Nilsen T.I., Bjoro T. // Eur. J. Endocrinol. — 2007. — № 156. — P. 181-186.
15. Boggio A. Is thyroid-stimulating hormone within the normal reference range a risk factor for atherosclerosis in women? / Boggio A., Muzio F., Fiscella M., Sommariva D., Branchi A. // Intern. Emerg. Med. — 2011. — 10.1007/11739-011-0743-z
16. Cabral M.D. Normal flow-mediated vasodilatation of the brachial artery and carotid artery intima-media thickness in subclinical hypothyroidism / Cabral M.D., Teixeira P.F., Silva N.A. et al. // Braz. J. Med. Biol. Res. — 2009. — № 42(5). — Р. 426-432.
17. Chiche F. Hypothyroidism is not associated with increased carotid atherosclerosis when cardiovascular risk factors are accounted for in hyperlipidemic patients / Chiche F., Jublanc C., Coudert M. et al. // Atherosclerosis. — 2009. — № 203(1). — Р. 269-276.
18. De Pergola G. Free triiodothyronine is associated with smoking habit, independently of obesity, body fat distribution, insulin, and metabolic parameters / De Pergola G., Ciampolillo A., Alo D., Sciaraffia M., Guida P. // J. Endocrinol. Invest. — 2006. — № 33. — Р. 815-818.
19. Fernandez-Real J.M. Thyroid function is intrinsically linked to insulin sensitivity and endothelium-dependent vasodilation in healthy euthyroid subjects / Fernandez-Real J.M., Lopez-Bermejo A., Castro A., Casamitjana R., Ricart W. // J. Clin. Endocrinol. Metab. — 2006. — № 91. — Р. 3337-3343.
20. Furong Wang Thyroid-Stimulating Hormone Levels within the Reference Range Are Associated with Serum Lipid Profiles Independent of Thyroid Hormones / Furong Wang, Yinyin Tan, Chenggang Wang J. et al. // Clin. Endocrinol. Metab. — 2012. — № 97(8). — Р. 2724-2731.
21. Canaris G.J. The Colorado Thyroid disease prevalence study / Canaris G.J., Manowitz N.R., Mayor G., Ridgway E.C. // Arch. Intern. Med. — 2000. — № 160. — Р. 526-534.
22. Garduno-Garcia Jde J. Hand free thyroxine concentrations are associated with differing metabolic markers in euthyroid subjects / Garduno-Garcia Jde J., Alvirde-Garcia U., Lopez-Carrasco G., Padilla Mendoza M.E., Mehta R. et al. // Eur. J. Endocrinol. — 2010. — № 163. — Р. 273-278.
23. Hak A.E. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam Study / Hak A.E., Pols H.A., Visser T.J., Drexhage H.A., Hofman A., Witteman J.C. // Ann. Intern. Med. — 2000. — № 132. — Р. 270-278.
24. Howland R.H. Thyroid dysfunction in refractory depression: implications for pathophysiology and treatment / R.H. Howland // J. Clin. Psychiatry. — 1993. — Vol. 54, № 2. — P. 47-54.
25. Joffe R.T., Levitt A.J. Major depression and subclinical (grade 2) hypothyroidism / R.T. Joffe, A.J. Levitt / Psychoneuroendocrinology. — 1992. — Vol. 17, № 2–3. — P. 215-221.
26. Kumar H.K. Association between thyroid hormones, insulin resistance, and metabolic syndrome / Kumar H.K., Yadav R.K., Prajapati J., Reddy C.V., Raghunath M., Modi K.D. // Saudi Med. J. — 2009. — № 30. — Р. 907-911.
27. Lu L. The correlation between thyrotropin and dyslipidemia in a population-based study / Lu L., Wang B., Shan Z., Jiang F., Teng X., Chen Y., Lai Y. et al. // J. Korean Med. Sci. — 2011. — № 26. — Р. 243-249.
28. McQuade C. Hypothyroidism and moderate subclinical hypothyroidism are associated with increased all-cause mortality independent of coronary heart disease risk factors / McQuade C., Skugor M., Brennan D.M., Hoar B., Stevenson C., Hoogwerf B.J. // Thyroid. — 2011. — Vol. 21. — Р. 837-843.
29. Park S.B. The relation of thyroid function to components of the metabolic syndrome in Korean men and women / Park S.B., Choi H.C., Joo N.S. // J. Korean Med. Sci. — 2011. — № 26. — P. 540-545.
30. Pearce E.N. Update in lipid alterations in subclinical hypothyroidism / E.N. Pearce // J. Clin. Endocrinol. Metab. — 2011. — Vol. 97. — Р. 326-333.
31. Posadas-Romero C. et al. Fatty liver largely explains associations of subclinical hypothyroidism with insulin resistance, metabolic syndrome, and subclinical coronary atherosclerosis // Eur. J. Endocrinol. — 2014 — Vol. 171(3). — Р. 319-325.
32. Rodondi N. Subclinical hypothyroidism and the risk of coronary heart disease and mortality / den Elzen W.P., Bauer D.C., Cappola A.R., Razvi S., Walsh J.P., Asvold B.O. et al.; Thyroid studies collaboration // JAMA. — 2012. — Vol. 304. — Р. 1365-1374.
33. Roos A. Thyroid function is associated with components of the metabolic syndrome in euthyroid subjects / Roos A., Bakker S.J., Links T.P., Gans R.O., Wolffenbuttel B.H. / J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — Р. 491-496.
34. Ruhla S. A high normal TSH is associated with the metabolic syndrome / Ruhla S., Weickert M.O., Arafat A.M., Osterhoff M., Isken F., Spranger J., Pfeiffer A.F., Mohlig M. // Clin. Endocrinol. (Oxf). — 2009. — Vol. 72. — Р. 696-701.
35. Sharma R. Subclinical hypothyroidism and its association with cardiovascularrisk factors / Sharma R., Sharma T.K., Kaushik G.G., Sharma S., Vardey S.K., Sinha M. // Clin. Lab. — 2011. — Vol. 57. — Р. 719-724.
36. Surks M.I. The thyrotropin reference range should remain unchanged / Surks M.I., Goswami G., Daniels G.H. // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90(9). — Р. 5489-5496.
37. Takashima N. Characterization of subclinical thyroid dysfunction from cardiovascular and metabolic viewpoints: the Suita study / Takashima N., Niwa Y., Mannami T. et al. // Circ. J. — 2007. — Vol. 71(2). — Р. 191-195.
38. Velkoska Nakova V. Dyslipidaemia and hypertension in patients with subclinical hypothyroidism / Velkoska Nakova V., Krstevska B., Bosevski M., Dimitrovski Ch., Serafimoski V. // Prilozi. — 2009. — Vol. 30. — Р. 93-102.
39. Vierhapper H. Low density lipoprotein cholesterol in subclinical hypothyroidism / Vierhapper H., Nardi A., Grosser P. еt al. // Thyroid. — 2000. — Vol. 10. — P. 981-984.
40. Volzke H. Are serum thyrotropin levels with in the reference range associated with endothelial function? / Volzke H., Robinson D.M., Spielhagen T., Nauck M., Obst A., Ewert R., Wolff B., Wallaschofski H., Felix S.B. // Eur. Heart J. — 2009. — Vol. 30. — P. 217-224.
41. Waring A.C. Thyroid function and prevalent and incident metabolic syndrome in older adults: the health, ageing and body composition study / Waring A.C., Rodondi N., Harrison S. et al. // Clin. Endocrinol. (Oxf). — 2012. — Vol. 76. — Р. 911-918.
42. Westerink J. Relation between thyroid-stimulating hormone and the occurrence of cardiovascular events and mortality in patients with manifest vascular diseases / Westerink J., van der Graaf Y., Faber D.R., Spiering W., Visseren F.L. // J. Clin. Endocrinol. Metab. — 2012. — Vol. 97(8). — P. 2724-2731.
43. D. John Betteridge. Lipids: Current Perspectives // CRC Press. — 1996. — 312 р.
44. Scott M. Grundy Atlas of Atherosclerosis and Metabolic Syndrome. — Springer Science & Business Media, 2011. — 314 р.
1.BakIrova N.M. Osobennosti techeniya arterialnoy gipertonii u pozhilyih bolnyih s subklinicheskoy disfunktsiey schitovidnoy zhelezyi.//Avtoreferat disertatsIYi na zdobuttya naukovogo stupenya kandidata medichnih nauk. – Izhevsk – 2013. – 21s.
2. Blankova Z.N., Ageev F.T.i dr. Gipotireoz i serdechno-sosudistyie zabolevaniya. // Novosti meditsinyi i farmatsii. – 2014. – #512. – s.5-13
3. Budnevskiy A. V., Kaverzina M. Yu. Kachestvo zhizni i osobennosti terapii subklinicheskogo gipotireoza u bolnyih ishemicheskoy boleznyu serdtsa. Prikladnyie informatsionnyie aspektyi meditsinyi. 2014; 14(1): 52-57.
4. KlInIchnI rekomendatsIYi z arterIalnoYi gIpertenzIYi Evropeyskogo tovaristva gIpertenzIYi (ESH) ta Evropeyskogo tovaristva kardIologIv (ESC) 2013 roku. Naukoviy redaktor perekladu SIrenko Yu.M.// ArterIalna gIpertenzIya. – 2013. – #4. – 160s.
5. Levchenko I.A., FadEEv V.V. Subklinicheskiy gipotireoz.// Problemyi endokrinologii. – 2002 – #2 . – c.13-22.
6. Melnichenko G.A. Subklinicheskiy gipotireoz: problemyi lecheniya//G.A.Melnichenko, Fadeev V.V./ Vrach – 2002 — #7 – S. 41-43.
7. MItchenko O.I., Romanov V.Yu., Gvozdik M.V. RannI markeri aterosklerozu v zhInok z gIpertonIchnoyu hvoroboyu ta metabolIchnim sindromom na tlI subklInIchnogo gIpotireozu.//UkraYinskiy kardIologIchniy zhurnal. – 2014. – #1. – s.42-48.
8. Mitnik Z.M. ta In. Stan endokrinologIchnoYi sluzhbi UkraYini v 2007 r. ta perspektivi rozvitku medichnoYi dopomogi hvorim z endokrinnoyu patologIEyu // Statistichno-analItichniy dovIdnik MOZ UkraYini ta UkraYinskogo naukovo-praktichnogo tsentru endokrinnoYi hIrurgIYi, transplantatsIYi endokrinnih organIv I tkanin. — K., 2008. — s.49
9. NAMN UkraYini, DU «NatsIonalniy naukoviy tsentr Institut kardIologIYi ImenI akad. M.D.Strazheska» Hvorobi sistemi krovoobIgu yak mediko-sotsIalna I suspIlno-polItichna problema. (AnalItichno-statistichniy posIbnik). – KiYiv – 2014. – 279s.
10. Smulevich A.B. Psihokardiologiya // A.B. Smulevich, A.L. Syirkin/ M., 2005., S.777
11. Feskova A. A. Znachenie subklinicheskogo gipotireoza v patogeneze zabolevaniy serdechno-sosudistoy sistemyi (obzor literaturyi) / A. A. Feskova, E. S. Drobyisheva // Molodoy uchenyiy. — 2014. — #17. — S. 207-210.
12. Gabriela Brenta Saharnyiy diabet i schitovidnaya zheleza Perevod O.I. Vinogradskoy, pod redaktsiey V.V. Fadeeva// Zhurnal Tironet, 2011,#3;
13. Al Sayed A, Al Ali N, Bo Abbas Y, Alfadhli E. Subclinical hypothyroidism is associated with early insulin resistance in Kuwaiti women. Endocrine Journal 2006;53:653–657.
14. Asvold BO, Vatten LJ, Nilsen TI, Bjoro T 2007 The associationт between TSH within the reference range and serum lipid concentrations in a population-based study. The HUNT Study. Eur J Endocrinol 156:181.186
15. Boggio A, Muzio F, Fiscella M, Sommariva D, Branchi A 28 December 2011 Is thyroid-stimulating hormone within the normal reference range a risk factor for atherosclerosis in women? Intern Emerg Med doi: 10.1007/s11739-011-0743-z
16. Cabral M.D., Teixeira P.F., Silva N.A. et al. Normal flow-mediated vasodilatation of the brachial artery and carotid artery intima-media thickness in subclinical hypothyroidism. //Braz. J. Med. Biol. Res. – 2009. – 42(5): 426-432.
17. Chiche F., Jublanc C., Coudert M. et al. Hypothyroidism is not associated with increased carotid atherosclerosis when cardiovascular risk factors are accounted for in hyperlipidemic patients..// Atherosclerosis. – 2009. – 203(1): 269.276.
18. De Pergola G, Ciampolillo A, Alo` D, Sciaraffia M, Guida P 2010 Free triiodothyronine is associated with smoking habit, independently of obesity, body fat distribution, insulin, and metabolic parameters. J Endocrinol Invest 33:815-818.
19. Fernandez-Real JM, Lo. pez-Bermejo A, Castro A, Casamitjana R, Ricart W 2006 Thyroid function is intrinsically linked to insulin sensitivity and endothelium-dependent vasodilation in healthy euthyroid subjects. J Clin Endocrinol Metab 91:3337–3343
20. Furong Wang, Yinyin Tan, Chenggang Wang,J et al. Thyroid-Stimulating Hormone Levels within the Reference Range Are Associated with Serum LipidProfiles Independent of Thyroid Hormones//Clin Endocrinol Metab – 2012 – №97(8):2724–2731
21. Canaris G. J., Manowitz N. R., Mayor G., Ridgway E. C. The Colorado Thyroid disease prevalence study. Arch. Intern. Med. 2000;160: 526–534.
22. Gardun˜ o-Garcia Jde J, Alvirde-Garcia U, Lo. pez-Carrasco G, Padilla Mendoza ME, Mehta R, Arellano-Campos O, Choza R, Sauque L, Garay-Sevilla ME, Malacara JM, Gomez-Perez FJ, Aguilar-Salinas CA2010TS Hand free thyroxine concentrations are associated with differing metabolic markers in euthyroid subjects. Eur J Endocrinol 163:273-278.
23. Hak A. E., Pols H. A., Visser T. J., Drexhage H. A., Hofman A., Witteman J. C. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam Study. Ann. Intern. Med. 2000; 132: 270-278.
24. Howland R.H. Thyroid dysfunction in refractory depression: implications for pathophysiology and treatment. // J Clin Psychiatry. - 1993. - Vol. 54, № 2. - P. 47-54.
25. Joffe R. T., Levitt A. J. Major depression and subclinical (grade 2) hypothyroidism. // Psychoneuroendocrinology. - 1992. - Vol.17, № 2 - 3.- P. 215-221.
26. Kumar HK, Yadav RK, Prajapati J, Reddy CV, Raghunath M, Modi KD2009 Association between thyroid hormones, insulin resistance, and metabolic syndrome. Saudi Med J 30:907-911.
27. Lu L, Wang B, Shan Z, Jiang F, Teng X, Chen Y, Lai Y, Wang J, Xue H, Wang S, Li C, Liu H, Li N, Yu J, Shi L, Hou X, Xing Q, Bai X, Teng W 2011 The correlation between thyrotropin and dyslipidemia in a population-based study. J Korean Med Sci 26:243-249.
28. McQuade C, Skugor M, Brennan DM, Hoar B, Stevenson C, Hoogwerf BJ 2011 Hypothyroidism and moderate subclinical hypothyroidism are associated with increased all-cause mortality independentof coronary heart disease risk factors: a PreCIS database study. Thyroid 21:837-843.
29. Park SB, Choi HC, Joo NS 2011 The relation of thyroid function to components of the metabolic syndrome in Korean men and women. J Korean Med Sci 26:540-545.
30. Pearce EN 2012 Update in lipid alterations in subclinical hypothyroidism. J Clin Endocrinol Metab 97:326-333.
31. Posadas-Romero C et al. Fatty liver largely explains associations of subclinical hypothyroidism with insulin resistance, metabolic syndrome, and subclinical coronary atherosclerosis.// Eur J Endocrinol. 2014 – 171(3):319-25
32. Rodondi N, den Elzen WP, Bauer DC, Cappola AR, Razvi S, Walsh JP, Asvold BO, Iervasi G, Imaizumi M, Collet TH, Bremner A, Maisonneuve P, Sgarbi JA, Khaw KT, Vanderpump MP, Newman AB, Cornuz J, Franklyn JA, Westendorp RG, Vittinghoff E, Gussekloo J 2010 Thyroid studies collaboration. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA 304:1365–1374
33. Roos A, Bakker SJ, Links TP, Gans RO, Wolffenbuttel BH 2007 Thyroid function is associated with components of the metabolic syndrome in euthyroid subjects. J Clin Endocrinol Metab 92:491–496
34. Ruhla S, Weickert MO, Arafat AM, Osterhoff M, Isken F, Spranger J, Scho. fl C, Pfeiffer AF, Mo. hlig M 2010 A high normal TSH is associated with the metabolic syndrome. Clin Endocrinol (Oxf) 72: 696–701
35. Sharma R, Sharma TK, Kaushik GG, Sharma S, Vardey SK, SinhaM 2011 Subclinical hypothyroidism and its association with cardiovascularrisk factors. Clin Lab 57:719–72
36. Surks MI, Goswami G, DanielsGH 2005 The thyrotropin reference range should remain unchanged. J Clin Endocrinol Metab 90:5489–5496
37. Takashima N., Niwa Y., Mannami T. et al. (2007) Characterization of subclinical thyroid dysfunction from cardiovascular and metabolic viewpoints: the Suita study. Circ. J., 71(2): 191–195.
38. Velkoska Nakova V, Krstevska B, Bosevski M, Dimitrovski Ch, Serafimoski V 2009 Dyslipidaemia and hypertension in patients with subclinical hypothyroidism. Prilozi 30:93–102
39. Vierhapper H., Nardi A., Grosser P., et al. Lowdensity lipoprotein cholesterol in subclinical hypothyroidism. // Thyroid. – 2000. – Vol. 10. – P. 981-984.
40. Volzke H, Robinson DM, Spielhagen T, Nauck M, Obst A, Ewert R, Wolff B, Wallaschofski H, Felix SB, Do. rr M 2009 Are serum thyrotropin levels within the reference range associated with endothelial function?// Eur Heart J – 2009 – Vol.30:217-224.
41. Waring AC, Rodondi N, Harrison S, Kanaya AM, Simonsick EM, Miljkovic I, Satterfield S, Newman AB, Bauer DC. Thyroid function and prevalent and incident metabolic syndrome in older adults: the health, ageing and body composition study.// Clin Endocrinol (Oxf) 2012;76:911-918.
43. Westerink J, van der Graaf Y, Faber DR, Spiering W, Visseren FL Relation between thyroid-stimulating hormone and theoccurrence of cardiovascular events and mortality in patients with manifest vascular diseases. //J Clin Endocrinol Metab – 2012 – 97(8):2724-2731.
D. John Betteridge Lipids: Current Perspectives// CRC Press – 1996 – P. 312
44. Scott M. Grundy Atlas of Atherosclerosis and Metabolic Syndrome// Springer Science& Business Media – 2011 – P. 314.

/72.jpg)
/73.jpg)
/74.jpg)
/75.jpg)