Статтю опубліковано на с. 87-91
Роботу виконано в рамках науково-дослiдної роботи Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ.
Вступ
Проблема остеопорозу стає все більш актуальною у зв’язку з повсюдним збільшенням тривалості життя. Збільшення кількості осіб похилого віку супроводжується зростанням частоти метаболічних захворювань, серед яких остеопороз займає провідне місце. Прогнозована кількість випадків перелому шийки стегна — найтяжчого ускладнення остеопорозу у всьому світі збільшиться з 1 700 000 (на 1990 р.) до 8 200 000 у 2050 р. за умови, що частота таких випадків із віком підвищується на 1 % щорічно [1]. У жінок європеоїдної раси ризик перелому шийки стегна протягом життя становить 1 : 6, що вище, ніж ризик розвитку раку молочної залози (1 : 9) [2]. Переломи проксимального відділу стегнової кістки збільшують смертність на 6–37 % залежно від попереднього стану здоров’я пацієнта. Результати великих багатоцентрових досліджень SOF (Study of Fractures) і EPOS (Europian Prospective Osteoporosis Study) показали, що значним збільшенням смертності супроводжуються і переломи хребта. Проведені в Україні дослідження показали, що летальність серед пацієнтів з остеопоротичними переломами проксимального відділу стегнової кістки впродовж двох років становить 18,6 %; 47 % пацієнтів зазначеної групи помирають протягом перших шести місяців після виникнення перелому [3]. Крім цього, на тлі збільшення тривалості життя зростатимуть й економічні витрати на лікування ускладнень остеопорозу, що включають не тільки госпіталізацію внаслідок переломів, а й соціальні витрати. Наявність цукрового діабету (ЦД) 2-го типу і менопаузи у хворих значно погіршує прогноз для пацієнтів. Наявність коморбідної патології пов’язана не тільки з підвищенням смертності від загальних причин, а й з підвищеним ризиком виникнення переломів, який вдвічі вищий від даного показника в загальній популяції [2, 4–8].
Мета — дослідження впливу цукрового діабету на фосфорно-кальцієвий обмін у постменопаузних жінок залежно від типу та тривалості хвороби, терміну менопаузи, маси тіла та виду цукрознижуючої терапії.
Матеріали та методи
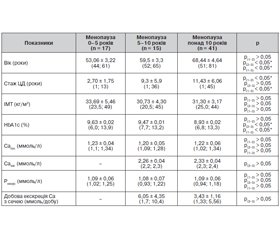
Нами було обстежено 86 жінок, хворих на ЦД 1-го типу (13 пацієнток) та ЦД 2-го типу (73 пацієнтки). Критеріями виключення були наявність тяжких соматичних захворювань, що впливають на фосфорно-кальцієвий обмін (хронічна ниркова недостатність, анемія тяжкого ступеня тощо). Також були виключені хворі із протеїнуричною стадією нефропатії. У період обстеження пацієнтки не отримували лікарських засобів, що були здатні впливати на стан мінеральної щільності кісткової тканини (МЩКТ). Тривалість захворювання у жінок із ЦД 2-го типу становила в середньому 9,6 року, середній вік у хворих вказаної групи — 63 роки; тривалість ЦД 1-го типу відповідно у середньому становила 12,8 року, середній вік — 33,1 року (табл. 1). Середній вік у групі жінок із тривалістю менопаузи менше 5 років становив 53,1 року, із тривалістю менопаузи від 5 до 10 років — 59,5 року, із тривалістю менопаузи понад 10 років — 68,4 року. Відповідно до розподілу тривалість ЦД 2-го типу у першій групі становила в середньому 2,7 року, у другій групі — 9,3 року, у третій групі — 11,4 року (табл. 2). Вивчалися анамнез захворювання, особливості перебігу ЦД, вік, коли був верифікований ЦД. Оцінювали ступінь компенсації ЦД, тривалість менопаузи.
/88.jpg)
Разом із типовою для ЦД симптоматикою активно виявляли скарги з боку кісткової системи. Приділялась увага способу життя пацієнтів, дотриманню режиму лікування згідно з рекомендаціями ендокринолога, особливостям харчування, фізичної активності, наявності шкідливих звичок (тютюнопаління, вживання алкоголю). Хворі отримували терапію пероральними цукрознижуючими препаратами (метформін, препарати сульфонілсечовини) або комбіновану терапію (інсулінотерапія та пероральні цукрознижуючі препарати). Розраховували індекс маси тіла (ІМТ). Рівень компенсації вуглеводного обміну визначали за глікованим гемоглобіном (НbА1с). Стан кальцієво-фосфорного обміну оцінювали за показниками вмісту в крові загального кальцію (Сазаг.), іонізованого кальцію (Саіон.), неорганічного фосфору (Рнеорг.) і показниками екскреції кальцію з сечею за добу. Вміст загального кальцію визначали спектрометричним методом із метилтимоловим синім на біохімічному аналізаторі Sapphire-400 (Японія) за допомогою стандартних наборів. Іонізований кальцій визначали іоноселективним методом на апараті Easylyte Calcium (США) із використанням референтного електрода для кальцію іонізованого. Неорганічний фосфор визначали спектрометричном методом із фосфор-молібденом на апараті Cobas e411 з використанням реагентів Elitech diagnostics (Франція). Глікований гемоглобін визначали методом високошвидкісної рідинної хроматографії. Добову екскрецію кальцію в сечі вивчали за допомогою прямого колориметричного комплексометричного тесту з реактивом арсеназо ІІІ на апараті Sapphire-400 (Японія).
Статистичну обробку отриманих результатів проводили методом варіаційної статистики. Вірогідність різниць (р) оцінювали за критерієм Стьюдента. Результати досліджень визнавали вірогідними у випадках, коли показник не перебільшував 0,05.
Результати
Результати дослідження впливу типу ЦД на деякі показники фосфорно-кальцієвого обміну подані в табл. 1. Вірогідними визначені різниця у віці та в ІМТ у бік їх збільшення, що обумовлено особливістю нозології, гірша компенсація вуглеводного обміну при ЦД 2-го типу на тлі нормальних показників іонізованого кальцію сироватки в жінок обох груп (min 1,0; max 1,29 при ЦД 1-го типу; min 1,02; max 1,36 при ЦД 2-го типу). Концентрація неорганічного фосфору сироватки в жінок із ЦД 2-го типу також не виходила за межі норми (min 0,93; max 1,22).
Порушення фосфорно-кальцієвого обміну при ЦД спостерігається на різних стадіях розвитку захворювання, однак відомості про характер та ступінь вираженості цих порушень мають суперечливий характр. Зокрема, існують дані щодо виявлення в цих пацієнтів нормокальціємії та нормофосфоремії [9], що узгоджується з отриманими нами результатами вивчення іонізованого кальцію та неорганічного фосфору сироватки крові при ЦД 1-го та 2-го типу.
Вплив конституційних чинників на показники МЩКТ у загальній популяції добре вивчений різними авторами. Вік є найважливішою детермінантою, що визначає щільність кісткової тканини. Період росту та розвитку, що характеризується наростанням МЩКТ, завершується у 20–30 років досягненням пікової (максимальної) кісткової маси. Далі, після 40 років, розпочинається поступове зниження МЩКТ зі швидкістю 1–2 % за рік, що продовжується до глибокої старості. Інші фактори, такі як рання менопауза, аменорея, дієта з малим вмістом кальцію, захворювання кишечника, довготривале використання кортикостероїдів, спадковість, паління, зловживання алкоголем та кавою, малорухомий спосіб життя, низька маса тіла, також впливають на темпи розвитку зниження щільності кісткової маси. У пацієнтів із ЦД 1-го типу вже із дитячого віку пікова кісткова маса значно менша, ніж у здорових осіб. Тому вони мають низьку стартову точку, від якої розпочинається обумовлена віковими змінами втрата кісткової речовини. Із досліджених нами 13 пацієнток із ЦД 1-го типу у 6 ЦД був верифікований у дитячому віці. Однак, незважаючи на цей факт, рівні іонізованого кальцію в обох групах були практично однаковими, що вказує на можливий протекторний ефект інсулінотерапії на МЩКТ.
Результати дослідження впливу тривалості менопаузи на показники фосфорно-кальцієвого обміну в жінок із ЦД 2-го типу наведені в табл. 2.
Показано, що вік та анамнестичні дані тривалості ЦД 2-го типу в пацієнток досліджуваних груп розподіляються відповідно до періоду менопаузи. А найбільший показник ІМТ і середній рівень HbA1c спостерігалися в групі пацієнток із меншою тривалістю менопаузи. Різниця вмісту загального та іонізованого кальцію та неорганічного фосфору між досліджуваними групами не була вірогідною, концентрація іонів у сироватці крові перебувала в межах фізіологічної норми. Можливо, ініційована цукрознижуюча терапія (інсулінотерапія та/чи секретагоги й інсуліносенситайзери) нівелює вікові зміни МЩКТ.
Результати дослідження показників фосфорно-кальцієвого обміну в жінок із ЦД 2-го типу залежно від тривалості ЦД наведені в табл. 3.
Обговорення
Згідно з отриманими даними, вірогідна різниця між досліджуваними показниками визначалася щодо віку, тривалості ЦД та менопаузи, при цьому ІМТ та ступінь компенсації ЦД були праткично однаковими. Концентрації в сироватці крові загального кальцію, іонізованого кальцію, неорганічного фосфору перебували в межах фізіологічних коливань та не відрізнялися між групами обстежених жінок. Добова екскреція кальцію з сечею в жінок другої групи була в межах норми, проте деякі індивідуальні показники перевищували норму або були нижчими (min 1,33; max 10,4; норма 2,5–7,5 ммоль/добу).
Згідно з даними літератури, доказаний взаємо-зв’язок між тривалістю ЦД 2-го типу та збільшенням ризику переломів [10], але без дослідження впливу виду цукрознижуючої терапії на стан МЩКТ та/чи фосфорно-кальцієвий обмін у постменопаузних жінок із ЦД 2-го типу.
Відповідно до припущення авторів на розвиток остеопорозу при лікуванні пацієнта із ЦД може впливати застосування інсулінотерапії. Результати дослідження показників фосфорно-кальцієвого обміну в жінок із ЦД 2-го типу залежно від виду цукрознижуючої терапії подано в табл. 4.
За власними даними, у групах порівняння рівень HbA1c вірогідно не відрізнявся, пацієнтки обох груп мали близькі показники екскреції кальцію, рівень загального та іонізованого кальцію, неорганічного фосфору сироватки крові. Отже, цукрознижуюча терапія (інсулінотерапія та/чи пероральні цукрознижуючі препарати), можливо, позитивно впливає на оновлення білкової матриці кістки та дозволяє потенційно зменшувати ризик виникнення переломів у жінок постменопаузного віку із ЦД 2-го типу.
Висновки
1. Рівень іонізованого кальцію не може слугувати головним маркером стану фосфорно-кальцієвого обміну та МЩКТ у жінок постменопаузного віку, хворих на ЦД 1-го та 2-го типу за умов відсутності тяжкої хронічної ниркової недостатності та відповідної коморбідної патології.
2. Вид цурознижуючої терапії (бігуаніди, похідні сульфонілсечовини, інсулінотерапія) та маса тіла не впливають на показники фосфорно-кальцієвого обміну при лікуванні ЦД 2-го типу в постменопаузних жінок різного віку.
Конфлікт інтересів. Автори гарантують вiдсутнiсть конфлiкту iнтересiв та власної фiнансової зацiкавленостi при виконаннi роботи та написаннi статтi.
Список литературы
1. Sambrook P., Cooper C. Age-specific and sex-specific incidence of radiographic vertebral, hip and distal forearm fractures // Lancet. — 2006. — Vol. 367. — P. 2010-2018.
2. Van Staa T.P., Dennison E.M., Leufkens H.E., Cooper C. Epidemiology of fractures in England and Wales // Bone. — 2001. — Vol. 29. — P. 517-522.
3. Povoroznjuk V.V., Dzerovich N.I., Karasevskaya T.A. Bone mineral density in Ukrainian women of different age // Annals of the New York Academy of Sciences. — 2007. — Vol. 1119. — Р. 243-252.
4. Fucumoto S. Updates on lifestyle-related diseases and bone metabolism // Clin. Calcium. — 2014. — Vol. 24(11). — P. 1701-5. — doi: CliCa141117011705.
5. Adil C., Aydin T., Taşpınar Ö. et al. Bone mineral density evaluation of patients with type 2 diabetes mellitus // J. Phys. Ther. Sci. — 2015. — Vol. 27(1). — P. 179-182. — doi: 10.1589/jpts.27.179. Epub 2015 Jan 9.
6. Leidig-Bruckner G., Grobholz S., Bruckner T. et al. Prevalence and determinants of osteoporosis in patients with type 1 and type 2 diabetes mellitus // BMC Endocr. Disord. — 2014. — Apr 11. — P. 14-33. — doi: 10.1186/1472-6823-14-33.
7. Ogata M., Ide R., Takizawa M. et al. Association between basal metabolic function and bone metabolism in postmenopausal women with type 2 diabetes // Nutrition. — 2015. — Vol. 31(11–12). — P. 1394-1401. — doi: 10.1016/j.nut.2015.06.012.
8 .Kurra S., Siris E. Diabetes and bone health: the relationship between diabetes and osteoporosis-associated fractures // Diabetes Metab. Res. Rev. — 2011. — Vol. 27(5). — P. 430-435. — doi: 10.1002/dmrr.1197.
9. МcNair P., Christiansen M.S., Madsbad S. et al. Hypoparathyroidism in diabetes mellitus // Acta Endocrinol. — 1991. — Vol. 96. — P. 81-86.
10. Yamamoto M., Yamaguchi T., Nawata K. et al. Decreased PTH levels accompanied by low bone formation are associated with vertebral fractures in postmenopausal women with type 2 diabetes // Clin. Endocrinol. Metab. — 2012. — Vol. 97(4). — P. 1277-1284. — doi: 10.1210/jc.2011-2537. Epub 2012 Feb 15.

/88.jpg)
/90.jpg)