Статтю опубліковано на с. 65-75
Тиреоїдні вузли та пухлини є одними з найпоширеніших захворювань не тільки щитоподібної залози (ЩЗ), а й організму людини в цілому. Питання належної діагностики та адекватного лікування продовжує викликати надзвичайний інтерес усіх авторитетних світових наукових асоціацій та товариств. Це викликано не тільки суто медичним аспектом проблеми, але й соціально-економічною її складовою. Адже дрібновогнищеве ураження щитоподібної залози, яке не загрожує здоров’ю та життю, можна виявити майже в усіх дорослих людей, що викликає слушне запитання: чи не різновидом норми є такий стан організму? З іншого боку, реальна поширеність мікрокарцином (переважно папілярного раку ЩЗ розміром менше від 10 мм) є набагато вищою за офіційну статистику та може становити 3–5 % від чисельності населення, темпи зростання поширеності є найбільшими серед усієї онкопатології, цей різновид раку погрожує стати найпоширенішим у жінок, він є потенційно смертельною хворобою, хоча й не має клінічних відмінностей від доброякісних та безпечних тиреоїдних вузлів, а ризик смерті пов’язаний лише з 1 % пухлин. У США щороку діагностується понад 60 тисяч нових випадків тиреоїдного раку, витрачаються десятки мільярдів доларів на вивчення проблеми, лікування та моніторинг пролікованих пацієнтів, але кількість померлих не зростає протягом останніх десятиріч та становить 3–5 на мільйон населення. Медицина та суспільство постали перед питанням, як позбавити людину ризиків, пов’язаних із онкологічною складовою диференційованого раку (ДР) ЩЗ (ДР ЩЗ), не завдавши їй шкоди через надлишкове (або й зовсім непотрібне) обстеження та лікування.
В останньому номері найбільш авторитетного світового журналу з проблем патології ЩЗ Thyroid за 2015 рік оприлюднені новітні рекомендації Американської тиреоїдної асоціації (АТА) щодо діагностики та лікування дорослих із вузлами та диференційованим раком ЩЗ, що були підготовлені групою американських фахівців із залученням спеціалістів з Канади, Франції та Італії [1]. Рекомендації доступні в електронному вигляді, вони розіслані для схвалення цілій низці національних товариств та асоціацій (в тому числі Українській асоціації ендокринних хірургів), тому є змога ознайомити з їх змістом українську аудиторію, зацікавлених лікарів та пацієнтів.
Після виходу в світ оновлених (2009 р.) рекомендацій АТА щодо лікування тиреоїдних вузлів та ДР ЩЗ минуло 6 років, за які відбулися суттєві зміни як у розумінні патогенезу цих захворювань, так і в міцній доказовій базі щодо ефективності окремих видів діагностичних та лікувальних заходів [2]. Продовжує швидко зростати захворюваність на ДР ЩЗ — від 37 200 нових випадків у США на момент виходу попередніх рекомендацій у 2009 році до 63 000 випадків у 2014 році (14,5 на 100 000 населення). Проте це зростання викликано переважно маленькими папілярними формами раку — менше від 1 см у діаметрі, які виявлялися у 1989 році у 25 % випадків, а в 2009 році — у 39 %.
Оскільки ЩЗ розташована поверхнево, вона є добре доступною для візуалізації за допомогою ультразвукового дослідження (УЗД). Сучасна апаратура дає змогу розпізнавати вузли розміром всього 1–2 мм та проводити їх біопсію для виключення раку. Та постає інше питання: чи взагалі слід це робити?
Виявилось, що агресивна діагностична тактика, направлена на виявлення вузлів у ЩЗ за допомогою скринінгового ультразвукового сканування шиї, призводить до виявлення величезного числа вогнищевих утворень, більшість з яких не становлять жодної загрози для життя та здоров’я пацієнта. Зокрема, при автопсійному дослідженні в 10–30 % хворих, які померли від будь-яких причин, знаходять прихований ДР ЩЗ, але клінічно значущим цей рак стає не більше ніж в одному випадку на 1000 мікрокарцином. Загалом ризик для життя існує не більше ніж у 10 % пацієнтів зі встановленим діагнозом раку ЩЗ. Але, не маючи змоги спрогнозувати поведінку пухлини в подальшому, лікарі піддають більшість таких пацієнтів радикальному та досить травматичному хірургічному лікуванню — тиреоїдектомії. Більш того, трапляються випадки, коли тиреоїдектомію виконують помилково при відсутності малігнізації вузла, про що стає відомо лише під час заключного гістологічного дослідження операційного матеріалу. Склалася парадоксальна ситуація, коли велика кількість пацієнтів зазнає більшого ризику ускладнень від лікування, ніж від самої хвороби. Отже, говорячи про вогнищеву патологію ЩЗ, можна з упевненістю стверджувати, що розвиток візуалізуючих діагностичних технологій значно випереджує потребу в цьому. Крім впливу на життя та здоров’я пацієнта, агресивна діагностична та лікувальна тактика вогнищевих утворень ЩЗ призводить до значного збільшення видатків для системи охорони здоров’я. Прогнозується, що до 2019 р. щорічні витрати на спостереження та лікування раку ЩЗ в США зростуть із теперішніх 3,5 до 20 млрд доларів. Це дуже великі кошти навіть для США, не кажучи вже про Україну, з огляду на те, що смертність від ДР ЩЗ становить лише 3–5 випадків на 1 млн населення та не зростає останніми десятиріччями.
Беручи до уваги низьку вірогідність швидкого прогресування раку ЩЗ, японські вчені ще у 2010 році переглянули традиційні підходи до лікування даної патології. Поштовхом до впровадження таких змін у тактиці лікування стали результати тривалих спостережень (протягом більше ніж десять років) на групі з більше ніж 1200 хворих з ДР ЩЗ, які продемонстрували, що тільки 5–6 % пацієнтів за такий значний період часу демонструють ознаки прогресування раку ЩЗ і потребують хірургічного лікування. При цьому частота рецидивів після операції серед пацієнтів, яким виконали хірургічне лікування через 3–10 років після встановлення діагнозу раку ЩЗ, виявилася такою ж, як і при невідкладному лікуванні. Отже, при застосуванні очікувальної тактики в 94 % випадків оперативне втручання не було потрібне, а в разі необхідності його проведення прогноз виживаності пацієнтів не погіршувався. У результаті в Японії були затверджені національні клінічні рекомендації, що передбачають можливість спостереження за пацієнтами з високодиференційованими мікрокарциномами, що не мають ознак агресивного росту й метастазів у лімфовузли шиї. Зараз це стосується хворих віком понад 60 років із розмірами пухлини до 1 см. Більш агресивний перебіг ДР ЩЗ у дітей та більші ризики застосування радіоактивного йоду з огляду на можливість розвитку інших злоякісних пухлин у майбутньому стали основними викликами для прийняття окремих рекомендацій АТА для дітей, які вже опубліковані в 2015 році [3].
Отже, на сьогодні візуалізація вузлів ЩЗ та лімфатичних вузлів шиї не є проблемою. Більш актуальне завдання — диференціювати безпечні інтратиреоїдні вузлики від ракових пухлин ЩЗ, а в разі підтвердження діагнозу онкологічного захворювання — відрізнити пухлину, що становить собою безпечне повільно зростаюче новоутворення, від агресивного, що становить загрозу для життя.
Вирішити ці завдання дозволяє генетичне дослідження цитологічного матеріалу. Нещодавно на ринку розвинених країн з’явились набори для молекулярно-біологічних і генетичних досліджень утворень ЩЗ — «панель найбільш частих мутацій, що призводять до раку ЩЗ» (Mutational analysis panel) і «класифікатор експресії генів» (Gene expression classifier). Перший включає в себе комплекс реагентів для виявлення в пункційному матеріалі вузла ЩЗ семи найбільш поширених онкогенних мутацій: KRAS, BRAF, HRAS, NRAS, RET/PTC1, RET/PTC3 та PAX8/PPARγ, що випускається серійно у вигляді комерційних наборів AFIRMA. Другий передбачає визначення експресії 167 найбільш відповідальних за тиреоїдний канцерогенез генів з розрахунком специфічного генетичного профілю також шляхом застосування стандартизованого набору. Якщо мають місце дві та більше мутації, ризик агресивного раку вважається високим, що вимагає застосування активної лікувальної тактики. Виявлення найбільш частих мутацій на практиці дозволяє вдвічі зменшити кількість невиправданих оперативних втручань на ЩЗ. При поєднанні обох методів точність діагностики зростає. Через високу вартість ці дослідження поки що є малодоступними, але, без сумніву, за ними майбутнє. На сьогодні їх починають активно впроваджувати в країнах із розвиненою страховою медициною (США, країни Європи). Більш того, за останній рік з’явилися повідомлення про підвищення точності (насамперед специфічності) генетичних методів діагностики раку за рахунок розширення панелі мутацій з 7 до 15 — новий набір реагентів дозволяє з точністю 92 % встановлювати діагноз раку серед тиреоїдних вузлів шляхом пункційної біопсії з подальшою молекулярною діагностикою.
Що стосується лікувального етапу в контролі над ДР ЩЗ, то тут триває дискусія навколо необхідності виконання у всіх випадках папілярного та фолікулярного раку ЩЗ тотальної тиреоїдектомії, центральної дисекції шиї, а також визначення показань до латеральної дисекції лімфатичних колекторів шиї. Предметом суперечок є не стільки користь від агресивного хірургічного лікування, скільки ризик специфічних хірургічних ускладнень, насамперед пошкоджень гортанних нервів та прищитоподібних залоз. Доцільність такого диспуту підтверджується відомостями про те, що велика частка операцій із приводу ДР ЩЗ виконується малодосвідченими хірургами (кількість щорічних операцій, які виконуються ними, не перевищує 5–10), навіть у США та Канаді. Накопичено чимало доказів негативної побічної дії радіоактивного йоду — не тільки пошкодження слинних залоз та зубів, а й зростання частоти інших онкологічних захворювань (лейкози, рак сечового міхура, легень, молочних залоз, слинних залоз) протягом життя пацієнта. Не припиняються пошуки ефективних таргетних препаратів (переважно мультикіназних інгібіторів), націлених на обрив молекулярних шляхів прогресування ракової пухлини.
Усі ці дані стимулювали визначення найбільш важливих клінічних питань, на які авторитетні фахівці міжнародної робочої групи, спираючись на світовий досвід та об’єктивні факти доказової медицини, спробували дати відповідь у новітніх рекомендаціях АТА. Вони мають стати основним настановчим документом для ендокринологів, хірургів, сімейних лікарів, що прийде на зміну відомим об’єднаним рекомендаціям Американської асоціації клінічних ендокринологів і ендокринних хірургів, Європейської тиреоїдної асоціації та Італійської асоціації клінічних ендокринологів, що були оприлюднені 2010 року [4]. Ці документи не стосуються медулярного раку ЩЗ, що походить із С-клітин-тиреоцитів. Окремі оновлені настанови з діагностики, лікування, моніторингу медулярного раку ЩЗ вийшли також нещодавно під егідою АТА, вони були оприлюднені у 2015 році [7].
Усього новітні настанови АТА містять 101 рекомендацію, що розподілені на 3 підрозділи (А — стосуються тиреоїдних вузлів, рекомендації 1–31; В — стосуються початкового лікування диференційованого раку ЩЗ, рекомендації 32–61; С — визначають оптимальні режими тривалого моніторингу та лікування персистенції або рецидивів раку, рекомендації 62–101). Окремий підрозділ D стосується визначення основних напрямків досліджень у майбутньому. Як завжди, рекомендації містять інформацію щодо їх сили (сильна, слаба, відсутня) та якості доказової бази (висока, помірна, низька якість).
Не ставлячи за мету повністю висвітлити всі аспекти нових рекомендацій АТА (матеріал викладено на 411 сторінках!), хотілося б ознайомити лікарів і пацієнтів хоча б із найбільш важливими моментами цього документу.
Виникає певний конфлікт між існуючими рекомендаціями Європейської тиреоїдної асоціації (ЕТА‑2006 [5]), за якими вже звикли працювати вітчизняні фахівці [6], та новими рекомендаціями АТА‑2015 [1]. Останні є набагато ліберальнішими за низкою визначень:
1) показання до пункційної біопсії звужуються та залежать переважно від сонографічної картини (за ЕТА — будь-який вузол понад 1 см або менший у групах ризику);
2) показання до хірургічного втручання за ознак цитологічної підозри на рак або атипії тиреоїдного епітелію (за АТА‑2015 припускається можливість спостереження без операції навіть при доведеному неагресивному варіанті ДР ЩЗ, не кажучи вже про 3–4-й класи системи Bethesda‑2009);
3) показання до виконання тотальної тиреоїдектомії (за ЕТА‑2006 — для будь-якого раку ЩЗ, а за АТА‑2015 можливість лобектомії зберігається для неагресивного тиреоїдного раку T1-2N0M0);
4) показання до центральної та латеральної дисекції лімфатичних колекторів шиї (за АТА‑2015 — тільки при доведених цитологічно або гістологічно метастазах, мікрометастази центральної групи не вважаються загрозливими для життя);
5) показання до застосування лікувальних активностей радіоактивного йоду‑131 (за ЕТА‑2006 його можна було уникнути тільки в групі дуже низького ризику — солітарна інтратиреоїдна мікрокарцинома без метастазів у пацієнтів віком понад 18 років, а за АТА‑2015 — навіть при інтратиреоїдній пухлині менше від 4 см або мікрометастазах папілярного раку ЩЗ до центральної групи лімфатичних вузлів можна утриматись від призначення радіойод-абляції);
6) показання до супресивної терапії та цільові рівні ТТГ при застосуванні супресивної терапії препаратами тироксину у хворих різних категорій ризику (АТА наголошує на ретельній оцінці серцево-судинних ризиків при лікуванні тироксином навіть у групах пацієнтів із поганим прогнозом);
7) критерії післяопераційної оцінки стану хвороби пролікованих пацієнтів із ДР ЩЗ (ЕТА‑2006 рекомендувало досягнення нульового базального та стимульованого тиреоглобуліну сироватки для визнання пацієнта здоровим, а АТА‑2015 визнає доцільним оцінювати критерії одужання відповідно до вихідного статусу (категорія ризику: низька, проміжна, висока) та відгуку на лікування (відмінний, проміжний, біохімічно неповний, структурно неповний), а потім робити висновки щодо подальшого моніторингу та необхідного додаткового лікування; самі показники цільового рівня тиреоглобуліну суттєво пом’якшені);
8) вводиться принципово нове поняття — динамічна стратифікація (переоцінка) ризику рецидивів відповідно до первинного статусу та відгуку на лікування. Це регламентує ретельність подальших діагностично-лікувальних заходів та визначає актуальний ризик рецидиву та смерті;
9) чітко окреслюється перелік адекватних заходів у випадку рецидиву або персистенції захворювання, викладаються показання до повторних операцій чи малоінвазивних маніпуляцій, а також застосування нових таргетних хіміотерапевтичних препаратів.
Думка автора цього огляду не завжди збігається з викладеним матеріалом, але слід дивитись на зміст та раціональність цих рекомендацій з позицій соціальної користі та в масштабі великої країни, а не погляду окремого спеціалізованого медичного закладу. Подальше вивчення цих рекомендацій, графічного матеріалу, на який є посилання у тексті (таблиці та рисунки), а також пояснень до них буде можливим через Інтернет або за друкованим варіантом рекомендацій. Сподіваюся, що кожен з лікарів буде ставити за найвищу мету не нашкодити пацієнту із вузловим утворенням в ЩЗ, вчасно діагностувати або запідозрити агресивний перебіг захворювання, виявити рак серед вузлів та обрати адекватне його лікування, зваживши користь та потенційні ризики для здоров’я, життя, погіршання соціального статусу та навіть банкрутства (про що попереджають американські автори). Тільки з урахуванням балансу цих критеріїв можна обрати вірний шлях до лікування цієї надзвичайно поширеної хвороби людини — вузлів та диференційованого раку ЩЗ.
/69.jpg)
Вибрані ключові рекомендації АТА‑2015
[A] Тактика ведення пацієнтів з вузлами ЩЗ
Рекомендація 2. Першим лабораторним кроком у дослідженні пацієнтів із вузлами в ЩЗ має бути визначення рівня ТТГ у крові. При субнормальному рівні радіоізотопна сцинтиграфія (бажано з йодом‑123) повинна застосовуватися як початкове обстеження, а в разі нормального або підвищеного — не повинна.
Рекомендація 4. Робоча група не може ані порадити, ані заперечити рутинне визначення кальцитоніну сироватки у пацієнтів із тиреоїдними вузлами (немає рекомендацій, недостатня доказова база).
(Примітка автора статті. Європейські фахівці та фахові асоціації наполягають на суцільному застосуванні аналізу на сироватковий кальцитонін для всіх пацієнтів із тиреоїдними вузлами вже на початку обстеження, а рівень понад 100 пг/мл вважають таким, що підтверджує наявність медулярного раку ЩЗ; визначення рівня кальцитоніну крові є важливим доповненням алгоритму обстеження пацієнтів із тиреоїдними вузлами. Адже єдиний позитивний такий результат може вирішити питання щодо доцільності операції та запобігти прогресуванню загрозливого для життя захворювання. Із суто економічних міркувань, коли вартість дослідження є важливою для пацієнта, прийнятним може бути варіант, коли аналіз на кальцитонін крові робитиметься для хворих із результатами пункційної біопсії, що викликають певну підозру щодо раку ЩЗ, тобто це 3–5-й класи за системою Bethesda‑2009.)
Рекомендація 6. Сонографія ЩЗ та лімфатичних вузлів шиї є обов’язковим дослідженням для всіх пацієнтів з підозрою на вузли в ЩЗ.
Рекомендація 7. ТАПБ є процедурою вибору за наявності вузлів у ЩЗ, коли це клінічно обґрунтовано.
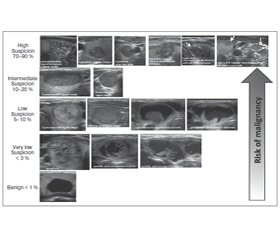
Рекомендація 8. Діагностична ТАПБ рекомендується: а) для вузлів > 1 см із високим ступенем сонографічної підозри на рак; b) для вузлів > 1 см з проміжним ступенем сонографічної підозри на рак; с) для вузлів > 1,5 см з низьким ступенем сонографічної підозри на рак.
Діагностична ТАПБ може бути показаною: d) для вузлів > 2 см з дуже низьким ступенем сонографічної підозри на рак (наприклад, губчастої структури); спостереження без ТАПБ може бути виправданою опцією.
Діагностична ТАПБ не показана: е) для тих вузлів, що не відповідають зазначеним вище критеріям; f) для чисто кістозних вузлів.
Рекомендація 9. Цитологічний висновок після ТАПБ має відповідати класифікації Bethesda System (2009).
Рекомендація 10. А) неінформативні результати ТАПБ потребують повторної біопсії під контролем УЗД та з оцінкою препаратів на місці.
В) Повторні неінформативні висновки цитологічного дослідження за наявності підозрілих сонографічних зразків вузлів ЩЗ потребують ретельного нагляду або хірургічного видалення їх.
С) Також хірургічний варіант лікування слід розглядати при повторних неінформативних цитологічних висновках, коли існують клінічні фактори ризику або росту вузлів більше ніж на 20 % у двох вимірюваннях.
Рекомендація 12. У випадку цитологічного підтвердження раку ЩЗ рекомендується хірургічне лікування.
Активне спостереження може розглядатись як альтернатива для негайної операції, якщо: а) пацієнт має пухлину дуже низького ризику (наприклад, папілярна мікрокарцинома без інвазії та метастазів, а також за відсутності морфологічних чи генетичних ознак агресивності захворювання; b) пацієнт належить до групи високого хірургічного ризику через супутні захворювання; с) пацієнт має відносно коротку очікувану тривалість життя (через тяжкі хвороби або дуже похилий вік); d) пацієнт має більш нагальні медичні проблеми терапевтичного або хірургічного профілю.
Рекомендація 13. Якщо пацієнтові планується проводити молекулярно-генетичні дослідження пухлин ЩЗ, його слід попередити про певні обмеження та непевність методики.
Рекомендація 14. Генетичні дослідження мають виконуватись лише в сертифікованих відповідним чином лабораторіях.
Рекомендація 15. Для пацієнтів із цитологічним результатом, що відповідає Bethesda 3 (AUS/FLUS), після зважування всіх клінічних та сонографічних даних має бути прийняте рішення щодо повторної ТАПБ, молекулярно-генетичного тестування з метою обрання тактики спостереження або діагностичної операції. Таке рішення обговорюється з пацієнтом з урахуванням його особистої думки.
Рекомендація 16. Для вузлів ЩЗ із цитологічним висновком категорії Bethesda 4 (FN/SFN) типовим та випробуваним тактичним рішенням є діагностична хірургічна операція, однак застосування молекулярно-генетичного тестування є також доцільним для вибору належного лікування. Якщо останнє є неможливим або його результат залишається невизначеним, хірургічна операція може бути запропонована.
Рекомендація 17. Для тиреоїдних вузлів 5-ї категорії (підозра на рак) слід застосовувати хірургічний підхід, як і у випадку раку ЩЗ, залежно від клініко-сонографічних критеріїв, переваг хворого та результатів молекулярного тестування на мутації. Панель мутацій може бути також застосована, якщо це впливатиме на обсяг хірургічного лікування.
Рекомендація 19. Коли хірургічне лікування обирається для пацієнтів із невизначеними за цитологічними даними вузлами, гемітиреоїдектомія має бути початковим обсягом операції, якщо вузол є поодиноким.
Рекомендація 20. Перевагу тотальній тиреоїдектомії слід віддавати у випадках підвищеного ризику злоякісності за наявності вузлів невизначеного діагнозу з певною підозрою на рак, коли присутні сонографічні риси раку, розміри понад 4 см або для пацієнтів із сімейним анамнезом тиреоїдного раку, опроміненням у минулому, коли фінальний діагноз ДР ЩЗ буде вимагати виконання остаточної тиреоїдектомії. Також тотальну тиреоїдектомію доцільно використовувати для хворих із двобічними вузлами ЩЗ, супутніми тяжкими захворюваннями або якщо вони самі наполягають на повному видаленні ЩЗ.
Рекомендація 21. А) Пацієнти із множинними вузлами ЩЗ > 1 см мають досліджуватись так само, як і пацієнти з поодиноким вузлом > 1 см.
В) У виборі вузлів для ТАПБ слід керуватися сонографічними ознаками, а не розмірами.
С) Якщо жоден з вузлів не має ознак злоякісності, ТАПБ слід виконати для домінуючих вузлів, більших за 2 см, та в подальшому керуватись сонографічним спостереженням.
Рекомендація 22. При супресованому рівні ТТГ може бути присутня тиреоїдна автономія, і після сцинтиграфії ЩЗ слід виконувати ТАПБ для «холодних» вузлів та тих, що мають підозрілі сонографічні риси.
Рекомендація 24. Тиреоїдні вузли, що не відповідали показанням для ТАПБ при первинному огляді, потребують динамічного спостереження з періодичністю 6–24 місяці залежно від сонографічних критеріїв ризику злоякісності.
Рекомендація 25. Супресивна терапія тироксином для доброякісних вузлів ЩЗ загалом не рекомендується через перевагу потенційної шкоди для здоров’я над очікуваним ефектом.
Рекомендація 26. Кожному індивідууму з доброякісними тиреоїдними вузлами потрібно забезпечити належне вживання йоду, а якщо є підозра на неадекватне забезпечення йодом, слід рекомендувати щоденне вживання 150 мкг йодиду.
Рекомендація 27. Хірургічне лікування може розглядатись для пацієнтів із доброякісними вузлами ЩЗ, що викликають компресійні симптоми, є більшими за 4 см, або з огляду на клінічні застереження. Повільно зростаючі доброякісні вузли загалом можуть бути під наглядом без операції.
Рекомендація 28. Кістозні вузли, що відновлюються після пункції, мають розглядатись як показання для хірургічного лікування або склерозування етанолом, якщо вони викликають компресійні симптоми або є косметичними вадами. Асимптомні можуть спостерігатись консервативно.
Рекомендація 30. ТАПБ тиреоїдних вузлів за відповідними показаннями слід проводити для вагітних, які мають еутиреоїдний стан.
У випадку пригніченого ТТГ, що триває після 16 тижнів гестації, ТАПБ слід відкласти на період після пологів та припинення лактації.
Рекомендація 31. А) Якщо папілярний рак ЩЗ діагностується під час вагітності та не має ознак інвазії, ураження лімфатичних вузлів та тенденції до зростання, він може бути відкладений для лікування після пологів. В іншому разі операція має бути виконана до 24–26-го тижня вагітності. Якщо рак виявлений у другій половині вагітності та є стабільним за сонографією, то його лікування може бути відтерміноване до післяпологового періоду.
В) У вагітних з діагностованим або запідозреним папілярним раком ЩЗ терапію тиреоїдними гормонами слід контролювати за цільовим рівнем ТТГ 0,1–1,0 мОд/л, якщо вона взагалі є потрібною.
[B] Диференційований рак ЩЗ:рекомендації з початкового лікування
Головними цілями початкового лікування ДР ЩЗ вважаються покращення загального та хворобоспецифічного виживання, зменшення ризику персистенції й рецидивів захворювання та пов’язаної з цим шкоди для здоров’я, забезпечення точного визначення стадій хвороби та групи ризику з одночасною мінімізацією ризиків самого лікування та застосування зайвих лікувальних процедур.
Рекомендація 32. А) Передопераційне УЗД шийних лімфатичних вузлів (особливо латеральних колекторів шиї) обов’язкове для всіх пацієнтів, що йдуть на операцію з приводу раку чи підозри на рак ЩЗ.
В) ТАПБ під контролем УЗД лімфатичних вузлів шиї, більших за 8–10 мм, слід робити всім пацієнтам для визначення тактики лікування.
С) Доцільно додатково визначати рівень тиреоглобуліну (ТГ) біохімічним методом у змивах голки після пункції лімфатичних вузлів для додаткової оцінки їх можливого метастатичного ураження.
Рекомендація 33. Комп’ютерна або магнітно-резонансна томографія (КТ, МРТ) рекомендується для передопераційної оцінки лімфатичних вузлів при підозрі на агресивний варіант раку чи збільшених лімфатичних вузлах.
Рекомендація 35. А) Для всіх пацієнтів із раком ЩЗ понад 4 см або клінічними ознаками інвазії, наявними метастазами в лімфовузли шиї або дистантними метастазами показано виконання тотальної тиреоїдектомії з максимально можливим видаленням вогнищ пухлини.
В) Для пацієнтів із ДР ЩЗ > 1 см та < 4 см з групи низького ризику без екстратиреоїдної інвазії та клінічно визначених метастазів до лімфатичних вузлів (cN0) достатнім об’ємом лікування може стати гемітиреоїдектомія (лобектомія), якщо лікувальна команда не наполягатиме на тотальній тиреоїдектомії задля забезпечення можливості проведення терапії радіоактивним йодом та спостереження за рівнем ТГ.
С) Для пацієнтів із ДР ЩЗ < 1 см без інвазії та метастазів або ураження контралатеральної частки достатнім обсягом операції є лобектомія, якщо відсутні інші показання до тиреоїдектомії, а також не було опромінення голови та шиї в минулому, сімейного анамнезу раку ЩЗ та немає клінічно визначених шийних метастазів.
Рекомендація 36. А) Лікувальна центральна дисекція лімфовузлів шиї (VI компартмент) має виконуватись додатково до тиреоїдектомії в разі наявних клінічно визначених метастазів центральної групи лімфатичних вузлів.
В) Профілактична центральна дисекція шиї має виконуватись навіть за відсутніх визначених метастазів у VI лімфатичному колекторі у разі інвазивного росту, великих пухлин (Т3-Т4), наявних латеральних шийних метастазів або необхідності визначити подальші лікувальні кроки.
С) Тиреоїдектомія без профілактичної центральної дисекції може бути достатнім обсягом операції у випадку неінвазивних невеликих інтратиреоїдних папілярних пухлин без клінічно визначених метастазів та в більшості випадків фолікулярного РЩЗ.
Рекомендація 37. Лікувальна терапевтична латеральна дисекція шиї має виконуватись при доведених біопсією метастазах у ІІ–V колекторах шиї.
Рекомендація 38. Остаточна (завершальна) тиреоїдектомія після операції в обсязі лобектомії має проводитися для тих пацієнтів, кому тотальна тиреоїдектомія мала бути призначена за відомого діагнозу перед операцією. Лобектомія може бути достатньою для пацієнтів низького ризику.
Абляція радіоактивним йодом для досягнення ефекту остаточної тиреоїдектомії після лобектомії не проводиться.
Рекомендація 39. Пацієнт має бути поінформований перед операцією стосовно специфічних хірургічних та анестезіологічних ризиків, включаючи пошкодження гортанних нервів та прищитоподібних залоз.
Рекомендація 40. Усі пацієнти мають пройти оцінку голосової функції перед операцією.
Рекомендація 41. Ларингоскопія має бути проведена всім пацієнтам з порушенням голосової функції, операціями на шиї чи верхній частині грудної клітини, при розташуванні ракової пухлини в задній частині ЩЗ з можливою інвазією або наявних метастазах центрального компартменту.
Рекомендація 42. А) Візуальна ідентифікація поворотного гортанного нерва упродовж тиреоїдектомії та дисекції має проводитися у всіх випадках. Необхідні кроки для запобігання ушкодженню зовнішньої гілки верхнього гортанного нерва також мають бути зроблені при дисекції верхніх полюсів ЩЗ.
В) Інтраопераційна електростимуляція з нейромоніторингом або без нього може бути застосована для полегшення ідентифікації нервів та підтвердження їх функціонування.
Рекомендація 43. Прищитоподібні залози мають бути ідентифіковані та збережені разом із їх кровопостачанням упродовж тиреоїдної операції.
Рекомендація 44. Пацієнти мають пройти оцінку свого голосу після операції. Формальне обстеження гортані слід проводити у випадку порушення голосу.
Рекомендація 46. А) Додатково до основних критеріїв пухлини, що вимагає класифікація AJCC/UICC, для кращого вивчення ДР ЩЗ та визначення прогнозу пухлини необхідні такі показники, як межі резекції пухлини, наявність судинної інвазії та кількість уражених судин, кількість досліджених лімфатичних вузлів та метастазів у них, розмір метастатичних вузлів, найбільшого метастазу, наявність позавузлової інвазії метастазу.
В) Слід відзначати окремі гістопатологічні варіанти ДР ЩЗ, які вказують на гірший прогноз захворювання (висококлітинний, колоноподібний, цвяхоподібний або мікропапілярний варіанти папілярного РЩЗ, широкоінвазивний фолікулярний РЩЗ, низькодиференційований рак ЩЗ) або на кращий прогноз (інкапсульований фолікулярний варіант папілярного РЩЗ без інвазії, мінімально-інвазивний фолікулярний РЩЗ).
С) Також слід вказувати на варіанти, притаманні сімейним синдромам (крібриформно-морулярний варіант папілярного РЩЗ асоціюється із сімейним аденоматозним поліпозом та гамартомним пухлинним синдромом).
Рекомендація 47. Визначення стадій пухлини за класифікацією AJCC/UICC рекомендується для всіх хворих на ДР ЩЗ через ефективну оцінку ризику смерті та врахування у всіх канцер-регістрах.
Рекомендація 48. А) Початкова стратифікація на групи ризику (низький, проміжний та високий), рекомендована АТА 2009 року, з огляду на її корисність у передбаченні рецидивів та персистенції, має й надалі використовуватись для оцінки ДР ЩЗ.
В) Додатковий більш детальний розподіл на групи ризику з використанням додаткових критеріїв може застосовуватись для більш точного розподілу пацієнтів за схемою, наведеною в модифікованій системі початкової оцінки ризику рецидивів. Водночас поки неможливо оцінити клінічну користь від такої стратифікації.
С) Хоча поки що не рекомендується рутинне застосування оцінки мутаційного стану BRAF, TERT та інших, ці дослідження мають потенціал для більш точного визначення ризику хвороби разом з іншими клініко-патологічними критеріями.
Рекомендація 49. Початковий розподіл на групи ризику рецидивів має підлягати перегляду впродовж тривалого спостереження, тому що ризик рецидиву та смерті змінюється залежно від перебігу захворювання та його відгуку на лікування.
Варіанти відгуку на терапію, що використовуються для переоцінки ризику:
— відмінний відгук: немає клінічних, біохімічних та структурних доказів існування захворювання;
— біохімічно неповний відгук: ненормальні рівні ТГ або зростаючі титри антитіл до ТГ за відсутності вогнищ пухлини при застосуванні візуалізаційних методів дослідження;
— структурно неповний відгук: персистуючі або нові вогнища регіональних чи віддалених метастазів;
— проміжний відгук: неспецифічні біохімічні або структурні знахідки, що не можуть бути чітко класифіковані як злоякісні чи доброякісні. Це включає також стабільні або такі, що зменшуються, рівні антитіл до ТГ без структурних доказів захворювання.
Рекомендація 50. А) Післяопераційна оцінка стану захворювання (присутність чи відсутність персистенції хвороби) має розглядатись для визначення необхідності у додатковому лікуванні (радіоактивний йод, операція або інше).
В) Післяопераційний рівень сироваткового ТГ (базального чи стимульованого) допомагає визначити персистенцію хвороби або тиреоїдного залишку та передбачити рецидив у майбутньому. ТГ досягає свого найменшого рівня в більшості пацієнтів через 3–4 тижні після операції.
С) Оптимальний граничний рівень ТГ та стану його визначення (базальний чи стимульований ТГ) для оцінки необхідності застосування радіоактивного йоду наразі невідомий.
D) Післяопераційне діагностичне сканування з радіоактивним йодом може бути корисним лише у випадку невизначеності попереднього обсягу операції та стану захворювання з використанням хірургічних протоколів та сонографії.
Початкова мета застосування радіоактивного йоду після тотальної тиреоїдектомії може полягати:
1) у радіойод-абляції (РЙА) тиреоїдного залишку (для полегшення діагностики рецидиву та початкового студіювання шляхом визначення ТГ або сканування всього тіла);
2) радіойод-ад’ювантній терапії (спрямована на покращання виживання шляхом потенційного руйнування можливих метастазів, особливо в пацієнтів підвищеного ризику);
3) радіойод-терапії, або РЙТ (спрямована на покращання хворобоспецифічного та вільного від хвороби виживання шляхом руйнування персистуючих вогнищ раку в пацієнтів найвищого ризику).
Рекомендація 51. А) РЙА загалом не рекомендується після тиреоїдектомії в пацієнтів із низьким ризиком рецидивів за АТА. Специфічні індивідуальні особливості захворювання та преференції пацієнта можуть впливати на рішення щодо призначення радіоактивного йоду.
В) РЙА загалом не рекомендується після операції з приводу папілярної однофокусної чи С) багатофокусної мікрокарциноми, якщо немає інших застережень.
D) РЙТ доцільно призначати після операції у пацієнтів із проміжним ризиком за АТА.
Е) РЙТ рутинно треба застосовувати після тиреоїдектомії у пацієнтів із високим ризиком рецидивів/персистенції за АТА.
Рекомендація 53. А) Коли схема відміни тироксину застосовується для підготовки до РЙТ, тироксин слід відмінити за 3–4 тижні. Трийодтиронін може замінити тироксин на перших тижнях його відміни, а його прийом має бути припинено за 2 тижні до призначення радіоактивного йоду. ТТГ має бути визначений перед цим для оцінки ступеня його підвищення.
В) Цільове значення ТТГ має бути більшим за 30 мОд/л, але оптимальний рівень, що впливає на кінцевий результат лікування, невідомий.
Рекомендація 55. А) Для пацієнтів низького ризику та частини пацієнтів проміжного ризику низька доза (30 мСі) має переваги перед високими дозами.
В) Для пацієнтів проміжного ризику з обсягом операції, меншим за тотальну тиреоїдектомію, великими тиреоїдними залишками або з підозрою на присутність метастазів показано застосування більших активностей радіоактивного йоду.
Рекомендація 56. Дозу радіоактивного йоду слід збільшувати до 150 мСі, якщо є підозра на мікроскопічну резидуальну тканину пухлини (за відсутності дистантних метастазів). Невідомо, чи покращує результати лікування подальше збільшення дози понад 150 мСі.
Рекомендація 57. Низькойодована дієта має застосовуватись протягом 1–2 тижнів перед призначенням радіоактивного йоду.
Рекомендація 58. Сканування всього тіла слід зробити після призначення РЙА або РЙТ.
Рекомендація 59. А) Для групи високого ризику рекомендується дотримуватись цільового початкового рівня ТТГ нижче від 0,1 мОд/л протягом супресивної терапії тироксином.
В) Для пацієнтів проміжного ризику початковий цільовий рівень ТТГ має становити 0,1–0,5 мОд/л.
С) Для пацієнтів низького ризику, які отримали РЙА після тиреоїдектомії та мають рівень ТГ, менший від межі визначення, цільовий рівень ТТГ становить 0,5–2,0 мОд/л, так само як і для пацієнтів, які не підлягали РЙА та також мають рівень ТГ нижче від межі визначення.
D) Для пацієнтів низького ризику, які отримали РЙА після тиреоїдектомії та мають низький рівень ТГ, цільовий рівень ТТГ становить 0,1–0,5 мОд/л з моніторингом можливого рецидиву, так само як і для пацієнтів, які не підлягали РЙА та також мають низький рівень ТГ.
Е) Для пацієнтів низького ризику, які прооперовані в обсязі лобектомії, рівень ТТГ має триматись поблизу нижньої межі (0,5–2,0 мОд/л). У частини з них можлива відміна тироксину, якщо ТТГ відповідає цим значенням.
[С] Довготривалий контроль та рекомендації з лікування поширеного раку щитоподібної залози
Рекомендація 62. А) ТГ крові має визначатись тільки у відповідним чином сертифікованих лабораторіях (CRM457 стандарт у США). Антитіла до ТГ мають визначатися щоразу, коли рівень ТГ досліджується у пацієнтів з ДР ЩЗ. В ідеалі ТГ та антитіла до ТГ мають визначатися в тій самій лабораторії та тим самим методом для кожного пацієнта.
В) Протягом початкового спостереження сироватковий ТГ та антитіла до ТГ на тлі вживання тироксину мають визначатися кожні 6–12 місяців, а в пацієнтів високого ризику — частіше.
С) Для пацієнтів низького ризику з відмінним прогнозом періодичність контролю ТГ може збільшуватись до 24 міс.
Рекомендація 63. А) Для пацієнтів низького та проміжного ризику, які пройшли абляцію радіоактивним йодом та мають негативні результати сонографії, сироватковий ТГ має визначатись шляхом застосування надчутливих методик (< 0,2 /мл) або після стимуляції підвищеним рівнем ТТГ для верифікації відсутності хвороби (відмінний відгук).
В) Повторний стимульований ТГ не рекомендується для пацієнтів низького та проміжного ризику з відмінним відгуком на лікування.
С) Для пацієнтів із невизначеним, біохімічно неповним або структурно неповним відгуком повторне визначення стимульованого ТГ рекомендується для подальшої оцінки відгуку на лікування.
Рекомендація 65. Підозрілі за даними УЗД (кожні 6–12 міс.) лімфатичні вузли шиї мають підлягати біопсії залежно від клінічних даних та рівня ТГ.
Для пацієнтів низького ризику після абляції радіоактивним йодом, тих, у кого відсутні свідчення про тривалість хвороби за даними УЗД та вимірювання ТГ (надчутливим методом на тлі прийому тироксину або при стимуляції підвищеним ТТГ), достатнім є клінічне спостереження та періодичне вимірювання ТГ на тлі прийому тироксину.
Рекомендація 66. Пацієнти низького та проміжного ризику з відмінним відгуком на лікування не потребують контрольного діагностичного сканування всього тіла з використанням радіоактивного йоду.
Рекомендація 68. ПЕТ з флуородезоксиглюкозою (PET-FDG‑18F) має пропонуватись пацієнтам з негативними результатами сканування та підвищеним рівнем (загалом понад 10 нг/мл) ТГ крові, а також для пацієнтів із низькодиференційованою карциномою ЩЗ або пацієнтів із високим ризиком та поганою відповіддю на лікування.
Рекомендація 71. Повторні операційні втручання з центральної або латеральної дисекції в пацієнтів, що вже були оперовані в цих ділянках шиї, мають виконуватись при доведених метастазах розміром понад 8 мм для центрального компартменту та понад 10 мм для латеральних колекторів шиї.
Рекомендація 72. Хірургічне втручання з приводу інвазії пухлиною ЩЗ дихально-травних шляхів має застосовуватись, якщо технічне виконання операції є можливим, і доповнюватись радіоізотопним та променевим лікуванням.
Рекомендація 77. Мікрометастази в легені мають лікуватися повторними курсами РЙТ з використанням емпіричних доз (100–200 мСі; або 100–150 мСі для пацієнтів, старших за 70 років).
Рекомендація 81–82. Емпіричне призначення лікувальних дозувань РЙТ в межах 100–200 мСі може розглядатись у випадку зростання ТГ вище за 10 нг/мл або зростання антитіл до ТГ, навіть якщо структурних ознак персистенції хвороби немає. Відсутність накопичення ізотопу за даними сканування після РЙТ свідчить на користь йод-рефрактерного захворювання та вказує на недоцільність подальшої РЙТ.
Якщо спостерігається накопичення ізотопу, подальші сеанси РЙТ є обґрунтованими за неможливості хірургічного видалення вогнищ пухлини. Повинні зважуватись ризики й переваги такого лікування.
Рекомендація 92. Пацієнти з радіойод-рефрактерними пухлинами, що є асимптомними, стабільними або повільно-прогресуючими, можуть спостерігатись без націленого лікування на тлі супресивного лікування тироксином.
Рекомендація 93. Стереотаксична променева терапія або націлена термальна терапія можуть бути слушними засобами контролю метастазів без суттєвих побічних реакцій. Таке лікування має бути випробуване перед призначенням системної хіміотерапії.
Рекомендація 95. Неуспішне хірургічне, ізотопне або націлене лікування осередків пухлини може слугувати приводом для включення хворих до проспективних клінічних випробувань системної терапії за визначеними вимогами за умов позитивної оцінки вірогідної користі такого лікування.
Рекомендація 96. Кіназні інгібітори можуть бути застосовані в пацієнтів із швидко прогресуючим симптомним йод-рефрактерним ДР ЩЗ, якщо інші методи не дають ефекту.
Рекомендація 100. Традиційна цитотоксична хіміотерапія може бути показаною для метастатичного прогресуючого йод-рефрактерного раку ЩЗ, що не контролюється іншими засобами, включаючи мультикіназні інгібітори.
[D] Які напрямки подальших досліджень плануються в майбутньому
D2. Оптимізація молекулярних маркерів для діагностики, прогнозу та вибору лікування.
D3. Вивчення опції активного спостереження пацієнтів із первинним ДР ЩЗ.
D4. Покращання стратифікації груп ризику.
D5. Покращання нашого розуміння ризиків та переваг лікування ДР ЩЗ.
D6. Розробка питань визначення рівнів ТГ та антитіл до ТГ.
D7. Лікування шийних метастазів, що діагностуються шляхом УЗД.
D8. Новітні засоби терапії йод-рефрактерних варіантів хвороби.
D9. Нагляд за пацієнтами з ДР ЩЗ, які вижили, і турбота про них.
Тести, рекомендовані «Сінево»
1703 Пакет № 274 (моніторинг раку щитоподібної залози) (тиреотропний гормон (ТТГ); тиреоглобулін, антитіла (АТТГ); тиреоглобулін (ТГ); тироксин вільний (T4 вільний))
2068 Кальцитонін

/69.jpg)
/70.jpg)
/71.jpg)
/72.jpg)