Международный эндокринологический журнал 2 (74) 2016
Ассоциация отдельных показателей эндотелиальной функции с T894G полиморфизмом гена эндотелиальной синтазы монооксида азота у больных гипотиреозом и сопутствующим хроническим холециститом
Авторы: Присяжнюк И.В., Пашковская Н.В. - Кафедра клинической иммунологии, аллергологии и эндокринологии, ВГУЗ Украины «Буковинский государственный медицинский университет», г. Черновцы, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Резюме
Досліджено асоціацію T894G поліморфізму гена eNOS з окремими показниками ендотеліальної функції у хворих на гіпотиреоз і супутній хронічний некалькульозний холецистит. У пацієнтів із Т-алеллю відзначено вірогідне зростання на 33,1 % (P = 0,01) кількості десквамованих ендотеліоцитів у крові порівняно з такою в обстежених носіїв GG-генотипу. Також встановлено на 10,4 % (P = 0,04) вищу концентрацію загальних стабільних метаболітів монооксиду азоту та на 10,8 % (P = 0,02) більший рівень нітрат-аніонів у крові щодо групи порівняння. У хворих на гіпотиреоз із супутнім хронічним холециститом вміст судинного ендотеліального фактора росту в носіїв T-алелі на 27,7 % (P = 0,03) переважав такий у пацієнтів із GG-генотипом.
Исследована ассоциация T894G полиморфизма гена eNOS с отдельными показателями эндотелиальной функции у больных гипотиреозом и сопутствующим хроническим некалькулезным холециститом. Установлено, что у больных с Т-аллелью отмечали достоверное увеличение на 33,1 % (P = 0,01) количества десквамированных эндотелиоцитов в крови по сравнению с таковым у обследованных носителей GG-генотипа. Также у таких пациентов наблюдали на 10,4 % (P = 0,04) выше концентрацию общих стабильных метаболитов оксида азота и на 10,8 % (P = 0,02) больше уровень нитрат-анионов в крови. У больных гипотиреозом и сопутствующим хроническим холециститом носителей T-аллели содержание сосудистого эндотелиального фактора роста на 27,7 % (P = 0,03) превышало таковое у пациентов с GG-генотипом.
The association of the T894G endothelial nitric oxide synthase (eNOS) gene polymorphism with certain indicators of endothelial function in patients with hypothyroidism and concomitant chronic non-calculous cholecystitis was investigated. Significant increase by 33.1 % (P = 0.01) of desquamated endothelial cells number in the blood was found in patients with T-allele compared with that of in GG-genotype carriers. Also, the concentration of total nitric oxide stable metabolites was 10.4 % (P = 0.04) higher and the level of nitrate anions in the blood was 10.8 % (P = 0.02) higher than in comparison group. Among patients with hypothyroidism and concomitant chronic cholecystitis, the content of vascular endothelial growth factor was 27.7 % (P = 0.03) higher in T-allele carriers as compared with patients with GG-genotype.
Ключевые слова
хронічний холецистит, гіпотиреоз, ген eNOS, судинний ендотеліальний фактор росту.
хронический холецистит, гипотиреоз, ген eNOS, фактор роста эндотелия сосудов.
chronic cholecystitis, hypothyroidism, eNOS gene, vascular endothelial growth factor.
Статтю опубліковано на с. 80-84
Вступ
Відомо, що у хворих на гіпотиреоз знижується метаболізм у тканинах, чутливих до тиреоїдних гормонів, охоплюючи вуглеводний, жировий і білковий обміни. У свою чергу, зазначені зміни часто поєднуються із захворюваннями органів шлунково-кишкового тракту, зокрема з хронічним холециститом [6]. Тиреоїдні гормони впливають на секрецію та виділення жовчі, тому будь-які зміни функціонального стану щитоподібної залози (ЩЗ) призводять до порушень фізичних і біохімічних властивостей жовчі, моторики жовчного міхура та біліарного тракту в цілому [5]. Більше того, низька концентрація тироксину в крові спричинює гіпертонус сфінктера Одді, що зумовлює більш тривале перебування жовчі в протоковій системі печінки, що є одним із факторів розвитку хронічного холециститу [9].
Окрім зазначених механізмів, значна увага приділяється дослідженню ролі ендотеліальної дисфункції у розвитку патологічних змін різних органів за умов гіпотиреозу [4]. У роботах R. Napoli et al. встановлено, що гіпотиреоз асоціюється з ендотелій- та неендотелій-залежною судинною дисфункцією, що виникає навіть у випадку нетривалого зниження рівнів гормонів ЩЗ у крові [14]. У свою чергу, порушення функціонального стану ендотелію є важливим компонентом в патогенезі хронічного холециститу [7].
Серед ключових генів, які відіграють роль у регуляції тонусу судин, важлива роль належить гену eNOS [10], що кодує синтез ферменту, відповідального за продукцію монооксиду азоту (NO) в судинній стінці, — одного з найбільш важливих вазодилататорів, антиагрегантів і антиоксидантів [3]. Зменшення активності eNOS, що властиво для окремих алельних варіантів зазначеного гена, призводить до зниження рівня експресії NO-синтази й нестачі NO, що проявляється дисфункцією ендотелію та спричиняє посилення атерогенезу й атеротромбозу [13]. Зокрема, 894G>T варіант поліморфізму гена eNOS характеризується тим, що носійство мінорної Т-алелі спричиняє зниження активності ферменту eNOS [15] і зменшення концентрації NO [16]. Численні дослідження, присвячені 894G>T поліморфізму цього гена, виявили асоціацію мінорної T-алелі з вищою частотою розвитку інфаркту міокарда й артеріальної гіпертонії [1, 8].
Відомий зв’язок експресії гена eNOS із розвитком захворювань гепатобіліарної системи. Зокрема, C. Selmi et al. вважають, що різні генетичні варіанти цього гена (894G/T, -786T/C) асоціюють із тяжкістю первинного міліарного цирозу печінки [12]. В експериментальних дослідженнях Y. Nozaki et al. встановили, що недостатня концентрація NO може посилити прогресування ранніх стадій неалкогольної жирової хвороби печінки [11].
Відомо, що гіпотиреоз погіршує ендотелій-залежну вазодилатацію, у той час як гіпертиреоз збільшує вироблення ендотеліального монооксиду азоту [20]. В експериментальному дослідженні I. Rodríguez-Gómez et al. показано, що активність eNOS та iNOS у нирках, серці та аорті підвищувалася в щурів із гіперфункцією ЩЗ та знижувалася у тварин із гіпотиреозом [17].
Мета дослідження: дослідити ймовірну асоціацію T894G поліморфізму гена eNOS з окремими показниками ендотеліальної функції у хворих на гіпотиреоз і супутній хронічний некалькульозний холецистит (ХНХ).
Матеріал і методи
У дослідженні взяли участь 52 пацієнти з гіпотиреозом і супутнім хронічним некалькульозним холециститом (середній вік 46,1 ± 14,4 року). У групу контролю увійшли 20 практично здорових осіб, репрезентативних за віком і статтю до обстежених пацієнтів. Усі обстежені пацієнти та практично здорові особи дали письмову інформовану згоду на участь у дослідженні. Кров брали натще з ліктьової вени. Як антикоагулянт застосовували 5% розчин етилендіамінтетраацетату динатрієвої солі.
Кількість циркулюючих десквамованих ендотеліальних клітин у крові розраховували за методом J. Hladovec у модифікації Н.Н. Петрищева і співавт. [2]. Стабільні метаболіти NO визначали за вмістом нітрит-аніону (NO2) й суми NO2 і нітрат-аніону (NO3) в крові фотоколориметричним методом за допомогою реактиву Гріса [18]. Концентрацію VEGF досліджували в плазмі крові імуноферментним методом.
Дослідження T894G поліморфізму гена eNOS проводили у Державному закладі «Референс-центр з молекулярної діагностики МОЗ України» (м. Київ). Молекулярно-генетичне дослідження ґрунтувалося на виділенні геномної ДНК з периферійної крові за допомогою комерційної тест-системи «innuPREPBloodDNAMiniKit» (Analytik Jena, Німеччина) із застосуванням центрифужних фільтрів. Дослідження поліморфних варіантів гена eNOS (G894T) (rs1799983) здійснювали методом ПЛР за модифікованими протоколами зі специфічними олігонуклеотидними праймерами компанії Metabion (табл. 1) [19] та подальшим аналізом поліморфізму довжини рестрикційних фрагментів (ПДРФ).
Для забезпечення відповідного температурного режиму ПЛР пробірки з готовою ампліфікаційною сумішшю розміщували в ампліфікатор FlexCyclerBU (Analytik Jena, Німеччина).
Отримані продукти ампліфікації (амплікони) гена eNOS (G894T) оцінювалися в гель-електрофорезі, та лише за наявності відповідного фрагмента ДНК 248 п.н. здійснювався подальший аналіз ПДРФ. Для цього отримані амплікони підлягали гідролітичному розщепленню за допомогою ендонуклеази рестрикції MboI (Thermo Scientific, США).
ПДРФ аналіз проводили в мікротермостаті при 37 °С протягом 12 годин. Реакцію зупиняли підвищенням температури до 65 °С упродовж 20 хвилин. Стан ампліфікаційних і рестрикційних фрагментів аналізували в 2% агарозному гелі (агароза виробництва компанії Cleaver Scientific, Великобританія), з додаванням бромистого етидію, маркера молекулярної ваги GeneRuler 50 bpDNALadder (Thermo Scientific, США). Візуалізували отримані результати в трансілюмінаторі з використанням комп’ютерної програми Vitran. На рис. 1 наведена електрофореграма фрагментів рестрикційного аналізу гена eNOS (G894T).
Тип розподілу даних визначали за порівнянням середньої арифметичної, моди й медіани та за допомогою тесту Шапіро — Уїлка. Для визначення статистичних відмінностей між двома незалежними групами використовували критерій Манна — Уїтні. Відповідність розподілу генотипів до закону Харді — Вайнберга перевіряли зa допомогою тесту χ-квадрат.
Результати
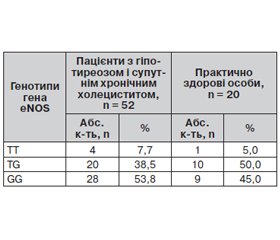
Визначено T894G поліморфізм гена eNOS у 52 хворих на гіпотиреоз із супутнім ХНХ та 20 практично здорових осіб. Розподіл генотипів зазначеного поліморфізму гена вказаний у табл. 2.
У групі практично здорових осіб виявлено: 1 носій (5,0 %) TT-генотипу, 10 гетерозиготних носіїв (50,0 %), 9 носіїв GG-генотипу (45,0 %). Т-алель гена eNOS серед практично здорових осіб спостерігали в 12 (30,0 %) випадках із 40 виділених алелей, G-алель — у 28 (70,0 %) відповідно. Відповідність розподілу генотипів до закону Харді — Вайнберга в контрольній групі була перевірена зa допомогою тесту χ-квадрат із 1-м ступенем свободи, без використання корекції Йетса. Розподіл генотипів у контрольній групі відповідає закону Харді — Вайнберга.
У групі хворих на гіпотиреоз із супутнім ХНХ носіїв TT-генотипу було 4 (7,7 %), TG — 20 (38,5 %), GG — 28 (53,8 %); Т-алель гена eNOS спостерігали в 28 (26,9 %) випадках із 104 виділених алелей, G-алель — у 76 (73,1 %) відповідно. Використавши тест χ-квадрат із двома ступенями свободи, не вдалося виявити статистично значущі відмінності в розподілі генотипів у групі хворих та в групі практично здорових людей (P > 0,05).
За допомогою методу визначення відношення шансів (OR) встановлено, що поширеність Т- та G-алелей вірогідно не відрізнялася в групі пацієнтів із гіпотиреозом і супутнім ХНХ та у групі практично здорових осіб — OR = 0,86 (95% ДІ 0,39–1,92).
Проаналізовано показники функції ендотелію в обстежених хворих залежно від T894G поліморфізму гена eNOS (табл. 3). Оскільки кількість носіїв TT-генотипу була обмежена (n = 4), ми проводили аналіз показників за наявністю мінорної T-алелі.
У результаті дослідження особливостей функціонального стану ендотелію в крові обстежених пацієнтів обох груп встановлено вірогідне збільшення вмісту десквамованих ендотеліоцитів у крові порівняно з таким у практично здорових осіб. Зокрема, у пацієнтів із GG-генотипом гена eNOS таке зростання становило 47,2 % (P < 0,001), у хворих носіїв T-алелі — 96,0 % (P < 0,001) порівняно з контрольними показниками відповідно. Більше того, у хворих із Т-алеллю відзначали вірогідне зростання на 33,1 % (P = 0,01) кількості десквамованих ендотеліоцитів у крові порівняно з такою в обстежених носіїв GG-генотипу, що вказує на більш значне ушкодження ендотелію у хворих із мінорною T-алеллю гена eNOS.
Обговорення
У пацієнтів обох дослідних груп спостерігали вірогідне зростання вмісту стабільних метаболітів монооксиду азоту в крові порівняно з таким показником у практично здорових осіб. У хворих на гіпотиреоз із супутнім ХНХ носіїв GG-генотипу таке збільшення становило 13,2 % (P = 0,003), у пацієнтів із T-алелю — 24,9 % (P = 0,002) відповідно (табл. 3). Також для обох обстежених груп властиве збільшення у крові рівнів нітрит-аніону на 25,1 % (P = 0,048) і 36,5 % (P = 0,04) та нітрат-аніону — на 9,0 % (P = 0,04) і 20,8 % (P = 0,008) відповідно порівняно з такими в практично здорових осіб (табл. 3).
/83.jpg)
У пацієнтів — носіїв Т-алелі реєстрували вірогідно вищу на 10,4 % (P = 0,04) концентрацію загальних стабільних метаболітів NO, ніж у хворих із GG-генотипом. Такі зміни відбувалися переважно за рахунок вірогідно більшого вмісту нітрат-аніонів, що у пацієнтів — носіїв T-алелі на 10,8 % (P = 0,02) переважав відповідний показник у хворих із GG-генотипом. Вірогідної різниці у рівнях нітрит-аніонів у крові обстежених пацієнтів залежно від алельного поліморфізму гена eNOS не спостерігали.
В обстежених пацієнтів — носіїв різних алельних варіантів гена eNOS відзначали вірогідно вищий вміст у крові судинного ендотеліального фактора росту (VEGF), який у носіїв GG-геотипу був у 2,16 раза (P = 0,004), а у носіїв T-алелі — у 2,76 раза (P = 0,0001) більший за відповідний показник у крові осіб групи контролю (табл. 4). Більше того, у хворих на гіпотиреоз із супутнім ХНХ, носіїв T-алелі, рівень VEGF на 27,7 % (P = 0,03) переважав такий у пацієнтів із GG-генотипом.
Висновки
1. Поширеність мінорної T-алелі T894G поліморфізму гена ендотеліальної синтази монооксиду азоту у хворих на гіпотиреоз із супутнім хронічним холециститом статистично не відрізняється від такої в практично здорових людей.
2. Носійство T-алелі гена ендотеліальної синтази монооксиду азоту у хворих на гіпотиреоз із супутнім хронічним холециститом асоціюється з вірогідно більшою кількістю десквамованих ендотеліоцитів, вищою концентрацію нітрат-аніонів і загальних стабільних метаболітів монооксиду азоту, а також більш високим рівнем судинного ендотеліального фактора росту в крові, що вказує на більш виражену дисфункцію ендотелію в таких пацієнтів.
Перспективу подальших досліджень вбачаємо в поглибленні досліджень можливих зв’язків поліморфних варіантів гена eNOS з перебігом хронічних захворювань гепатобіліарної системи на фоні гіпофункції ЩЗ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Список литературы
1. Абдалла Х. Распределение генотипов и встречаемость аллелей генов СЕТР и еNOS у пациентов, перенесших инфаркт міокарда / Х. Абдалла // Україн. терапевт. журн. — 2011. — № 2. — C. 56-61.
2. Диагностическая ценность определения десквамированных эндотелиальных клеток в крови / Н.Н. Петрищев, О.А. Беркович, Т.Д. Власов и др // Клиническая лабораторная диагностика. — 2001. — Т. 1. — С. 50-52.
3. Клинико-генетические аспекты гипотензивного ответа и обратного развития гипертрофии левого желудочка у больных артериальной гипертонией / В.С. Моисеев, Е.П. Коровина, Ж.Д. Кобалава [и др.] // Тер. архив. — 2002. — № 10. — C. 30-37.
4. Коваленко О.Є. Особливості перебігу гіпертонічної енцефалопатії у хворих з гіпотиреозом / О.Є. Коваленко, О.В. Литвин // Український медичний альманах. — 2011. — Т. 14, № 6. — С. 103.
5. Павловський М.П. Особливості лікування пацієнтів із жовчнокам’яною хворобою і тиреотоксикозом / М.П. Павловський, О.М. Сироїд, В.І. Коломійцев // Клінічна ендокринологія та ендокринна хірургія. — 2012. — № 2(39). — С. 77-78.
6. Паньків В.І. Синдром гіпотиреозу / В.І. Паньків // Міжнародний ендокринологічний журнал. — 2012. — № 5. — С. 83-87.
7. Показники синдрому ендогенної «метаболічної» інтоксикації у хворих на неалкогольний стеатогепатит, поєднаний з хронічним некалькульозним холециститом, при застосуванні комбінованої терапії / О.Я. Бабак, Г.Д. Фадєєнко, В.М. Фролов та ін. // Сучасна гастроентерологія. — 2012. — № 1. — С. 19-24.
8. Полиморфизм генов эндотелиальной NO-синтазы и коннексина‑37 как фактор риска развития инфаркта миокарда у лиц без коронарного анамнеза / А.В. Балацкий, Е.Ю. Андреенко, Л.М. Самоходская [та ін.] // Тер. архив. — 2013. — № 9. — C. 18-22.
9. Сироїд О.М. Ендокринні чинники патогенезу жовчнокам’яної хвороби / О.М. Сироїд // Науковий вісник Ужгородського університету. Серія «Медицина». — 2011. — № 2. — С. 233-236.
10. Спиридонова М.Г. Молекулярно-генетический анализ полиморфных маркеров генов, ответственных за функционирование факторов эндотелиальной системы в связи с осложненным протеканием беременности / М.Г. Спиридонова, Е.А. Трифонова, С.В. Фадюшина // Медицинская генетика. — 2007. — № 7. — C. 38-42.
11. Deficiency of eNOS exacerbates early-stage NAFLD pathogenesis by changing the fat distribution / Y. Nozaki, K. Fujita, K. Wada // BMC Gastroenterol. — 2015. — Vol. 15(1). — P. 177.
12. Genetic variant sof endothelial nitricoxidesynthase in patients with primary biliary cirrhosis: association with diseases everity / C. Selmi, M. Zuin, M.L. Biondi [et al.] // Journal of Gastroenterology and Hepatology. — 2003. — Vol. 18. — P. 1150-1155.
13. Harrison D.G. Cellular and molecular mechanisms of endothelial cell dysfunction / D.G. Harrison // J. Clin. Invest. — 1997. — Vol. 100(9). — P. 2153-2157.
14. Impaired endothelial- and nonendothelial-mediated vasodilation in patients with acute or chronichypothyroidism / R. Napoli, V. Guardasole, E. Zarra [et al.] // Clin. Endocrinol. (Oxf.). — 2010. — № 72(1). — Р. 107-111.
15. Intracellular processing of endothelial nitric oxide synthase isoforms associated with differences in severity of cardiopulmonary disease: cleavage of proteins with aspartate vs. position 298 / M. Tesauro, W.C. Thompson, P. Rogliani [et al.] // Proc. Natl. Acad. Sci. USA. — 2000. — Vol. 97. — P. 2832-2835.
16. Khalkhai-Ellis Z. Nitric oxide regulation of maspin expression in normal mammaty epithelial and breast cancer cells / Z. Khalkhai-Ellis, M.J. Hendrix // Am. J. Pathol. — 2003. — Vol. 162. — P. 1411-1417.
17. L-Arginine metabolism in cardiovascular and renal tissue from hyper- and hypothyroid rats / I. Rodríguez-Gómez, J.N. Moliz, A. Quesada [et al.] // Exp. Biol. Med. (Maywood). — 2015. — Vol. 23. — P. 153-157.
18. Lazebnik L.B. The role of nitric oxide (NO) in the etiopathogenesis of some digestive organs diseases / L.B. Lazebnik, V.N. Drozdov, E.N. Barishnykov // Experimental and Clinical gastroenterology. — 2005. — № 2. — P. 4-11.
19. The role of endothelial nitric oxide synthase (eNOS) T‑786C, G894T, and 4a/b gen epolymorphisms in the risk of idiopathic male infertility / M.R. Safarinejad, N. Shafiei, S. Safarinejad [et al.] // Molecular Reproduction and Development. — 2010. — Vol. 77(8). — P. 720-727.
20. Thyroid hormone affects both endothelial and vascular smooth muscle cells in rat arteries / Y. Cai, M.M. Manio, G.P. Leung [et al.] // Eur. J. Pharmacol. — 2015. — Vol. 747. — P. 18-28.
1. Abdalla X. The distribution of genotypes and alleles of genes Setter and eNOS in patients with myocardial infarction. Ukrayin. terapevt. zhurn., 2011; 2: 56–61. Russian
2. Petryshhev NN, Berkovych OA, Vlasov TD. Diagnostic value of determination of desquamated endothelial cells in the blood. Klynycheskaya laboratornaya dyagnostyka, 2001; 1: 50–52. Russian
3. Moyseev VS, Korovyna EP, Kobalava ZhD. Clinical and genetic aspects of the hypotensive response and reverse development of left ventricular hypertrophy in hypertensive patients. Ter. arxyv, 2002; 10: 30–37. Russian
4. Kovalenko OYe, Lytvyn OV. Peculiarities of hypertensive encephalopathy in patients with hypothyroidism. Ukrayinskyy medychnyy al'manakh, 2011; 14: 103. Ukrainian
5. Pavlovskyy MP, Syroyid OM, Kolomiytsev VI. Features of patients with cholelithiasis and thyrotoxicosis. Klinichna endokrynolohiya ta endokrynna khirurhiya, 2012; 2(39): 77–78.Ukrainian
6. Pankiv VI. Hypothyroidism syndrome. Mizhnarodnyy endokrynolohichnyy zhurnal, 2012; 5: 83 – 87.Ukrainian
7. Babak OYa, Fadyeyenko HD, Frolov VM. Indicators syndrome endogenous «metabolic» intoxication in patients with nonalcoholic steatohepatitis, combined with chronic non-calculous cholecystitis, the application of combination therapy. Suchasna hastroenterolohiya, 2012; 1: 19-24.Ukrainian
8. Balaczkyj AV, Andreenko EYu, Samoxodskaya LM. Polymorphism of genes of endothelial NO-synthase and connexin-37 as a risk factor for myocardial infarction in patients without a history of coronary.Ter. arxyv, 2013; 9: 18–22. Russian
9. Syroyid OM. Endocrine factors of gallstone disease pathogenesis. Naukovyy visnyk Uzhhorods'koho universytetu. Ser.: Medytsyna, 2011; 2: 233–236. Ukrainian
10. Spyrydonova MG, Tryfonova EA, Fadyushyna SV. Molecular genetic analysis of polymorphic markers of genes responsible for the operation of the factors endothelial system in connection with the occurrence of complicated pregnancy. Medycynskaya genetyka, 2007; 7: 38–42. Russian
11. Nozaki Y, Fujita K, Wada K. Deficiency of eNOS exacerbates early-stage NAFLD pathogenesis by changing the fat distribution. BMC Gastroenterol, 2015; 15(1): 177.
12. Selmi C, Zuin M, Biondi ML, Invernizzi P, Battezzati PM, Bernini M, Meda F, Gershwin ME, Podda M. Genetic variants of endothelial nitric oxide synthase in patients with primary biliary cirrhosis: association with disease severity. Journal of Gastroenterology and Hepatology, 2003; 18: 1150–1155.
13. Harrison DG. Cellular and molecular mechanisms of endothelial cell dysfunction. J. Clin. Invest,1997;100(9):2153–2157.
14. Napoli R, Guardasole V, Zarra E, D'Anna C, De Sena A, Lupoli GA, Oliviero U, Matarazzo M, Lupoli G, Saccà L. Impaired endothelial- and nonendothelial-mediated vasodilation in patients with acute or chronic hypothyroidism. ClinEndocrinol (Oxf), 2010; 72 (1): 107–111.
15. Tesauro M, Thompson WC, Rogliani P, Qi L, Chaudhary PP, Moss J. Intracellular processing of endothelial nitric oxide synthase isoforms associated with differences in severity of cardiopulmonary disease: cleavage of proteins with aspartate vs. position 298. Proc. Natl. Acad. Sci. USA, 2000; 97: 2832–2835.
16. Khalkhai-Ellis Z, Hendrix MJ. Nitric oxide regulation of maspin expression in normal mammaty epithelial and breast cancer cells. Am. J. Pathol, 2003; 162: 1411–1417.
17. Rodríguez-Gómez I, Moliz JN, Quesada A, Montoro-Molina S, Vargas-Tendero P, Osuna A, Wangensteen R, Vargas F. L-Arginine metabolism in cardiovascular and renal tissue from hyper- and hypothyroid rats. Exp Biol Med (Maywood), 2015; 23: 153–157.
18. Lazebnik LB, Drozdov VN, Barishnykov EN. The role of nitric oxide (NO) in the etiopathogenesis of some digestive organs diseases. Experimental and Clinical gastroenterology, 2005; 2: 4–11.
19. Safarinejad MR1, Shafiei N, Safarinejad S. The role of endothelial nitric oxide synthase (eNOS) T-786C, G894T, and 4a/b gene polymorphisms in the risk of idiopathic male infertility. Molecular Reproduction and Development, 2010; 77(8): 720–727.
20. Cai Y, Manio MM, Leung GP, Xu A, Tang EH, Vanhoutte PM. Thyroid hormone affects both endothelial and vascular smooth muscle cells in rat arteries. Eur J Pharmacol, 2015; 747: 18–28.
/82.jpg)
/83.jpg)

/81.jpg)
/81_2.jpg)
/82_2.jpg)