Международный эндокринологический журнал 2 (74) 2016
Вернуться к номеру
Влияние дистрибуции полиморфизма гена дейодиназы 1-го типа на показатели тиреоидного гомеостаза у больных хроническими гепатитами и циррозом печени невирусной этиологии
Авторы: Чимпой К.А. - Кафедра внутренней медицины, ВГУЗ Украины «Буковинский государственный медицинский университет», г. Черновцы, Украина; Пашковская Н.В. - Кафедра клинической иммунологии, аллергологии и эндокринологии, ВГУЗ Украины «Буковинский государственный медицинский университет», г. Черновцы, Украина; Павлюкович Н.Д. - Кафедра внутренней медицины, клинической фармакологии и профессиональных болезней, ВГУЗ Украины «Буковинский государственный медицинскиий университет», г. Черновцы, Украина; Короташ І.Ф., Рыбак О.Я., Мисечко А.И. - ВГУЗ Украины «Буковинский государственный медицинский университет», г. Черновцы, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Вивчено особливості тиреоїдного гомеостазу у хворих на хронічні дифузні захворювання печінки залежно від А/С поліморфізму гена DIO1. Встановлено залежність показників тиреоїдного гомеостазу у хворих на хронічні дифузні захворювання печінки від дистрибуції А/С поліморфізму гена DIO1, а також відсутність зв’язку титру антитіл до тканини щитоподібної залози з даним поліморфізмом.
Изучены особенности тиреоидного гомеостаза у больных хроническими диффузными заболеваниями печени в зависимости от А/С полиморфизма гена DIO1. Установлена зависимость показателей тиреоидного гомеостаза у больных хроническими диффузными заболеваниями печени от дистрибуции А/С полиморфизма гена DIO1, а также отсутствие связи титра антител к ткани щитовидной железы с данным полиморфизмом.
The features of thyroid homeostasis in patients with chronic diffuse liver diseases, depending on the A/C polymorphism in DIO1 gene, have been studied. The dependence of indicators of thyroid homeostasis in patients with chronic diffuse liver diseases on the distribution of A/C polymorphism in DIO1 gene, as well as the absence of correlation of titer of antibodies to thyroid tissue and this polymorphism have been established.
хронічні дифузні захворювання печінки, поліморфізм, тиреоїдний гомеостаз, антитіла до тканини щитоподібної залози.
хронические диффузные заболевания печени, полиморфизм, тиреоидный гомеостаз, антитела к ткани щитовидной железы.
chronic diffuse liver diseases, polymorphism, thyroid homeostasis, antibodies to thyroid tissue.
Статтю опубліковано на с. 92-95
Вступ
Матеріали та методи
/93_2.jpg)
/93_3.jpg)
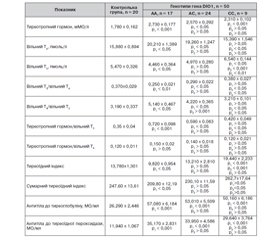
Результати
Обговорення
Висновки
1. Макар Р.Д. Функціональна автономія щитоподібної залози (патогенез, діагностика, лікування) / Р.Д. Макар // Міжнародний ендокринологічний журнал. — 2007. — Т. 2, № 8. — C. 27-34.
2. Олійник В.А. Хронічний лімфоцитарний тиреоїдит (тиреоїдит Хашимото): сучасний стан проблеми (огляд літератури і власні дані) / В.А. Олійник // Ендокринологія. — 2006. — T. 11, № 1. — C. 71-79.
3. Патология щитовидной железы у больных ревматоидным артритом / Б.Т. Турмухамбетова, А.С. Аметов, Л.К. Козлова [и др.] // Клиническая и экспериментальная тиреоидология. — 2009. — № 3. — С. 63-68.
4. Поліморфізм гена гемахроматозу у хворих на хронічний гепатит С / Л. Мороз, В. Дудник, О. Турський [та ін.] // Сучасна гастроентерологія. — 2009. — № 2. — С. 26-28.
5. Bastaki M. Genotype-activity relationship for Mn-superoxide dismutase, glutathione peroxidase 1 and catalase in humans / M. Bastaki, K. Huen, P. Manzanillo [et al.] // Pharmacogenet Genomics. — 2006 — Vol. 16. — Р. 279-286.
6. Chrissobolis S. Gluathione peroxidase‑1 plays a major role in protecting against angiotensin II-induced vascular dysfunction / S. Chrissobolis, S.P. Didion, D.A. Kinzenbaw [et al.] // Hypertension. — 2008. — Vol. 51. — Р. 872-877.
7. Panicker V. A Common Variation in Deiodinase 1 Gene DIO1 Is Associated with the Relative Levels of Free Thyroxine and Triiodothyronine / V. Panicker, C. Cluett, B. Shields [et al.] // J. Clin. Endocrinol. Metab. — 2008. — Vol. 93, № 8. — Р. 3075-3081.
8. Panicker V. Heritability of serum TSH, free T4 and free T3 concentrations: a study of a large UK twin cohort / V. Panicker, S.G. Wilson, T.D. Spector [et al.] // Clin. Endocrinol. (Oxf). — 2008. — Vol. 68. — Р. 652-659.
9. Wagner Andreas H. Upregulation of Glutathione Peroxidase Offsets Stretch-Induced Proatherogenic Gene Expression in Human Endothelial Cells Arteriosclerosis, Thrombosis, and Vascular Biology / H. Wagner Andreas, O. Kautz, K. Fricke [et al.] // ATVBAHA. — 2009 — Vol. 21. — Р. 316-325.
1. Makar RD. [Functional autonomy of the thyroid gland (pathogenesis, diagnosis, treatment)]. Mizhnarodnyy endokrynolohichnyy zhurnal. 2007;2(8):27-34. Ukrainian.
2. Oliynyk VA. [Chronic lymphocytic thyroiditis (Hashimoto thyroiditis): contemporary state of the problem (literary review and own data)]. Endokrynolohiya. 2006;11(1):71-79. Ukrainian.
3. Turmukhambetova BT, Ametov AS, Kozlova LK et al. [Thyroid gland pathology in patients with rheumatic arthritis]. Klynycheskaya y эksperymental'naya tyreoydolohyya. 2009; 3:63-68. Russian.
4. Moroz L, Dudnyk V, Turs'kyy O et al. [Haemochromatosis gene polymorphism in patients with chonic hepatitis C]. Suchasna hastroenterolohiya. 2009; 2:26-28. Ukrainian.
5. Bastaki M. Genotype-activity relationship for Mn-superoxide dismutase, glutathione peroxidase 1 and catalase in humans. Pharmacogenet Genomics. 2006;16:279-286.
6. Chrissobolis S. Gluathione peroxidase-1 plays a major role in protecting against angiotensin II–induced vascular dysfunction. Hypertension. 2008; 51:872-877.
7. Panicker V, Cluett C, Shields B et al. Common Variation in Deiodinase 1 Gene DIO1 Is Associated with the Relative Levels of Free Thyroxine and Triiodothyronine J. Clin. Endocrinol. Metab. 2008;93(8): 3075-3081.
8. Panicker V, Wilson SG, Spector TD et al. Heritability of serum TSH, free T4 and free T3 concentrations: a study of a large UK twin cohort Clin. Endocrinol. (Oxf). 2008;68:652-659.
9. Wagner Andreas H, Kautz O, Fricke K et al. Upregulation of Glutathione Peroxidase Offsets Stretch-Induced Proatherogenic Gene Expression in Human Endothelial Cells Arteriosclerosis, Thrombosis, and Vascular Biology. ATVBAHA. 2009;21:316-325.

/93.jpg)
/94.jpg)