Статтю опубліковано на с. 101-105
Вступ
Згідно із сучасною класифікацією остеопорозу за етіологічним і патогенетичним принципом, маніфестний тиреотоксикоз належить до захворювань, що призводять до вторинного остеопорозу [8]. Гормони щитоподібної залози (ЩЗ) у підвищеній концентрації зв’язуються зі своїм рецептором в ядрі остеобластів, пришвидшують кістковий метаболізм і посилюють кісткову резорбцію [1, 10]. Декілька нещодавніх експериментальних досліджень виявили експресію рецептора до тиреотропного гормона (ТТГ) та його функціональну активність на остеобластах і остеокластах тварин і культурах кісткових клітин людини [5]. Е. Abe і співавт. [12] встановили, що у гризунів, повністю позбавлених рецепторів до ТТГ, відзначалося зменшення маси тіла і маси та довжини кісток. При введенні трийодтироніну (Т3) і тироксину (Т4) спостерігалася нормалізація маси тіла, але не маса і довжина кісток. Ці експерименти припускають можливість впливу ТТГ незалежно від гормонів ЩЗ на метаболізм кісткової тканини.
У працях інших авторів показано, що низький рівень ТТГ асоціюється зі зниженими показниками мінеральної щільності кісткової тканини (МЩКТ) у жінок у менопаузальному періоді [2, 7]. З іншого боку, у проспективному когортному дослідженні [11] не виявлено зв’язку між зниженням рівня ТТГ і швидкістю втрати маси кістки у жінок похилого віку. Суперечливість результатів може бути обумовлена відмінностями патогенезу зниження рівня ТТГ: унаслідок супресивного лікування, функціональної автономії ЩЗ або тиреостатичного лікування у хворих із високим титром антитіл [4].
Стан субклінічного гіпертиреозу можна розглядати як оптимальну модель для оцінки значення ТТГ для кісткової тканини в клінічній практиці. На сьогодні відсутні дослідження зміни кісткового метаболізму залежно від форми субклінічного гіпертиреозу. Крім того, поширеність субклінічного гіпертиреозу, як і остеопорозу, збільшується з віком населення, що підтверджує актуальність вивчення ефективності профілактики та лікування остеопорозу у жінок як з екзогенним, так і з ендогенним субклінічним тиреотоксикозом у постменопаузальний період.
Мета дослідження: здійснити порівняльний аналіз впливу субклінічного гіпертиреозу різного генезу на показники мінеральної щільності кісткової тканини і параметри кісткового обміну.
Матеріали і методи
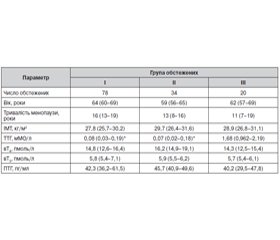
У дослідження в амбулаторних умовах було включено 112 жінок із діагнозом «субклінічний гіпертиреоз» і тривалістю менопаузи принаймні 5 років. Із числа обстежених ендогенний субклінічний гіпертиреоз спостерігався у 78 жінок (група I), субклінічний гіпертиреоз на тлі супресивної терапії левотироксином (LT4) (група II) — у 34. До контрольної групи (група III) увійшло 20 жінок без порушення функції ЩЗ. Критеріями виключення був прийом замісної гормональної терапії препаратами жіночих статевих гормонів. Усі обстежені з ендогенним субклінічним гіпертиреозом перебували в стані компенсації тиреотоксикозу з досягненням цільового рівня ТТГ. Хворі з екзогенним субклінічним гіпертиреозом продовжували отримувати супресивну терапію LT4.
Діагноз субклінічного гіпертиреозу встановлювався за наявності зниження рівня ТТГ при нормальному рівні вільних Т4 і Т3. Оцінювали антропометричні показники — ріст, маса тіла, індекс маси тіла (ІМТ). Біохімічний аналіз крові (загальний та іонізований кальцій, фосфор, лужна фосфатаза (ЛФ), креатинін, загальний холестерин (ЗХС), тригліцериди (ТГ), холестерин ліпопротеїдів високої щільності, холестерин ліпопротеїдів низької щільності (ХС ЛПНЩ)) проводили на біохімічному аналізаторі стандартними наборами. Визначення рівня біохімічного маркера β-термінального телопептиду колагену I типу (β-СТх), остеокальцину (ОК), паратгормона (ПТГ) проведено імуноферментним методом у лабораторії відділу клінічної фізіології і патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова Національної академії медичних наук України».
Визначення МЩКТ проводили методом двохфотонної рентгенівської абсорбціометрії поперекового відділу хребта та проксимального відділу стегнової кістки (денситометр Lunar Prodigy Primo фірми General Electric, США). Оцінювали мінеральну щільність губчастої тканини (окремо кожного хребця поперекового відділу хребта — L1, L2, L3, L4, а також усього проміжку L1–L4 із міжхребцевими щілинами). Згідно з рекомендаціями робочої групи Всесвітньої організації охорони здоров’я щодо обстеження і лікування хворих на остеопороз, діагностику остеопорозу здійснювали, ґрунтуючись на Т-критерії: оцінка вираженості остеопенії (від –1 до –2,5 SD), остеопорозу (нижче –2,5 SD), діапазон нормальних коливань МЩКТ від 1 до –1 SD, що відповідає: < 67,0 % — остеопороз, 67,0–80,0 % — остеопенія та 100,0 ± 20,0 % — нормальна МЩКТ, > 120,0 % — остеосклероз. Для визначення структурно-функціонального віку кісткової системи застосовували методику В.В. Поворознюка [2].
Статистичний аналіз результатів проводили з використанням параметричної і непараметричної статистики. Методи описової статистики включали середню арифметичну величину (М), середнє квадратичне відхилення (σ) і середню помилку середньої величини (m). Дані наведені для нормально розподілених ознак як середнє арифметичне, в інших випадках — медіана (Me) (інтерквартильний розмах — Q25–Q75). Кореляційний аналіз проводили з використанням непараметричного критерію Спірмана. Ступінь взаємозв’язку трактували як слабкий за значень r від 0 до 0,29, середній — від 0,3 до 0,69, сильний — від 0,7 до 1,0.
Дослідження проведене відповідно до етичних принципів Гельсінкської декларації 1975 р. та її перегляду 1983 р. і схвалене комісією з питань етики при Буковинському державному медичному університеті.
Результати
Серед трьох груп пацієнтів, включених у дослідження, не було виявлено відмінностей стосовно чинників ризику розвитку остеопорозу. Загальна характеристика хворих на момент включення в дослідження наведена в табл. 1.
В обстежених із субклінічним гіпертиреозом спостерігалися вірогідно вищі показники кісткового метаболізму порівняно з контрольною групою. Рівень ОК був вищим на 50,6 % у групі I (р < 0,05), на 30,7 % — у групі II (р < 0,001) порівняно з групою контролю (39,5 ± 7,2 нг/мл). Рівень β-СТх був вищим на 19,3 % (р < 0,05) у групі I, на 17,9 % (р < 0,05) — у групі II порівняно з контрольною групою (0,84 ± 0,11 пг/мл). При аналізі залежностей між рівнями гормонів і показниками кісткового метаболізму були виявлені кореляції між рівнями ТТГ, вТ3, ПТГ (крім вТ4) і маркерами кісткового метаболізму для усіх включених в обстеження осіб.
Так, прямі кореляційні зв’язки середньої сили були виявлені між ПТГ і ОК (r = 0,26; р < 0,05); ПТГ і β-СТх (r = 0,27; р < 0,05). Прямі залежності були встановлені між вТ3 i OK (r = 0,22; р < 0,05); вТ3 і β-СТх (r = 0,26; р < 0,05).
Негативна кореляція середньої сили була виявлена між рівнем ТТГ і ОК (r = –0,36; р < 0,05), а також ТТГ і β-СТх (r = –0,38; р < 0,05).
Нами не встановлено вірогідної залежності між рівнем ТТГ і показниками МЩКТ. У той же час при порівняльному аналізі МЩКТ обстежених осіб були виявлені статистично значущі відмінності в усіх відділах скелета.
Так, МЩКТ у поперекових хребцях в групі I була на 7,9 % (L1–L4) (р < 0,05) і 9,2 % (L2–L4) (р < 0,05) нижчою порівняно з групою III, а також на 9,4 % (L1–L4) (р < 0,05) і 9,6 % (L2–L4) (р < 0,05) нижчою в групі I порівняно з групою II.
У групі I показники МЩКТ в шийці стегна на 8,2 % (р < 0,05) і в стегні загалом на 11,3 % (р < 0,05) нижчi порівняно з контрольною групою, а також на 10,2 % (шийка стегна) (р < 0,05) і 10,9 % (р < 0,05) (стегно загалом) нижчі порівняно з групою II. Показники МЩКТ у групах II і III статистично значимо не відрізнялися.
У променевій кістці показники МЩКТ були на 11,9 % (р < 0,05) нижчі в групі I порівняно з контрольною групою, а також на 14,7 % (р < 0,001) нижчі в групі I порівняно з групою II. Статистично значущих відмінностей між групами II і III не було виявлено.
Вірогідне зниження МЩКТ спостерігалося лише у жінок з ендогенним субклінічним гіпертиреозом, тоді як показники МЩКТ пацієнток з екзогенним субклінічним гіпертиреозом не відрізнялися від групи контролю. Тому можна припустити, що не лише зниження рівня ТТГ, але й механізми розвитку субклінічного гіпертиреозу справляють вплив на МЩКТ у жінок у постменопаузальному періоді.
У пацієнтів з ендогенним субклінічним гіпертиреозом (група I) спостерігалося зниження МЩКТ до 15 % переважно в дистальних і проксимальних відділах кортикальної кістки.
У той же час пацієнти з екзогенним субклінічним гіпертиреозом не відрізнялися від групи контролю.
При порівняльному аналізі показників біохімічного аналізу крові вірогідних відмінностей між трьома групами обстежених осіб не було виявлено, за винятком рівня ЛФ, який був статистично значимо вищим (р < 0,05) у пацієнтів групи I порівняно з групою контролю.
Серед пацієнтів із субклінічним гіпертиреозом (112 осіб) дисліпідемія IIа була виявлена у 70,5 % (79) випадків, дисліпідемія IIb — у 6,3 % (7) і нормальний рівень ліпідів — у 23,2 % випадків (26 жінок). У пацієнтів групи III (20 осіб) дисліпідемія IIа була виявлена в 70 % (14) випадків, дисліпідемія IIb — у 15 % (3) і нормальний рівень ліпідів — у 15 % (3) випадків.
Нами був проведений порівняльний аналіз рівня ліпідів між усіма пацієнтами із субклінічним гіпертиреозом і групою контролю. Рівні ЗХС (p < 0,05) і ТГ (р < 0,05) були нижчими у пацієнтів із субклінічним гіпертиреозом порівняно з групою контролю. При порівнянні рівнів ліпідів у пацієнтів з ендогенним субклінічним гіпертиреозом (група I) і групою контролю були виявлені нижчі показники ТГ (р < 0,05), а також коефіцієнта атерогенності (р < 0,05) у пацієнтів з ендогенним субклінічним гіпертиреозом порівняно з групою контролю.
Показники ліпідограми пацієнтів з екзогенним субклінічним гіпертиреозом (група II) не відрізнялися від групи контролю. Отримані нами дані загалом співпадають з результатами зарубіжних досліджень. Так, у двох дослідженнях у пацієнтів похилого віку з ендогенним субклінічним гіпертиреозом спостерігалися статистично значимо нижчі показники ЗХС, ХС ЛПНЩ порівняно з групою контролю. У той же час у пацієнтів на тлі супресивної терапії LТ4 впродовж 10 років не відзначалося будь-яких відмінностей в ліпідному профілі порівняно із здоровими особами [12].
Обговорення
На підставі комплексного системного підходу з використанням сучасних методів дослідження нами проаналізований стан кісткової системи у пацієнток у менопаузі із захворюваннями ЩЗ, що супроводжуються зниженням рівня ТТГ на тлі нормальної концентрації тиреоїдних гормонів. У дослідженні вперше проведений порівняльний аналіз стану кісткового метаболізму, показників МЩКТ, а також показників фосфору і кальцію, ліпідного спектру крові у жінок із субклінічним гіпертиреозом різної етіології.
Позитивна кореляція маркерів кісткового метаболізму і вТ3 як гормонів, необхідних для розвитку скелета і підтримки його гомеостазу, вказує на фізіологічний вплив ПТГ і вТ3 на кісткову тканину [3]. Відсутність кореляцій між рівнями вТ4 і маркерами кісткового метаболізму в сироватці крові можна пояснити значно меншою активністю тироксину порівняно з Т3. Зворотну статистично значущу залежність між рівнями маркерів кісткового метаболізму і ТТГ слід розглядати як непрямий доказ поєднаного впливу ТТГ і Т3 на кістковий метаболізм. Справді, в експерименті ТТГ розглядається як пригнічуючий чинник скелетного ремоделювання [6], тобто зниження рівня ТТГ з високою вірогідністю може призводити до збільшення рівня маркерів кісткового метаболізму, що й виявлено нами в осіб із субклінічним гіпертиреозом.
Відомо, що досягнення еутиреозу призводить до відновлення показників МЩКТ і маркерів кісткового метаболізму в середньому впродовж 6–9 місяців стійкого еутиреозу у пацієнтів із дифузним токсичним зобом [9]. У проведеному нами дослідженні осіб з ендогенним субклінічним гіпертиреозом (група I) спостерігалося зниження МЩКТ до 15 % здебільшого в дистальних і проксимальних відділах кортикальної кістки.
В експериментальних дослідженнях визначалася активність йодтироніндейодинази 2-го типу в культурі клітин нормальних остеобластів людини і клітинах остеосаркоми людини. При цьому активність йодтироніндейодинази 2-го типу стимулювалася ТТГ в обох культурах клітин [5]. ТТГ через свої рецептори регулює продукцію йодтироніндейодинази 2-го типу і відповідає за вміст Т3. Більша частина внутрішньоклітинного Т3 утворюється в результаті периферичного метаболізму Т4, тому низький рівень ТТГ може призвести до зниження вмісту Т3 в цитоплазмі остеобластів у всіх осіб із субклінічним гіпертиреозом. Однак відносно більш висока продукція Т3 може спостерігатися у пацієнтів з ендогенним субклінічним гіпертиреозом. При цьому слід підкреслити, що рівень вТ3 в усіх обстежених нами осіб перебував у межах нормальних значень. Крім того, через відсутність клінічних симптомів неможливо визначити тривалість зниження рівня ТТГ у пацієнтів групи I.
Показано, що стан кісткового метаболізму і МЩКТ залежить не лише від вмісту ТТГ, але й від причин розвитку субклінічного гіпертиреозу.
Отже, жінки в постменопаузальному періоді з діагностованим ендогенним субклінічним гіпертиреозом входять до групи ризику розвитку остеопорозу і потребують проведення двохенергетичної рентгенівської абсорбціометрії з визначенням показників МЩКТ у проксимальному відділі стегна і променевої кістки. Ендогенний субклінічний гіпертиреоз у таких жінок рекомендується довести до еутиреоїдного стану з метою запобігання втраті МЩКТ. Виявлення підвищених маркерів кісткового метаболізму у жінок у постменопаузальному періоді при нормальних показниках фосфорно-кальцієвого обміну слід розглядати як показання для визначення ТТГ.
Висновки
У жінок постменопаузального періоду з ендогенним субклінічним гіпертиреозом спостерігається вірогідне зниження показників МЩКТ, більш виражене в кістках із кортикальною будовою.
При екзогенному субклінічному гіпертиреозі не виявлено вірогідних відмінностей показників МЩКТ порівняно з жінками контрольної групи.
Рівень маркерів кісткоутворення та кісткової резорбції статистично значимо вищий у жінок із субклінічним гіпертиреозом порівняно з групою контролю.
Виявлена негативна кореляційна залежність між маркерами кісткового метаболізму і ТТГ серед усіх пацієнтів, включених у дослідження.
Пацієнтки постменопаузального періоду із субклінічним гіпертиреозом не відрізняються за показниками фосфорно-кальцієвого обміну. При вивченні ліпідного профілю у таких осіб виявлені нижчі показники рівнів ЗХС і ТГ порівняно з групою контролю.
Конфлікт інтересів. Автор декларує відсутність конфлікту інтересів при підготовці статті.
Список литературы
1. Балаболкин М.И. Фундаментальная и клиническая тиреоидология / М.И. Балаболкин, Е.М. Клебанова, В.М. Креминская. — М.: Медицина, 2007. — 816 с.
2. Поворознюк В.В. Захворювання кістково-м’язової системи в людей різного віку (вибрані лекції, огляди, статті): У 3 томах / Поворознюк В.В. — К., 2009. — Т. 3. — 664 с.
3. A modest protective effect of thyrotropin against bone loss is associated with plasma triiodothyronine levels / T.H. Kim, J.Y. Joung, M. Kang [et al.] // PLoS One. — 2015. —Vol. 10(12). — e0145292. — Doi: 10.1371/journal.pone.0145292. eCollection 2015.
4. Antiresorptive therapy in hyperthyroid patients: longitudinal changes in bone and mineral metabolism / E. J'odar, M. Mu~noz-Torres, F. Escobar-Jim'enez [et al.] // J. Clin. Endocrinol. Metab. — 1997. — Vol. 82(6). — P. 1989-1994.
5. Biochemistry, cellular and molecular biology, and physiological roles of the iodothyronine selenodeiodinases / A.C. Bianco, D. Salvatore // Endocr. Rev. — 2002. — Vol. 23(1). — P. 38-89.
6. Boutin A. β-Arrestin‑1 mediates thyrotropin-enhanced osteoblast differentiation / A. Boutin, E. Eliseeva, M.C. Gershengorn, S. Neumann // FASEB J. — 2014. —Vol. 28(8). — P. 3446-3455. — Doi: 10.1096/fj.14-251124.
7. González-Rodriguez L.A. Thyroid dysfunction in an adult female population: A population-based study of Latin American Vertebral Osteoporosis Study (LAVOS) / L.A. González-Rodriguez, M.E. Felici-Giovanini, L. Haddock // P.R. Health Sci. J. — 2013. — Vol. 32. — P. 57-62.
8. Hudec S.M. Secondary causes of osteoporosis / S.M. Hudec, P.M. Camacho // Endocr. Pract. — 2013. — Vol. 19(1). — P. 120–128. — Doi: 10.4158/EP12059.
9. Hyperthyroid levels of TSH correlate with low bone mineral density: the HUNT 2 study / A. Svare, T.I. Nilsen, T. Bjøro [et al.] // Europ. J. Endocrinol. — 2009. — Vol. 161. — P. 779-786.
10. The association between serum thyrotropin levels and bone mineral density in healthy euthyroid men / B.J. Kim, S.H. Lee, S.J. Bae [et al.] // Clin. Endocrinol. — 2010. — Vol. 73(3). — P. 396-403.
11. The relationship between serum TSH and bone mineral density in men and postmenopausal women: the Tromsø study / G. Grimnes, N. Emaus, R.M. Joakimsen [et al.] // Thyroid. — 2008. — Vol. 18. — P. 1147-1155.
12. TSH is a negative regulator of skeletal remodeling / E. Abe, R.C. Marians, W. Yu [et al.] // J. Cell. — 2003. — Vol. 115. — P. 151-162.
1. Balabolkin M.I. Fundamentalnaya i klinicheskaya tiroidologiya / M.I. Balabolkin, E.M. Klebanova, V.M. Kreminskaya. – M.: OAO Izdatelstvo «Meditsina», 2007. – 816 s.
2. Povoroznyuk V.V. Zahvoryuvannya kIstkovo-m’yazovoYi sistemi v lyudey rIznogo vIku (vibranI lektsIYi, oglyadi, stattI): u 3-h tomah / Povoroznyuk V.V. – K., 2009. – T. 3. – 664 s.
3. Kim TH, J.Y. Joung JY, Kang M. A modest protective effect of thyrotropin against bone loss is associated with plasma triiodothyronine levels. PLoS One. 2015; 10 (12):e0145292. doi: 10.1371/journal.pone.0145292. eCollection 2015.
4. Jódar E, Muñoz-Torres M, Escobar-Jiménez F. Antiresorptive therapy in hyperthyroid patients: longitudinal changes in bone and mineral metabolism. J Clin Endocrinol Metab. 1997; 82 (6): 1989-94.
5. Bianco AC, Salvatore D. Biochemistry, cellular and molecular biology, and physiological roles of the iodothyronine selenodeiodinases. Endocr Rev. 2002; 23 (1): 38-89.
6. Boutin A, Eliseeva E, Gershengorn MC, Neumann S. β-Arrestin-1 mediates thyrotropin-enhanced osteoblast differentiation. FASEB J. 2014; 28 (8): 3446-55. doi: 10.1096/fj.14-251124.
7. González-Rodríguez LA, Felici-Giovanini ME, Haddock L. Thyroid dysfunction in an adult female population: A population-based study of Latin American Vertebral Osteoporosis Study (LAVOS). P.R. Health Sci. J. 2013; 32: 57-62.
8. Hudec SM, Camacho PM. Secondary causes of osteoporosis. Endocr Pract. 2013; 19(1): 120-128. doi: 10.4158/EP12059.
9. Svare A, Nilsen TI, Bjøro T. Hyperthyroid levels of TSH correlate with low bone mineral density: the HUNT 2 study. Europ. J. Endocrinol. 2009; 161: 779-86.
10. Kim BJ, Lee SH, Bae SJ. The association between serum thyrotropin levels and bone mineral density in healthy euthyroid men. Clin. Endocrinol. 2010; 73(3): 396-403.
11. Grimnes G, Emaus N, Joakimsen RM. The relationship between serum TSH and bone mineral density in men and postmenopausal women: the Tromsø study. Thyroid. 2008;18: 1147-55.
12. Abe E, Marians RC, Yu W. TSH is a negative regulator of skeletal remodeling. J. Cell. 2003; 115: 151-62.

/103.jpg)