Статтю опубліковано на с. 19-24
Вступ
Кишечний мікробіоценоз характеризується унікальним видовим і кількісним складом та змінюється при патологічних станах, що супроводжуються імуносупресією (цукровий діабет, онкозахворювання, променева терапія, прийом антибіотиків, гормонів, імуносупресивних препаратів, трансплантація, оперативні втручання та хронічні гнійні запальні процеси), що веде до дисбіозу кишечника [2, 9, 15].
Значна частина мікрофлори тіла людини заселяє різні відділи шлунково-кишкового тракту [7]. Склад нормальної мікрофлори товстої кишки надзвичайно різноманітний [3]. Стабільність видового складу і фізіологічних функцій її підтримується складними механізмами симбіозу з мікроорганізмами [3, 15, 19].
У товстій кишці завжди домінують групи мікроорганізмів, які у кількісному відношенні становлять основу біоценозу [9]. Це представники автохтонної облігатної (домінантної, головної, індигенної, резидентної) мікрофлори, що є ключовою складовою мікробіоценозу [8, 12, 19]. Головна мікрофлора товстої кишки містить облігатні анаеробні бактерії роду Bifidobacterium, Bacteroides, Lactobacillus, Propionibacterium, Peptostreptococcus, а також факультативнi анаеробні та аеробні бактерії роду Escherichia, Enterococcus [8].
Мікрофлора товстої кишки виконує понад 22 важливі функції [2, 6, 9]. При зниженні у кишковому біоценозі рівня бактерій роду Bifidobacterium і Lactobacillus та їх біологічної активності порушуються процеси всмоктування поживних речовин, засвоєння заліза, кальцію, вітаміну D, синтезу та абсорбції екзогенних вітамінів, знижується активність низки ферментів і біологічно активних речовин, розвиваються гіпопротеїнемія, авітаміноз і бактеріємія, суттєво знижується колонізаційна резистентність слизових оболонок шлунково-кишкового тракту, що сприяє розвитку інфекційно-запальних захворювань [2, 8, 12, 16].
Цукровий діабет (ЦД) 1-го типу характеризується порушенням обміну речовин, насамперед вуглеводного, а також тяжкими ускладненнями [16]. Вищезазначене свідчить про необхідність вивчення якісного та кількісного складу мікрофлори товстої кишки хворих на ЦД 1-го типу з метою вдосконалення діагностики та лікувальної тактики не тільки основного захворювання, але й супутніх захворювань (запальних процесів лор-органів) [12, 16]. Дисбіоз кишечника — це клініко-лабораторний синдром із розвитком метаболічних та імунологічних зрушень, які на фоні ЦД 1-го типу призводять до виникнення, розвитку та несприятливого клінічного перебігу більшості хронічних захворювань, у тому числі лор-органів [2, 6, 9].
Вплив ЦД 1-го типу на перебіг патологічних процесів також обумовлений пригніченням імунологічного захисту організму, що в подальшому призводить до тяжкого перебігу хронічних захворювань, зокрема хронічних гнійних синуїтів, виникнення інших тяжких ускладнень [1, 5, 17, 18, 20]. Порушення регенераторної функції тканин, послаблення фагоцитарної активності макрофагів і лейкоцитів, зниження захисного бар’єра слизових оболонок сприяє посиленню адгезії мікроорганізмів і формуванню хронічних осередків інфекції, зокрема в піднебінних мигдаликах і приносових пазухах [10, 14].
Слизова оболонка верхніх дихальних шляхів є першим захисним бар’єром, її стан разом із функціональною спроможністю слизової оболонки товстої кишки визначають ризик виникнення як захворювань лор-органів, так і організму в цілому. Лікувальні маніпуляції більшості оториноларингологічних захворювань, що супроводжуються больовим синдромом, небезпечні за наявності супутніх захворювань, зокрема ЦД 1-го типу. Фактори місцевого імунітету та стан мікробіоти товстого кишечника при запальних захворюваннях верхніх дихальних шляхів на фоні ЦД 1-го типу вивчені недостатньо [4, 11, 13].
Мета дослідження — вивчити видовий склад і популяційний рівень головної та додаткової мікрофлори вмісту порожнини товстої кишки хворих на цукровий діабет 1-го типу залежно від тривалості захворювання та віку хворих.
Матеріал і методи
Бактеріологічним і мікологічним методами проведено обстеження вмісту порожнини товстої кишки у 50 хворих на ЦД 1-го типу середнього ступеня тяжкості віком від 15 до 60 років, а також у 30 практично здорових людей аналогічного віку, які вважали себе здоровими і не хворіли протягом останніх шести місяців. Показники мікрофлори вмісту порожнини товстої кишки були характерними для здорової людини. Серед основної групи були 23 (46 %) чоловіки і 27 (54 %) жінок. Забраний матеріал з товстої кишки негайно доставляли для бактеріологічного і мікологічного дослідження у баклабораторію. Результати враховували в тих випадках, коли термін від узяття свіжого матеріалу до його бакдослідження був не більше двох годин.
Посіви виставляли для росту і розмноження мікроорганізмів. Факультативні анаеробні й аеробні мікроорганізми інкубували у термостаті при температурі 37 °С протягом 24–48 годин. Облігатні анаеробні бактерії вирощували у стаціонарному анаеростаті «СО2 incubator T‑125» фірми ASSAB (Швеція) протягом 5–7 діб. Із колоній одержували чисті культури облігатних і факультативних анаеробних і аеробних мікроорганізмів. Для встановлення приналежності бактерій до відповідного роду або виду визначали їх основні властивості. При ідентифікації бактерій використовували «Определитель бактерий Берджи» (1997) та «Изменения в таксономии и номенклатуре бактерий» (2004).
Для зручності викладу матеріалу і математично-статистичного опрацювання використовували десяткові логарифми кількісного показника вирощених колоній мікроорганізмів (lg КУО/г.).
Ентеробактерії вирощували на селективних середовищах Ендо, Левіна, Плоскірєва, стафілококи — на кров’яному м’ясо-пептонному агарі (КМПА) та середовищі Чапмена — Бернса, жовтково-сольовому МПА за Чистовичем, молочно-сольовому МПА; ентерококи — на жовчно-кров’яному МПА Беленького; дріжджоподібні гриби роду Candida — на твердому середовищі Сабуро та рисовому середовищі Левиної; анаероби — на кров’яному агарі Цейслера, кров’яному агарі для бактероїдів; лактобактерії — на середовищі Ленцнера; біфідобактерії — на середовищі Блаурока на печінковому відварі та на модифікованому середовищі Блаурока з додаванням до середовища азиду натрію (100 мг/л).
Отримані результати вивчення якісного та кількісного складу мікрофлори вмісту порожнини товстої кишки піддавалися математично-статистичному аналізу за допомогою стандартного пакета прикладних програм для медико-біологічних досліджень на персональному комп’ютері із застосуванням Microsoft office для Windows XP.
Результати
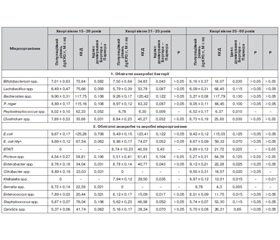
Хворі на ЦД 1-го типу згідно з класифікацією вікової періодизації були розподілені на вікові групи: 15–20 років; 21–35 років; 36–60 років. Нами вивчений видовий склад і популяційний рівень мікробіоти вмісту порожнини товстої кишки хворих залежно від віку. Головну мікробіоту вмісту товстої кишки хворих на ЦД 1-го типу віком 15–20 років становлять умовно-патогенні ентеробактерії, пептококи, стафілококи та інші. Додатково мікробіота у цих хворих представлена клостридіями, ентеробактером. Особливістю мікробіоти вмісту товстої кишки хворих на ЦД 1-го типу є контамінація порожнини товстої кишки патогенними (ентеротоксигенними ешерихіями) та умовно-патогенними (бактеріями роду Enterobacter, Citrobacter, Serratia) ентеробактеріями та клостридіями, які не виявлені у жодної практично здорової людини.
У частини хворих на ЦД 1-го типу за індексом постійності та частотою виявлення встановлена елімінація біфідобактерій, лактобактерій, пептострептококів та ентерококів. Зростає також контамінація порожнини товстої кишки пептококами, протеями, стафілококами і дріжджоподібними грибами роду Candida. Порушення видового складу мікробіоти будь-якого біотопу завжди супроводжується змінами кількісних відношень таксонів мікробного угрупування.
У хворих на ЦД 1-го типу у вмісті порожнини товстої кишки відзначається виражений дефіцит автохтонних облігатних бактерій роду Bifidobacterium на 43,94 % (на 3 порядки), Lactobacillus — на 15,10 % (на 2 порядки), Peptostreptococcus — на 4,86 %, Enterococcus — на 12,67 %. При цьому зростає популяційний рівень умовно-патогенних бактерій роду Bacteroides на 14,95 %, E. coli — на 35,43 %, Proteus — на 28,61 %, Staphylococcus — на 74,51 %, дріждоподібних грибів роду Candida — 69,4 %.
За даними коефіцієнта кількісного домінування (ККД), індексу Бергера — Паркера і коефіцієнта значущості (КЗ) встановлено, що роль біфідобактерій у мікробіоценозі порожнини товстої кишки хворих на ЦД 1-го типу віком 15–20 років знижується у 2,06 раза, лактобактерій — на 66,53 %, пептострептококів — на 49,30 %, ентерококів — у 4,54 раза. На цьому фоні суттєво зростає роль у спрямованості порушень мікробіоценозу порожнини товстої кишки умовно-патогенних P. niger — у 8,36 раза, протеїв — у 2,2 раза, стафілококів — у 10,52 раза, кишкової палички — на 18,07 %, дріжджоподібних грибів роду Candida — у 5,2 раза.
У хворих на ЦД 1-го типу віком 21–35 років у вмісті порожнини товстої кишки встановлено дефіцит авто–хтонних, найважливіших у складі товстокишкового мікробіоценозу бактерій роду Bifidobacterium на 34,53 % (на 2–3 порядки), Lactobacillus — на 46,46 % (на 3 порядки), Enterococcus — на 9,48 %. При цьому зростає кількість умовно-патогенних бактерій роду Bacteroides на 14,04 %, P. niger — на 43,98 %, Escherihia — на 32,91 %, Proteus — на 56,09 %, Staphylococcus — 71,87 % і дріжджоподібних грибів роду Candida — на 52,78 %. Крім того, бактерії, які контамінують порожнину товстої кишки, досягають високого популяційного рівня.
Зміни популяційного рівня автохтонних облігатних і факультативних мікроорганізмів порушують не тільки мікроскопічні відношення між видами, а також, що важливіше, взаємозв’язки в екосистемі «мікроорганізми — макроорганізм». Знижується роль у мікробіоценозі порожнини товстої кишки бактерій роду Bifidobacterium у 4,30 раза, Lactobacillus — у 2,34 раза, Peptostreptococcus — у 14,77 раза, Enterococcus — у 6,15 раза. Значно зростає роль у мікробіоценозі порожнини товстої кишки хворих на ЦД 1-го типу віком 21–35 років P. niger — у 6,05 раза, E. coli — на 16,33 %, бактерій роду Proteus — у 2,29 раза, Staphylococcus — у 6,5 раза, дріждоподібних грибів роду Candida — на 62,78 %.
Отже, у 57,14 % хворих на ЦД 1-го типу віком 21–35 років у вмісті порожнини товстої кишки формується дисбіоз, що характеризується у частини хворих елімінацією найважливіших для біотопу біфідобактерій, лактобактерій, пептострептококів та ентерококів, дефіцит яких виявлений у більшості хворих.
У частини хворих на ЦД 1-го типу віком 36–50 років настає елімінація бактерії роду Bifidobacterium (у 76,92 %), Lactobacillus (11,54 %), Peptostreptococcus (66,78 %), Enterococcus (y 58,67 %). Елімінація автохтонних облігатних бактерій сприяє контамінації біотопу іншими — патогенними (E. coli Hly+, ЕПКП) та умовно патогенними (Enterobacter, Citrobacter, Klebsiella, Serratia, Proteus) ентеробактеріями, клостридіями, пептококами (у 62,93 % хворих), стафілококами (58,19 %) і дріжджоподібними грибами роду Candida (у 32,98 %).
Звертає на себе увагу наявність вираженого дефіциту автохтонних облігатних найважливіших за функціональною роллю у формуванні мікроекологічної схеми бактерій роду Bifidobacterium на 63,80 % (на 4 порядки), Lactobacillus — на 39,24 % (на 2 порядки), Peptostreptococcus — на 28,99 %, Enterococcus — на 10,99 %.
На цьому фоні зростає кількість в угрупованні мікробіоту бактерій роду Bacteroides — на 14,16 %, P. niger — 45,26 %, E. coli — 31,93 %, Proteus — 49,24 %, Staphylococcus — на 75,54 % і дріжджоподібних грибів роду Candida — 74,81 %.
Порушення видового складу і популяційного рівня автохтонних облігатних мікроорганізмів вмісту порожнини товстої кишки хворих на ЦД 1-го типу віком 35–50 років призводить до зміни їх ролі у мікробіоценозі. За ККД, КЗ, індексом домінування Бергера — Паркера, роль біфідобактерій у мікробіоценозі знижується у 8,3 раза, лактобактерій — на 84,08 %, пептострептококів — у 14,61 раза, ентерококів — у 7,89 раза. При цьому суттєво зростає біологічна роль у мікробіоценозі пептокока — у 6,42 раза, кишкової палички — на 8,48 %, протеїв — у 2,4 раза, стафілококів — у 7,37 раза, дріжджоподібних грибів роду Candida — у 4,51 раза.
Бактерії, що контамінують порожнину товстої кишки у хворих на ЦД 1-го типу віком 36–60 років, досягають високого популяційного рівня (від 8,67 ± 0,09 lg КУО/г до 9,50 ± 0,31 lg КУО/г), а їх біологічна роль у мікробіоценозі порожнини товстої кишки сягає, за ККД і КЗ, від 13,01 і 0,02 до 59,32 і 0,08 відповідно. Важливість мікробіотичного вмісту товстої кишки хворих на ЦД 1-го типу віком 36–60 років в тому, що порожнина товстої кишки контамінується різними таксонами патогенних (досягають популяційного рівня 8,78 ± 0,11 lg КУО/г та умовно-патогенних (досягають популяційного рівня 8,31 ± 0,24 lg КУО/г) ентеробактерій. Популяційний рівень умовно патогенних ентеробактерій (протеїв) не досягає 4,00 lg КУО/г (3,53 ± 0,09 lg КУО/г), що свідчить про значну роль у мікробіоценозі патогенних та умовно-патогенних ентеробактерій, рівень яких зростає до 122,55 проти 26,78 (підвищення ролі у мікробіологічній системі в 4,58 раза).
Ілюстрація узагальнених результатів вивчення показників впливу віку хворого на видовий склад, популяційний рівень, індекс постійності, частоту виявлення мікроба, індекс домінування Бергера — Паркера, ККД і КЗ виду або групи мікроорганізмів, що формують мікробіоту вмісту товстого кишечника хворих на ЦД 1-го типу, наведена у табл. 1.
Обговорення
Встановлено, що у хворих на ЦД 1-го типу формується виражений дефіцит автохтонних анаеробних біфідобактерій і лактобактерій у вмісті порожнини товстої кишки. З віком хворого цей дефіцит посилюється, прогнозується чітка картина зниження ролі біфідобактерій у товстокишковому мікробіоценозі. Так, домінування бактерій роду Bifidobacterium з віком хворого понижується — у 21–35 років встановлено зниження індексу домінування Бергера — Паркера на 90,70 %, ККД — у 2,09 раза. У хворих на ЦД 1-го типу віці 36–60 років ці показники знижені порівняно з таким показником у групі 21–35 років на 43,33 % та у 2,12 раза. Подібна ситуація формується у бактерій Lactobacillus, Peptostreptococcus та Enterococcus: так, починаючи з 15–21 і до 36–60 років у хворих на ЦД 1-го типу знижується домінуюча роль лактобактерій на 10,53 %, пептострептококів — у 6,2 раза, ентерококів — на 40,0 %.
При цьому зростає біологічна роль у мікробіоценозі бактерoїдів на 22,64 % і на 2,27 % патогенних (E. coli Hly+, ЕПКП) та умовно-патогенних (Proteus, Enterobacter, Citrobacter, Klebsiella, Serratia) ентеробактерій, клостридій, стафілококів і дріжджоподібних грибів роду Candida.
Отже, з віком посилюються негативні процеси змін видового складу і популяційного рівня, індексу постійності, домінування Бергера — Паркера, частоти виявлення, ККД і КЗ: формується дефіцит і знижується роль у мікробіоценозі автохтонних облігатних бактерій роду Bifidobacterium, Lactobacillus, Peptostreptococcus, факультативних анаеробних та аеробних бактерій роду Enterococcus.
На противагу цьому у хворих на ЦД 1-го типу з віком настає контамінація порожнини товстої кишки патогенними (E. coli Hly+, ЕПКП) та умовно-патогенними (Proteus, Enterobacter, Citrobacter, Klebsiella, Serratia) ентеробактеріями, клостридіями, стафілококами, пептококом, дріжджоподібними грибами роду Candida. Ці мікроорганізми досягають високого популяційного рівня і стають основними у мікробіоценозі. Їх домінуюча роль зростає з віком у пацієнтів із ЦД 1-го типу. Зі збільшенням віку хворих зменшується персистенція у порожнині товстої кишки бактерій роду Bifidobacterium, Lactobacillus, Peptostreptococcus, Enterococcus, зростає кількість патогенних та умовно патогенних ентеробактерій, стафілококів та дріжджоподібних грибів роду Candida.
Висновки
1. У хворих на ЦД 1-го типу настає контамінація порожнини товстої кишки патогенними та умовно-патогенними (бактеріями роду Enterobacter, Citrobacter, Proteus) ентеробактеріями, бактеріями роду Staphylococcus, Peptococcus, Bacteroides, дріжджоподібними грибами роду Candida, формується виражений дефіцит автохтонних анаеробних біфідобактерій, лактобактерій, пептострептококів і факультативних анаеробних та аеробних бактерій роду Enterococcus, що з віком хворого посилюється, та прогнозується чітка картина зниження ролі біфідобактерій у товстокишковому мікробіоценозі.
2. Зі збільшенням віку хворих на ЦД 1-го типу посилюються негативні процеси змін видового складу і популяційного рівня, індексу постійності, домінування Бергера — Паркера, частоти виявлення, ККЗ і КЗ.
3. Домінування бактерій роду Bifidobacterium з віком хворого знижується: у 21–35 років встановлено зниження індексу домінування Бергера — Паркера на 90,70 %, ККД — у 2,09 раза. У хворих на ЦД 1-го типу віком 36–60 років ці показники знижені порівняно з аналогічним показником у хворих віком 21–35 років на 43,33 %. Розпочинаючи з віку 15–20 років і до 36–60 років знижується домінуюча роль лактобактерій на 10,53 %, пептострептококів — у 6,2 раза, ентерококів — на 40,0 %.
Список литературы
1. Бездетко А.В. Эпидемиология и частота сахарного диабета и диабетической ретинопатии / А.В. Бездетко, К.С. Горбачова // Международный эндокринологический журнал. — 2006. — № 4(6). — С. 76-80.
2. Бондаренко В.М. Дисбактериозы кишечника у взрослых / В.М. Бондаренко, Н.М. Грачова, Т.В. Мацулевич. — М.: Медицина, 2003. — 217 с.
3. Бухарин О.В. Бактериально-грибковые ассоциации кишечника в условиях колонизации дрожжеподобными грибами рода Candida / [О.В. Бухарин, А.В. Валышев, Н.Б. Перунова [и др.] // Журн. микробиологии. — 2002. — № 5. — С. 45-48.
4. Гавриленко О.М., Лайко А.А., Головня О.М. Мікробіоценоз піднебінних мигдаликів у дітей, хворих на цукровий діабет 1 типу, з наявністю хронічного тонзиліту / О.М. Гавриленко, А.А. Лайко, О.М. Головня // ЖВНГХ. — 2014. — № 5. — С. 49-54.
5. Гуров А.В. Современные проблемы діагностики и лечения гнойно-воспалительных заболеваний ЛОР-органов у больных с сахарным диабетом / А.В. Гуров, Е.В. Бирюкова, М.А. Юшкина // Вестник оториноларингологии. — 2011. — № 2. — С. 76-79.
6. Ершова И.Б. Спорные проблемы дисбактериоза: советы практическому врачу / И. Ершова, А. Высоцкий, В. Ткаченко // Здоровье ребенка. — 2008. — № 2. — С. 74-76.
7. Ефимов Б.А. Характеристика микроорганизмов, колонизирующих кишечник человека / Б.А. Ефимов, Н.Н. Володин, Л.И. Кафарская [и др.] // Журн. микробиологии. — 2000. — № 5. — С. 98-104.
8. Заболотна Д.Д. Клініко-експериментальне обґрунтування застосування пробіотиків в комплексній терапії хронічних неспецифічних запальних та алергічних захворювань верхніх дихальних шляхів: Автореф. дис… д.м.н. — К., 2010. — 47 с.
9. Заболотная Д.Д. Применение пробиотических препаратов при лечении пациентов с хроническими заболеваниями ЛОР-органов / Д.Д. Заболотная // Журн. вуш., нос. і горл. хвороб. — 2005. — № 3. — С. 99.
10. Кіщук В.В. Хронічний тонзиліт: стан проблеми / В.В. Кіщук // Здоров’я України. — 2010. — № 3. — С. 58-59.
11. Лайко А.А. Стан місцевого імунітету у дітей, хворих на цукровий діабет 1 типу / А.А. Лайко, Ю.В. Гавриленко, О.Ф. Мельников // ЖВНГХ. — 2015. — № 1. — С. 54-58.
12. Митрохин С.Д. Дисбактериоз: современный взгляд на проблему / С.Д. Митрохин // Инфекц. и антимикробная терапия. — 2000. — № 5. — С. 144-148.
13. Николаева Н.В. Изучение адаптационных механизмов и коррекция их нарушения у детей и подростков с сахарным диабетом / Н.В. Николаева, Н.В. Болотова, В.Ф. Киричук // Педиатрия. — 2009. — Т. 88, № 6. — С. 21-26.
14. Пальчун В.Т. Современное представление о токсико-аллергических проявлениях тонзиллярной патологии, ее этиологическая и патологическая роль в возникновении общих заболеваний / В.Т. Пальчун, А.В. Гуров, А.В. Аксьонова, О.А. Гусева // Вестник оториноларингологии. — 2012. — № 2. — С. 5-12.
15. Савченков М. Дисбактериозы как гигиеническая проблема / Савченков М., Рахманин Ю., Попкова С., Муратов В. // Гигиена и санитария. — 2008. — № 2. — С. 43-46.
16. Сидорчук І.Й. Дисбіоз кишківника в діабетології / [І.Й. Сидорчук., Р.П. Ляшук, Н.В. Пашковська та ін.]. — Чернівці: Мед. університет, 2006. — 120 с.
17. Статистичний довідник дитячого ендокринолога за 2010 рік / [голов. ред. Аніщенко О.В.] — К., 2011. — 102 с.
18. Тронько М.Д. За матеріалами Європейської асоціації з вивчення ЦД / М.Д. Тронько, В.Л. Орленко // Здоров’я України. — 2006. — № 21. — С. 21-24.
19. Шендеров Б.А., Медицинская микробная экология: некоторые итоги и перспективы исследований / Б.А. Шендеров // Вестник Российской АМН. — 2005. — № 12. — С. 13-17.
20. Nicoloff G. Circulating immune complexe samong diabetic children / G. Nicoloff, A. Brazhev, C. Petrovs, P. Christova // Clin. Dev. Immunol. — 2004. — Vol. 11, № 1. — P. 61.

/22.jpg)