Международный эндокринологический журнал 3 (75) 2016
Вернуться к номеру
Прогностическое значение показателей протеолиза в формировании диабетической ретинопатии
Авторы: Зяблицев С.В. - Украинский научно-практический центр эндокринной хирургии, трансплантации эндокринных органов и тканей МЗ Украины, г. Киев, Украина; Коробова А.В. - Донецкий национальный медицинский университет им. М. Горького, г. Лиман, Украина; Петренко О.В. - Национальная медицинская академия последипломного образования им. П.Л. Шупика, г. Киев, Украина; Сердюк В.Н. - ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепропетровск, Украина; Могилевский С.Ю. - Национальная медицинская академия последипломного образования им. П.Л. Шупика, г. Киев, Украина
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
У статті наводяться результати дослідження порушень у системі протеолізу у хворих на цукровий діабет (ЦД) 2-го типу і діабетичну ретинопатію (ДР). Вивчалися рівні матриксної металопротеїнази‑9 (ММП‑9) і тканинного інгібітора матриксної металопротеїнази‑1 (ТІМП‑1) у крові і внутрішньоочній рідині (ВОР) хворих на ЦД 2-го типу імуноферментним методом (Bender Medsystems, Австрія). Встановлено зміни в системі протеолізу у хворих на ДР і ЦД 2-го типу, які полягали в підвищенні рівня ММП‑9 і ТІМП‑1 у крові і ВОР як за відсутності ознак ДР, так і за будь-якої її стадії порівняно з рівнем цих показників у хворих без діабету. Встановлено, що рівень ММП‑9 у ВОР і давність ЦД 2-го типу впливають на ймовірність розвитку діабетичного макулярного набряку (ДМО). При рівні ММП‑9 ≥ 105 нг/мл і тривалості ЦД 2-го типу ≥ 10 років імовірність розвитку ДМО становить 100 %. На ймовірність розвитку проліферативної ДР у хворих на ЦД 2-го типу протягом чотирьох років спостереження впливають: рівень ММП‑9 у ВОР, стадія ДР на початку спостереження і тривалість ЦД 2-го типу. При рівні ММП‑9 ≥ 100 нг/мл, тривалості ЦД 2-го типу ≥ 10 років і відсутності ознак ДР на початку спостереження ймовірність розвитку проліферативної ДР становить 85,9 %.
В статье приведены результаты исследований нарушений в системе протеолиза у больных сахарным диабетом (СД) 2-го типа и диабетической ретинопатией (ДР). Определяли уровни матриксной металлопротеиназы‑9 (ММП‑9) и тканевого ингибитора матриксной металлопротеиназы‑1 (ТИМП‑1) в крови и внутриглазной жидкости (ВГЖ) у больных СД 2-го типа иммуноферментным методом (Bender Medsystems, Австрия). Установлены изменения в системе протеолиза у больных ДР и СД 2-го типа, которые заключались в повышении уровня ММП‑9 и ТИМП‑1 в крови и ВГЖ как при отсутствии признаков ДР, так и при любой ее стадии в сравнении с уровнем этих показателей у больных без СД. Установлено, что уровень ММП‑9 во ВГЖ и давность СД 2-го типа влияют на вероятность развития диабетического макулярного отека (ДМО). При уровне ММП‑9 ≥ 105 нг/мл и длительности СД 2-го типа ≥ 10 лет вероятность развития ДМО составляет 100 %. На вероятность развития пролиферативной ДР у больных СД 2-го типа в течение четырех лет наблюдения влияют: уровень ММП‑9 во ВГЖ, стадия ДР в начале наблюдения и длительность СД 2-го типа. При уровне ММП‑9 ≥ 100 нг/мл, длительности СД 2-го типа ≥ 10 лет и отсутствии признаков ДР в начале наблюдения вероятность развития пролиферативной ДР составляет 85,9 %.
The article presents the results of the study on the violations in the proteolysis system of patients with type 2 diabetes mellitus (DM) and diabetic retinopathy (DR). We have evaluated the levels of matrix metalloproteinase‑9 (MMP‑9) and tissue inhibitor of matrix metalloproteinase‑1 (TIMP‑1) in the blood and in the aqueous humor (AH) of patients with type 2 DM by means of immunoenzyme method (Bender Medsystems, Austria). The changes in proteolysis system were detected in patients with DR and type 2 DM, they consisted in the increase in the levels of MMP‑9 and TIMP‑1 in the blood and AH in patients both with no signs of DR and with any its stage, compared to the levels of these parameters in patients without diabetes. It was found that MMP‑9 level in the AH and DM type 2 duration have an impact on the probability of developing diabetic macular edema (DME). At the level of MMP‑9 ≥ 105 ng/ml and duration of type 2 DM ≥ 10 years, the risk of developing DME is 100 %. The probability of proliferative DR in patients with type 2 DM over four years of follow-up is influenced: by the level of MMP‑9 in the AH, stage of DR at baseline and duration of DM type 2. When the level of MMP‑9 is ≥ 100 ng/ml, type 2 DM duration ≥ 10 years and there are no signs of DR at the beginning of the observation, the probability of proliferative DR is 85.9 %.
діабетична ретинопатія, система протеолізу, металопротеїназа‑9, тканинний інгібітор матриксної металопротеїнази‑1, внутрішньоочна рідина.
диабетическая ретинопатия, система протеолиза, металлопротеиназа‑9, тканевый ингибитор матриксной металлопротеиназы‑1, внутриглазная жидкость.
diabetic retinopathy, proteolysis system, metalloproteinase‑9, tissue inhibitor of matrix metalloproteinase‑1, aqueous humor.
Статья опубликована на с. 32-36
В последние годы система протеолиза, к которой относятся матриксные металлопротеиназы (ММП) и тканевые ингибиторы матриксных металлопротеиназ (ТИМП), активно изучается при хронических воспалительных процессах различного генеза, при сердечно-сосудистых, аутоиммунных и онкологических заболеваниях [1, 2]. ММП — класс секретируемых или связанных с поверхностью клетки цинк- либо кальцийзависимых протеиназ, которые принимают участие в эмбриональном развитии, морфогенезе и ремоделировании ткани [2–4]. Имеется значительное число публикаций о ММП‑9 в связи с ее ролью в патогенезе инфаркта миокарда, ревматоидного артрита, онкопатологии, обструктивных заболеваний легких, рассеянного склероза, гепатитов и цирроза печени, а также в развитии такого осложнения сахарного диабета (СД), как диабетическая ретинопатия (ДР) [5–9].
Материалы и методы
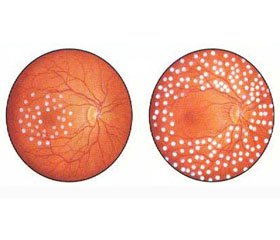
Результаты
/34.jpg)
Обсуждение
/34_2.jpg)
Выводы
1. Evrosimovska B., Velickovski B., Dimova C., Veleska-Stefkovska D. Matrix metalloproteinases (with accent to collagenases) // Journal of Cell and Animal Biology. — 2011. — Vol. 5, № 7. — P. 113-120.
2. Raffetto J.D., Khalil R.A. Matrix Metalloproteinases and their Inhibitors in Vascular Remodeling and Vascular Disease // Biochemical Pharmacology. — 2008. — Vol. 75, № 2. — P. 346-359. — Doi: 10.1016/j.bcp.2007.07.004.
3. Nagase H., Woessner J.F. Matrix metalloproteinases // The Journal of Biological Chemistry. — 1999. — Vol. 274. — Р. 21491-21494. — Doi: 10.1074/jbc.274.31.21491.
4. Giebel S.J., Menicucci G., McGuire P.G. Matrix metalloproteinases in early diabetic retinopathy and their role in alteration of the blood-retinal barrier // Laboratory Investigation. — 2005. — Vol. 85, № 5. — P. 597-607. — Doi: 10.1038/labinvest.3700251.
5. Malemud C.J. Matrix metalloproteinases (MMPs) in health and disease: an overview // Frontiers in Bioscience. — 2006. — Vol. 11. — Р. 1696-1701.
6. Rogowicz A., Zozulińska D., Wierusz-Wysocka B. Role of matrix metalloproteinases in the development of vascular complications of diabetes mellitus — clinical implications // Polskie Archivum Medycyny Wewnętrznej. — 2007. — Vol. 117, № 3. — Р. 1-7.
7. Bhatt L.K., Addepalli V. Attenuation of diabetic retinopathy by enhanced inhibition of MMP‑2 and MMP‑9 using aspirin and minocycline in streptozotocin-diabetic rats // American Journal of Translational Research. — 2010. — Vol. 2, № 2. — Р. 181-189.
8. Kowluru R.A., Mohammad G., dos Santos J.M., Zhong Q. Abrogation of MMP‑9 Gene Protects Against the Development of Retinopathy in Diabetic Mice by Preventing Mitochondrial Damage // Diabetes. — 2011. — Vol. 60, № 11. — P. 3023-3033. — Doi: 10.2337/db11-0816.
9. Derosa G., D’Angelo A., Tinelli C. et al. Evaluation of metalloproteinase 2 and 9 levels and their inhibitors in diabetic and healthy subjects // Diabetes & Metabolism. — 2007. — Vol. 33, № 2. — P. 129-134. — Doi: 10.1016/j.diabet.2006.11.008.
10. Rangasamy S., McGuire P.G., Das A. Diabetic retinopathy and inflammation: novel therapeutic targets // Middle East African Journal of Ophthalmology. — 2012. — Vol. 19, № 1. — P. 52-59.
11. Kowluru R.A. Role of Matrix Metalloproteinase‑9 in the Development of Diabetic Retinopathy and Its Regulation by H-Ras // Investigative Ophthalmology & Visual Science. — 2010. — Vol. 51, № 8. — Р. 4320-4326. — Doi: 10.1167/iovs.09-4851.
12. Zheng Y., He M., Congdon N. The worldwide epidemic of diabetic retinopathy // Indian Journal of Ophthalmology. — 2012. — Vol. 60, № 5. — P. 428-431. — Doi: 10.4103/0301-4738.100542.
13. El-Azab M.F., Mysona B.A., El-Remessy A.B. Statins for prevention of diabetic-related blindness: a new treatment option? // Expert Review of Ophthalmology. — 2011. — Vol. 6, № 3. — P. 269-272. — Doi: 10.1586/eop.11.36.
14. Shaw J.E., Sicree R.A., Zimmet P.Z. Global estimates of the prevalence of diabetes for 2010 and 2030 // Diabetes Research and Clinical Practice. — 2010. — Vol. 87, № 1. — P. 4-14. — http://dx.doi.org/10.1016/j.diabres.2009.10.007.
15. International Diabetes Federation. IDF Diabetes Atlas, 7th ed. — Brussels, Belgium: International Diabetes Federation, 2015.
16. Wilkinson-Berka J.L. Angiotensin and diabetic retinopathy // The International Journal of Biochemistry and Cell Biology. — 2006. — Vol. 38. — P. 752-765. — Doi: 10.1016/j.biocel.2005.08.002.
17. Cheung N., Mitchell P., Wong T.Y. Diabetic retinopathy // Lancet. — 2010. — Vol. 376(9735). — Р. 124-136. — Doi: 10.1016/S0140-6736(09)62124-3.
18. Тронько М.Д., Соколова Л.К., Власенко М.В., Костюкевич А.А. Досягнення цілей лікування пацієнтами із цукровим діабетом в Україні. Результати Міжнародного дослідження з вивчення практики ведення цукрового діабету (IDMPS) // Ендокринологія. — 2015. — № 20(4). — С. 658-668.
19. Kowluru R.A., Zhong Q., Santos J.M. Matrix metalloproteinases in diabetic retinopathy: potential role of MMP‑9 // Expert Opin. Investig. Drugs. — 2012. — Vol. 21, № 6. — P. 797-805. — Doi: 10.1517/13543784.2012.681043.
20. Demirel, S., Argo, C., Agarwal, A. et al. Updates on the Clinical Trials in Diabetic Macular Edema // Middle East African Journal of Ophthalmology. — 2016. — Vol. 23, № 1. — P. 3-12. — http://doi.org/10.4103/0974-9233.172293.
21. Wilkinson C.P., Frederick L. Ferris III, Ronald E. Klein et al. Global Diabetic Retinopathy Project Group. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales // Ophthalmology. — 2003. — Vol. 110, № 9. — P. 1677-1682. — http://dx.doi.org/10.1016/S0161-6420(03)00475-5.
22. Jonas J.B., Jonas R.A., Neumaier M., Findeisen P. Cytokine concentration in aqueous humor of eyes with diabetic macular edema // Retina. — 2012. — Vol. 32, № 10. — P. 2150-2157. — Doi: 10.1097/IAE.0b013e3182576d07.