Статтю опубліковано на с. 43-47
Вступ
Про зниження когнітивної функції у пацієнтів з цукровим діабетом (ЦД) відомо ще з часів відкриття інсуліну, тобто з 1922 року. За цей період було проведено багато досліджень, присвячених ЦД та його ускладненням. Більшість із них висвітлювала такі ускладнення, як діабетична ретинопатія, нейропатія, нефропатія, в той час як стан когнітивної функції вивчався набагато менше. Проте в дослідженнях з використанням нейропсихологічних тестів у пацієнтів із ЦД відзначалися більш низькі показники порівняно зі здоровими пацієнтами аналогічного віку [1]. Механізми ураження головного мозку за умов гіперглікемії не відрізняються від формування інших ускладнень ЦД, що призводять до ураження нейронів. Так, у дослідженні ACCORD (Action to Control Cardiovascular Risk), яке включало вивчення оцінки пам’яті (ACCORD-MIND), при обстеженні 2977 пацієнтів із ЦД 2-го типу було продемонстровано наявність зв’язку між підвищеним рівнем глікованого гемоглобіну (HbA1c) та зниженням рівня показників когнітивного тестування [2, 3]. Наявність гіпоглікемій може призводити до нейроглікопенії та порушень функції мозку. Епізоди тяжкої гіпоглікемії з необхідністю сторонньої допомоги суттєво підвищують розвиток деменції. Відомо, що розвиток деменції після тяжких гіпоглікемій відбувається переважно у пацієнтів похилого віку, оскільки вони мають нижчий когнітивний резерв [4]. ОДночасно вплив легких гіпоглікемій залишається не з’ясованим. При вивченні впливу нічних гіпоглікемій (рівень глікемії нижче 3,0 ммоль/л та тривалістю 101 ± 38 хв) на виконання нейропсихологічних тестів і час реакції у 8 пацієнтів молодого віку з ЦД 1-го типу було показано, що, незважаючи на порушення сну, нічні гіпоглікемії не погіршують пізнавальну функцію наступного ранку [5]. При проведенні метааналізу 33 досліджень, метою якого було дослідження впливу повторних епізодів гіпоглікемії та неадекватного метаболічного контролю на вираженість когнітивних порушень у пацієнтів із ЦД 1-го типу порівняно з групою контролю, продемонструвано зниження інтелекту [6]. Вираженість когнітивних порушень у пацієнтів була від легкої до помірної, але навіть легка форма когнітивної дисфункції може перешкоджати повсякденній діяльності та сприяти виникненню неадекватної реакції у більш складній ситуації, що може призвести до інвалідизації пацієнта [6]. У невеликому рандомізованому плацебо-контрольованому дослідженні було показано, що введення 20 ОД інтраназального інсуліну двічі на день протягом 21 дня у хворих із помірними когнітивними порушеннями призводило до кращого збереження вербальної інформації (р = 0,04) та покращення уваги (р = 0,01) [7]. Також було показано, що введення 10 ОД (р = 0,05), 20 ОД (р = 0,03), 40 ОД (р = 0,03) інтраназального інсуліну поліпшувало пізнавальну функцію, у той час як введення 60 ОД не давало позитивного результату. Дослідники зробили висновок, що низькі дози інсуліну мають більший позитивний вплив, ніж високі [7]. Отже, були отримані різні дані щодо впливу різних доз інтраназального інсуліну, епізодів гіпоглікемії та неадекватного метаболічного контролю на величину когнітивних порушень у пацієнтів з ЦД 1-го типу, але не було досліджено впливу різних видів інсуліну, а саме аналогів людського інсуліну, чи впливу постійного підшкірного введення інсуліну та впливу добових доз цих інсулінів на стан когнітивної сфери у пацієнтів з ЦД 1-го типу.
Мета нашої роботи — оцінювання стану когнітивної функції у пацієнтів молодого віку з ЦД 1-го типу та виявлення можливих факторів ризику.
Матеріали та методи
Було обстежено 33 пацієнти з ЦД 1-го типу, з них 17 жінок і 16 чоловіків. До контрольної групи було включено 10 осіб без ЦД, із них 6 жінок і 4 чоловіки. Критеріями виключення з дослідження були інсульт, черепно-мозкова травма, зловживання алкоголем.
Пацієнти не мали статистично вірогідної різниці за статтю, віком і тривалістю навчання. Характеристика пацієнтів подана в табл. 1. Дані наведені як середнє значення ± похибка середнього (М ± m).
Середній рівень HbA1c в обстежених хворих становив 8,74 ± 1,55 %. Середня тривалість захворювання на ЦД — 9,03 ± 8,02 року. Серед пацієнтів, хворих на ЦД, артеріальну гіпертензію в анамнезі мали 27,3 %, нейропатію — 39,4 %, в анамнезі у родичів наявність ЦД — 48,5 %, наявність інсульту у родичів — 24,2 %, епізоди гіпоглікемії (рівень глікемії нижче 3,9 ммоль/л) за останні 3 місяці — 63,6 %.
Всі пацієнти отримували інсулінотерапію, з них 12,5 % перебували на постійному підшкірному введенні інсуліну, 40,6 % отримували людський інсулін, 46,9 % — аналоги людського інсуліну. Залежно від дози інсуліну пацієнти були розподілені на 4 групи. До першої увійшли хворі, які отримували добову дозу інсуліну до 20 ОД, до другої — 21–40 ОД, до третьої — 41–60 ОД, до четвертої — 61 ОД і більше.
Оцінка порушення когнітивних функцій проводилась зранку за допомогою таких методів:
— тест «5 слів»;
— проби Шульте;
— шкала оцінки психічного статусу (MMSE);
— батарея тестів на лобну дисфункцію (БЛД);
— оцінка тесту «малювання годинника».
Шкала MMSE включала визначення орієнтування у часі, в місці, запам’ятовування, концентрацію уваги та рахування, згадування, мовлення та праксис. Якщо хворий набирав від 30 до 28, це означало відсутність когнітивних порушень, 27–24 бали — переддементні когнітивні порушення, 23–20 балів — легкі дементні порушення, 19–11 балів — помірні порушення, 10 балів і менше — тяжка деменція [8–10]. БЛД містила визначення концептуалізації, швидкості мовлення, динамічного праксису, просту та складну реакцію вибору та дослідження хватальних рефлексів. Якщо пацієнт набирав 18–16 балів, це відповідало нормальним когнітивним функціям, 15–12 балів — свідчило про помірну лобну дисфункцію за відсутності деменції, а 11 балів та нижче — про деменцію лобного типу [11–13].
Також хворому пропонували намалювати годинник, який показує певний час. Якщо зображений годинник оцінювався у 9 балів та нижче, це свідчило про клінічно значущі когнітивні порушення [14]. При проведенні тесту «5 слів», якщо хворий згадував менше 8 слів, це також оцінювалось як прояв когнітивних порушень [15].
Статистична обробка результатів проводилась за допомогою програми SPSS‑15.
Результати
У пацієнтів із ЦД 1-го типу виявлено вірогідне зниження когнітивних функцій порівняно з особами контрольної групи за даними нейропсихологічних тестів (табл. 2).
За даними оцінки психічного статусу, серед пацієнтів із ЦД 1-го типу відсутність когнітивних порушень була діагностована у 45,5 % пацієнтів, переддементні когнітивні порушення — у 48,5 %, дементні — у 6,0 % хворих. Загалом порушення когнітивної функції відзначалися у 54,5 % обстежених. У групі контролю тільки в однієї особи було діагностовано переддементні порушення.
За даними БЛД, у 45,5 % пацієнтів отримані дані свідчили про нормальну когнітивну функцію, у 48,5 % — про помірну лобну дисфункцію, у 6,0 % — деменцію лобного типу. В контрольній групі 10 % обстежених мали помірну лобну дисфункцію.
За даними тесту «5 слів», у групі контролю не було виявлено осіб із когнітивними порушеннями, в той час як серед пацієнтів, хворих на ЦД 1-го типу, у 63,6 % було діагностовано зниження когнітивних функцій.
За даними тесту «малювання годинника», когнітивні порушення спостерігались у 54,5 % пацієнтів з ЦД 1-го типу, в контрольній групі у всіх обстежених не було когнітивних порушень.
Отже, за даними нейропсихічних тестів, частота когнітивних порушень становить від 54,5 % за даними тесту «малювання годинника» до 63,6 % за даними тесту «5 слів».
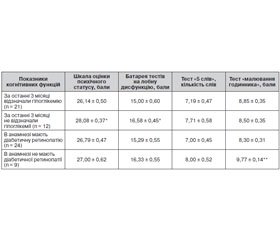
Було відзначено вірогідне зниження показників нейропсихологічних тестів, а саме за оцінкою БЛД та шкалою оцінки психічного статусу, у пацієнтів, які мали в анамнезі гіпоглікемію за останні 3 місяці порівняно з особами без гіпоглікемій. Також відзначався вірогідний негативний вплив на виконання тесту «малювання годинника» наявної у пацієнтів діабетичної ретинопатії в анамнезі (табл. 3).
Не було знайдено впливу на стан когнітивної функції периферичної нейропатії, артеріальної гіпертензії, хронічної хвороби нирок, рівня загального холестерину, рівня тригліцеридів, наявності в анамнезі родичів, хворих на ЦД, родичів, які перенесли інсульт.
Був проведений аналіз стану когнітивної сфери між групами пацієнтів, які отримували аналоги інсуліну, людські інсуліни чи були на постійному підшкірному введенні інсуліну.
Обговорення
За результатами табл. 4, пацієнти, які отримували інсулінотерапію на основі аналогів людського інсуліну, мали вірогідно вищі показники за даними нейропсихологічних тестів, а саме БЛД та MMSE, тобто стан когнітивної функції у них був кращий, ніж у групі, яка отримувала людські інсуліни як інсулінотерапію.
Цікавий той факт, що між групами пацієнтів, які отримували інсулінотерапію у вигляді постійного підшкірного введення інсуліну, людські інсуліни та аналоги людського інсуліну, вірогідної різниці не спостерігалося. Можливо, це пов’язано з кількістю пацієнтів, які мали гіпоглікемію, в кожній групі. Так, у групі, яка отримувала аналоги людського інсуліну, 40,0 % хворих мали гіпоглікемії, на людських інсулінах — 71,43 %, при постійному підшкірному введенні інсуліну — 75,0 % пацієнтів.
З метою аналізу когнітивної функції залежно від добової дози інсуліну пацієнти були розподілені на 3 групи. До першої зарахували пацієнтів із добовою дозою інсуліну до 40 ОД, до другої — від 41 до 60 ОД, до третьої — від 61 ОД та більше.
Згідно з табл. 5, найбільш вірогідно низькі показники відзначалися в групі III (добова доза понад 60 ОД), тоді як у групі I показники когнітивної функції були найкращі за даними оцінки БЛД. Очевидно, це також пов’язано з більшим відсотком пацієнтів, які мали гіпоглікемічні явища. Так, у групі III було 75,0 % хворих, які мали гіпоглікемію, тоді як у групі I було 66,7 % таких пацієнтів.
Висновки
1. У пацієнтів із ЦД 1-го типу відзначається погіршення когнітивної функції за даними нейропсихологічних тестів порівняно з особами контрольної групи.
2. За даними нейропсихологічних тестів, частота когнітивних порушень у пацієнтів із ЦД 1-го типу становить від 54,5 до 63,6 % (залежно від проведеного тесту).
3. На стан когнітивної функції впливає наявність гіпоглікемії та діабетичної ретинопатії. Наявність нейропатії, хронічної хвороби нирок, рівні загального холестерину, тригліцеридів, наявність у родичів ЦД, інсульту не впливають на показники когнітивної функції.
4. Пацієнти, які отримують інсулінотерапію на основі аналогів людського інсуліну, мають вірогідно кращі показники когнітивної функції, що пояснюється меншою кількістю випадків гіпоглікемії порівняно з терапією людськими інсулінами та постійним підшкірним введенням інсуліну.
5. Пацієнти з добовою дозою інсуліну понад 60 ОД мають вірогідно гірші показники когнітивної функції за даними нейропсихологічних тестів, а саме за БЛД, порівняно з групою, яка отримує добову дозу менше 40 ОД, що також може бути пов’язано з більшою кількістю проявів гіпоглікемії.
Список литературы
1. Strachan M.W.J., Reynolds R.M., Frier B.M. The relationship between type 2 diabetes and dementia // British Medical Bulletin. — 2008. — Vol. 88. — P. 131-146.
2. Cukierman-Yaffe T., Gerstein H.C., Williamson J.D., Lazar R.M., Lovato L., Miller M.E., Coker L.H., Murray A., Sullivan M.D., Marcovina S.M., Launer L.J. Relationship between baseline glycemic control and cognitive function in individuals with type 2 diabetes and other cardiovascular risk factors: the action to control cardiovascular risk in diabetes-memory in diabetes (ACCORD-MIND) trial // Diabetes Care. — 2009 Feb. — Vol. 32(2). — P. 221-6.
3. Launer L.J., Miller M.E., Williamson J.D., Lazar R.M., Gerstein H.C., Murray A.M., Sullivan M., Horowitz K.R., Ding J., Marcovina S., Lovato L.C., Lovato J., Margolis K.L., O’Connor P., Lipkin E.W., Hirsch J., Coker L., Maldjian J., Sunshine J.L., Truwit C. et al. ACCORD MIND Investigators. Effects of intensive glucose lowering on brain structure and function in people with type 2 diabetes (ACCORD-MIND): a randomised open-label substudy // Lancet Neurol. — 2011. — Vol. 10(11). — P. 969-77.
4. Rachel A. Whitmer, Andrew J. Karter, Kristine Yaffe, Charles P. Quesenberry, Jr., and Joseph V. Selby. Hypoglycemic Episodes and Risk of Dementia in Older Patients with Type 2 Diabetes Mellitus // JAMA. — 2009 Apr 15. — Vol. 301(15). — P. 1565-1572.
5. Bendtson I., Gade J., Theilgaard A., Binder C. Cognitive function in type 1 (insulin-dependent) diabetic patients after nocturnal hypoglycaemia // Diabetologia. — 1992 Sep. — Vol. 35(9). — P. 898-903. PMID1397787.
6. Brands M.A., Biessels G.J., De Haan H.F., Kappelle L.J., Kessels P.C. A meta-analysis. The Effects of Type 1 Diabetes on Cognitive Performance // Diabetes Care. — 2005. — Vol. 28, Numer 3. — P. 726-735. [http://care.diabetesjournals.org/content/28/3/726.full]
7. Reger M.A., Watson G.S., Green P.S., Wilkinson C.W., Baker L.D., Cholerton B., Fishel M.A., Plymate S.R., Breitner J.C., DeGroodt W., Mehta P., Craft S. Intranasal insulin improves cognition and modulates beta-amyloid in early AD // Neurology. — 2008. — Vol. 70(6). — P. 440-448 [PubMed].
8. Pangman V.C., Sloan J., Guse L. An Examination of Psychometric Properties of the Mini-Mental State Examination and the Standardized Mini-Mental State Examination: Implications for Clinical Practice // Applied Nursing Research. — 2000. — Vol. 13(4). — P. 209-213. doi: 10.1053/apnr.2000. 9231. PMID11078787.
9. Mungas D. In-office mental status testing: a practical guide // Geriatrics. — July 1991. — Vol. 46(7), № 54–8. — P. 63, 66. PMID2060803.
10. Lloyan D., Timothy D., Standish M. Mental Status and Neuropsychological Assessment. A Guide to the Standardized Mini-Mental State Examination // International Psychogeriatrics. — 1997. — Vol. 9, Suppl. 1. — P. 87-94.
11. Lavarone A., Ronga B., Pellegrino L., Loré E., Vitaliano S., Galeone F., Carlomagno S. The Frontal Assessment Battery (FAB): normative data from an Italian sample and performances of patients with Alzheimer’s disease and frontotemporal dementia // Functional Neurology. — 2004. — Vol. 19(3). — P. 191-195.
12. Dubois B., Slachevsky A., Litvan I., Pillon B. The FAB: a frontal assessment battery at bedside // Neurology. — 2000. — Vol. 55. — P. 1621-1626.
13. Bruno Kopp, Nina Rӧser, Sandra Tabeling, Hans Jurg Sturenburg, Bianca de Haan, Hans-Otto Karnath and Karl Wessel. Performance on the Frontal Assessment Battery is sensitive to frontal lobe damage in stroke patients // BMC Neurology. — 2013. — Vol. 13. — P. 179.
14. Berit Agrell, Ove Dehljn. The clock-drawing test // Age and Ageing. — 1998. — Vol. 27. — P. 399-403.
15. Mazzoleni R., Peeters J.C., Lakaye A., Decock C., Uytdenhoef P., Jacquy J. The five-word test in memory deficiency // Rev. Med. Brux. — 2004 Oct. — Vol. 25(5). — P. 437-41.

/44.jpg)
/45.jpg)
/45_2.jpg)
/46.jpg)