Статтю опубліковано на с. 70-75
Вступ
Регулярне надходження есенціальних мікроелементів (ЕМ) до організму дитини абсолютно необхідне для його нормальної життєдіяльності [8, 9]. ЕМ (залізо, йод, мідь, марганець, цинк, кобальт, молібден, селен, хром, фтор) входять до складу ферментів, вітамінів, гормонів і безпосередньо впливають на роботу ендокринної системи на різних етапах її розвитку. Дефіцит мікроелементів, як і їх надлишок, призводить до порушень розвитку та росту дітей; визначені порушення мікроелементного обміну обов’язково потребують корекції. Крім того, дефіцит кожного з ЕМ може суттєво погіршити перебіг і прогноз вже існуючого захворювання в дитини [3].
Оскільки мікроелементи відіграють важливу роль у забезпеченні повноцінного розвитку та росту дітей [10, 12], вивчення мікроелементного стану є актуальним. Не викликає сумнівів, що дефіцит мікроелементів негативно впливає на процеси метаболізму в дитячому віці. Однак на тлі значної кількості досліджень мікроелементного стану в дитячій популяції загалом практично відсутні роботи щодо вмісту есенціальних мікроелементів, зокрема цинку, селену, міді, хрому, марганцю, в дітей із вже наявним порушенням росту. Відсутні комплексні дослідження вмісту декількох ЕМ у дітей різних вікових груп із низькорослістю, що пов’язана або не пов’язана із соматотропною недостатністю. До кінця не з’ясований взаємозв’язок між системою гормон росту (ГР)/інсуліноподібний фактор росту 1 (ІФР‑1) та ЕМ у дітей із низькорослістю різного генезу. В Україні подібні дослідження практично не виконувались, відсутні дані щодо особливостей мікроелементного стану при патології росту, зокрема при низькорослості внаслідок дефіциту ГР.
Мета дослідження — встановити вміст ІФР‑1 та есенціальних мікроелементів у плазмі крові в дітей із різними формами низькорослості.
Матеріали та методи
У дослідження включено 240 осіб: 166 хлопців (69,17 %) та 74 дівчинки (30,83 %) віком від 3 до 18 років (середній вік 9,65 ± 0,17 року). Серед них 206 дітей та підлітків із різними формами низькорослості: 144 хлопчики (69,9 %) та 62 дівчинки (30,1 %), середній вік яких становив 10,06 ± 0,20 року (табл. 1, 2).
Контрольну групу становили 34 пацієнти (22 хлопчики, 64,71 %) віком 3–18 років (середній вік 9,08 ± 0,50 року). Пацієнти перебували під наглядом у відділі дитячої ендокринної патології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України». Період спостереження становив 4 роки.
У всіх дітей здійснювали загальне клінічне обстеження (табл. 3). До початку обстеження пацієнти та їх батьки надали інформовану згоду на участь у дослідженні та використання отриманих даних.
/71_3.jpg)
Ріст вимірювали за допомогою стадіометра System Dr. Keller J., масу тіла — за допомогою електронних вагів SECA890. Дефіцит росту визначали за перцентильними таблицями варіантів нормального росту. Для визначення кістковогу віку використовували атлас W.W. Greulich та S.P. Pyle (1993). Статевий розвиток оцінювали за J.M. Tanner (1962). Рівень ІФР‑1 у крові визначали радіоімунологічним методом за допомогою стандартних наборів IRMA IGF‑1 фірми Immunotech (Чехія). Вміст мікроелементів (цинку, селену, марганцю, хрому, міді) у плазмі крові визначали за допомогою рентген-флуоресцентного спектрометра ElvaX-med (Україна) за методикою виконання вимірювань вмісту хімічних елементів у плазмі крові (методика МВВ 081/12-0468-07), що атестована Українським державним комітетом із стандартизації, метрології та сертифікації (свідоцтво від 12.10.2007 р.) і затверджена Державною санітарно-епідеміологічною службою України (Постанова № 8 від 05.10.2000 р.). Статистичну обробку результатів дослідження виконували з використанням статистичних програм Microsoft Excel із застосуванням методів варіаційної статистики. Результати надані як середні значення та їх стандартна похибка (M ± m). Статистичну вірогідність оцінювали за параметричним критерієм Стьюдента (t). Різниця в результатах вважалася вірогідною при р < 0,05, при 0,05 < р < 0,01 відмічали тенденцію до вірогідності. Для вивчення кореляційного зв’язку використовували метод прямої кореляції, знаходячи коефіцієнти кореляції (r) та детермінації (D).
Результати дослідження
Установлено, що середній рівень ІФР‑1 у сироватці крові в дітей із низькорослістю (загалом по групі, n = 206) становив 150,21 ± 8,41 нг/мл, що вірогідно
нижчий, ніж у контрольній групі — 202,85 ± 13,78 нг/мл, р < 0,001. Рівень ІФР‑1 у хлопчиків із низькорослістю був вірогідно нижчим, ніж у контрольній групі (142,16 ± 9,41 та 193,86 ± 16,51 нг/мл відповідно, р < 0,01) та ніж у дівчат з низькорослістю (р < 0,05). У дівчат також спостерігалася вірогідна різниця рівнів ІФР‑1 порівняно з показниками в групі контролю (168,87 ± 8,48 та 219,32 ± 18,84 нг/мл відповідно, р < 0,05). Проаналізовано рівні ІФР‑1 у плазмі крові в хлопчиків та дівчат при різних формах низькорослості (табл. 4). Найнижчі показники рівня ІФР‑1 у плазмі крові спостерігали в пацієнтів ІІІ, І та ІІ груп.
/72.jpg)
У пацієнтів І групи загалом (діти з низькорослістю, обумовленою повною соматотропною недостатністю) середній рівень ІФР‑1 та рівень у хлопчиків і дівчат окремо були вірогідно нижчими, ніж у контрольній групі (р < 0,001). Вірогідної різниці між показниками ІФР‑1 хлопчиків і дівчат І групи виявлено не було (р > 0,1). Середнє відхилення ІФР‑1 становило –1,65 ± 0,09 SD, вірогідної різниці між показниками SD у хлопчиків і дівчат не спостерігали (р > 0,1).
У II групі пацієнтів (діти з низькорослістю, обумовленою частковою соматотропною недостатністю) середній рівень ІФР‑1 та рівень у хлопчиків і дівчат були вірогідно нижчими, ніж у контрольній групі (р < 0,05). Показники рівня ІФР‑1 у хлопчиків були нижчими, ніж у дівчат, але не вірогідно (р > 0,1). Середнє відхилення ІФР‑1 становило –0,97 ± 0,11 SD, вірогідної різниці між показниками SD ІФР‑1 у хлопчиків і дівчат не спостерігали (р > 0,1).
У пацієнтів ІII групи (діти з низькорослістю, обумовленою синдромом біологічно неактивного гормону росту) середні показники рівня ІФР‑1, а також рівень ІФР‑1 у хлопчиків і дівчат були найнижчі серед усіх груп і вірогідно нижчі, ніж у конт–рольній групі (р < 0,001). Крім того, показники ІФР‑1 у дівчат були вірогідно нижчими, ніж у хлопців (48,86 ± 11,28 та 96,97 ± 12,66 нг/мл відповідно, р < 0,01). Середнє відхилення ІФР‑1 було найбільшим і становило –1,61 ± 0,13 SD, вірогідної різниці між показниками SD у хлопчиків і дівчат не спостерігали (р > 0,1). У IV групі хворих (діти з сімейно-конституціональною низькорослістю) середні показники ІФР‑1, а також рівень ІФР‑1 у хлопчиків і дівчат окремо не мали вірогідної різниці з групою контролю (р > 0,1). Показники ІФР‑1 у дівчат були вірогідно вищими, ніж у хлопців (360,34 ± 31,15 та 219,57 ± 12,66 нг/мл відповідно, р < 0,001). Середнє відхилення ІФР‑1 становило –0,52 ± 0,09 SD, вірогідної різниці між показниками SD ІФР‑1 у хлопчиків і дівчат не спостерігалось (р > 0,1).
У V групі пацієнтів (діти з генетично детермінованою низькорослістю) середній рівень ІФР‑1 у плазмі крові був нижчим, ніж у контрольній групі, з тенденцією до вірогідності (0,05 < р < 0,1). Вірогідної різниці між показниками ІФР‑1 у хлопчиків порівняно з показниками контрольної групи виявлено не було (р > 0,1). У дівчат показники ІФР‑1 у плазмі крові були нижчими, ніж у дівчат у контрольній групі з тенденцією до вірогідності (0,05 < р < 0,1). Середнє відхилення ІФР‑1 становило –1,31 ± 0,19 SD, у хлопчиків відставання від показників ІФР‑1 не спостерігали, у дівчат відставання було досить вираженим — –1,69 ± 0,24 SD.
Для вивчення взаємозв’язку ІФР‑1 та мікроелементів проведено кореляційний аналіз цих показників (табл. 5).
/73.jpg)
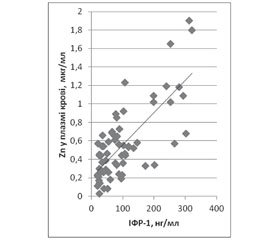
Таким чином, виявлено вірогідно слабкий кореляційний зв’язок між показниками ІФР‑1 та середнім рівнем цинку в плазмі крові дітей із низькорослістю (р < 0,01). Кореляція між середніми показниками цинку в плазмі крові дітей із низькорослістю становить 0,0915, що свідчить про дуже слабкий кореляційний зв’язок між цими показниками. У той же час у групі дітей з ізольованою соматотропною недостатністю, повною або частковою (І, ІІ групи), виявлено вірогідно сильний кореляційний зв’язок між показниками ІФР‑1 та цинку в плазмі крові. Кореляція між середніми показниками цинку в плазмі крові дітей І та ІІ груп — 0,2766 та 0,3982 відповідно, що свідчить про слабкий кореляційний зв’язок між цими показниками. У дітей ІІІ групи в плазмі крові виявлено вірогідно середній кореляційний зв’язок між показниками ІФР‑1 та рівнем цинку. А кореляція між середніми показниками цинку в плазмі крові дітей цієї групи становила 0,5246, що говорить про середній кореляційний зв’язок між цими показниками. У ІV групі кореляційний зв’язок між показниками цинку та ІФР‑1 у плазмі крові вірогідно слабкий, а між середніми показниками цинку — дуже слабкий (r = 0,0220). У V групі вірогідного кореляційного зв’язку між показниками ІФР‑1 та цинком не виявлено. А кореляція між середніми показниками цинку в плазмі крові дітей цієї групи становила 0,5230, що свідчить про середній кореляційний зв’язок між цими показниками (рис. 1).
Кореляційного зв’язку між показниками ІФР‑1 у плазмі крові та показниками селену, марганцю, хрому, міді в плазмі крові виявлено не було.
Обговорення результатів
Результати популяційних досліджень свідчать про вкрай недостатнє споживання вітамінів та мікроелементів (залізо, цинк, йод) [5, 13].
У наших дослідженнях наголошується на суттєвому порушенні мікроелементного стану в дітей із низькорослістю незалежно від етіології захворювання. Разом із тим у більшості пацієнтів із низькорослістю спостерігаються порушення в системі гормон росту/інсуліноподібний фактор 1, а саме — різке зниження базального та стимульованого рівнів гормону росту та ІФР‑1 у плазмі крові. Наші дані свідчать про тісний взаємозв’язок системи росту з ЕМ цинком, що співпадає з даними щодо участі цинку в гормональній регуляції поділу клітин та впливу на систему ГР/ІФР‑1. Дефіцит цинку супроводжується зниженням рівня ІФР‑1, а в деяких випадках і гормону росту за рахунок його участі в сигнальній взаємодії гормонів [11]. Доведено, що в структурі ГР є ділянка, що зв’язує молекулу гормону росту з цинком, що важливий для функції гормону росту [7]. Висока концентрація цинку в гіпофізі забезпечує утворення димера ГР, що менш схильний до деградації [4]. Експериментальні дані показали, що в щурів з адекватним рівнем цинку введення рекомбінантного ГР стимулює ріст кісткової тканини, а в цинк-дефіцитних тварин такого впливу не виявлено [6]. Цинк має прямий (синтез ДНК, РНК, білків) та опосередкований (через ГР і ІФР‑1) вплив на процеси росту. Вивчення впливу дефіциту цинку на темпи зростання проводиться в багатьох країнах світу: Туреччині, Ірані, Японії та ін. [14]. В Україні дослідження стану мікроелементів та їх взаємозв’язок із системою ГР/ІФР‑1 у дітей із низькорослістю вперше започатковані у відділі дитячої ендокринної патології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» [1, 2].
Доведено чіткий кореляційний взаємозв’язок рівня цинку та ІФР‑1 у плазмі крові в дітей із низькорослістю, що свідчить про можливість і доцільність застосування препаратів цинку при комплексному лікуванні дітей із відставанням у рості з метою підвищення рівня ІФР‑1 і, відповідно, підвищення ефективності ріст-коригуючої терапії.
Висновки
1. Установлено наявність суттєвого дисбалансу есенціальних мікроелементів у пацієнтів із низькорослістю, перш за все обумовленою дефіцитом гормону росту та інсуліноподібного фактора росту 1.
2. Виявлено вірогідно слабкий кореляційний зв’язок між показниками ІФР‑1 та середнім рівнем цинку в плазмі крові дітей із низькорослістю загалом по групі. У той же час у дітей з ізольованою соматотропною недостатністю, повною або частковою, виявлено вірогідно сильний кореляційний зв’язок між показниками інсуліноподібного фактора росту 1 та цинку в плазмі крові.
3. Кореляційного зв’язку між показниками інсуліноподібного фактора росту 1 у плазмі крові та селену, марганцю, хрому, міді не виявлено.
4. Отримані дані свідчать про доцільність вивчення мікроелементного стану в дітей із низькорослістю та проведення відповідної корекції в разі виявлення дефіциту есенціальних мікроелементів.
Конфлікт інтересів. Автори гарантують відсутність конфлікту інтересів та власної фінансової зацікавленості при виконанні роботи та написанні статті.
Список литературы
1. Большова О.В., Пахомова В.Г. Цинк і його значення для росту та статевого розвитку дітей // Клінічна ендокринологія та ендокринна хірургія. — 2011. — № 3(36). — С. 77-82.
2. Большова О.В., Пахомова В.Г., Спринчук Н.А. Вміст цинку в організмі дітей та підлітків з соматотропною недостатністю // Лікарська справа. — 2013. — № 5. — С. 70-75.
3. Гончарова Н.Н. Физическое развитие и функциональное состояние детей младшего школьного возраста с различным уровнем соматического здоровья / Н.Н. Гончарова // Педагогика, психология и медико-биологические проблемы физического воспитания и спорта. — 2007. — № 5. — С. 57-59.
4. Нетребенко O.K. Некоторые эссенциальные микронутриенты в питании недоношенных детей / O.K. Нетребенко. — М., 2004. — С. 5-83.
5. Ahn J. Effects of zinc and essential acids deficiency on the lymphatic adsorption of vitamin A and secretion of phospholipids / J. Ahn, S.I. Koo // J. Nutr. Bioch. — 1995. — Vol. 6 — P. 595-603.
6. Growth hormone and bone / C. Ohlsson, B.A. Bengtsson, O.G. Isaksson Isaksson et al. // Endocrin. Rev. — 1998. — Vol. 19. — P. 55-79.
7. Growth hormone-releasing factor affects macronutrient intake during the anabolic phase of zinc repletion: total hypothalamic growth hormone-releasing factor content and growth hormone-releasing factor immunoneutralization during zinc repletion / T.M. Rains, H.F. Mangian, T. Liang et al. // J. Nutritional Neuroscience. — 2001. — Vol. 4, № 4. — P. 282-294.
8. Gude D. Tracing elements’ in hair / D. Gude // Int. J. Trichology. — 2011. — Vol. 3, № 2. — P. 132-133.
9. Ozmen H. The levels of calcium and magnesium, and of selected trace elements, in whole blood and scalp hair of children with growth retardation / H. Ozmen, S. Akarsu, F. Polat, A. Cukurovali // Iran J. Pediatr. — 2013. — Vol. 23, № 2. — P. 125-130.
10. Imdad A. Effect of preventive zinc supplementation on linear growth in children under 5 years of age in developing countries: a meta-analysis of studies for input to the lives saved tool / A. Imdad, Z.A. Bhutta // BMC Public Health. — 2011. — Vol. 11, Suppl. 3. — P. 22.
11. MacDonald R. The role of zinc in growth and cell proliferation / R. MacDonald // J. Nutr. — 2000. — Vol. 130. — P. 1500-1508.
12. Mayo-Wilson E. Zinc supplementation for preventing mortality, morbidity, and growth failure in children aged 6 months to 12 years of age / E. Mayo-Wilson, J.A. Junior, A. Imdad et al. // Cochrane Database of Systematic Reviews. — 2014. — Issue 5. Art. No.: CD009384.
13. Ren S.C. Direct administration of testosterone increases rat tibial epiphyseal growth plate width / S.С. Ren, S. Malozovski, P. Sanches // Acta Endocrinol. — 1989. — Vol. 121. — P. 401-404.
14. World Health Organization. Trace elements in human nutrition. — Geneva: WHO, 1992.
/71_2.jpg)
/73_2.jpg)

/71.jpg)
/71_3.jpg)
/72.jpg)
/73.jpg)