Международный эндокринологический журнал 4 (76) 2016
Вернуться к номеру
Кальцифікація й апоптоз клітин крові як маркер наявності, тяжкості і прогресування ішемічної хвороби серця у поєднанні з цукровим діабетом 2-го типу: ультраструктурні та цитологічні дослідження
Авторы: Кияк Ю.Г., Когут М.А., Андрушевська О.Ю., Когут Л.М., Кияк Г.Ю., Барнетт О.Ю. - Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
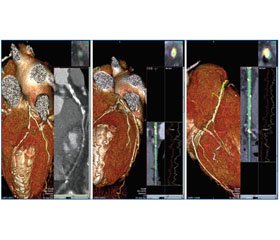
Актуальність. Збільшення внутрішньоклітинного вмісту Са2+ призводить до запуску процесів апоптозу і кальцифікації клітин крові та серцево-судинної системи. Тісний зв’язок між апоптозом клітин крові та їх кальцифікацією дає підстави вважати кальцій важливим маркером та ініціатором цього процесу. Мета роботи — дослідити ультраструктурні зміни та стан клітинного імунітету у пацієнтів з гострим коронарним синдромом (ГКС) і цукровим діабетом (ЦД) 2-го типу і виявити асоціацію між збільшенням внутрішньоклітинного кальцію в еритроцитах та кальцифікацією вінцевих артерій. Матеріали та методи. Обстежені 20 пацієнтів із ГКС у поєднанні з ЦД 2-го типу. Контрольну групу становили 10 осіб. Середній вік пацієнтів — 65,0 ± 5,6 року. Було проведено: мультиспіральну комп’ютерну томографію; цитологічне визначення солей кальцію в еритроцитах за методом Мак-Гі-Рассела; імунологічні дослідження апоптозу лейкоцитів за допомогою набору ApoLect; електронну мікроскопію для виявлення ультраструктурних ознак апоптозу клітин крові. Результати. У пацієнтів з високим і дуже високим індексом кальцифікації вінцевих артерій цитологічно спостерігається наявність в еритроцитах гранул кальцію різної величини і форми, фіолетово-синього забарвлення, анізо- та пойкілоцитоз еритроцитів; імунологічно — збільшення кількості апоптотично змінених і поява некротично змінених клітин крові; характерні також класичні ультраструктурні ознаки апоптозу лейкоцитів. Висновки. Наявність ГКС у пацієнтів із ЦД 2-го типу супроводжується активацією процесів апоптозу лейкоцитів, накопиченням іонів кальцію в еритроцитах, що асоціюється з високим і дуже високим індексом кальцифікації вінцевих артерій. Виявлення таких змін при дослідженні периферичної крові пацієнтів дає можливість вчасно запідозрити загрозу виникнення ішемічної хвороби серця й запобігти розвитку її тяжких ускладнень.
Актуальность. Увеличение внутриклеточного содержания Са2+ приводит к запуску процессов апоптоза и кальцификации клеток крови и сердечно-сосудистой системы. Тесная связь между апоптозом клеток крови и их кальцификацией дает основание считать кальций важным маркером и инициатором этого процесса. Цель роботы — исследовать ультраструктурные изменения и состояние клеточного иммунитета у пациентов с острым коронарным синдромом (ОКС) и сахарным диабетом (СД) 2-го типа, выявить ассоциацию между увеличением внутриклеточного кальция в эритроцитах и кальцификацией коронарних артерий. Материалы и методы. Обследованы 20 пациентов с ОКС в сочетании с СД 2-го типа. Контрольная группа представлена 10 пациентами. Средний возраст пациентов составил 65,0 ± 5,6 года. Проведена мультиспиральная компьютерная томография; цитологическое определение солей кальция в эритроцитах по методу Мак-Ги-Рассела; иммунологические исследования апоптоза лейкоцитов с помощью набора ApoLect; электронная микроскопия для выявления ультраструктурних признаков апоптоза клеток крови. Результаты. У пациентов с высоким и очень високим индексом кальцификации коронарних артерий цитологически наблюдается наличие в эритроцитах гранул кальция различной величины и формы, фиолетово-синей окраски, анизо- и пойкилоцитоз эритроцитов; иммунологически — увеличение количества апоптотически измененных и появление некротически измененных клеток крови; характерными также являються классические ультраструктурные признаки апоптоза лейкоцитов. Выводы. Наличие ОКС у пациентов с СД 2-го типа сопровождается активацией процессов апоптоза лейкоцитов, накоплением ионов кальция в эритроцитах, что ассоциируется с высоким и очень високим индексом кальцификации коронарних артерий. Выявление данных изменений при исследовании периферической крови пациентов дает возможность своевременно заподозрить угрозу возникновения ишемической болезни сердца и предупредить развитие тяжелых ее осложнений.
Background. The increase of intercellular content of Ca2+ leads to the initiation of apoptosis processes and calcification of the cells of the blood and cardiovascular system. The close relationship between the apoptosis of blood cells and their calcification gives reason to believe that calcium is an important marker and initiator of this process. Objective of the study — to follow-up ultrastructural changes and the state of cellular immunity in patients with acute coronary syndrome (ACS) and type 2 diabetes mellitus (DM), and to identify the association between increased intracellular calcium in red blood cells and calcification of coronary arteries. Materials and methods. The study involved 20 patients with ACS associated with type 2 DM. The control group included 10 persons. The average age of patients was 65.0 ± 5.6 years. The following examinations were performed: multispiral computed tomography; cytological determination of calcium salts in red blood cells using McGee-Russell method; immunological study of leukocyte apoptosis by means of ApoLect set; electron microscopy for detection of ultrastructural signs of blood cell apoptosis. Results. In patients with high and very high index of calcification of the coronary arteries, the presence of calcium granules of various sizes and shapes in red blood cells can be detected cytologically, as well as aniso- and poikilocytosis; immunologically — an increase in the number of apoptotically altered blood cells and the appearance of necrotically modified ones; also, classic ultrastructural signs of leukocyte apoptosis are typical. Conclusions. The presence of ACS in patients with type 2 DM is associated with activation of leukocyte apoptosis processes, accumulation of calcium ions in red blood cells, which is accompanied by a high and very high index of calcification of the coronary arteries. Detection of such changes in the study of peripheral blood of patients enables to suspect timely the threat of coronary heart disease and to prevent its serious complications.
апоптоз, кальцифікація, гострий коронарний синдром, цукровий діабет 2-го типу, клітини крові.
апоптоз, кальцификация, острый коронарный синдром, сахарный диабет 2-го типа, клетки крови.
apoptosis, calcification, acute coronary syndrome, type 2 diabetes mellitus, blood cells.
Статтю опубліковано на с. 15-21
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
1. Біохімічні механізми апоптозу: Навчальний посібник/ Л.І. Остапченко, Т.Б. Синельник, Т.В. Рибальченко, В.К. Рибальченко. — К.: Видавничо-поліграфічний центр «Київський університет», 2010. — С. 8-9.
2. Гандзюк В.А. Аналіз захворюваності на ішемічну хворобу серця в Україні / В.А. Гандзюк // Український кардіологічний журнал. — 2014. — № 3. — С. 45-52.
3. Діагностика ураження коронарних артерій у хворих на ішемічну хворобу серця за допомогою мультизрізової комп’ютерної томографії / О.С. Никоненко, А.О. Никоненко, Б.С. Гавриленко, А.І. Лозовий // Запорізький медичний журнал. — 2015. — № 1(88). — С. 4-8.
4. Колісник Н.В. Біологія нейтрофілів, сучасний погляд. Огляд / Н.В. Колісник, Ж.С. Качанова // Вісник Запорізького національного університету. — 2009. — № 1.
5. Стан системи нейтрофільних гранулоцитів як чинник ризику післяопераційних ускладнень при аневризмах черевної аорти / І.В. Гомоляко, П.І. Нікульніков, О.В. Ліскунов [та ін.] // Серце і судини. — 2015. — № 3. — С. 80-85.
6. Целуйко С.С. Предполагаемые механизмы гистохимического исследования кальция, железа, натрия, цинка др. и витаминов в организме: Метод. рекомендации / С.С. Целуйко, С.В. Зиновьев. — ГБОУ ВПО Амурская государственная медицинская академия, г. Благовещенск, 2013. — С. 17.
7. Associations between C-reactive protein, coronary arterycalcium, and cardiovascular events: Implications for the JUPITER population from MESA, a population-based cohort study / M.J. Blaha, M.J. Budoff, A.P. DeFilippis [et al.] // Lancet. — 2011. — Vol. 378. — Р. 684-692.
8. Coronary artery calcification is an independent stroke predictor in the general population / D.M. Hermann, J. Gronewold, N. Lehmann [et al.] // Stroke. — 2013. — Vol. 44. — Р. 1008-1013.
9. Coronary artery calcium score and risk classification for coronary heart diseaseprediction / T.S. Polonsky, R.L. McClelland, N.W. Jorgensen [et al.] // JAMA. — 2010. — Vol. 303. — Р. 1610-1016.
10. Coronary calcium score improves classification of coronary heart disease risk in the elderly: The Rotterdam study / S.E. Elias-Smale, R.V. Proenca, M.T. Koller [et al.] // J. Am. Coll. Cardiol. — 2010. — Vol. 56. — Р. 1407-1414.
11. Effect of high glucose concentrations on human erythrocytes in vitro / Jana Viskupicova, Dusan Blaskovic, Sabina Galiniak [et al.] // Redox Biology. — 2015. — Vol. 5. — Р. 381-387.
12. Erythrocyte: Programmed Cell Death, Anemia. Donald Silverberg, Daniela Vittori, Daiana Vota, Alcira Nesse (Ed.). — 2012. — Available from: http://www.intechopen.com/books/anemia/erythrocyte-programmed-cell-death
13. Family history of coronary heart disease and the incidence and progression of coronary artery calcification: Multi-Ethnic Study of Atherosclerosis (MESA) / A.K. Pandey, M.J. Blaha, K. Sharma [et al.] // Atherosclerosis. — 2014. — Vol. 232. — Р. 369-376.
14. Increased cation conductance in human erythrocytes artificially aged by glycation / Y.V. Kucherenko, S.K. Bhavsar, V.I. Grischenko [et al.] // J. Membr. Biol. — 2010. — Vol. 235. — Р. 177-189.
15. Kumar R. Biochemical changes in erythrocyte membrane in type 2 diabetes mellitus / R. Kumar // Indian J. Med. Sci. — 2012. — Vol. 66. — Р. 131-135.
16. Manno S. ATP-dependent mechanism protects spectrin against glycation in human erythrocytes / S. Manno, N. Mohandas, Y. Takakuwa // J. Biol. Chem. — 2010. — Vol. 285. — Р. 33923-33929.
17. Oxidative damage increases intracellular free calcium [Ca2+] concentration in human erythrocytes incubated with lead / M.A. Quintanar-Escorza, M.T. Gonzalez-Martinez, M.P. Intriago-Ortega, J.V. Calderon-Salinas // Toxicol. іn Vitro. — 2010. — Vol. 24. — Р. 1338-1346.
18. Prediction of coronary artery calcium progression in individuals with low Framingham Risk Score: The Multi-Ethnic Study of Atherosclerosis / T.M. Okwuosa, P. Greenland, G.L. Burke [et al.] // JACC Cardiovasc. Imaging. — 2012. — Vol. 5. — Р. 144-153.
19. Relation of the contractile reserve of hibernating myocardial structure in humans / S.F. Nagueh, I. Mikati, D. Weilbaecher [et al.] // Circulation. — 1999. — Vol. 98, Suppl. — P. 490-496.

/18.jpg)
/19.jpg)
/20.jpg)